新型可用于荧光标记的α-氰基丙烯酸酯单体的合成及在小鼠活体成像中的应用
2016-06-30汤永嘉刘克良
张 涛, 汤永嘉, 徐 亮, 刘克良
(军事医学科学院毒物药物研究所, 抗毒药物与毒理学国家重点实验室, 北京 100850)
新型可用于荧光标记的α-氰基丙烯酸酯单体的合成及在小鼠活体成像中的应用
张涛, 汤永嘉, 徐亮, 刘克良
(军事医学科学院毒物药物研究所, 抗毒药物与毒理学国家重点实验室, 北京 100850)
摘要设计合成了新型含有荧光基团的α-氰基丙烯酸酯单体, 并与其它α-氰基丙烯酸酯单体共聚, 得到产生荧光的聚氰基丙烯酸酯材料. 将其包埋在小鼠背部肌肉层, 可获得良好的荧光成像效果. 通过对荧光强度的监测, 初步研究了聚氰基丙烯酸酯材料中的侧链酯基在小鼠体内的降解情况. 单体合成是以蒽合氰基丙烯酸和4,4′-二甲氧基三苯基-氨基己醇为原料, 得到蒽合氰基丙烯酸(4,4′-二甲氧基三苯基-氨基己醇)酯, 脱保护后再将异硫氰酸荧光素以化学键合的方式标记在末端氨基上, 脱蒽还原烯双键后, 得到可用于荧光标记的α-氰基丙烯酸(异硫氰酸荧光素-氨基己醇)酯单体. 反应中间体及单体结构采用核磁共振氢谱和质谱进行表征. 该单体及其高聚物均可在激发光(488 nm)和发射光(525 nm)条件下观察到明显荧光.
关键词α-氰基丙烯酸酯; 异硫氰酸荧光素; 活体荧光成像
α-氰基丙烯酸酯类化合物最早是由德国科学家在1949年合成发现的[1,2], 具有可快速聚合、 黏接强度大、 无溶剂、 单组分等优点. 尤其是α-氰基丙烯酸烷基酯在化工及生活等方面有广泛用途, 也是目前临床使用的化学类医用胶的主要成分, 相关产品如强生公司开发的“多抹棒”等[3~5].α-氰基丙烯酸酯单体在常温下呈液态, 当接触到机体组织和皮肤表面等阴离子时, 单体中烯双键能快速聚合, 形成高聚物. 由于其单体和高聚物一般呈无色透明性状, 使得这类材料在使用后尤其是对其进行动物体内模型研究时, 其黏接效果和后续监测存在一定困难. 如, 当这类材料用于动物肠道组织黏接时[6,7], 需术后打开受试动物腹腔, 否则无法有效地观察胶体在组织上的黏接效果; 并且, 由于使用量小及胶体透明等因素, 难以准确判断胶体在组织上的残留情况. 因此, 对这类材料进行荧光标记, 可辅助检验黏接效果及后续监测.
异硫氰酸荧光素(FITC)是一种常用的荧光标记试剂, 可以与氨基在室温条件下快速化学键合形成稳定的化学键, 其量子产率高, 有较好的光稳定性和较低的温度系数, 不会在体内环境下发生荧光淬灭, 已在药物和生物材料的荧光标记中得到应用[8~11]. 本文设计合成了新型含有FITC荧光基团的α-氰基丙烯酸酯单体, 并获得良好的荧光活体成像效果, 适用于小鼠体内模型的研究; 并通过对荧光强度的监测, 初步探讨了聚氰基丙烯酸酯材料结构中的侧链酯基在小鼠体内的降解情况.
1实验部分
1.1试剂、 仪器与动物
4,4′-二甲氧基三苯基氯甲烷(DMT-Cl, 吉尔生化上海有限公司);N,N-二异丙基碳二亚胺(DIC, 阿达玛斯试剂上海有限公司); 4-二甲氨基吡啶(DMAP, 上海化学试剂公司); 异硫氰酸荧光素(FITC, 美国TCI公司); 其它试剂购自国药集团化学试剂有限公司; 所用试剂均为分析纯. Sprague-Dawley远交群(SD)小鼠, 体重(25±2) g, 雄性, 由军事医学科学院实验动物中心提供, 许可证号为SCXK(军)2012-0004. 实验动物由军事医学科学院实验动物中心的专业人员进行分笼词养, 手术过程均在军事医学科学院实验动物中心完成, 实验过程中实验动物均受到人文关怀, 无虐待动物行为.
JNM-ECA-400核磁氢谱仪(1H NMR, 日本电子株式会社); API-150EX 液相质谱仪(美国AB公司); IVIS@SPECTRUM小动物活体成像仪(英国Perkin Elmer公司); Waters 1515 GPC凝胶色谱系统(GPC, 美国Water公司).
1.2实验过程
1.2.14,4′-二甲氧基三苯基-氨基己醇(1a)的合成合成路线如Scheme 1所示. 将6-氨基己醇(5 g, 0.043 mol)置于 250 mL三口瓶中, 加入50 mL吡啶, 搅拌溶解, 在冰浴条件下滴加三甲基氯硅烷(13.9 g, 0.128 mol), 反应4 h, 加入DMT-Cl(17.3 g, 0.051 mol), 室温反应12 h; 减压除去吡啶, 调节反应液pH至中性, 萃取, 有机相分别以100 mL饱和NaHCO3、 100 mL饱和NaCl洗涤2次, 用无水Na2SO4干燥过夜. 以石油醚-乙酸乙酯混合液(体积比4∶1)为洗脱液, 柱层析法纯化分离, 减压除去溶剂, 得淡黄色黏稠状液体9.71 g, 即为化合物1a, 产率为53.9%.1H NMR(CDCl3, 400 MHz),δ: 1.25~1.62[m, 8H, (CH2)4], 2.72(d, 2H, CH2CH2NH), 3.80(s, 6H, Ph-OCH3), 4.22(s, 1H, CH2OH), 6.83~7.48(m, 13H, Ph-H), 8.29(s, 1H, CH2NH). MS,m/z: 420[M-H+].
1.2.2蒽合氰基丙烯酸-(4,4′-二甲氧基三苯基-氨基己醇)酯(3b)的合成合成路线如Scheme 2所示. 化合物2a参考文献[12~14]方法, 由α-氰基丙烯酸乙酯与蒽的加成反应得到蒽合氰基丙烯酸乙酯, 再在碱性溶液条件下水解得到. 将化合物2a(12.7 g, 0.046 mol)加入到50 mL二氯甲烷中, 依次加入DMAP(0.56 g, 4.60 mmol)和DIC(5.8 g, 0.046 mol), 室温下搅拌至完全溶解, 然后加入化合物1a(19.3 g, 0.046 mol), 于室温条件下反应6 h; 过滤, 滤液以饱和NaHCO3溶液和饱和NaCl溶液分别洗涤3次, 用无水Na2SO4干燥; 以石油醚-乙酸乙酯-三乙胺混合液(体积比5∶1∶0.2)为洗脱液, 柱层析法纯化分离, 减压除去溶剂, 得黄色油状液体21 g, 即为化合物3b, 产率为67.5%.1H NMR(CDCl3, 400 MHz),δ: 1.25~1.62[m, 8H, (CH2)4], 2.20(dd, 2H, CCH2CH), 2.72(d, 2H, CH2CH2NH), 2.77(dd, 2H, CCH2CH), 3.80(s, 6H, Ph-OCH3), 4.05(t, 2H, COOCH2), 4.43(t, 1H, Ph-CH-Ph), 4.86(s, 1H, CCH-Ph), 6.83~7.48(m, 21H, Ph-H), 8.29(s, 1H, CH2NH). MS,m/z: 677.5[M-H+], 698.9[M-Na+].
1.2.3蒽合氰基丙烯酸-6-氨基己醇酯(4c)的合成合成路线如Scheme 2所示. 将化合物3b(0.1 g, 0.14 mmol)用2 mL二氯甲烷溶解, 加入10 μL醋酸, 室温搅拌. 用20 μL三乙胺调反应液pH至中性, 用饱和NaCl溶液洗涤3次, 无水Na2SO4干燥, 减压除去溶剂即可得到淡黄色油状液体43.6 mg, 即为化合物4c, 产率为83.3%.1H NMR(CDCl3, 400 MHz),δ: 1.25~1.62[m, 8H, (CH2)4], 1.77(s, 2H, CH2NH2), 2.20(dd, 2H, CCH2CH), 2.77(dd, 2H, CCH2CH), 3.32(t, 2H, CH2CH2NH2), 4.05(t, 2H, COOCH2), 4.43(t, 1 H, Ph-CH-Ph), 4.86(s, 1H, CCH-Ph), 7.20~7.49(m, 8H, Ph-H). MS,m/z: 375.3[M-H+].
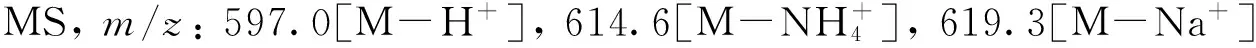
1.2.5α-氰基丙烯酸(FITC-氨基己醇)酯(6e)的合成合成路线如Scheme 2所示. 将化合物5d(0.19 g, 0.2 mmol)、 马来酸酐(0.08 g, 0.8 mmol)、 2 mL二甲苯和1 mL无水乙醇加入反应瓶中, 室温搅拌5 h后, 加热至50 ℃反应2 h, 减压除去二甲苯, 得黄绿色液体61.0 mg, 即为化合物6e, 产率为61.7%, 液体在接触到皮肤和组织时能产生黏接力, 避光保存.1H NMR(CDCl3, 400 MHz),δ: 1.25~1.62[m, 8H, (CH2)4], 3.20(t, 2H, CH2CH2NH), 4.05(t, 2H, COOCH2), 4.41(d, 2H, OCH2CH), 4.86(s, 1H, CCH-Ph), 6.01(s, 1H, CH2NH), 6.03(s, 1H, CH2CCN), 7.06(s, 1H, CH2CCN), 7.02~7.32(m, 9H, Ph-H).
1.3FITC标记的α-氰基丙烯酸酯的体外荧光显色实验
分别取30 μL上述方法得到的α-氰基丙烯酸(FITC-氨基己醇)酯, 及其与α-氰基丙烯酸正丁酯按质量比1∶5共混得到的配伍胶, 设为实验组A和B, 分别置于96孔板中; 取30 μL氰基丙烯酸正丁酯同样置于96孔板中, 设为对照组, 置于荧光成像系统下观察胶体有无荧光. 将实验组和对照组在潮湿环境下聚合后, 再次观察胶体聚合物有无荧光.
1.4小鼠活体成像实验
取5只Sprague-Dawley远交群(SD)小鼠, 以10%(质量分数)水合氯醛溶液麻醉后, 脱去背部毛. 用手术刀分别在小鼠背部两侧开一长1 cm深至肌肉层的口子, 在SD小鼠背部皮肤左侧包埋事先聚合好的聚氰基丙烯酸正丁酯材料(胶块平面大小约为0.25 cm2,α-氰基丙烯酸正丁酯用量约为30 mg), 设为对照组; 在其皮肤右侧包埋FITC荧光标记的聚氰基丙烯酸酯[α-氰基丙烯酸(FITC-氨基己醇)酯与α-氰基丙烯酸正丁酯按质量比1∶5 得到的配伍胶, 胶块平面大小约为0.25 cm2, 配伍胶重量约为30 mg], 设为实验组. 以α-氰基丙烯酸正丁酯将伤口黏合后避光正常饲养, 利用荧光成像系统IVIS@SPECTRUM在不同时间点(0, 7和14 d), 对实验小鼠进行活体成像观察.
1.5聚合物体内降解及分子量变化
将包埋有聚合物材料的SD小鼠在14 d时处死, 对小鼠背部右侧部位进行解剖, 观察右侧皮肤包埋有荧光标记聚氰基丙烯酸酯的降解情况. 取出残余固体, 真空干燥过夜, 取25 mg溶于1 mL四氢呋喃中, 利用Waters 1515 GPC凝胶色谱系统, 对残余固体分子量进行分析.
2结果与讨论
2.1单体合成
通过1.2节的合成方法, 得到重要中间体2a, 3b, 4c和5d及新型含有荧光基团的α-氰基丙烯酸酯单体6e, 通过核磁氢谱和质谱验证了其结构正确性. 由于氨基能够快速与FITC进行反应, 也能够引发α-氰基丙烯酸酯结构中的烯双键聚合, 因此, 在合成路线的设计上, 先对氰基丙烯酸酯中的烯双键用蒽进行保护, 脱去酯基后, 获得起始反应物2a. 氨基采用酸敏感的DMT基团进行保护, 目的是其脱除条件温和且不影响化合物3b中的酯基. 虽然单体6e结构中有仲氨结构, 但单体在储存条件下可稳定存在, 说明采用的FITC荧光基团的引入方式, 以及FITC本身的结构均不会引发α-氰基丙烯酸酯中烯双键的聚合. 这一合成方法具有一定的通用性, 还可将氨基己醇替换为氨基丁醇和氨基辛醇等, 从而获得不同酯基长度的单体结构; 也可将FITC替换为其它荧光标记基团.
2.2FITC标记的α-氰基丙烯酸酯的体外荧光显色
在激发光488 nm、 发射光为525 nm条件下可观察到, 含有α-氰基丙烯酸(FITC-氨基己醇)酯单体的2个孔中均有明显的荧光. 实验组A, 即α-氰基丙烯酸(FITC-氨基己醇)酯单体的荧光强度为1.440×1010Photon·s-1·cm-2·sr-1; 实验组B, 即α-氰基丙烯酸(FITC-氨基己醇)酯与α-氰基丙烯酸正丁酯按质量比1∶5得到的配伍胶的荧光强度为3.740×109Photon·s-1·cm-2·sr-1; 而对照组α-氰基丙烯酸正丁酯则几乎观察不到荧光, 结果表明新型α-氰基丙烯酸(FITC-氨基己醇)酯单体可获得良好的荧光成像效果, 且荧光强度大小可通过FITC标记单体的含量进行调节.
实验组和对照组在潮湿环境下聚合后, 同样, 在激发光488 nm、 发射光为525 nm条件下观察到含有聚氰基丙烯酸(FITC-氨基己醇)酯的2个孔中均有明显的荧光, 如图1所示, 实验组A即聚氰基丙烯酸(FITC-氨基己醇)酯的荧光强度为1.219×1010Photon·s-1·cm-2·sr-1; 实验组B, 即FITC荧光标记的聚氰基丙烯酸酯类材料[α-氰基丙烯酸(FITC-氨基己醇酯)与α-氰基丙烯酸正丁酯的质量比为1∶5]的荧光强度为3.360×109Photon·s-1·cm-2·sr-1; 而对照组聚氰基丙烯酸正丁酯几乎看不到荧光. 说明α-氰基丙烯酸(FITC-氨基己醇)酯单体在聚合后仍然具有明显荧光, 且荧光强度未发生明显变化, 说明单体结构中烯双键聚合与否, 不会对FITC荧光标记的氰基丙烯酸酯材料的荧光强度产生显著影响.
2.3小鼠活体成像实验结果
在对SD小鼠进行背部胶块包埋手术后, 迅速利用荧光成像系统IVIS@SPECTRUM进行观察, 结果如图2所示. 在激发光488 nm及发射光为525 nm条件下可观察到包埋有FITC荧光标记的聚氰基丙烯酸酯[α-氰基丙烯酸(FITC-氨基己醇)酯与α-氰基丙烯酸正丁酯按质量比1∶5得到的配伍胶]小鼠右侧部位有明显的荧光产生, 荧光强度为1.188×1010Photon·s-1·cm-2·sr-1; 左侧对照组部位以及小鼠其它部位在相同条件下无荧光产生, 说明制备的α-氰基丙烯酸(FITC-氨基己醇)酯单体适用于小鼠体内模型的研究, 可获得良好的荧光成像效果, 小鼠本身不会对荧光观察产生干扰.
2.4 FITC荧光标记的α-氰基丙烯酸酯在动物体内的降解
图3(A)是在0, 7和14 d时监测到的小鼠荧光强度照片, 图3(B)是其对应的数值和以0 d为100%参比时的荧光残留百分比. 可以看出, 将聚氰基丙烯酸材料包埋在小鼠肌肉层以下部位后, 随着时间的推移, 荧光强度随着时间延长而减小, 在7 d时, 荧光强度约为初始强度的(30.0±10.2)%, 在14 d时, 荧光强度约为初始强度的(14.0±9.0)%. 与此同时, FITC荧光标记的聚氰基丙烯酸酯[α-氰基丙烯酸(FITC-氨基己醇)酯与α-氰基丙烯酸正丁酯按质量比1∶5得到的配伍胶]在体外条件下(避光、 干燥), 相同时间内其荧光强度几乎不变.
14 d时SD小鼠解剖情况如图4所示. 可见小鼠背部右侧部位包埋有FITC荧光标记的聚氰基丙烯酸酯[α-氰基丙烯酸(FITC-氨基己醇)酯与α-氰基丙烯酸正丁酯按质量比1∶5得到的配伍胶]仍存在明显的胶块, 未观察到体积明显缩小的现象. 进一步, 利用分子排阻色谱(GPC)对取出的降解残余固体进行分子量分析, 结果如图5所示. 荧光标记的聚氰基丙烯酸酯[α-氰基丙烯酸(FITC-氨基己醇)酯与α-氰基丙烯酸正丁酯按质量比1∶5得到的配伍胶]降解前的分子量为283345; 在SD小鼠体内降解14 d后其残余固体的分子量为243689.
实验中观察到荧光标记的聚氰基丙烯酸酯的荧光强度降低且在动物体内其它部位并未出现荧光的明显蓄积, 说明了含有FITC结构的碎片分子从聚合物结构中被逐渐降解, 并且被快速排出动物体外. 但在动物解剖中, 发现胶体仍残留在植入部位, 体积未出现等同于荧光降低程度的明显减小. 考虑到在生理条件下, 聚氰基丙烯酸酯结构中侧链酯键更易水解[15~17]; 同时, 通过核磁氢谱测定的残余固体中侧链酯基部位氢峰与聚合物主链―CH2―峰积分比例变小, 可推测聚合物发生的主要是侧链酯基部分的降解, 而聚合物的碳碳主链, 即残留的大部分聚氰基丙烯酸结构仍然未能被有效降解. 进一步结合GPC中观察到的聚合物分子量变化, 可进一步印证这一过程, 即分子量减少主要是由于酯基部分的降解. 目前市售α-氰基丙烯酸酯医用胶聚合后形成线型主链的高聚物分子, 其聚合物侧链酯基的水解不涉及碳碳主链部分. 本文通过荧光检测的方法, 为阐明该类聚合物材料在体内条件下的降解和代谢模式, 提供了辅助的证据. 结果显示, 荧光标记的聚氰基丙烯酸酯在体内条件下, 首先发生的是酯键的逐渐断裂和酯基部分的代谢(14 d在80%以上), 但其残留的(聚氰基丙烯酸+聚氰基丙烯酸酯)混合物的结构, 由于分子量巨大, 难以在短期内被组织有效吸收, 并且, 由于分子量巨大且远远超过了肾小球滤过的范围, 还存在可能无法代谢出体外的问题, 因此, 这类物质能否在体内安全应用值得引起关注.
3结论
合成了新型可用于荧光标记α-氰基丙烯酸酯单体, 其体外及体内荧光显色实验结果显示, 该单体及其聚合物可作为荧光探针应用于小动物皮下部位活体成像. 初步研究了聚氰基丙烯酸酯材料结构中的侧链酯基在小鼠体内的降解情况, 为探讨这类材料在体内条件下的结构和分子量变化规律提供了辅助证据, 即, 聚氰基丙烯酸酯类材料的侧链酯键虽然可以断裂, 但其聚合物主链仍然不能在短期内被有效降解. 需要指出的是, 本文中仅研究了材料在小鼠的浅表组织的荧光活体成像, 其在动物深层组织和脏器(如肠道组织)是否仍能获得良好的荧光活体成像效果, 仍需进一步实验验证. 采用本文的合成方法, 可标记穿透力更强的近红外入射和发射光染料, 如Cy5等. 此外, 考虑到聚氰基丙烯酸酯纳米微球是近年来研究较多的一类药物递送载体材料[17~19], 本文提供的荧光标记方法, 还可以进一步运用到这类研究中, 对材料进入动物体内后的代谢情况进行辅助的观测.
参考文献
[1]Adam J., Singer M. D., James V., Judd E. H.,AmericanJournalofEmergencyMedicine, 2008, 32(26), 491—492
[2]Zhang F., Meng X. K., Lei Y. Q., Chen J.L.,ActaAcademiaeMedicinaeNeimongol, 2008, 30(2), 118—121(张飞, 孟兴凯, 雷艳秋, 武隽忞, 陈敬龙. 内蒙古医学院学报, 2008, 30(2), 118—121)
[3]Chow A., Marshall H., Zacharakis E.,J.Am.Coll.Surg., 2010, 211(1), 114—125
[4]Leggat P. A., Kedjarune U., Smith D. R.,IndustrialHealth, 2004, 42(2), 207—211
[5]Pfister W. R.,AdhesiveAge, 1990, 33(13), 2—4
[6]Zhao H. R., Zhao F., Zhang L., Han L. B., Xu S., Zhang Q. G.,JournalofChinaMedicalUniversity, 1998, 27(1), 87—88(赵惠儒, 赵凡, 张林, 韩立波, 许顺, 张其刚.中国医科大学学报, 1998, 27(1), 87—88)
[7]Wu Y. P., Yao Q.,ChineseJournalofNewDrugsandClinicalRemedies, 1996, 15(4), 247—248(吴义平, 姚芹. 新药与临床, 1996, 15(4), 247—248 )
[8]Zhang H. S., Wang H., Zhao Y. Y.,MolecularProbesandDetectionTechnology, Science Press, Beijing, 2002, 297—298(张华山, 王红, 赵媛媛. 分子探针与检测技术, 北京: 科学出版社, 2002, 297—298)
[9]Onishi H., Machida Y.,Biomaterials, 1999, 20(2), 175—182
[10]Tanaka T., Kaneo Y., Shiramoto S., Iguchi S.,Biological&PharmaceuticalBulleint, 1993, 16, 1270—1275
[11]Seymour L. W., Ulbrich K., Steyger P. S., Brereton M., Subr V., Strohalm J., Duncan R.,BritishJournalofCancer, 1994, 70(4), 636—641
[12]Yu X. C.,LiaoningChemicalIndustry, 2007, 36(4), 227—229(余先纯.辽宁化工, 2007, 36(4), 227—229)
[13]Buck C. J., Heights B.,MedifiedCyanoacrylateMonomersandMethodsforPreparation, US4012402, 1976-06-23
[14]Tahtouh M., Kalman J. R., Reedy B. J.,JournalofPolymerScience,PartA:PolymerChemistry, 2011, 49(1), 257—277
[15]Vauthier C., Dubernet C., Fattal E., Pinto-Alphandary H., Couvreur P.,AdvancedDrugDeliveryReview, 2003, 55(4), 519—548
[16]Leonard F., Kulkarni R. K., Brandes G., Nelson J., Cameron J. J.,JournalofAppliedPolymerScience, 1966, 10, 259—272
[17]Lenaerts V., Couvreur P., Christiaens-Leyh D., Joiris E., Roland M., Rollman B., Speise P.,Biomaterials, 1984, 5, 65—68
[18]Brigger I., Dubernet C., Couvreur P.,AdvancedDrugDeliveryReview, 2002, 54(5), 631—651
[19]Douglas S., Illum L., Davis S., Kreuter J.,J.ColloidInterfaceSci., 1984, 101, 149—158
(Ed.: D, Z)
† Supported by the Natural Science Foundation of China(No.81573345) and the National Science and Technology Major Projects of China(No.2012ZX09301003).
Synthesis of a New Cyanoacrylate Monomer and Its Application in Fluorescence Imaginginvivo†
ZHANG Tao, TANG Yongjia, XU Liang*, LIU Keliang*
(BeijingInstituteofPharmacologyandToxicology,StateKeyLaboratoryofToxicologyandMedicalCountermeasures,Beijing100850,China)
KeywordsCyanoacrylate; Fluorescein isothiocyanate(FITC); Fluorescence imaginginvivo
AbstractA new cyanoacrylate monomer with fluorescein isothiocyanate(FITC) labeling was synthesized. It could copolymerize with any other cyanoacrylate monomers and result in copolymer being able to produce fluorescence. Well fluorescence imaging could be got when the copolymer was embedded in subcutaneous tissue of Sprague-Dawley(SD) mice. We also discussed the degradation pattern of polycyanoacrylate by monitoring the fluorescence intensity with time. The synthesis was started with anthracene /cyanoacrylate acid adduct and 6-(4,4′-dimethoxytriphenylmethyl)-amino-1-hexanol. After deprotection of 4,4′-dimethoxytriphenylmethyl group from intermediate anthracene/6-(4,4′-dimethoxytriphenylmethyl)-amino-1-hexanol cyanoacrylate adduct, FITC was labeled onto the amino group. The target product was finally got by reduction of the ethylenic bond. Structure of intermediates and target compound were identified by1H NMR and MS spectroscopy. Both the monomer and polymer could be observed fluorescence around 525 nm wavelength by an exciting light at 488 nm.
收稿日期:2016-01-30. 网络出版日期: 2016-05-26.
基金项目:国家自然科学基金(批准号: 81573345)和国家科学和技术重大专项(批准号: 2012ZX09301003)资助.
中图分类号O632.1
文献标志码A
联系人简介: 刘克良, 男, 博士, 研究员, 博士生导师, 主要从事多肽药物、 核酸化学和医药用高分子材料的研究.
E-mail: keliangliu55@126.com
徐亮, 男, 博士, 副研究员, 主要从事核酸化学和医药用高分子材料的研究. E-mail: wj24998@163.com
