咔咯钴(Ⅲ)配合物与DNA的相互作用及抗肿瘤活性
2016-06-30杨文聪曾淑莹莫婷婷曹曼丽刘海洋
史 蕾, 杨文聪, 曾淑莹, 莫婷婷,张 召, 曹曼丽, 刘海洋
(1. 广东第二师范学院化学系, 广州 510303; 2. 华南理工大学化学系, 广州 510641)
咔咯钴(Ⅲ)配合物与DNA的相互作用及抗肿瘤活性
史蕾1, 杨文聪1, 曾淑莹1, 莫婷婷1,张召2, 曹曼丽1, 刘海洋2
(1. 广东第二师范学院化学系, 广州 510303; 2. 华南理工大学化学系, 广州 510641)
摘要合成了10-(4-羟基苯基)-5,15-二(五氟苯基)咔咯钴(Ⅲ)配合物(1-Co)和10-(4-吩噻嗪苯基)-5,15-二(五氟苯基)咔咯钴(Ⅲ)配合物(2-Co), 并采用核磁共振波谱、 质谱和紫外-可见光谱等对其结构进行了表征, 利用紫外光谱、 荧光光谱、 圆二色谱、 黏度测试和琼脂糖凝胶电泳等技术研究了配合物1-Co和2-Co与小牛胸腺DNA(ct-DNA)之间的相互作用. 结果表明, 配合物1-Co和2-Co与DNA之间的作用模式为外部结合, 且在光照下均能引发DNA断裂. 细胞毒性实验结果表明, 配合物1-Co和2-Co具有很低的暗细胞毒性, 但在光照条件下均能有效抑制H460, HeLa, A549等肿瘤细胞株增殖, 表明配合物1-Co和2-Co在光动力治疗中具有潜在的应用价值. 细胞核染色和线粒体膜电位检测结果表明, 在光照条件下配合物2-Co可能是通过氧化损伤线粒体的途径抑制肿瘤细胞增殖.
关键词咔咯; 吩噻嗪; 卟啉; DNA; 抗肿瘤活性
卟啉类化合物及其衍生物具有独特的结构和物理化学及光学特征, 已被广泛应用于高选择性荧光和比色离子探针[1]、 燃料敏化太阳能电池[2~5]及光动力学治疗(PDT)[6]等领域. 咔咯(Corrole)是与卟啉具有类似结构的大环化合物, 在失去3个内氢原子变成三价阴离子后可与高价态金属形成稳定的配合物[7]. 近年来的研究表明, 咔咯及其配合物在生物医药领域有潜在应用前景[8]. 例如, 含单羟基的咔咯衍生物能光诱导鼻咽癌细胞发生凋亡[9]; 磺酸型镓咔咯配合物与乳腺癌细胞靶向蛋白质自组装形成的非共价复合物可用于肿瘤组织的检测和消除[10]; 磺酸型铁咔咯配合物能有效减缓动脉粥样硬化的发生[11]. 许多抗肿瘤药物分子均以DNA为作用靶点[12~14], 药物与细胞内DNA间的相互作用可能会抑制肿瘤细胞复制, 最终导致细胞凋亡或死亡[15]. 因此研究咔咯及其金属配合物与DNA的相互作用有助于进一步了解该类化合物的药物作用机理[16]. 研究表明, 咔咯及其镓、 铁、 锰等金属配合物能以外部或插入模式与DNA结合, 并能在光照或氧化剂条件下有效断裂DNA[17~20]. Zhou等[21~23]合成了一系列阳离子型咔咯, 发现它们可通过稳定G-四链体结构抑制端粒酶表达. Purrello等[24]发现+3价阳离子型的吡啶基咔咯及其锗配合物可识别不同结构类型核酸, 可用作DNA分子探针.
钴是生物体内必需的微量元素, 在生命体内起重要生理作用的维生素B12和超氧化物歧化酶的活性中心都含有钴离子[25,26]. 钴金属配合物在生物化学中的应用也引起了科研工作者的注意, 在抗菌[27,28]、 抗肿瘤[29,30]、 抗氧化[31,32]和人工核酸酶[33,34]等领域都有潜在应用前景. 本文制备了10-(4-羟基苯基)-5,15-二(五氟苯基)-咔咯钴(Ⅲ)(1-Co)和10-(4-吩噻嗪苯基)-5,15-二(五氟苯基)咔咯钴(Ⅲ)(2-Co)(Scheme 1), 并对其结构进行了表征, 研究了其与DNA的相互作用及抗肿瘤活性.
1实验部分
1.1试剂与仪器
小牛胸腺DNA(ct-DNA)、 吩噻嗪-10-碳酰氯(PTZ)、 1,8-二氮杂二环[5,4,0]十一碳-7-烯(DBU)均购于Sigma公司; pBR322DNA购于大连宝生物工程有限公司; 三羟甲基甲胺(Tris)、 氯化钠(NaCl)、 硼酸(H3BO3)、 琼脂糖、 溴酚蓝和溴化乙锭(EB)均为色谱纯, 购于上海生工生物工程公司; H460, HeLa, A549等肿瘤细胞株均购于American Type Culture Collection公司; 四甲基偶氮唑蓝(MTT)购于Amresco公司; Hoechst33342购于上海江莱生物科技有限公司; 线粒体膜电位检测试剂盒(含JC-1原液及JC-1缓冲液). 购于上海前尘生物科技有限公司; 其它试剂均为分析纯, 实验用水为去离子水.
1.2咔咯钴(Ⅲ)配合物的合成
参照文献[17]方法合成化合物1和2. 称取31.1 mg化合物1溶解于30 mL甲醇中, 再加入146 mg四水合乙酸钴[(CH3COO)2Co54H2O]和105 mg三苯基膦(PPh3), 室温反应20 min. 反应结束后, 旋转蒸干溶剂, 用二氯甲烷/水(200 mL, 体积比1∶1)萃取, 收集有机相并用水洗涤3次. 柱层析分离, 以二氯甲烷(DCM)/正己烷(Hex)(体积比1∶2)为洗脱剂, 收集红色条带, 旋转蒸干得到血红色产物1-Co, 产率约为85%.1H NMR(400 MHz, CDCl3),δ: 8.69(d, 2H), 8.31(d, 2H), 8.20(d, 2H), 8.01(d, 2H), 7.73~7.68(m, 5H), 7.55(d, 3H), 7.49(d, 5H), 7.11(d, 6H).19F NMR(376 MHz, CDCl3),δ: 136.80~136.92(m, 2F), 137.80~137.94(m, 2F), 154.26(m, 2F), 161.99~162.36(m, 2F), 162.56~162.80(m, 2F). UV-Vis(CH2Cl2),λmax/nm: 381, 402, 554, 589. HR-MS,m/z计算值: 1063.1065(C55H28CoF10N4NaOP); 实测值: 1063.1071[M+Na]+.
配合物2的合成过程与配合物1相同, 只是在合成中用化合物2代替化合物1, 反应物的用量分别为40 mg(化合物2)、 30 mL(甲醇)、 196 mg(四水合乙酸钴)和141 mg(三苯基膦), 反应时间为30 min. 产率约为90%.1H NMR(400 MHz, CDCl3),δ: 8.76(d, 2H), 8.28(d, 4H), 8.08(d, 3H), 7.85(d, 2H), 7.73(d, 2H), 7.61(d, 1H), 7.56~7.40(m, 10H), 7.33(d, 2H), 7.05(d, 3H), 6.70(d, 6H).19F NMR(376 MHz, CDCl3),δ: 136.89(d, 2F), 137.88(d, 2F), 154.16(d, 2F), 162.00(d, 2F), 162.51~162.70(m, 2F). UV-Vis(CH2Cl2),λmax/nm: 376, 409, 554, 593. HR-MS,m/z计算值: 1288.1314(C66H35CoF10N5NaO2PS); 实测值: 1288.1327[M+Na]+.
1.3咔咯钴(Ⅲ)配合物与ct-DNA结合模式的表征
所有测定均在Tris-HCl缓冲溶液I(5 mmol/L Tris-HCl, 50 mmol/L NaCl, 2%(体积分数)DMF, pH=7.2)中进行. ct-DNA浓度通过测定其紫外吸收光谱来确定, ct-DNA在260 nm处的摩尔消光系数为6600 mol-1·cm-1·L[35].
1.3.1紫外-可见光谱测试以缓冲溶液I作为空白, 配制浓度为1.0×10-5mol/L的咔咯钴(Ⅲ)配合物, 逐次加入2 μL浓度为1.5×10-3mol/L的ct-DNA储备液, 使ct-DNA与配合物浓度的比值不断增加. 测定前搅拌5 min, 使ct-DNA与配合物完全结合并分布均匀, 检测咔咯钴(Ⅲ)配合物在300~800 nm范围内的紫外-可见光谱变化. 配合物1-Co和2-Co与DNA的结合常数(Kb)通过下式计算[36]:
(1)
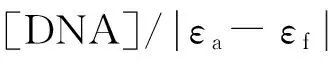
骆驼城井灌区水资源管理工作是全县的示范点,安装取水计量设施并实现远程传输的优点,一是便于管理机井,通过电脑就可以掌握当前的用水机井数、用水量、剩余水量等;二是发现故障及时排除;三是方便群众购买,便于查看;四是实现了购水、用水的公开透明,消除了用水矛盾。
1.3.2荧光光谱测试咔咯钴(Ⅲ)配合物自身没有荧光, 本文采用溴化乙锭(EB)竞争法间接研究配合物与DNA的相互作用. 在EB-DNA([EB]=5.0×10-6mol/L, [DNA]=3.0×10-5mol/L)体系中, 逐次加入3 μL浓度为1×10-3mol/L的配合物溶液, 搅拌5 min使ct-DNA与配合物完全结合并分布均匀, 然后测定EB-DNA在500~700 nm范围内的荧光光谱变化(λex=370 nm). 通过Stern-Volmer方程计算不同温度下的猝灭常数(KSV)[37]:
(2)
式中:F0和F分别代表EB-DNA 自身荧光强度以及与配合物结合时的荧光强度; [Q]代表配合物的浓度;τ0表示未加配合物时的荧光平均寿命(~10-8s); 以F0/F对[Q]作图, 线性拟合的斜率即为KSV.
1.3.3圆二色光谱(CD)测试在固定ct-DNA浓度为1.5×10-4mol/L的溶液中逐次加入咔咯钴(Ⅲ), 使配合物浓度依次为1.5×10-5, 3.0×10-5和6.0×10-5mol/L. 每次测定前搅拌5 min, 使ct-DNA与配合物完全结合并分布均匀, 然后再测定在225~600 nm范围内ct-DNA的圆二色光谱(CD)变化.
1.3.4黏度测试黏度测试采用乌氏黏度计, 恒温槽溶液温度维持在(30±0.1)℃. 固定 ct-DNA浓度为1.0×10-4mol/L, 逐渐加大咔咯钴(Ⅲ)配合物的浓度, 分别测定不同配合物浓度下溶液流经毛细管所需的时间, 按下式计算黏度(η)[38]:
(3)
式中:t0为缓冲溶液流经毛细管所需的时间,t为含不同浓度配合物的DNA溶液流经毛细管所需的时间. 以(η/η0)1/3对[配合物]/[DNA]的比值作图,η0为DNA溶液的相对黏度.
1.4琼脂糖凝胶电泳
向含有0.1 μg pBR322DNA的溶液中加入不同浓度的咔咯钴(Ⅲ)配合物, 再加入Tris-HCl缓冲溶液Ⅱ(5 mmol/L Tris-HCl, 18 mmol/L NaCl, 2%DMF, pH=7.2), 使总体积为10 μL. 将反应液置于红光灯(5 W)下照射2 h(将光源和反应液置于避光系统, 反应液和光源之间的距离为10 cm). 琼脂糖凝胶电泳2 h(77 V, 30 mA)后, 放入EB溶液中染色15 min, 用水冲洗后放入凝胶成像系统中成像.
1.5细胞毒性实验
配合物1-Co与2-Co对宫颈癌细胞(Hela)与肺癌细胞(H460, A549)生长抑制的光毒性及暗毒性采用MTT方法测试, 具体测试条件参照文献[39]. 首先选取对数生长期的测试细胞接种到96孔板内(5×103Cell/well), 于37 ℃, 含5%二氧化碳的饱和湿度培养箱中孵育生长12 h, 每组设6个复孔, 重复3次. 吸去上清液, 加入新的包含不同浓度的测试化合物的培养基, 每孔总体积100 μL, 继续培养2 h后, 距离培养皿15.5 cm处用灯光照射1 h(620 nm红光, 5 W, 60 min, 光照强度为750 lx), 然后培养2 h, 去掉培养基, 每孔加入100 μL MTT(5 mg/mL), 继续培养4 h后弃去上层清液, 每孔加入100 μL DMSO, 振荡使结晶完全溶解后, 用酶标仪测定波长在570 nm下各孔的吸光度值, 根据所测得的各细胞存活率, 计算目标化合物对肿瘤的半数抑制浓度(IC50)值, 得到配合物的光毒性结果. 配合物的暗毒性测试与光毒性类似, 不同之处在于免去光源照射.
1.6细胞核染色
将生长对数期的肺癌H460细胞首先接种在六孔板内(2×105Cell/well), 于37 ℃、 含5%二氧化碳的饱和溶液中培养12 h后, 加入配合物2-Co (20 μmol/L), 在与1.5节中相同的光照条件下, 光照后继续培养24 h. 以没有进行任何处理的细胞作为对照测试. 借助Hoechst 33342(5 μg/mL)染色[39], 使用倒置荧光显微镜观察加入配合物2-Co后肺癌细胞核的状态变化.
1.7线粒体膜电位的变化
将生长对数期的肺癌H460细胞首先接种在六孔板内(2×105Cell/well), 于37 ℃, 含5%二氧化碳的饱和溶液中培养12 h后, 加入配合物2-Co (20 μmol/L), 在与1.5节中相同的光照条件下, 光照后继续培养24 h. 以没有进行任何处理的细胞作为对照测试. 肺癌细胞首先用0 ℃的PBS洗涤3次, 然后加入JC-1原液, 于避光、 37 ℃下培养染色20 min. 再用JC-1缓冲溶液洗涤3次后, 通过倒置荧光显微镜观察加入配合物2-Co后肺癌细胞线粒体膜电位的变化.
2结果与讨论
2.1化合物与DNA的结合模式
2.1.1紫外-可见吸收光谱分析小分子配合物与DNA结合后, 由于小分子所处环境发生变化, 电子结构受到DNA扰动, 会引起其紫外-可见吸收光谱变化, 可以通过变化幅度推测其与DNA结合强度和模式. 对于卟啉类分子, 通常插入结合会导致卟啉Soret带发生较大幅度减色效应(大于35%), 并伴随明显红移现象(大于15 nm); 而当发生外部结合模式时常伴随较小程度红移和减色效应[40]. 如图1所示, 随着ct-DNA的加入, 配合物1-Co和2-Co的紫外光谱Soret带都发生了较小程度的减色效应, 减色率分别为14.0%和10.9%, 并伴有微弱的红移(3 nm). 计算结果表明, 配合物1-Co和2-Co与DNA的结合常数分别为1.21×106L/mol和2.65×105L/mol, 推测这2种咔咯钴(Ⅲ)配合物与DNA结合模式可能均为外部结合.
2.1.2荧光光谱分析咔咯钴(Ⅲ)配合物没有荧光, 因此采用溴化乙锭(EB)作为荧光探针间接探究2种配合物与DNA的相互作用. EB自身荧光很弱, 但与DNA结合后形成的EB-DNA体系在610 nm会有很强的荧光[41]. 如图2所示, 随着配合物1-Co的加入, EB-DNA的荧光强度不断降低, 表明1-Co与DNA之间发生了相互作用. 荧光猝灭通常分为动态猝灭和静态猝灭, 动态猝灭是由于处于激发态的荧光分子与猝灭剂发生碰撞而导致荧光猝灭, 温度升高, 有效碰撞几率增大, 进而猝灭常数(KSV)相应地增大; 静态猝灭是指猝灭剂与荧光分子在基态时形成了不发光的基态复合物而导致荧光猝灭, 温度升高使得基态复合物稳定性下降,KSV相应减小[42]. 由Stern-Volmer方程拟合结果可以看出, 不同温度下配合物1-Co的F0/F与[Q]之间有很好的线性关系, 表明猝灭方式只有一种. 且随着温度升高,KSV减小, 分别为5.22×104(298 K), 3.12×104(304 K)和2.41×104(310 K)(表1), 远大于动态猝灭常数(2×102L/mol)[42,43]. 配合物2-Co与1-Co表现出相似的规律(图3), 随着温度升高, 猝灭常数也相应减小, 分别为4.87×104(298 K), 4.83×104(304 K)和4.03×104(310 K)(表1). 因此, 推测这2种咔咯钴(Ⅲ)配合物对EB-DNA体系荧光猝灭过程可能均为静态猝灭过程.
2.1.3圆二色谱分析利用圆二色谱进一步研究了咔咯钴(Ⅲ)配合物与DNA的结合模式. ct-DNA自身在246 nm处有1个B型DNA螺旋引起的负CD吸收峰, 在275 nm处有1个由DNA碱基对堆积引起的正CD吸收峰[44]. 通常, 小分子与DNA以插入模式结合会导致2个正、 负峰吸收强度增加, 而发生外部结合或静电相互作用对正、 负CD峰吸收强度影响不大[45]. 如图4所示, 随着配合物2-Co和1-Co的加入, ct-DNA的正、 负CD信号峰强度都发生了微小的减弱, 且峰形没有发生变化. 因此可以推测2种配合物与DNA之间没有发生插入模式结合, 且未导致DNA的构象产生变化. 此外, 对于非手性卟啉分子, 其在Soret带没有吸收峰, 但与DNA发生相互作用可能会产生诱导CD(ICD): 当非手性卟啉分子与DNA发生外部结合时, 会产生正的ICD或没有ICD; 当采取插入模式结合时, 会产生负的ICD; 而采取自堆积模式结合时, 会同时出现正、 负ICD[24,40]. 由图4可以看出, 随着2种配合物的加入, 均未看到有ICD峰的出现, 因此可进一步确定这2种咔咯钴(Ⅲ)配合物与ct-DNA发生的均是外部结合.
2.1.4黏度测试分析当配合物插入到DNA碱基对间时, 会导致DNA双螺旋延长, 使得DNA溶液的黏度增加(如经典插入剂EB); 部分插入模式可能会使DNA双螺旋发生扭结, 导致DNA溶液的黏度减小; 而配合物与DNA发生外部结合时, 对DNA构象影响不大, DNA黏度也无明显变化[46~48]. 如图5所示, 随着配合物1-Co和2-Co的加入, DNA溶液的黏度呈上升趋势, 但增加幅度不大, 远小于经典插入剂EB引起DNA黏度增大的程度. 因此, 综合黏度测试和光谱学实验结果, 可判断配合物1-Co和2-Co均以外部模式与DNA相互作用.
2.2 咔咯钴(Ⅲ)光断裂pBR322 DNA
图6为配合物1-Co 和 2-Co的紫外-可见吸收光谱图. 可以看出这2种咔咯钴配合物均表现出咔咯典型的Soret带(400 nm附近)和Q带(500~700 nm), 配合物2-Co与配合物1-Co相比, 在260 nm附近多出1个吩噻嗪的吸收峰; 这2个化合物在红光区均有一定的吸收. 图7为不同浓度的配合物1-Co和配合物2-Co在红光照射下断裂DNA的电泳图. DNA空白样品(无光照)、 DNA空白样品(光照2 h)以及DNA中加入320 μmol/L配合物1-Co而无光照条件下均未发现DNA有明显的断裂[图7(A)中Lanes 1~3]. 在光照下, 当配合物1-Co的浓度为40 μmol/L时, 其能使7%的Form Ⅰ DNA(SC)转变为Form Ⅱ DNA(NC)[图7(A)中Lane 4]; 增大配合物浓度, 其光断裂DNA的活性相应增强; 当配合物浓度为320 μmol/L时, 其光断裂DNA的活性最强, 断裂分数为14%[图7(A)中Lane 8]. 配合物2-Co表现出相似的规律, 但是其光断裂DNA的活性明显高于配合物1-Co, 当配合物2-Co的浓度为40 μmol/L时, 其能使28%的Form I DNA(SC)转变为FormⅡ DNA(NC)[图7(B)中Lane 4]; 当浓度增大为320 μmol/L时, 其断裂分数达到41%[图7(B)中Lane 8]. 可以看出, 配合物2-Co在红光照射下表现出良好的光断裂DNA活性, 预示着其在光动力治疗(PDT)方面具有潜在的应用前景.
2.3抗肿瘤活性
2.3.1细胞毒性分析采用MTT法评估了在暗条件或光照下, 配合物1-Co和2-Co分别对H460, HeLa和A549等肿瘤细胞株增殖的影响. 从表2数据可以看出, 配合物1-Co和配合物2-Co在暗条件下对所选用的3种细胞株生长抑制作用不明显. 然而, 在光照条件下, 配合物1-Co和配合物2-Co对H460, HeLa和A549细胞的增殖均表现出有效的抑制作用. 配合物1-Co和2-Co极低的暗毒性和良好光细胞毒性表明它们作为新型光敏剂在光动力治疗中具有潜在应用. 从表2中可以看出, 在所选用的3种肿瘤细胞株中, 配合物1-Co和2-Co对H460的细胞毒性最强. 此外, 配合物2-Co具有更低的IC50值, 表明配合物2-Co的细胞毒性高于配合物1-Co. 此现象可能与配合物2-Co中吩噻嗪基团潜在的抗肿瘤作用及脂溶性的吩噻嗪基团能够增强其和细胞的跨膜吸收等诸多因素有关[17,49].
2.3.2细胞凋亡分析为了进一步研究咔咯钴(Ⅲ)配合物抑制肿瘤细胞增殖的潜在机理, 以配合物2-Co为例, 采用Hoechst 染色H460细胞核的方法观测细胞核形态结构变化. 如图8所示, 在不加化合物单独光照条件下, 细胞呈现完整的细胞核形态. 然而, 在光照和配合物2-Co共同作用下, H460细胞核发生皱缩, 染色质凝结并伴有细胞核碎片出现, 这都是当细胞发生凋亡时细胞核的形态结构[50]. 因此, 推测配合物2-Co可能是通过诱导肿瘤细胞凋亡的途径抑制肿瘤细胞增殖[39].
2.3.3线粒体膜电位分析线粒体在细胞凋亡过程中具有重要作用[51,52], 在细胞凋亡早期会不可逆地发生线粒体跨膜电位的降低[53]. JC-1是一种广泛用于检测线粒体膜电位的理想荧光探针. 当线粒体跨膜电位处正常水平时, JC-1聚集在线粒体基质中形成聚合物, 发出强烈的红色荧光; 一旦线粒体膜电位下降或丧失, JC-1会以单体的形式存在于胞浆中, 产生绿色荧光[54]. 如图9所示, 在单独光照条件下, JC-1发出强烈的红色荧光, 表明线粒体膜电位处于正常水平. 光照条件下随着配合物2-Co的加入, JC-1发出绿色荧光, 且随着配合物2-Co浓度升高, 绿色荧光强度增加, 表明配合物2-Co可以氧化损伤肺癌细胞线粒体膜, 导致线粒体膜电位下降, 且损伤程度具有浓度依赖性. 综合细胞核形态变化可进一步推测配合物2-Co可能是通过氧化损伤线粒体导致细胞凋亡的途径抑制肺癌细胞增殖的.
3结论
合成并表征了咔咯钴(1-Co)和咔咯-吩噻嗪钴(2-Co)2种配合物, 采用紫外-可见光谱、 荧光光谱、 圆二色谱、 黏度测试和琼脂糖凝胶电泳等技术研究了其与DNA的相互作用. 结果表明, 配合物1-Co和配合物2-Co均是通过外部模式与DNA相结合, 且在光照下能够引起DNA发生断裂, 且配合物2-Co的活性大于配合物1-Co. MTT实验结果表明, 在光照下配合物1-Co和配合物2-Co能有效抑制H460, HeLa和A549细胞增殖, 同样配合物2-Co的细胞毒性更强. 通过观察细胞核形态并测试线粒体膜电位, 推断配合物2-Co可能是通过氧化损伤线粒体的途径导致肺癌细胞凋亡的.
参考文献
[1]Ding Y. B., Tang Y. Y., Zhu W. H., Xie Y. S.,Chem.Soc.Rev., 2015, 44, 1101—1112
[2]Xie Y. S., Tang Y. Y., Wu W. J., Wang Y. Q., Liu J. C., Li X., Tian H., Zhu W. H.,J.Am.Chem.Soc., 2015, 137, 14055—14058
[3]Wei T. T., Sun X., Li X., Ågren H., Xie Y. S.,ACSAppl.Mater.Interfaces, 2015, 7, 21956—21965
[4]Wang Y. Q., Chen B., Wu W. J., Li X., Zhu W. H., Tian H., Xie Y. S.,Angew.Chem.Int.Ed., 2014, 53, 10779—10783
[5]Mi Y. S., Liang P. X., Yang Z., Wang D., Cao H., He W. L., Yang H.,Chem.Res.ChineseUniversities, 2015, 31(6), 992—996
[6]Vanya B., Lidiya P., Pavel K.,Photochem.Photobiol.B-Biology, 2015, 153, 276—280
[7]Liu H. Y., Mahmood M. H. R., Qiu S. X., Chang C. K.,Coord.Chem.Rev., 2013, 267, 1306—1333
[8]Aviv-Harel I., Gross Z.,Coord.Chem.Rev., 2011, 255, 717—736
[9]Chang C. K., Kong P. W., Liu H. Y., Yeung L. L., Koon H. K., Mak N. K.,Proc.SPIE, 2006, 6139, 613915
[10]Agadjanian H., Ma J., Rentsendorj A., Valluripalli V., Hwang J. Y., Mahammed A., Farkas D. L., Gray H. B., Gross Z., Medina-Kauwe L. K.,Proc.Natl.Acad.Sci., 2009, 106, 6105—6110
[11]Haber A., Mahammed A., Fuhrman B., Volkova N., Coleman R., Hayek T., Aviram M., Gross Z.,Angew.Chem.Int.Ed., 2008, 47, 7896—7900
[12]Gossens C., Tavernelli I., Rothlisberger U.,J.Am.Chem.Soc., 2008, 130, 10921—10928
[13]An D., Zhao X. H., Zhou M., Ye Z. W.,Chem.J.ChineseUniversities, 2014, 35(2), 275—280(安东, 赵晓辉, 周密, 叶志文. 高等学校化学学报, 2014, 35(2), 275—280)
[14]Li X. L., Ma D. L., Yang H. L., Tan G. H., Du H. R., Wang K. R., Zhang P. Z., Chen H.,Chem.J.ChineseUniversities, 2014, 35(6), 1181—1188(李小六, 马东来, 杨海龙, 谭官海, 杜会茹, 王克让, 张平竹, 陈华. 高等学校化学学报, 2014, 35(6), 1181—1188)
[15]Zhang H., Liu C. S., Bu X. H., Yang M.,J.Inorg.Biochem., 2005, 99, 1119—1125
[16]Wang J. M., Shi L., Liu H. Y.,Prog.Chem., 2015, 27(6), 755—762(王家敏, 史蕾, 刘海洋. 化学进展, 2015, 27(6), 755—762)
[17]Shi L., Liu H. Y., Peng K. M., Wang X. L., You L. L., Lu J., Zhang L., Wang H., Ji L. N., Jiang H. F.,Tetrahedron.Lett., 2010, 51, 3439—3442
[18]Huang J. T., Zhang Y., Wang X. L., Ji L. N., Liu H. Y.,ChineseJ.Inorg.Chem., 2013, 29(8), 1649—1656(黄俊腾, 张阳, 王湘利, 计亮年, 刘海洋. 无机化学学报, 2013, 29(8), 1649—1656
[19]Zhang Y., Chen H., Wen J. Y., Wang X. L., Wang H., Ji L. N., Liu H. Y.,Chem.J.ChineseUniversities, 2013, 34(11), 2462—2469(张阳, 陈欢, 闻金燕, 王湘利, 王惠, 计亮年, 刘海洋. 高等学校化学学报, 2013, 34(11), 2462—2469)
[20]Zhang Y., Wen J. Y., Wang X. L., Mahmood M. H. R., Liu Z. Y., Wang H., Ji L. N., Liu H. Y.,Appl.Organometal.Chem., 2014, 28, 559—566
[21]Fu B. Q., Huang J., Ren L., Weng X. C., Zhou Y. Y., Du Y. H., Wu X. J., Zhou X., Yang G. F.,Chem.Commun., 2007, 3264—3266
[22]Fu B. Q., Zhang D., Weng X. C., Zhang M., Ma H., Ma Y. Z., Zhou X.,Chem.Eur.J., 2008, 14, 9431—9441
[23]Ma H., Zhang M., Zhang D., Huang R., Zhao Y., Yang H., Liu Y. J., Weng X. C., Zhou Y. Y., Deng M. G., Xu L., Zhou X.,Chem.AsianJ., 2010, 5, 114—122
[24]Durso A., Nardis S., Pomarico G., FragalM. E., Paolesse, R., Purrello R.,J.Am.Chem.Soc., 2013, 135, 8632—8638
[25]Cannon J. R., Johnson A. W., Todd A. R.,Nature, 1954, 174, 1168—1169
[26]Djinovic K., Coda A., Antolini L.,J.Mol.Biol., 1992, 226, 227—238
[27]Lv J., Liu T. T., Cai S. L., Wang X., Liu L., Wang Y. M.,J.Inorg.Biochem., 2006, 100, 1888—1896
[28]Singh K., Kumar Y., Puri P., Kumar M., Sharma C.,Eur.J.Med.Chem., 2012, 52, 313—321
[29]López-Sandoval H., Londono-Lemos M. E., Garza-Velasco R., Poblano-Meléndez I., Granada-Macías P., Gracia-Mora I., Barba-Behrens N.,J.Inorg.Biochem., 2008, 102, 1267—1276
[30]Ott I., Abraham A., Schumacher P., Shorafa H., Gastl G., Gust R., Kircher B.,J.Inorg.Biochem., 2006, 100, 1903—1906
[31]Dimiza F., Papadopoulos A. N., Tangoulis V., Psycharis V., Raptopoulou C. P., Kessisso-glou D. P., Psomas G.,Dalton.Trans., 2010, 39, 4517—4528
[32]Dimiza F., Papadopoulos A. N., Tangoulis V., Psycharis V., Raptopoulou C. P., Kessisso-glou D. P., Psomas G.,J.Inorg.Biochem., 2012, 107, 54—64
[33]Farinas E. T., Tan J. D., Mascharak P. K.,Inorg.Chem., 1996, 35, 2637—2643
[34]Lu W. J., Wang H. M., Yuann J. M. P., Huang C. Y., Hou M. H.,J.Inorg.Biochem., 2009, 103, 1626—1633
[35]Sun Y., Hou Y. J., Zhou Q. X., Lei W. H., Chen J. R., Wang X. S., Zhang B. W.,Inorg.Chem., 2010, 49, 10108—10116
[36]Wolfe A., Shimer G. H., Meehan T.,Biochem., 1987, 26, 6392—6396
[37]Lakowicz J. R., Webber G.,Biochem., 1973, 12, 4161—4170
[38]Satyanarayana S., Dabrowiak J. C., Chaires J. B.,Biochem., 1993, 32, 2573—2584
[39]Zhang Z., Wen J. Y., Lv B. B., Li X., Ying X., Wang Y. J., Zhang H. T., Wang H., Liu H. Y., Chang C. K.,Appl.Organometal.Chem., 2016, 30, 132—139
[40]Pasternack R. F., Gibbs E. J., Villafranca J. J.,Biochem., 1983, 22, 2406—2414
[41]LePecq J. B., Paoletti C.,J.Mol.Biol., 1967, 27, 87—106
[42]Yun-Kai L. V., Li P., Jiao M. L., Liu B. S., Yang C.,Turk.J.Chem., 2014, 38, 202—209
[43]Sun Y. T., Peng T. T., Zhao L., Jiang D. Y., Cui Y. C.,J.Lumin., 2014, 156, 108—115
[44]Ivanov V. I., Minchenkova L. E., Schyolkina A. K., Poletayev A. I.,Biopolymers, 1973, 12, 89—110
[45]Nordén B., Tjerneld F.,Biopolymers, 1982, 21, 1713—1734
[46]Satyanarayana S., Dabrowiak J. C., Chaires J. B.,Biochem., 1992, 31, 9319—9324
[47]Ji L. N., Zhou X. H., Liu J. G.,Coord.Chem.Rev., 2001, 216, 513—536
[48]Inclán M., Albelda M. T., Frías J. C., Blasco S., Verdejo B., Serena C., Salat-Canela C., Díaz M. L., García-Espaa A., García-Espaa E.,J.Am.Chem.Soc., 2012, 134, 9644—9656
[49]Qi L., Ding Y. Q.,ScientiaSinicaVitae, 2013, 43(11), 939—946
[50]Xiang J. Y., Xia X. S., Jiang Y., Leung A. W. N, Wang X. N., Xu J., Wang P., Yu H. P., Bai D. Q., Xu C. S.,Ultrasonics, 2011, 51, 390—395
[51]Domingo-Gil E., Esteban M.,Apoptosis., 2006, 11, 725—738
[52]Zhao C. Q., Zhang Y. H., Jiang S. D., Jiang L. S., Dai L. Y.,AGE, 2010, 32, 161—177
[53]Green D. R., Reed J. C.,Science, 1998, 28, 1309—1312
[54]Reers M., Smiley S. T., Mottola-Hartshorn C., Chen A., Lin M., Chen L. B.,MethodEnzymol., 1995, 260, 406—414
† Supported by the National Natural Science Foundation of China(Nos.21171057, 21371059), the Natural Science Foundation of Guangdong Province, China(No.S2012040006270), the Science and Technology Innovation Foundation of Guangdong University Students(Special Foundation for Glimbing Plan) of China and the National Training Programs of Innovation and Entrepreneurship for Undergraduates(No.201514278005).
(Ed.: F, K, M)
DNA-binding and Anti-tumor Activities of Cobalt Corrole Complexes†
SHI Lei1*, YANG Wencong1, ZENG Shuying1, MO Tingting1,ZHANG Zhao2, CAO Manli1, LIU Haiyang2*
(1.DepartmentofChemistry,GuangdongUniversityofEducation,Guangzhou510303,China;2.DepartmentofChemistry,SouthChinaUniversityofTechnology,Guangzhou510641,China)
KeywordsCorrole; Phenothiazine; Porphyrin; DNA; Anti-tumor activity
Abstract10-(4-Hydroxylphenyl)-5,15-bis(pentafluorophenyl)corrolatocobalt(1-Co) and 10-(4-phenothiazine)-5,15-bis(pentafluorophenyl)corrolatocobalt(2-Co) were synthesized and characterized by NMR, HR-MS and UV-Vis spectrometries. The interactions of the two complexes with ct-DNA were studied by fluorescence, UV-Vis and circular dichroism spectrometries, viscosity measurements as well as agarose gel electrophoresis. The results suggested that complexes 1-Co and 2-Co both interact with DNAviaan outside binding mode. Furthermore, the two cobalt corrole complexes can effectively cleavage DNA under irradiation. MTT experiments indicated that both complexes display low levels of dark toxicity, but have high photocytoto-xic activity against H460, HeLa and A549 cell lines. This implies complexes 1-Co and 2-Co may have potential application in photodynamic therapy(PDT) as photosensitizer. Through the observation of the nucleus morphological and the measurement of mitochondrial membrane potential, we speculated that complex 2-Co can constrain tumor cell proliferation through the oxidative damage of mitochondria possibly.
收稿日期:2016-01-13. 网络出版日期: 2016-05-26.
基金项目:国家自然科学基金(批准号: 21171057, 21371059)、 广东省自然科学基金(批准号: S2012040006270)、 广东大学生科技创新培育专项资金(攀登计划专项资金)和国家级大学生创新创业训练计划项目(批准号: 201514278005)资助.
中图分类号O614.81
文献标志码A
联系人简介: 史蕾, 女, 博士, 讲师, 主要从事咔咯大环化合物的合成及生物学性质研究. E-mail: shil@gdei.edu.cn
刘海洋, 男, 博士, 教授, 主要从事咔咯大环化合物的合成及性质研究. E-mail: chhyliu@scut.edu.cn
