东湖通道工程对沿线底泥细菌群落结构和多样性的影响
2016-06-29赵媛莉李彤彤刘新华吕锦刚章晋勇毕永红中国科学院水生生物研究所武汉40072中国科学院大学北京00049武汉市政工程设计研究院有限责任公司武汉40022
赵媛莉李彤彤刘新华吕锦刚章晋勇毕永红(.中国科学院水生生物研究所,武汉 40072; 2.中国科学院大学,北京 00049; .武汉市政工程设计研究院有限责任公司,武汉 40022)
东湖通道工程对沿线底泥细菌群落结构和多样性的影响
赵媛莉1,2李彤彤1,2刘新华1,2吕锦刚3章晋勇1毕永红1
(1.中国科学院水生生物研究所,武汉 430072; 2.中国科学院大学,北京 100049; 3.武汉市政工程设计研究院有限责任公司,武汉 430022)
摘要:为调查东湖通道工程对沿线底泥细菌群落结构和多样性可能造成的影响,随着隧道施工的进程,在东湖通道沿线的3个湖区中的19个采样点进行了3次采样,通过PCR-DGGE结合分子克隆技术,分析了细菌群落的群落结构及多样性。3批样品共检出细菌类群分别为5门18属、6门17属、5门11属。在门水平上,底泥中的优势菌是变形菌门,但其在总量中的比例随施工进程逐渐下降,依次为86%、80.6%和43.9%。在属水平上,施工初期的优势菌是埃希氏杆菌属,施工后期却是Steroidobacter。通道施工初期,汤菱湖、郭郑湖的湖心区域在属水平上的群落结构相似性较高,与团湖差异显著; 接近施工区样点与远离施工区样点的底泥细菌群落存在显著差异; 因施工形成的临时封闭水域与敞水区除均有埃希氏杆菌属外,其他菌属类群差异显著。施工后期的汤菱湖、郭郑湖及团湖的湖心区的底泥微生物群落结构趋于相似; 接近施工区样点与远离施工区样点的底泥细菌群落差异不显著; 封闭区和敞水区有相似的细菌群落结构。施工期间,细菌群落的多样性指数的最高点都有出现在靠近施工区的位置。各批次样点的Simpson_1-D指数、Shannon_H指数、Margalef指数,均随着施工进程而逐渐增加。因此,东湖通道修建对通道沿线近距离的底泥细菌的群落结构和多样性产生了较显著的影响,这种影响是暂时性还是持续性的,尚需通道完工回填后的长期评估。研究将为进一步探讨通道修建等人为强干扰活动对浅水湖泊的可能环境影响和制定合理的生态修复策略提供理论基础和数据支撑。
关键词:东湖通道工程; 底泥细菌群落; 种类组成; 群落结构; 多样性; 影响; PCR-DGGE
东湖(114°23′E,30°22′N)位于武汉市武昌区东北部,最大水深4.75 m,平均水深2.21 m,年平均气温18.3℃,年均水温18.5℃,是长江中下游的一个中型浅水湖泊,流域面积187 km2,由多个大小不同的子湖组成[1]。随着武汉城市的不断发展,东湖环湖路已成为武珞路车辆分流的一条交通干线,景区超负荷车流日益破坏景区生态环境,为了加强东湖风景名胜区保护,合理利用与开发景区资源,武汉市开启了东湖通道建设[2]。东湖通道工程位于AAAAA级东湖风景名胜区内。通道起点与二环线水东段主线高架桥红庙立交衔接,于九女墩北侧进入隧道,隧道下穿郭郑湖北侧,过湖心岛,再下穿汤菱湖、沿湖路、郭郑湖南侧、梅园大门和磨山小区,穿过鲁磨路、访梅路与团山路路口后,起坡出地面。经过0.3 km地面段后再次于团山以北进入隧道,下穿团山后,于喻家湖北路以北出隧道,以地面段与喻家湖北路相接,止于喻家湖路光谷大道主线高架桥(虹景立交),全长12.14 km,其中湖底隧道全长约6.2 km[3]。隧道施工不可避免会影响东湖生态环境,并可能导致生态环境恶化,造成水环境污染,其中施工区废水是主要污染源[4],明渠开挖造成的湖底裸露与施工造成的底泥再悬浮等也将对隧道周边微生物群落结构造成不同程度的影响。湖泊底泥是一个微生物物种丰富、物质交换频繁、生物活性高的环境[5],且底泥微生物在物质循环及能量流动中起着重要作用。湖泊底泥微生物群落结构是水体环境变化和演替的重要标志,湖泊水环境质量的改变使其底泥微生物在数量和群落结构上发生变化,同时底泥中的微生物也会反过来影响湖泊水环境的质量。
为了考察东湖通道工程对沿线底泥细菌群落结构和多样性造成的可能影响,本研究以武汉东湖通道修建的周边底泥细菌为研究对象,运用PCRDGGE及分子克隆、测序技术,初步研究了通道修建期间武汉东湖3个主要受影响湖区底泥细菌类群的群落组成及多样性的变化,进而探讨通道修建的人为强干扰活动对浅水湖泊的可能影响,为制定合理的生态防护与修复策略提供理论基础和数据支撑。
1 材料与方法
1.1 采样时间和采样位置
根据GPS定位系统在东湖隧道周边的3个湖区内设置了19个采样点(图 1),红色虚线指的是建通道的位置,其中选取沙滩浴场4个(1—4#)、汤菱湖4个(5—8#)、郭郑湖10个(9—17#)、团湖2个(18—19#),并于2014年3月26日(第一批)、2014年4月22日(第二批)、2014年5月23日(第三批)各采样一次。其中第一批和第二批属于施工初期,第三批属于施工后期。施工初期,北岸敞口段,北侧岸边及湖底隧道暗埋段,沙滩浴场段隧道,湖底隧道暗埋段,半敞口式隧道和南岸敞口段均处于正在施工中。施工后期,沙滩浴场段隧道水已完全抽干,北岸敞口段,北侧岸边及湖底隧道暗埋段,湖底隧道暗埋段,半敞口式隧道和南岸敞口段也均处于施工中。用SBR-1型便携式沉积物-界面水采样器对底泥表层进行取样,顺序编号后用锡箔纸包裹,迅速置于4℃保存并带回实验室,部分底泥保存于-80℃备用。
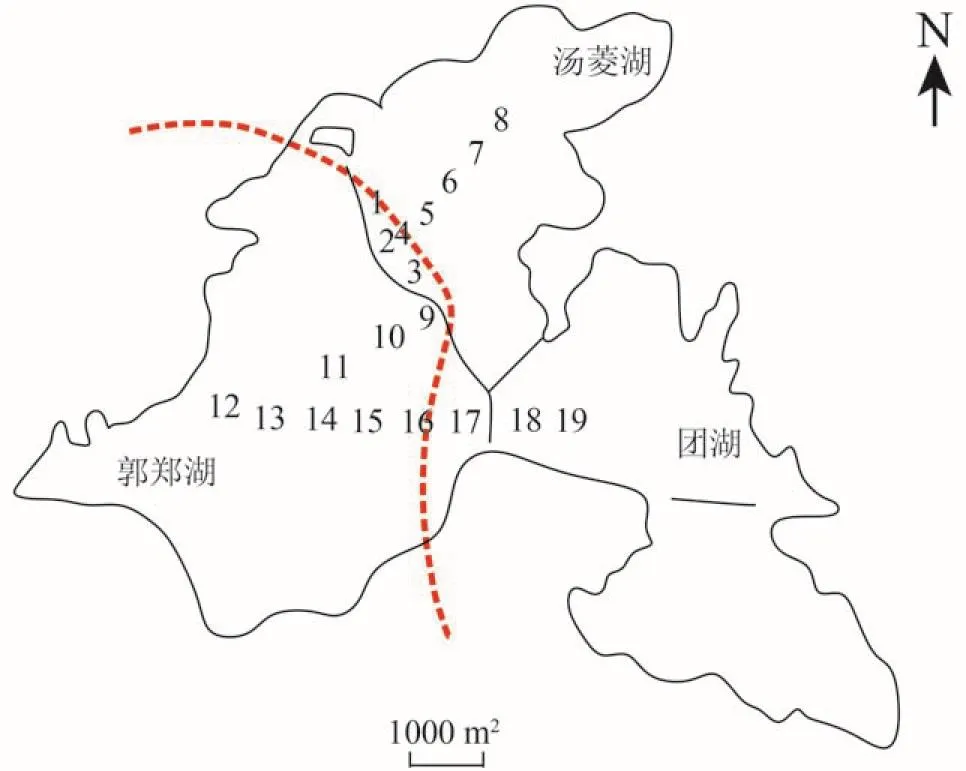
图 1 东湖建隧道的采样点示意图
1.2 样品分析
细菌总基因组提取 采用MP FastDNA土壤自旋提取试剂盒,具体操作参照说明书,提取完毕即用或保存于-20℃备用。
16S rDNA V3区PCR扩增 使用通用引物R518和5′端带40 bp GC夹的细菌特异性引物F338扩增基因组DNA[6]。采用50 μL PCR体系的降落PCR方法,程序如下:94℃预变性4min; 94℃变性30s,61℃退火30s,72℃延伸30s,然后每循环一次,降低0.5℃,进行10个循环; 94℃变性30s,56℃退火30s,72℃延伸30s,共20个循环; 72℃延伸10min。PCR产物用含有EB(溴化乙锭)染色剂的1.0%琼脂糖凝胶电泳进行检测,紫外成像并保存结果。其中为了便于对污染源进行追踪,在每一组PCR扩增过程中都设立了一个阴性对照(阴性对照除了不加模板DNA外,其余组分均加)。
变性梯度凝胶电泳 通过DGGE(Dcode system,BioRad)将细菌总基因组DNA的扩增产物进行变性梯度凝胶电泳,从而来分析细菌群落特征。所选用的聚丙烯酰胺的变性梯度范围为40%—60%,缓冲液为1×TAE,电泳参数为110 V、16h,温度为60℃,电泳结束采用银染法进行染色。
细菌16S rDNA片段克隆和测序 将DGGE图谱上的优势条带和特征条带割胶回收,放入1.5 mL的离心管,加入10 μLTE(pH 8.0),4℃浸泡一夜,以使DNA从凝胶中释放,然后取1 μL作为模板,使用F338(不带GC夹)和R518作为引物进行PCR扩增,扩增反应,热盖温度99℃,94℃预变性5min,94℃变性30s,55℃退火30s,72℃延伸30s,30个循环,最后在72℃延伸10min,4℃保存。纯化PCR产物之后连接到pMD18-T载体(TaKaRa,日本)质粒上,连接产物转入感受态DH5α大肠杆菌,之后挑选阳性克隆送往武汉擎科创新生物科技有限公司测序。
数据处理和统计分析 通过Quantity One4.2.3软件导出变性梯度凝胶电泳图谱条带丰度数据矩阵。运用PAST软件对生成的数据矩阵(属水平)进行基于Jaccard similarity/distance的PCoA分析,且计算出Simpson_1-D、Shannon_H、Margalef指数,来分析细菌群落结构的多样性。测序得到的序列去除载体序列后,在RDP(Ribosomal Database Project Ⅱ-Release 9 website,http://rdp.cme.msu.edu)上进行细菌分类分析,置信度阈值为80%[7]。并用R语言软件对数据矩阵(属水平)作出Heatmap图(http://www.r-project.org/)来对3批样品属水平的细菌群落进行聚类[8]。由于本文分析测试的数据分布不属于正态分布,因此采用独立样本的非参数检验对样本进行分析(SPSS,v19.0),多个组间计量资料比 较采用Kruskal-Wallis检验。数据显著性水平确定为P<0.05。
2 结果
2.1 种类组成
施工初期,第一批样品共检出5门18属,分别是Proteobacteria(变形菌门)、Acidobacteria(酸杆菌门)、Firmicutes(厚壁菌门)、Chloroflexi(绿弯菌门)、Bacteroidetes(拟杆菌门),各占86%、7.2%、2.6%、2.3%和1.9%(图 2A),种类最多的门是变形菌门,有11属细菌类群; 其次是酸杆菌门,有4属细菌类群; 厚壁菌门,有2属细菌类群,绿弯菌门和拟杆菌门均1属细菌类群。沙滩浴场处(样点1、2、3、4)所在的封闭区域与汤菱湖(样点6、7、8)和郭郑湖(样点10、11、12)的敞水区域均有埃希氏杆菌属(图 3A),但其他菌属存在显著差异(P<0.05;Kruskal-Wallis)。在汤菱湖中,最靠近通道的5、6号样点与较通道稍远的7、8号样点的种类组成,除优势菌群相同,其他菌属存在显著差异(P<0.05;Kruskal-Wallis); 在郭郑湖中,通道两侧的15、16样点的种类组成相近,但与这个湖中其他的样点(9、10、11、12、13、14)的菌属存在显著差异(P<0.05; Kruskal-Wallis); 在团湖中,最靠近通道的17与18号样点的种类组成也略有不同。且在汤菱湖的湖心区域(样点7、8)和郭郑湖的湖心区域(样点11、12)在属水平上的群落结构存在一定的均一性,而与团湖差异显著(P<0.05; Kruskal-Wallis)。
第二批样品共检出6门1 7属,分别是Proteobacteria(变形菌门)、Chloroflexi(绿弯菌门)、Verrucomicrobia(疣微菌门)、Fusobacteria(梭杆菌门)、Aminicenantes,各占80.6%、6.6%、2.2%、0.8%和2.2%(图 2B),其中种类最多的门是变形菌门,有12属细菌类群; 其次是绿弯菌门和梭杆菌门均有2属细菌类群,疣微菌门和Aminicenantes均有1属细菌类群。沙滩浴场处(样点2、3)所在的封闭区域与汤菱湖(样点6、7、8)和郭郑湖(样点10、11、12)的敞水区域均有埃希氏杆菌属(图 3B),但其他菌属存在显著差异(P<0.05; Kruskal-Wallis)。在汤菱湖中,最靠近通道的5号样点与6、7、8号样点的种类组成,除优势菌群相同,其他菌属存在显著差异(P<0.05; Kruskal-Wallis); 在郭郑湖中,通道两侧的15、16样点的种类组成相近,但与该湖中其他的样点(9、10、11、12)差异显著(P<0.05; Kruskal-Wallis); 在团湖中,最靠近通道的17与18、19号样点的优势菌群都不同,且种类组成相比略少。尽管各湖湖心区域细菌种类组成存在明显差异(P<0.05; Kruskal-Wallis),但各自湖心样点的细菌种类组成均较为相似,如汤菱湖(7、8样点)、郭郑湖(11、12样点)、团湖(18、19样点)。
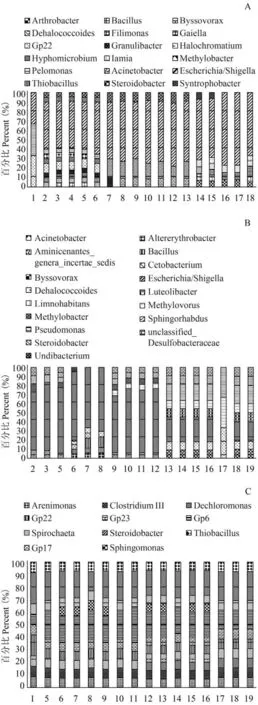
图 3 以属水平的细菌类群在每个样点的分布情况
施工后期,第三批样品共检出5门11属,分别是Proteobacteria(变形菌门)、Acidobacteria(酸杆菌门)、Chloroflexi(绿弯菌门)、Firmicutes(厚壁菌门)、Spirochaetes(螺旋体门),各占43.9%、25.1%、7.4%、3.7%和3.7%(图2C),其中种类最多的门仍是变形菌门,有5属细菌类群,但所占比例有所降低; 其次是酸杆菌门有4属细菌类群,螺旋体门有1属细菌类群。沙滩浴场处(样点1)所在的封闭区域与汤菱湖(样点6、7、8)和郭郑湖(样点10、11、12)的敞水区域的细菌类群很相似(图 3C),与施工初期的前两批细菌类群差异显著(P<0.05; Kruskal-Wallis)。在汤菱湖中,最靠近通道的5号样点与6、7、8号样点的种类组成略有不同; 在郭郑湖中,通道两侧的15、16样点的种类组成相近,但与这个湖中其他的样点(9、10、11、12)差异显著(P<0.05;Kruskal-Wallis); 在团湖中,最靠近通道的17与18、19号样点的种类组成相同。且各湖湖心区域细菌种类组成较相似。以上三批样品,由以上数据可得知,施工后期的样品(第三批)和施工初期(前两批)种类组成上发生了显著变化。
2.2 群落结构
在对这三批样品的属水平的菌群结构做基于Jaccard similarity/distance的主坐标分析时发现(图4),沿着PC1坐标的方向(贡献率为38.5%)的第三批样品(施工后期)与第一批、第二批样品(施工初期)远远分开。总体而言,经主坐标分析所得的2个主坐标,累计贡献率为52.1%。得出第三批样品(施工后期)的属水平的菌群结构与前两批(施工初期)存在显著差异(P<0.05; Kruskal-Wallis)。
如图 5,以属为水平的细菌类群,主要有Escherichia/Shigella(埃希氏杆菌属)、Halochromatium(盐着色菌属)、Acinetobacter(不动杆菌属)、Bacillus(芽孢杆菌属)、Pseudomonas(假单胞菌属)、Spirochaeta(螺旋体属)、Steroidobacter、Gp22等。热图中颜色的渐变可以形象的看出,各样点的细菌类群的组成及数量的变化。同时,热图可以很明显的看出,施工后期的样品(第三批)和施工初期(前两批)没有聚在一起,而是独自聚在一簇,说明施工后期的以属为水平的各样点的细菌类群的群落结构与施工初期有明显的区别。由此可推测施工后期,细菌类群的群落结构发生了变化。
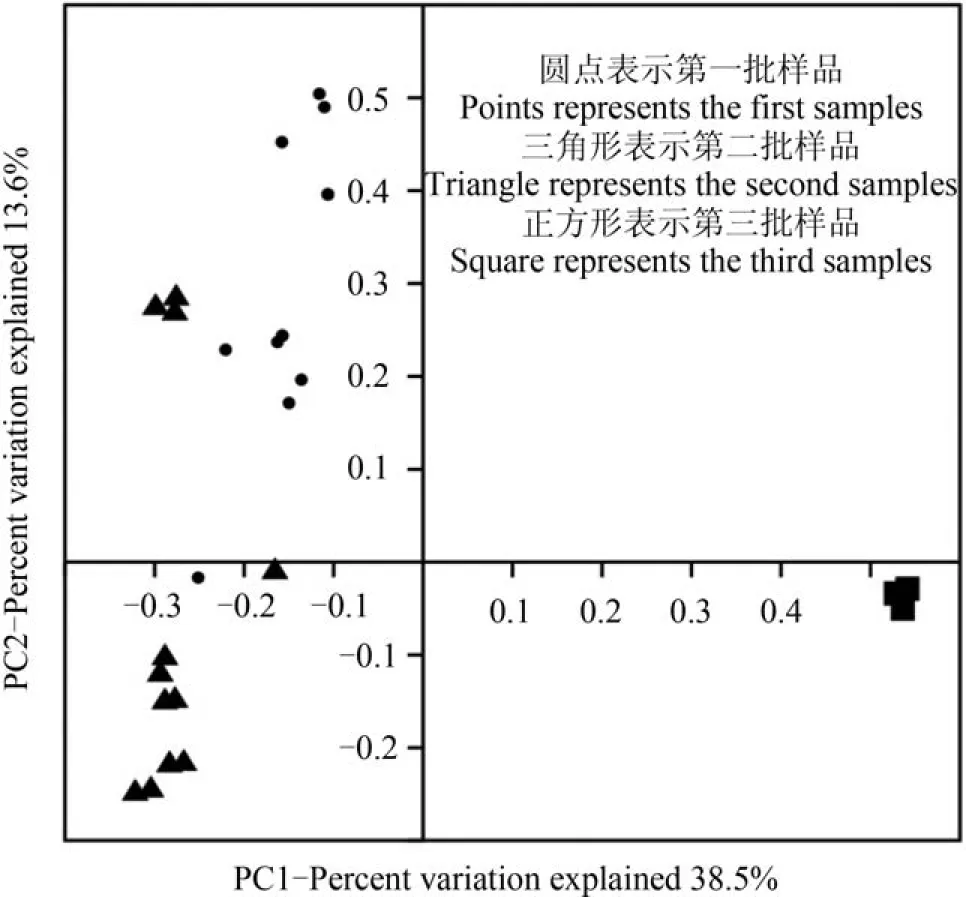
图 4 以属为水平的细菌类群,三批样品基于Jaccard similarity/ distance的主坐标分析图
2.3 物种多样性
在施工初期的样品(第一批)中,Simpson_1-D指数、Shannon_H指数、Margalef指数最高的采样点均是5号,5号是一个在汤菱湖中最靠近通道的采样点; 在第二批样品中,Simpson_1-D指数、Shannon_H指数、Margalef指数最高的采样点分别是13(14、15)号、16号、16号,15和16号是在郭郑湖中最靠近通道的采样点; 在施工后期的样品(第三批)中,Simpson_1-D指数、Shannon_H指数、Margalef指数最高的采样点均是6(15)号,其中15号是在郭郑湖中最靠近通道的采样点,6号是在汤菱湖中较靠近通道处,而9号采样点的三种多样性指数均低于5、15、16号采样点,9号是和通道隔着一条路。由此可知,在每一批样品中的细菌群落的各种多样性指数最高的都有出现在靠近通道处的采样点。各批次样点的Simpson_1-D指数、Shannon_H指数、Margalef指数,随着施工进程的变化范围分别为0.5781—0.947、1.099—2.944和1.303—6.113,且随着施工的进程,相应样点的指数(除5、6)都是逐渐增加的(表 1)。3批次相同样点的微生物群落的多样性指数存在显著差异(P<0.05;Kruskal-Wallis)。因此可知,随着施工的进程,细菌的多样性也相应增加。
3 讨论
本文是采用DGGE结合分子克隆技术,来分析东湖通道工程对沿线底泥细菌群落结构和多样性可能造成的影响,DGGE技术尽管与理论预期存在一定的差距,但依旧能够较好地反映环境中微生物群落结构的多样性[9]。外界环境条件的改变等因素是造成环境微生物群落变化的主要原因[10,11],环境细菌的群落结构特征及其变化能灵敏地反映环境的现状与变化趋势,在环境监测及污染治理工程中有非常重要的指示作用[12]。
3.1 东湖通道工程对沿线底泥细菌群落的种类组成和群落结构的影响
目前报道的淡水湖泊沉积物中的优势菌群通常是变形菌门[13,14],在我们这3批样品中均有体现,但可以看出3批样中变形菌门占总量的比例在逐渐下降,依次为86%、80.6%和43.9%。特别是第三批,变形菌门下降了近一半,酸杆菌门填补了空缺,占据总量的25.1%,说明在门水平的细菌群落结构发生了变化。属水平的优势菌群也发生了明显的变化:施工初期的样品(第一批和第二批)是埃希氏杆菌属,到施工后期的样品(第三批)是Steroidobacter,说明在属水平上的细菌群落结构发生了明显的变化。通道施工初期,汤菱湖、郭郑湖的湖心区域在属水平上的群落结构相似性较高,说明东湖主湖底泥细菌群落结构存在一定的均一性,而与团湖差异显著,这可能与团湖面积小而又与主湖隔离、莲藕栽种形成的底泥性质差异等有关; 在接近施工区样点与远离施工区样点的底泥细菌群落存在显著差异; 在沙滩浴场处,通道建设形成的临时封闭区域(样点1、2、3、4)与在汤菱湖(样点6、7、8)、郭郑湖(样点10、11、12)敞水区域,除均有埃希氏杆菌属外,其他菌属类群差异显著。施工后期,汤菱湖、郭郑湖及团湖的湖心区的底泥微生物群落结构趋于相似; 接近施工区样点与远离施工区样点的底泥细菌群落差异不显著; 封闭区和敞水区有相似的细菌群落结构,很可能是隧道施工的原因。由于东湖隧道施工区废水氮磷含量高于东湖原水,施工区废水TN是东湖原水的2—5倍,TP是东湖原水的5—7倍[15],而环境因素(OrgC,OrgN,TN,TC,TP等)对湖泊沉积物细菌群落结构多样性具有非常重要的影响[16,17],且水体环境的变化会影响沉积物中的细菌群落结构[18]。由此可推知,在东湖长期处于施工中,导致施工后期时东湖的水质较均一,均含有氮磷含量较高的废水,这是使得各处中底泥微生物的群落结构相似的原因之一。所以东湖通道工程对沿线底泥细菌的群落种类组成与结构产生了显著的影响。
3.2 东湖通道工程对沿线底泥细菌的多样性的影响
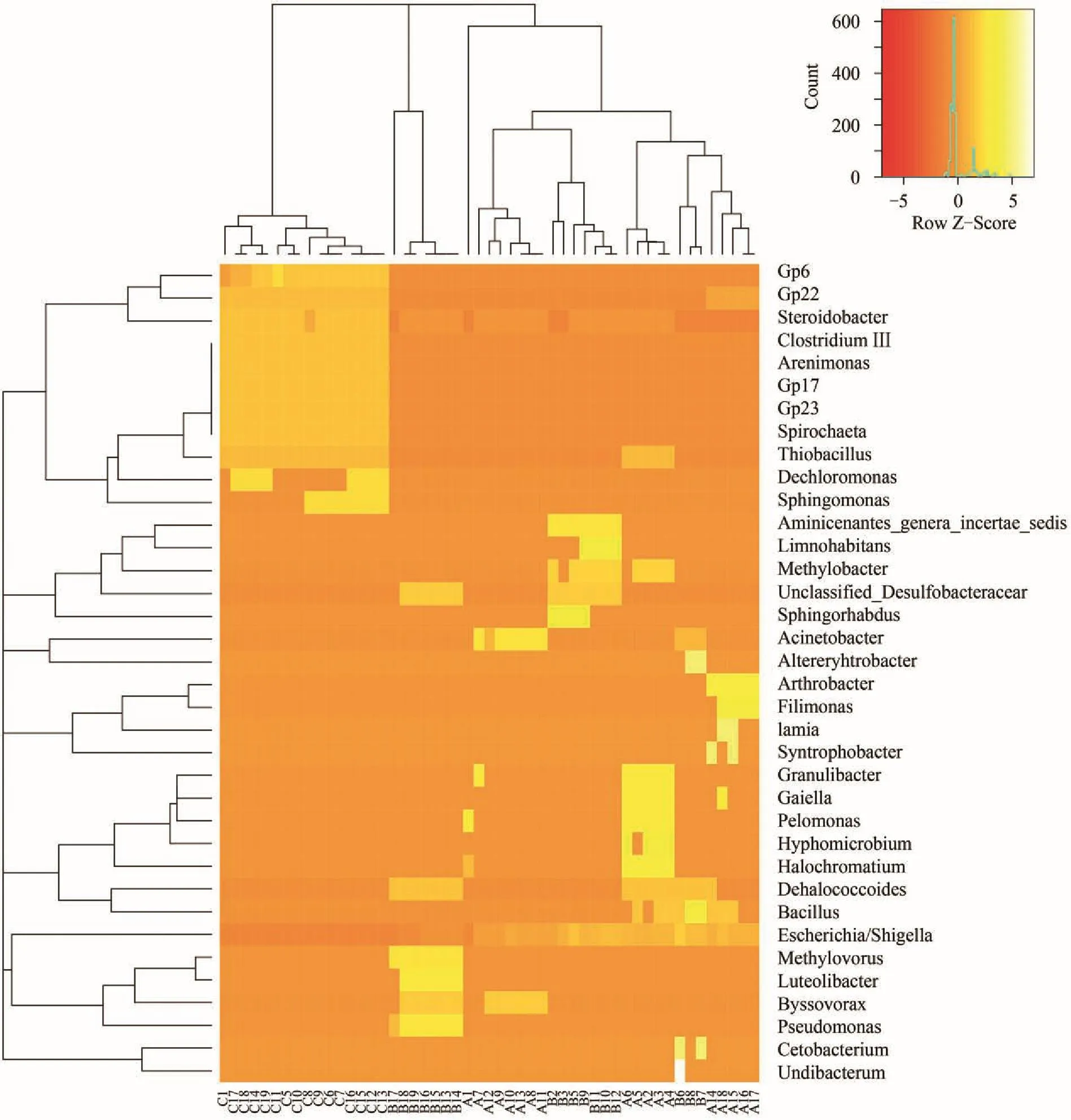
图 5 以属水平的细菌类群的热图
DGGE图谱中条带的多少可直观地反映每个采样点细菌的多样性的丰富程度,但多样性指数是研究群落物种数和个体数及其分布均匀度的综合指标[19]。Simpson指数(1-D)是随机取样的两个个体属于不同种的概率。Shannon均匀度指数是通过Shannon多样性指数计算出来的均度,包含两个因素:一是种类数目,即丰富度; 二是种类中个体分布的均匀度。种类数目越多,多样性越大; 同样,种类之间个体分配的均匀性增加也会使多样性提高[20]。Margalef指数反映群落物种丰富度,指数越大,细菌群落物种越丰富。在底泥细菌群落多样性指数中,每一批样品中的细菌群落的多样性指数最高的都有出现在靠近施工区采样点。随着通道施工的进程,Simpson_1-D指数、Shannon_H指数、Margalef指数均呈现逐渐升高,除了样点(5、6)外,这两个样点出现反常现象有可能是提取DNA的泥样,不具有该样点的代表性。细菌群落的3种多样性指数普遍是5月份大于4月份,4月份大于3月份,从3月到5月份,由春天逐步过渡到初夏,气温慢慢升高,有可能季节变化对微生物的多样性有一定的影响,推测温度[21]是影响湖泊沉积物中细菌群落结构多样性的因素之一,对其产生正相关的作用。然而在人为污染严重的环境中,较高的微生物多样性能够完成更多的生物地化循环过程,从而保持生态系统的稳定性,因此微生物丰度的增加是微生物群落适应环境变化的表现[22]。由此可推知,随着施工的进程,通道周边底泥细菌群落的多样性增加,是底泥微生物为了更好的适应变化的生态环境而出现的一种现象。所以东湖通道工程对沿线底泥细菌多样性产生了显著的影响。
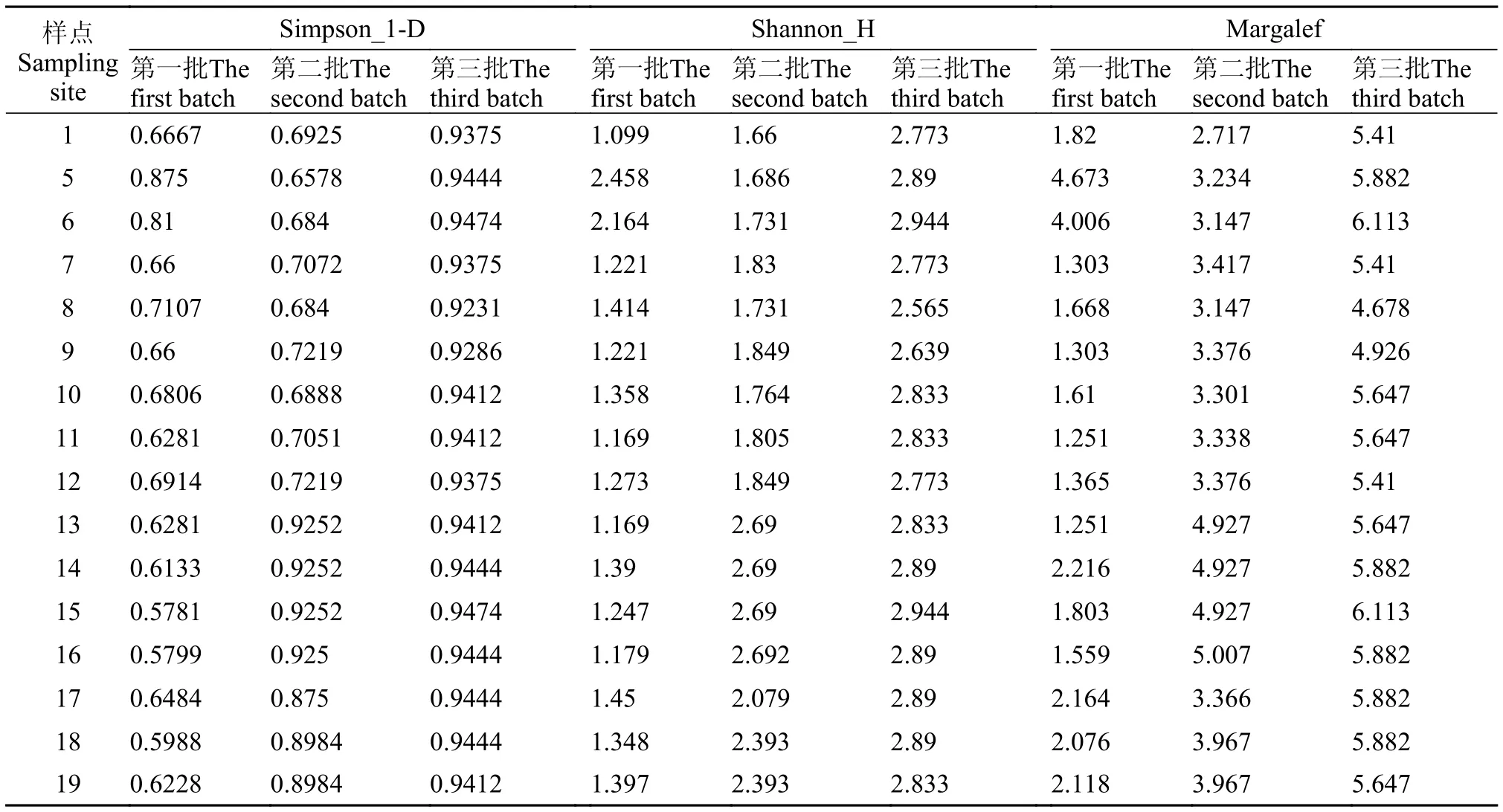
表 1 细菌多样性指数Tab.1 Bacterial diversity index
在东湖建通道中,对周边底泥细菌群落造成影响的很可能的环境因子是明渠开挖造成的湖底裸露与施工造成的底泥再悬浮。但是如何减少这些干扰因子对生态环境的影响,还需要更多的数据资料,进行更深入的研究。本文为东湖通道工程实施完后,进行填补东湖,探讨是否能恢复原来生态环境提供理论依据和数据支持。
参 考 文 献:
[1]Liu J G.Summary of Studies on the Ecology of Lake Donghu(First)[M].Beijing:Science Press.1990,379—387[刘建康.东湖生态学研究(一).北京:科学出版社.1990,379—387]
[2]Lin K M,Xi X B,Sun Y.Selection of Wuhan Donghu tunnel line[J].Urban Roads Bridges & Flood Control,2014,1(1):34—37[林克美,席晓波,孙勇.武汉市东湖通道路线选择.城市道桥与防洪,2014,1(1):34—37]
[3]Li C J.Cofferdam construction influence on the east lake flood controlled andmeasure[J].China Water Transport,2014,5(14):186—187[李长江.围堰施工对东湖防洪的影响及应对措施.中国水运,2014,5(14):186—187]
[4]Yang B,Mo P,Wu D G.Analysis of characters of quality of waste waterfrom tunnel construction[J].Technology of Highway and Transport,2009,6(3):133—137[杨斌,莫苹,吴东国.隧道施工废水水质特征分析.公路交通技术,2009,6(3):133—137]
[5]Zhao X Q,Yang L Y,Yin D Q,et al.Vertical distribution of physicochemical characteristics and the microbial diversity in different spatial sediments samples in Lake Taihu[J].Environmental Science,2008,29(12):3537—3545[赵兴青,杨柳燕,尹大强,等.不同空间位点沉积物物理化性质与微生物多样性垂向分布规律.环境科学,2008,29(12):3537—3545]
[6]Zhou W.Application of the PCR-DGGE to analyze the community biodiversity of soil bacteria in intensive cropping system[D].Thesis for Master of Science.Zhengzhou University,Zhengzhou.2007[周伟.基于PCRDGGE方法得集约化土壤细菌遗传多样性分析.硕士学位论文,郑州大学,郑州.2007]
[7]Wang Q,Garrity G M,Tiedje J M.Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J].Applied Environmental Microbiology,2007,73(16):5261—5267
[8]Li T T,Long M,Gatesoupe F J,et al.Comparative analysis of the intestinal bacterial communities in differentspecies of carp by pyrosequencing[J].Microbiology Ecology,2015,69(1):25—36
[9]Ni J J,Yu Y H.Assessing the reliability of DGGE by retrieving and sequencing DNA fragments in gel bands[J].Acta Hydrobiologica Sinica,2014,38(3):454—458[倪加加,余育和.凝胶条带内DNA回收测序评估DGGE可靠性.水生生物学报,2014,38(3):454—458]
[10]Koizumi Y,Takii S,Fukui M.Depth-related change in archaeal community structure in a freshwater lake sediment as determined with denaturing gradient gel electrophoresis of amplified 16S rRNA genes and reversely transcribed rRNA fragments[J].FEMS Microbiology Ecology,2004,48(2):285—292
[11]Wang F S,Liu C Q,Liang X B.Biogeochemical cycling of iron at lake water-sediment interface and its influence on trace metals[J].Geology-Geochemistry,2013,31(3):63—69[汪福顺,刘丛强,梁小兵.湖泊沉积物-水界面铁微生物地球化学循环及其与微量金属元素的关系.地质地球化学,2013,31(3):63—69]
[12]Sun Q H,Bo Q H,Zhao C,et al.Comparison of DGGE T-RFLP and LH-PCR in the analysis of microbial community diversity for two kinds of activated sludges[J].Chinese Journal of Environmental Engineering,2009,3(8):1365—1370[孙庆华,柏耀辉,赵翠,等.DGGE、T-RFLP、LH-PCR对两种活性污泥的微生物种群多样性分析的比较.环境工程学报,2009,3(8):1365—1370]
[13]Spring S,Schulze R,Overmann J,et al.Identification and characterization of ecologically significant prokaryotes in the sediment of freshwater lakes:molecular and cultivation studies[J].FEMS Microbiology Reviews,2000,24(5):573—590
[14]Tamaki H,Sekiguchi Y,Hanada S,et al.Comparative analysis of bacterial diversity in freshwater sediment of a shallow eutrophic lake by molecular and improved cultivation-based techniques[J].Applied and Environmental Microbiology,2005,71(4):2162—2169
[15]Wang B L,Huang Y B,Lü J G,et al.Investigation on the quality of waste water from East Lake tunnel construction and characteristics of its hydrostatic settling[J].Environment Science & Technology,2014,37(120):437—440[王斌梁,黄宇波,吕锦刚,等.东湖通道施工区废水及其静沉降特性研究.环境科学与技术,2014,37(120):437—440]
[16]Dang H,Wang C,Li J,et al.Diversity and distribution of sediment nirS-encoding bacterial assemblages in response to environmental gradients in the eutrophied Jiaozhou Bay,China[J].Microbial Ecology,2009,58(1):161—169
[17]Fortunato C S,Carlini D B,Ewers E,et al.Nitrifier and denitrifier molecular operational taxonomic unit compositions from sites of a freshwater estuary of Chesapeake Bay[J].Canadian Journal of Microbiology,2009,55(3):333—346
[18]Song H N,Du B H,Zhang M Y.Effect of environment factors on bacterial community in lake Dongping sediment[J].Acta Microbiologica Sinica,2010,50(8):1065—1071[宋洪宁,杜秉海,张明岩,等.环境因素对东平湖沉积物细菌群落结构的影响.微生物学报,2010,50(8):1065—1071]
[19]Nie Z J,Xu G C,Du F K,et al.PCR-DGGE fingerprinting and diversity analysis of the predominant bacterial community in Coilia nasus[J].Acta Hydrobiologica Sinica,2015,39(5):1019—1026[聂志娟,徐钢春,杜富宽,等.长江刀鲚体内菌群PCR-DGGE指纹图谱及多样性比较分析.水生生物学报,2015,39(5):1019—1026]
[20]Li X W.The characteristics of bacterial community in response tooil pollution and copper pollution in Jiaozhou bay sediment[D].Thesis for Master of Science.Ocean University of China,Qingdao.2012[李新伟.胶州湾近岸沉积物中细菌群落对石油和铜污染的响应特征.硕士研究生论文,中国海洋大学,青岛.2012]
[21]Zhang Y.Study on microbial diversity and anammox bacteria identification in lake sediments[D].Thesis for Master of Science.Huazhong Agricultural University,Wuhan.2012[张钰.湖泊沉积物微生物多样性和厌氧氨氧化菌鉴别研究.硕士研究生论文,华中农业大学,武汉.2012]
[22]Hunter-Cevera J,Karl D,Buckley M.Marine Microbial Diversity,the Key to Earth's Habitability[A].Washington DC:American Academy of Microbiology.2005,1—22
THE POSSIBLE EFFECT OF TUNNEL CONSTRUCTION ON THE SEDIMENT BACTERIAL COMMUNITY AND DIVERSITY IN LAKE EAST
ZHAO Yuan-Li1,2,LI Tong-Tong1,2,LIU Xin-Hua1,2,LÜ Jin-Gang3,ZHANG Jin-Yong1and BI Yong-Hong1
(1.Institute of Hydrobiology,Chinese Academy of Sciences,Wuhan 430072,China; 2.University of Chinese Academy of Sciences,Beijing 100049,China; 3.Wuhan Municipal Engineering Design & Research Institute Co.,Ltd.,Wuhan 430022,China)
Abstract:To evaluate effects of tunnel construction on the sediment bacterial community and diversity in Lake East,19 sampling points were selected and analyzed for 3 consecutive time points during the construction process.The PCRDGGE and molecular cloning were applied to analyze the bacterial species composition,community and diversity of all sampling sediment.A total of 18 bacterial genera belonging to 5 phyla,17 bacterial genera belonging to 6 phyla and 11 bacterial genera belonging to 5 phyla were identified from 3 different batches of sediment samples,respectively.At the level of phylum,Proteobacteria was predominant bacteria among all three batches,but its percentage among the total diversity was decreased with the tunnel construction,presenting 86%,80.6% and 43.9%,respectively.At the level of genera,Escherichia/Shigella was predominant bacteria at the first sampling while Steroidobacter at the third sampling.Attheearly stage of tunnel construction,bacterial community structure of the middle area of Lake Tangling and Lake Guozheng were similar at the level of genus,which was significantly different from those of Lake Tuan.The effect of tunnel construction on the sediment bacterial community was distance dependent.The bacterial community of the temporarily producing closed area for tunnel construction was remarkably different from that of open water area,although both contain Escherichia/Shigella.However,the community diversity and composition of the middle area of Lake Tangling,Lake Guozheng and Lake Tuan became similar at the late stage of tunnel construction.The distance dependent effect of tunnel construction on the bacterial community was not significant at the late stage of tunnel construction.Additionally,temporarily forming closed area was similar to open water area regarding their sediment bacterial community composition.During the construction,the highest diversity index of bacterial community for all three batches of samples appeared in the sampling point adjacent the tunnel.The Simpson_1-D index,Shannon_H index and Margalef index gradually increased with the tunnel construction.Therefore,our results indicated that the tunnel construction had a remarkable influence on the bacterial community and diversity of Lake East sediment,although the long-term effect should be further evaluated.
Key words:Tunnel construction in Lake East; Sediment bacteria; Species composition; Community structure;Diversity; The possible effect; PCR-DGGE
中图分类号:Q145+.2
文献标识码:A
文章编号:1000-3207(2016)03-0565-09
doi:10.7541/2016.76
收稿日期:2015-06-12;
修订日期:2015-12-12
基金项目:武汉市“重度人工干扰下水环境污染处置及综合控制关键技术研究”项目资助[Supported by the Research of Key Technologies for Disposal and Control of Water Environmental Pollution Caused by Severe Aritifical Intereference]
作者简介:赵媛莉(1991—),女,湖北鄂州人; 硕士研究生; 研究方向为微生物生态学。E-mail:zhaoyl@ihb.ac.cn
通信作者:章晋勇,E-mail:zhangjy@ihb.ac.cn; 毕永红,E-mail:biyh@ihb.ac.cn
