食蚊鱼CYP19b基因克隆及环境激素暴露对其表达的影响
2016-06-29赖静萍闫月明温茹淑方展强华南师范大学生命科学学院广东省高等学校生态与环境科学重点实验室广州5063嘉应学院生命科学学院梅州5405
赖静萍闫月明温茹淑方展强(.华南师范大学生命科学学院,广东省高等学校生态与环境科学重点实验室,广州 5063;.嘉应学院生命科学学院,梅州 5405)
食蚊鱼CYP19b基因克隆及环境激素暴露对其表达的影响
赖静萍1闫月明1温茹淑2方展强1
(1.华南师范大学生命科学学院,广东省高等学校生态与环境科学重点实验室,广州 510631;2.嘉应学院生命科学学院,梅州 514015)
摘要:为探讨17β-雌二醇(E2)、17α-甲基睾酮(MT)和雄烯二酮(AED)暴露对食蚊鱼脑组织CYP19b表达的影响,首次克隆和分析了食蚊鱼(Gambusia affinis)CYP19b cDNA的全系列。采用静水暴露方法,分别设置2、10、50和100 ng/L E2、MT和AED各4个实验组,并设置对照组和平行组,定量测定了1、3、5和7d脑组织中的CYP19b mRNA表达水平的变化。成功克隆了食蚊鱼CYP19b基因全长,获得基因片段总长1670 bp,ORF(Open Reading Frame)是从52 bp到1554 bp,共编码501个氨基酸。通过与其他相关鱼类CYP19b基因编码的氨基酸序列相似性作比较,食蚊鱼CYP19b基因氨基酸序列的同源性很高。结果显示,短时间的暴露,E2较低浓度组(2和10 ng/L)对食蚊鱼作用不明显,但E2相对较高浓度组(50和100 ng/L)能显著地上调食蚊鱼CYP19b基因的表达(P<0.01)。暴露早期MT对CYP19b表达无明显影响,随着暴露时间的持续延长,除了MT较高浓度组(50 ng/L)外,其他各浓度组MT对CYP19b的表达有显著的抑制作用(P<0.01),并呈一定的剂量相关关系。AED作为雄激素类似物与MT的作用效果相似,相对较高浓度(50和100 ng/L)的AED抑制CYP19b的表达(P<0.01)。研究结果初步表明,3种典型环境激素对食蚊鱼CYP19b基因表达的影响十分显著,但不同的暴露浓度及不同的取样时间点可能表现为促进或抑制CYP19b基因的表达。
关键词:环境激素; CYP19b基因; mRNA表达; 雌二醇; 甲基睾酮; 雄烯二酮; 食蚊鱼
细胞色素P450芳香化酶简称P450arom或CYP19,能够催化17α-甲基睾酮(17α-methytestosterone,MT)和雄烯二酮(Androstenedione,AED)不可逆的转化为雌激素,是雌激素生物合成中的关键酶和限速酶[1—4]。P450arom由CYP19基因编码,目前已有文献报道克隆了雄性黑头呆鱼(Fathead minnow)[5]、青鳉(Oryzias latipes)[6]和斑马鱼(Danio rerio)[7]等鱼类的CYP19基因,并用其作为生物标志物来探究与环境污染,尤其是环境激素(Environmental hormone)污染的关系,但目前未见有关食蚊鱼(Gambusia affinis)CYP19被克隆的报道。
环境激素对生物体生殖发育以及分子层面的影响已成为环境科学和生物科学的热点之一,尤其是水生环境中的鱼类作为良好的实验材料用以研究环境中的激素效应[8,9]。近年主要集中在以雌性实验动物研究环境雄激素的效应,以雄性实验动物研究环境雌激素的效应。闫月明[10]的研究显示,长时间的暴露,食蚊鱼能适应低浓度的环境激素,相对较高浓度的强雌激素17β-estradiol(E2)上调食蚊鱼CYP19a基因的表达,相对较高浓度的强雄激素17α-methyl testosterone(MT)则下调食蚊鱼CYP19a基因的表达。而CYP19基因家族中除了CYP19a以外,还有在脑组织中表达相对较高的CYP19b目前尚没有相关的数据。因此,本实验以雌性食蚊鱼为材料,首次克隆和分析了G.affinis CYP>19b cDNA的全系列; 研究强雄激素MT和强雌激素E2暴露对食蚊鱼CYP19b基因表达的影响。由于细胞色素P450芳香化酶能将androstendione(AED)转化成雌激素,本实验也设计了不同浓度的AED暴露对CYP19b基因表达的影响,探索几种外源环境激素暴露对生活在当地水域食蚊鱼CYP19基因表达水平的影响,以评价其对食蚊鱼的毒性效应。
1 材料与方法
1.1 化学试剂
暴露试剂 17β-雌二醇(E2)(Sigma公司,美国),纯度99%; 甲基睾酮(MT)(Dr.Ehtenstorfer公司,德国汉堡),纯度98%;雄烯二酮(AED)(Dr.Ehtenstorfer公司,德国汉堡),纯度98%; 分别使用纯度99.8%的二甲基亚砜(Dimethyl sulfoxide,sigma)将E2、MT和AED进行溶解,配成保存液。二甲基亚砜(DMSO)在本实验中作为溶剂对照,DMSO的剂量为50 μL/L,在先前的预实验中证明其对实验结果没有影响。
分子试剂 RNAiso Plus(TAKARA,Dalian,China)、Fastquant RT Kit(With gDNase)(TIANGEN,China)2×Taq PCR MasterMix(含染料)(TIANGRN,China)、5′ RACE System for Rapid Amplification of cDNA Ends,Version 2.0(Invitrogen,Carlsbad,CA)、SMARTer RACE cDNA Amplification Kit(Clontech,Palo Alto,CA),其他生化试剂盒化合物均为符合实验要求的国产试剂。
1.2 实验动物
食蚊鱼购自广州市花鸟虫鱼市场。捕捞回实验室后,放入鱼缸进行饲养。在实验室水族箱内驯养两周,待死亡率小于2%后选取形态发育良好、反应灵敏、大小均一健康的雄性个体用于暴露实验。食蚊鱼正常的雌雄个体鉴别及其性成熟的鉴定参照Leusch等[11]的描述:A.未成年雄性,臀鳍的第3鳍条长度有延长,基部宽度加宽,但是生殖足尚未发育完全; B.成年雄性,鳍条生殖足端部出现钩和肘; C.未成年雌性,体长<20 mm,第3鳍条长度未见加长,基部宽度未见加宽; D.成年雌性,体长≥20 mm,第3鳍条长度未见加长,基部宽度未见加宽; E.怀孕雌鱼,通过腹部下端所出现的黑色孕斑来识别。所挑选的雄鱼体长25—30 mm,具有生殖鳍(第3 鳍条明显延长),且鳍上具钩的为性成熟的雄鱼个体,在鱼缸中暂养。
1.3 染毒与制样
将食蚊鱼转移到10 L的鱼缸中进行暴露实验,实验所用水10 L,为曝气24h的自来水,硬度为2.4度(德国度),pH(6.8—7.2),水温控制在(26±1)℃,光周期控制在约14∶10(light∶dark),采用静水更新的实验模式。实验设置DMSO溶剂对照组,E2、MT 和AED浓度设置分别为2、10、50和100 ng/L,每个浓度组投入食蚊鱼数量为35条,并设置平行组。由于激素类物质会降解,加之鱼类的自身排泄物释放到鱼缸中会对鱼类活动造成影响,每隔2天将鱼缸中的水换掉,并清理鱼缸,然后重新加激素。每天喂食红虫1次,并在相同的时间段(早上10点)进行。在第1、第3、第5和第7天进行实验取样,每个浓度每次至少取4条食蚊鱼的脑组织,并迅速装入离心管中,然后快速投入液氮中进行速冻,进行食蚊鱼CYP19b Quantitative Realtime PCR检测。
1.4 总RNA提取和第一链cDNA合成
按照Trizol说明书,夹取食蚊鱼脑组织进行总RNA提取,对所提取的总RNA进行非变性胶琼脂糖凝胶电泳检测其完整性;使用Nanodro-1000 型分光光度计检测其浓度和纯度,确保OD值在1.8—2.0。使用DNA Purification System:GLASSMAX DNA isolation spin cartridges对经RNAase处理过的cDNA进行纯化。按照逆转录酶M-MLV说明书,以总RNA为模板,并以OligodT18为引物合成第一链cDNA。
1.5 引物设计,PCR扩增CYP19b cDNA片段

表 1 食蚊鱼CYP19b基因克隆引物Tab.1 Primers used for cloning mosquitofish CYP19b gene
根据已报道的青鳉(Oryzias latipes)、底鳉(Fundulus heteroclitus)、斑马鱼(Danio rerio)、金鱼(Carassius auratus)、鲤(Cyprinus carpio)等大脑CYP19b基因cDNA保守区域,登陆NCBI,获取前述几种鱼的cDNA序列,用Primer5引物设计软件在靠近5′和3′端的位置分别设计引物(表 1),由华大基因(Shenzhen,China)公司合成。然后以第一链cDNA为模板,完成对食蚊鱼CYP19b cDNA的中间片段进行克隆。PCR产物进行切胶并纯化回收后,通过鉴定将阳性克隆测序。
1.6 引物设计及荧光定量PCR
设计食蚊鱼CYP19b基因的荧光定量PCR引物,通过荧光定量仪进行荧光定量PCR扩增,完成PCR扩增后再进行溶解曲线分析,检测PCR质量。使用β-actin作为管家基因,以校正实验的误差,运用2-ΔΔCt方法[ΔΔCt =(Ct目的基因-Ct管家基因)实验组-(Ct目的基因-Ct管家基因)对照组]计算目的基因的表达倍数。采用SPSS 16.0软件对组间数据进行单因素方差分析(One-Way ANOVA),P<0.05表明差异显著,P<0.01表明差异极显著。所有结果以平均值± 标准差(mean±SD)表示。
2 结果
2.1 食蚊鱼CYP19b基因的序列分析
测序工作由生工(上海)公司完成。5′ & 3′RACE产物拼接结果显示是一段中间跨960 bp左右的序列。将得到的序列进行BLAST(www.ncbi.nlm.nih.gov/blast)序列分析,结果证明是CYP19b基因序列。用BioXM2.6软件进行序列翻译,此cDNA序列全长1670 bp,ORF(Open Reading Frame)是从52 bp到1554 bp,共编码501个氨基酸,5′端有51 bp的非编码区,3′末端有116 bp的非编码区。该食蚊鱼CYP19b基因cDNA序列已经提交Genbank(GenBank Accession Number:正在提交)。
通过用DNAMAN软件对8个不同物种(食蚊鱼、斑马鱼、鲫、鲤、底鳉、鲻、青鳉、平鲷)CYP19b基因进行氨基酸比对和氨基酸相似性分析。对比以上8个物种的CYP19b基因发现,其中有35个氨基酸是较为保守的,其相似性为26.30%。食蚊鱼与底鳉的CYP19b 基因其同源性是最高的,达到85.9%; 其次与青鳉、平鲷的同源性也很高,分别达到79.2%和79.0%; 食蚊鱼与鲫、鲤的相似性最低,分别为10.1%和10.0%。
使用DNAMAN软件对8个物种的CYP19b基因进行聚类分析,构建系统进化树比较食蚊鱼CYP19b基因与其他物种之间的亲缘关系。结果显示:食蚊鱼的CYP19b基因与底鳉的同源性最高。结合氨基酸同源性的分析数据表明,CYP19b基因在鱼类中具有的保守区段,在不同物种生长发育过程中发挥重要作用。
2.2 雌二醇(E2)、甲基睾酮(MT)和雄烯二酮(AED)暴露对食蚊鱼CYP19b基因表达的影响
在克隆得到的食蚊鱼CYP19b基因的中间片段设计引物,进行Quantitative Realtime PCR检测。以β-actin作为内参基因,使用SYBR GreenI荧光嵌合法进行实时定量反应。E2、MT、AED各浓度组和对照组在暴露实验期间都未发现实验鱼的死亡现象,也未发现行为异常,这表明在本实验范围内E2、MT和AED对食蚊鱼尚无可观测的急性毒性作用。

图 1 雌二醇暴露对食蚊鱼CYP19b基因表达的影响
雌二醇暴露对食蚊鱼CYP19b的表达水平影响如图 1所示。暴露1d后,与对照组比较,E2最低浓度组(2 ng/L)对CYP19b的表达水平下降,但结果不显著(P>0.05),暴露3d后,2 ng/L组对CYP19b的表达起促进作用(P<0.01),但随后至第5和第7天时CYP19b表达分别受到明显抑制(P<0.01或P<0.05)。E2较低浓度组(10 ng/L)暴露1d后,对CYP19b的表达水平呈下降趋势,暴露3d、5d和7d后对CYP19b的表达水平与对照组相持平,没有明显变化(P>0.05)。E2较高浓度组(50 ng/L)暴露1d后,对CYP19b表达呈十分显著的提升(P<0.01),但随着暴露时间的延长至第3天后CYP19b表达出现下滑趋势,至第5天后受抑制明显(P<0.05),至第7天后其表达量又呈提升趋势。与50 ng/L 浓度组相似,E2高浓度组(100 ng/L)在暴露1d后,对CYP19b表达水平呈提升趋势,随后至第3天后迅速下降,至第5天后CYP19b表达受抑制十分显著(P<0.01),但在7d后对CYP19b的表达提升十分显著性(P<0.01)。
结果显示,相对较低E2浓度组(2和10 ng/L)暴露对CYP19b的表达表现为初始的抑制、随后促进的趋势。相对较高E2浓度组(50和100 ng/L)暴露对CYP19b的表达表现为初始的促进、随后抑制后再促进的趋势。
甲基睾酮暴露对食蚊鱼CYP19b基因表达的影响如图 2所示。MT暴露1d后,与对照组比较,MT各浓度组对CYP19b基因的表达均呈现抑制的趋势,并且随着暴露时间延长,MT各浓度组对CYP19b的表达明显出现抑制的作用。MT最低浓度组(2 ng/L)暴露3d后,对CYP19b表达的抑制更为明显(P<0.05),随后至5d和7d后,对CYP19b的表达仍呈现下降的趋势。MT较低浓度组(10 ng/L)暴露3d后,CYP19b的表达与对照组持平,但至5d后对CYP19b的表达抑制作用十分显著(P<0.01),而至7d后则略为上升。MT较高浓度组(50 ng/L)暴露至3d和5d后,对CYP19b的表达抑制十分明显(分别P<0.01和P<0.05),但至7d后,却出现显著性提升(P<0.01)。MT最高浓度组(100 ng/L)暴露至3d、5d和7d后,CYP19b的表达一直受到明显抑制,尤其在第5天后表达的下降十分显著(P<0.01)。
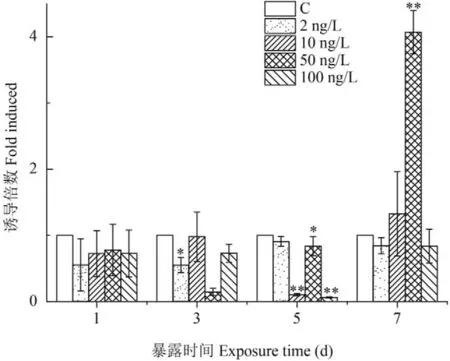
图 2 甲基睾酮暴露对食蚊鱼CYP19b基因表达的影响
结果显示,从总体上看,除了较高浓度组(50 ng/ L)外,其他不同浓度MT暴露对食蚊鱼CYP19b基因的表达呈明显地抑制作用。
雄烯二酮暴露对食蚊鱼CYP19b基因表达的影响如图 3所示。AED最低浓度组和较低浓度组(2和10 ng/L)暴露初始(1d)对CYP19b的表达呈上升趋势,随后至第3天后其表达水平与对照组基本持平;至第5天后两个浓度组对CYP19b的表达抑制作用则十分显著(P<0.01);至第7天最低浓度组(2 ng/L)对CYP19b的表达抑制作用仍十分显著(P<0.01),但较低浓度组(10 ng/L)对CYP19b的表达抑制作用出现反弹,上升十分显著(P<0.01)。较高浓度组和最高浓度组(50和100 ng/L)暴露1d后CYP19b的表达出现抑制趋势,至第3天后,较高浓度组(50 ng/L)CYP19b的表达受抑制作用十分显著(P<0.01);随后至第5和第7天,两个浓度组暴露对CYP19b的表达持续抑制作用都十分显著(P<0.01)。
结果显示,除了较低浓度组(10 ng/L)在第7天的表达出现上升外,AED各浓度组暴露对食蚊鱼CYP19b基因表达的影响十分明显,并随时间的推移抑制作用加强。

图 3 雄烯二酮暴露对食蚊鱼CYP19b基因表达的影响
3 讨论
3.1 食蚊鱼CYP19b基因的存在形式及芳香化酶保守区的讨论分析
食蚊鱼与许多硬骨鱼类一样,芳香化酶存在性腺芳香化酶基因(CYP19a)和脑芳香化酶基因(CYP19b)两种基因编码。食蚊鱼CYP19a基因已由本实验室闫月明[8]克隆出部分片段,并由甘为[12]完成全基因克隆;而本实验则已成功克隆出CYP19b基因的全长,并与斑马鱼、青鳉、鲤等物种的CYP19b基因进行比对。在ncbi上比对的结果得出多条其他物种的CYP19a或是与CYP19a相似的序列,另外也将食蚊鱼CYP19基因的两个基因编码进行对比,发现其相似性高达58.62%。张扬等[13]认为CYP19具有相同的祖先基因,在硬骨鱼类中,经历了一次鱼类特异的基因组复制事件,产生了两个包含芳香化酶基因的旁系同源基因框,经过亚功能化和长期的选择压力,分别形成了硬骨鱼类中的卵巢芳香化酶基因和脑芳香化酶基因。这也就解释了食蚊鱼CYP19的两个基因具有高相似性的原因。
本文在食蚊鱼脑芳香化酶中发现3个高度保守片段,依次为I-螺旋区、芳香化酶特异保守区以及血红素结合区[14],这与徐跑等[15]对黄颡鱼脑芳香化酶和卵巢芳香化酶的研究结果相一致,但是氨基酸序列稍有一些不同。Graham-Lorence等[16]发现人芳香化酶的氨基酸序列中有7个酶催化活性位点,包括I130、E298、P304、D305、T306、R431 和C433,与食蚊鱼脑芳香化酶在这些位点所编码的氨基酸作比对分析的结果证明仅有一部分相一致;同时与黄颡鱼[15]、泥鳅[17]脑及卵巢芳香化酶在这些位点所编码的氨基酸所作的比对分析结果也表明仅有一部分相同;虽然位点不近相同,但却都间接证明脑芳香化酶是具有催化活性的。由此可见,与其他鱼类相比较,食蚊鱼脑芳香化酶也具有3个高度保守片段,并具有催化活性,但是芳香化酶在不同鱼类中所存在的形式有所不同。崔俊莉[17]认为这种存在形式不一的原因:其一是可能由于鱼类不同物种在进化时基因复制出现偏差,生活环境多样,导致不同组织的芳香化酶基因由同一个基因编码;其二是在鱼类中均存在两种形式的CYP19基因,二者在不同组织中均有表达。
3.2 雌二醇暴露对食蚊鱼CYP19b基因表达的影响
目前国内对CYP19b基因的研究相对于CYP19a基因来说尚少见报,而国外的研究也相对较少。Cheshenko等[18]对斑马鱼进行雌激素处理并且观察CYP19b mRNA的表达来判断芳香化酶的活性,发现CYP19b mRNA表达量的升高表示芳香化酶的活性有所提高; 而对其胚胎进行48h的10 nmol/L(约3000 ng/L)17β-雌二醇(E2)的处理,结果能引起端脑,视前区和下丘脑内侧基底部的CYP19a 或CYP19b的转录以及蛋白强烈的上调表达[19]; 分别用0.1 nmol/L(约30 ng/L)和1 nmol/L(约300 ng/L)两个浓度的17α-乙炔基雌二醇(EE2)暴露都能抑制CYP19a的表达[20]。Lyssimachou等[21]用人工合成雌激素乙炔雌二醇(EE2)与防污剂三丁基锡(TBT)分别对大西洋鲑处理发现,EE2能提高CYP19a和CYP19b的mRNA的表达水平,而TBT则能降低CYP19b mRNA的表达水平。吴鹏[22]研究了三丁基氯化锡(TBTCl)暴露情况下雌性和雄性孔雀鱼T和E2含量以及CYP19a和CYP19b mRNA表达情况,结果表明,500 ng/L TBTCl暴露组雌鱼卵巢中CYP19a mRNA表达显著降低,抑制芳香化酶将甲基睾酮(MT)转化为雌二醇(E2)的过程,导致雌鱼E2显著降低。熊甜甜等[23]研究了E2暴露对食蚊鱼(Gambusia affinis)细胞色素P4501A基因(CYP4501A)表达的影响。结果也显示,高浓度E2(500 ng/L)极显著抑制CYP4501A mRNA的表达。这些实验结果表明,雌二醇暴露可以提高CYP19b mRNA的表达水平,起到促进作用; 但也可能降低其表达量,具有抑制作用。在本实验中发现,相对较低E2浓度组(2和10 ng/L)暴露对CYP19b的表达表现为初始的抑制、随后促进的趋势; 而相对较高E2浓度组(50和100 ng/L)暴露对CYP19b的表达表现为初始的促进、随后抑制后再促进的趋势,这与前人的研究结果基本相一致。结果表明,短时间的暴露,低浓度的E2对食蚊鱼作用不明显,但相对较高浓度的E2能显著地上调食蚊鱼CYP19b基因的表达;不同的暴露浓度及不同的取样时间点可能表现为促进或抑制CYP19b基因的表达。
本实验从基因表达方面来看,尚未能发现E2暴露在一定的剂量范围内与CYP19b的表达存在的线性关系,也没有发现规律性的现象,我们推断这很可能是实验操作的原因,或者是剂量的原因,需要在后续实验验证。目前虽然CYP19a的调控研究已比较完善,但是CYP19b的调控机制仍然不十分清楚。Kazeto等[24]在斑马鱼CYP19b启动子区发现雌激素应答原件(ERE),这一发现指明CYP19b具有雌激素应答效应。 Gloria等[25]根据多方面的研究推断:硬骨鱼内的雌二醇(E2)和甲基睾酮(MT)的转换受到CYP19b的调控,CYP19b的表达与雌激素受体(ER)紧密联系,ER一旦接收外源雌激素类物质,通过相关的信号通道诱导CYP19b的表达,从而合成细胞色素P450芳香化酶,进而硬骨鱼体内的E2和睾酮(T)的含量就会发生变化。而体内的E2也能同时与体内的ER结合,也能通过其他的基因向下调节,通过促性腺激素及其他神经效应调节机体,形成一个自动反馈的系统。由此可见,这些调控过程相当复杂,将有待后续的进一步研究。
3.3 甲基睾酮暴露对食蚊鱼CYP19b基因表达的影响
甲基睾酮(MT)是一种强的雄激素类物质,能对鱼类的生长发育,性逆转等造成重要的影响。本实验设置4个浓度组(2、10、50 和100 ng/L)MT对食蚊鱼进行短期暴露,研究了其对CYP19b表达的影响,本实验结果从总体上看,除了较高浓度组(50 ng/L)外,其他不同浓度MT暴露对食蚊鱼CYP19b基因的表达呈明显地抑制作用。范俊杰等[26]研究了甲基睾酮对生长发育期间的雌性食蚊鱼形态雄性化及目标基因表达的影响,结果显示,甲基睾酮(MT)高浓度组(500 nmol/L)的雄激素效应明显,导致雌鱼在生长发育过程中出现形态雄性化的变化。Martina Fenske等[27]用10000 ng/L的MT处理71日龄的斑马鱼,发现MT处理组的脑部CYP19b表达量明显高于对照组雄性CYP19b的平均表达量,约为其的5倍,这是由于在10000 ng/L浓度下,MT向E2转化了。这为MT暴露组中为什么CYP19b的表达会上调作了解释。本实验暴露浓度远低于前人所使用的浓度(10000 ng/L),由于在体内睾酮(T)能被P450arom酶催化转变为E2,E2又可以产生负反馈调节,所以MT暴露组表现出抑制CYP19b表达的现象。而在第7天高浓度50 ng/L MT的暴露增加了食蚊鱼CYP19b的表达量,这可能是由于MT的刺激增加了食蚊鱼体内的类固醇激素睾酮(T)的含量,促使MT往E2的方向转化,从而诱导P450arom酶表达,即表现为CYP19b的表达的上调;张勇[28]以MT喂食斜带石斑鱼,发现鱼体内的睾酮(T)含量与芳香化酶基因的表达活性密切相关,而MT单独作用于孵育下丘脑、脑垂体、性腺。但是MT是直接作用于性腺芳香化酶基因,还是通过其他调控因子影响CYP19b基因的表达,其机制还不得而知,有待作进一步研究。
3.4 雄烯二酮暴露对食蚊鱼CYP19b基因表达的影响
雄烯二酮(Androstenedione,AED)是雄激素物质之一,是睾酮(T)向雌激素转化的中间产物。在有关处理造纸废水的研究中,科研人员已经确认造纸厂废水流入的水体存在着雄烯二酮(AED),1,4雄烯二酮(Androstadienedione,ADD)和孕酮(Progesterone,PRO),造成生活在该水体中的雌性食蚊鱼发生了形态雄性化转变[29]。AED能够代谢为另外一些雄激素(如睾酮testosterone、11-酮睾丸激素11-ketotestosterone),同时也会干扰芳香信号途径[30]。AED暴露对CYP19基因表达的影响其研究非常少,难以找到前人的研究与本实验的结果进行对比,但AED对VTG的表达效应的研究结果有一定的参考价值。范俊杰[27]的研究表明,50和500 nmol/L AED处理极显著地抑制了雌性食蚊鱼VTGα mRNA的表达水平,0.5和5 nmol/L AED暴露组致VTGα mRNA表达水平也呈一定程度的增加,因此认为AED或许被部分芳香化成了一些具有雌激素活性的物质从而起到雌性化的作用。本实验结果表明,除了较低浓度组(10 ng/L)在第7天的表达出现上升外,AED各浓度组暴露对食蚊鱼CYP19b基因表达的影响十分明显,并随时间的推移抑制作用加强。AED暴露初期,低浓度组(2和10 ng/L)致CYP19b表达呈上调趋势,而随着暴露时间的延长,各浓度组AED对CYP19b的表达均起到极显著性的抑制作用,但至第7天,低浓度组(10 ng/L)则致CYP19b表达上升,为对照组的近2倍。解释这一结果可以参考Stanko和Angus[31]的假设,过量的AED在雌性食蚊鱼体内将很有可能被代谢成E2,导致E2含量的相对提升; 或者可能代谢为11-酮睾丸激素,而11-酮睾丸激素将抑制E2量的提升。由此E2受到抑制将会影响雌激素受体(ER)的表达,从而导致CYP19b的表达下调。而在暴露第7天,10 ng/L AED 出现上调作用,推测其低浓度AED与MT暴露后期的雄激素效应相似,刺激增加了食蚊鱼体内的睾酮(T)含量,促使T往E2的方向转化,从而诱导P450arom酶的表达,表现为CYP19b表达的上调。目前AED对CYP19b的研究几乎空白,其作用机制尚未清楚,同时有关CYP19a基因在这方面的研究尚少报道,因此将有待作进一步研究。
参 考 文 献:
[1]Seralin G E,Moslemi S.Aromatase inhibitors:past,present and future[J].Molecular and Cellular Endocrinology,2001,178(1—2):117—131
[2]John M T,Sonja G,Jared A,et al.Developmental expression of cytochrome P450 aromatase genes(CYP19a and CYP19b)in zebrafish fry(Danio rerio)[J].Journal of Experimental Zoology,2001,290(5):475—483
[3]Yu J H,Tang Y K,Li J L.Cloning,structure and expression pattern of the P450 aromatase genes in rice field eel(Monopterus albus)[J].Biochemical Genetics,2008,46(5):267—280
[4]Yang Y P.Studies on reproduction physiological function of the P450aron in rockfish(Sebactes schlegeli)[D].Thesis for Master of Science.Ocean University of China,Qingdao.2010[杨艳平.P450芳香化酶在许氏平繁殖生理中的作用研究.硕士学位论文.中国海洋大学,青岛.2010]
[5]Halm S,Pounds N,Maddix S.Exposure to exogenous 17 beta-oestradiol disrupts P450aromB mRNA expression in the brain and gonad of adult fathead minnows(Pimephales promelas)[J].Aquatic Toxicology,2002,60(3—4):285—299
[6]Contractor R G,Foran C M,Li S F,et al.Evidence of gender- and tissue-specific promoter methylation and the potential for ethinylestradiol-induced changes in Japan-ese medaka(Oryzias latipes)estrogen receptor and aromatase genes[J].Journal of Toxicology and Environmental Health Part A,2004,67(1):1—22
[7]Kishida M,McLellan M,Miranda J A,et al.Estrogen and xenoestrogens upregulate the brain aromatase isoform(P450aromB)and perturb markers of early development in zebrafish(Danio rerio)[J].Comparative Biochemistry and Physiology B-Biochemistry & Molecular Biology,2000,129(2—3):261—268
[8]Xie Y P,Fang Z Q.Evaluation of estrogen/androgen pollution by using the mosquitofish target gene expression in Hanxi River,Dongguan City[J].Acta Hydrobiologica Sinica,2013,37(4):691—697[谢勇平,方展强.利用食蚊鱼目标基因转录水平评价东莞寒溪河雌/雄激素物质污染现状.水生生物学报,2013,37(4):691—697]
[9]Xie Y P,Fang Z Q.Urban sewage induces morphological feminization/masculinization in mosquitofish(Gambusia affinis)[J].Biological Disaster Science,2015,38(2):106—113[谢勇平,方展强.城市废水暴露致食蚊鱼形态雌/雄性化的生物学效应.生物灾害科学,2015,38(2):106—113]
[10]Yan Y M.Effects of PCBs(Aroclor 1248)exposure on the expression of gonadal cytochmme P450 aromatase(CYP19a)gene and the toxic effect in mosquitofish(Gambusia affinis)[D].Thesis for Master of Science.South China Normal University,Guangzhou.2013[闫月明.多氯联苯(PCB 1248)暴露对食蚊鱼CYP19a mRNA表达的影响及毒性效应研究.硕士学位论文,华南师范大学,广州.2013]
[11]Leusch F D L,Vanden Heuvel M R,Laurie A D,et al.Quantification of vitellogenin mRNA induction in mosquitofish(Gambusia affinis)by reverse transcription realtime polymerase chain reaction(RT-PCR)[J].Biomarkers,2005,10(6):429—438
[12]Gan W.Molecular cloning and mRNA expression of CYP19a gene induced by tributyltin in the mosquitofish(Gambusia affinis)[D].Thesis for Master of Science.South China Normal University,Guangzhou.2015[甘为.食蚊鱼CYP19a基因的克隆及三丁基锡暴露对其表达的影响.硕士学位论文.华南师范大学,广州.2015]
[13]Zhang Y,Zhang L H,Zhang W M.CYP19 genes in Teleosts:origin,evolution,and expression regulation.Chinese Scientific Papers Online,fist time published:2010—12-29[张扬,张利红,张为民.硬骨鱼类芳香化酶基因起源、进化和表达调控.中国科技论文在线,首发时间:2010—12-29]
[14]Cao M X,Yang Y H,Jiang W B,et al.Cloning and expressional analysis of Cyp19b gene fragment in Gobiocypris rarus[J].Acta Hydrobiologica Sinica,2009,33(4):749—755[曹梦西,杨玉慧,江文波,等.稀有鮈鲫脑芳香化酶 cDNA片段的克隆与表达分析.水生生物学报,2009,33(4):749—755]
[15]Xu P,Yu J H,Tang Y K,et al.Molecular cloning of ovarian P450arom gene and its expression in male and female[J].Journal of Fishery Sciences of China,2005,12(5):541—548[徐跑,俞菊华,唐永凯,等.黄颡鱼卵巢P-450arom 基因的克隆及组织表达.中国水产科学,2005,12(5):541—548]
[16]Graham-Lorence S,Amameh B,White R E.A three-dimentional model of aromatase cytochome P450[J].Protein Science,1995,4(6):1065—1080
[17]Cui J L.Molecular cloning of CYP19 gene and their expression of adult and embryo in two apecies of Loaches[D].Thesis for Master of Science.Henan Normal University,Xinxiang.2013[崔俊莉.两种泥鳅中CYP19基因的克隆及表达分析.硕士学位论文.河南师范大学,新乡.2011]
[18]Chesheko K,Brion F,Le Page,et al.Expression of zebra fish aromatase CYP19a and CYP19b genes in response to the ligands of estrogen receptor and arylhydrocarbon receptor[J].Toxicological Sciences,2007,96(2):255—267
[19]Menuet A,Pellegrini E,Brion F,et al.Expression and estrogen-dependent regulation of the zebrafish brain aromatase gene[J].Journal of Comparative Neurology,2006,485(4):304—320
[20]Hinfray N,Palluel O,Turies C,et al.Brain and gonadal aromatase as potential targets of endocrine disrupting chemicals in a model species,the zebrafish(Danio rerio)[J].Environmental Toxicology,2006,21(4):332—337
[21]Lyssimachou A,Jenssen B M,Arukwe A.Brain cytochrome P450 aromatase gene isoforms and activity levels in Atlantic salmon after waterborne exposure to nominal environmental concentrations of the pharmaceutical enhinylestradiol and antifoulant tributyltin[J].Toxicological Sciences,2006,91(1):82—92
[22]Wu P.Effects and mechanisms of tributyltin on sexual chatacteristics and reproduction of guppy(Poecilia reticulate)[D].Thesis for Master of Science.Ocean University of China,Qingdao.2013[吴鹏.三丁基锡对孔雀鱼(Poecilia reticulata)性征和生殖的影响.硕士学位论文.中国海洋大学,青岛.2013]
[23]Xiong T T,Fang Z Q.Target gene expression in Gambusia affinis exposed to 17β-estradiol,Bisphenol A and Benzo[a]Pyrene[J].Journal of Biology,2015,32(5):19—24[熊甜甜,方展强.雌二醇、双酚A和苯并[a]芘混合物对食蚊鱼目标基因表达的影响.生物学杂志,2015,32(5):19—24]
[24]Kazeto Y,Trant J M.Molecular biology of channel catfish brain cytochrome P450 aromatase(CYP19A2):cloning,preovulatory induction of gene expression,hormonal gene regulation and analysis of promoter region[J].Journal of Molecular Endocrinology,2005,35(3):571—583
[25]Gloria V Callard,Anna V Tchoudakova,Mitsuyo Kishida,et al.Differential tissue distribution,developmental programming,estrogen regulation and promotercharacteristics of CYP19 genes in teleost fish[J].Journal of Steroid Biochemistry & Molecular Biology,2001,79(1—5):305—314
[26]Fan J J,Xu S Q,Fang Z Q.Target gene expression and morphological masculinization in mosquitofish(Gambusia affinis)exposed to 17α-methyl testosterone[J].Journal of Fisheries of China,2013,37(1):9—15[范俊杰,徐少群,方展强,等.17α-甲基睾酮对食蚊鱼形态雄性化及目标基因表达的影响.水产学报,2013,37(1):9—15]
[27]Martina Fenske,Helmut Segner.Aromatase modulation alters gonadal differentiation in developing zebrafish(Danio rerio)[J].Aquatic Toxicology,2004,67(2):105—126
[28]Zhang Y.Cytochrome P450aromatases in the orangespotted grouper(Epinephelus coioides):cDNA cloning and regulation of expression[D].Thesis for Doctor of Philosophy.Sun Yat-sen University,Guangzhou.2011[张勇.斜带石斑鱼P450芳香化酶基因克隆及其表达调控的研究.博士学位论文.中山大学,广州.2004]
[29]Denton E W,Howell W M.Allison J J,et al.Masculinization of female mosquitofish by exposure to plant sterols and Mycobacterium smegmatis[J].Bulletin of Environmental Contamination and Toxicology,1985,35(4):627—632
[30]Stanko J P,Angus R A.In vivo assessment of the capacity of androstenedione to masculinize female mosquitofish(Gambusia affinis)exposed through dietary and static renewal methods[J].Environmental Toxicology and Chemistry,2007,26(5):920—926.
[31]Fan J J.Vitellogenin gene expression and morphological masculinization in female western mosquitofish(Gambusia affinis)exposed to androgens and progesterone[D].Thesis for Master of Science.South China Normal University,Guangzhou.2012[范俊杰.雄激素和孕激素暴露对雌性食蚊鱼形态雄性化和生殖基因的影响.硕士学位论文,华南师范大学,广州.2012]
MOLECULAR CLONING AND mRNA EXPRESSION OF CYP19B GENE INDUCED BY ENVIRONMENTAL HORMONES IN THE MOSQUITOFISH(GAMBUSIA AFFINIS)
LAI Jing-Ping1,YAN Yue-Ming1,WEN Ru-Shu2and FANG Zhan-Qiang1
(1.Key Laboratory of Ecology and Environmental Science in Guangdong Higher Education,College of Life Science,South China Normal University,Guangzhou 510631,China; 2.College of Life Science,Jiaying University,Meizhou 514015,China)
Abstract:The current study investiaged effects of 17β-estradiol(E2),17α-methyl testosterone(MT)and androgen analogues androstendione(AED)exposure on brain tissue CYP19b gene expression in Gambusia affinis.The G.affinis CYP19b cDNA of full sequence was cloned and analyzed for the first time.G.affinis were randomly divided into five groups,with one control group and four experimental groups(2,10,50 and 100 ng/L E2,MT and AED,respectively).The CYP19b mRNA expression levels in fish brain tissues were determined after 1,3,5,and 7d exposure,respectively.The G.affinis CYP19b cDNA of full sequence was cloned,from which 1670 bp nucleotides were obtained,encoding 501 amino acids with an open reading frame(ORF)from 52 bp to 1554 bp.The comparison among the similarity amino acid sequence of CYP19b with other related fishes supports high similarity between species.The results indicated that E2 at high concentrations(50 ng/L and 100 ng/L groups)significantly up-regulated CYP19b gene expression(P<0.01)but E2 at low concentration(2 ng/L and 10 ng/L groups)did not.MT had no significant effect on CYP19b expression in early stages,but it significantly inhibited CYP19b expression with prolonged treatment except the relatively high concentrations of MT(50 ng/L group)with the characerisitc of dose correlativity.As androgen analogue,AED was found to have similar effects with MT,and the relatively high concentrations(50 ng/L and 100 ng/L groups)of AED inhibited the CYP19b expression(P<0.01).The results indicated the pivotal role of three typical environmental hormones under different concentration and various time points on the expression of CYP19b.
Key words:Environmental hormone; CYP19b gene; mRNA expression; 17β-estradiol; 17α-methyl testosterone;Androstendione; Gambusia affinis
中图分类号:Q785; S917
文献标识码:A
文章编号:1000-3207(2016)03-0451-08
doi:10.7541/2016.60
收稿日期:2015-05-19;
修订日期:2015-11-25
基金项目:广东省科技计划项目(2012B030800006)资助[Supported by the Science and Technology Project of Guangdong(No.2012B030800006)]
作者简介:赖静萍(1988—),女,广东广州人; 硕士; 主要从事水生动物生态毒理研究。E-mail:kenancheery@qq.com
通信作者:方展强,E-mail:fangzhq@scnu.edu.cn
