浮萍研究进展
2016-06-29黄明星朱思思张秋鸿
黄明星, 朱思思, 张秋鸿
(广东工业大学 轻工化工学院生物工程系, 广州 510006)
浮萍研究进展
黄明星, 朱思思, 张秋鸿
(广东工业大学 轻工化工学院生物工程系, 广州 510006)
摘要浮萍是世界上最小,生长速度最快,形态最简单的开花植物。多年来不仅被广泛应用于植物生理学、遗传学、生态学和环境检测等方面,而且被广泛应用于水体污染的治理,植物衰老的研究,以及除草剂的筛选。目前,浮萍在生物能源和生物制药方面也表现出了巨大的应用潜力。结合实验室的研究工作,首先对浮萍分类学和基因组学进行了介绍,然后侧重介绍近年来在分子层面有关浮萍的一些研究工作,以及其在生物制药上的突破。
关键词浮萍; 组织培养; 基因组测序; 植物表达体系
1浮萍分类
浮萍(duckweed),属于被子植物门(Magnoliophyta),单子叶植物纲(Liliopsida),棕榈亚纲(Arecidae),泽泻目(Alismatales),天南星科(Araceae),浮萍亚科(Lemnoideae)。早期的分类系统将浮萍科分类为天南星目下一个科,而近期的分类系统则将浮萍科并入到天南星科内,同时将天南星科分类为泽泻目下的一个科。浮萍亚科有5属,38种[1,2],各个属之间大体上可以根据其根的数目和叶的形状进行区分 (表1)。5个属分别为:紫萍属(Spirodela),含2个种;斑萍属(Landoltia),含1个种;青萍属(Lemna),含14个种;扁无根萍属(Wolffiella),含10个种;无根萍属(Wolffia),含11个种 (表2)。斑萍(中国植物主题数据库翻译[3])学名landoltiapunctata,异名spirodelapunctata或spirodelaoligorrkiza,斑萍以前是紫萍属的一个种,所以常被翻译为少根紫萍,但现在单独为一属[4]。笔者认为,为了与紫萍区分开,同时其叶上有许多小的乳状凸起,因此而得名斑萍。

表1 浮萍各属检索

表2 浮萍各个种属中英文名对照
2浮萍生物学特征及培养
浮萍是世界上最小,生长速度最快,形态最简单的开花植物[5]。单一的无根萍很少有超过1 mm的个体,和其它的开花植物相比几乎没有相似性。浮萍并不是大型被子植物的简单缩略版,其在体积缩小的同时伴随着结构组织的高度修饰,包括各种形态学和解剖学上特征的改变和简化,甚至丢失。浮萍这种极度退化的特征使得其各个组织具有特殊的学术称谓。其叶通常被称作“叶状体”(thallus或frond),是一些具有最小分化组织的集合体,叶状体表皮细胞下面是一些具有光合特性的软组织,这些软组织细胞之间常具有大量的气囊。其根通常被称作不定假根(adventitious rhizoid),假根位于叶状体远轴面(abaxial) 的分生区。母叶状体分生区常有1~2个侧袋(lateral pouch),子叶状体从侧袋中生出进行无性繁殖[6]。浮萍家族各个种的具体特征见表3和表4[2]。
虽然浮萍母叶状体分裂出子叶状体的代数有限,但是,在营养充足的条件下,浮萍几乎是以指数级生长速率生长,其倍增时间因品种和生长环境而异,但通常倍增时间为1~2 d,最短可以到20~24 h。本实验室和其它研究者都证明浮萍在许多液体培养基中都能很好地生长,包括SH、Hillman、Resh、Hutner、WP、MS、N6和B5培养基等。本实验室主要测试了国内商品化的3种培养基——MS、N6和B5培养基。相对而言,紫萍、斑萍和青萍3种有根品种在各种条件下,在B5培养基中生长速度和生物质积累量更快。在B5培养基中,浮萍的子叶状体能更快地从母叶状体上分离,使得浮萍能更快地分散平铺于培养瓶中,而在MS和N6培养基中,子叶状体和母叶状体常大量聚集在一起,这对个体较大的紫萍和斑萍更为显著。浮萍能够适应较广的pH值范围,对于大多数的品种,在pH 4.5~7.2范围内能良好生长。许多有机物(EDTA、柠檬酸、酒石酸、Vc、MES、MOPS)和蛋白稳定剂(PVP)对浮萍的生长没有明显影响[7]。蔗糖同样是浮萍培养碳源的首选,使用量在1%~3%,其它碳源,如山梨醇等也可以用于浮萍培养。

表3 浮萍系统进化分析中使用的特征
续表3

(0)(1)(2)(3)(4)(5)10腹部带状物:无有11叶柄:延长短12鳞茎:无有13根最大数:20111无14根最大长度:15cm7cm4cm015根鞘:无翼有翼缺失16根尖:尖尖或钝钝无营养体解剖结构17气室层数目:3~42~31~3无18保卫细胞质体:无有19晶胞:针晶簇晶无20色素细胞:有无21花青素:有无22叶状体管胞:至全叶脉至中脉远端至中脉中端中脉底端无23根管胞:有无24表皮细胞壁:平整/微起伏明显起伏生殖体形态25生殖袋数量:2126开花位置:侧面上面的边缘上面的中间27花器官:原叶包裹无原叶28雄蕊数:2129花药开裂:横断尖端30子房插入点:雄蕊上方雄蕊基部31子房形状:对称不对称32果:有翼轻微有翼无翼33最大胚珠数:72134种子:35-70肋纹8-22肋纹光滑生殖体解剖结构35花药:2室1室36花药壁形成:单子叶型退化型37丝状管胞延伸:横跨连接处连接处之下连接处基部或缺失38子房壁管胞:有无39胚囊:单孢子双孢子40子房:胚珠倒/横生胚珠直生41花药色素细胞:有无

表4 浮萍各个种在系统进化分析中的特征描述参照
续表4

特 性12345678910111213141516171819202122232425262728293031323334353637383940415.lingulata112050101010332330201410111111122211211106.neotropica111050101010332330201410111111122211211107.oblonga112050101010332330201410111111122211211108.repanda110051101010332330211410111111122211111109.rotunda1100511010103323302114101111111222112111010.welwitschii11205010101033233020141011111112221121110Wolffia1.angusta110250102011332340211410121111122211211102.arrhiza110250102011332340211410121111122211211103.australiana110250102011332340211410121111122211211104.borealis110250102011332340201410121111122211211105.brasiliensis110251102011332340201410121111122211211106.columbiana110250102011332340211410121111122211211107.elongata110250102011332340211410121111122211211108.globosa110250102011332340211410121111122211211109.microscopica11025010201033234021141012111112221111110
3浮萍基因组研究
浮萍家族的进化模式十分特殊,一般认为其具有“形态退化进化模式”[5]。浮萍家族5个属紫萍属,斑萍属,青萍属,扁无根萍属和无根萍属在形体上依次退化,即体积依次变小,根的数量依次减少直至全无 (图1);但是,其基因组的大小却在依次增加,从紫萍的150 Mbp左右,斑萍的370 Mbp左右,到无根萍的1 800 Mbp左右 (图2)。紫萍是浮萍家族体积最大,最原始,基因组最小的品种,其基因组大小和拟南芥相当。
目前,紫萍是浮萍家族中唯一一个实现了全基因组测序的品种(Accession: PRJNA205940)[8]。紫萍基因组共有20对染色体,大小约为158 Mbp。其蛋白编码序列预测有19 623个,比拟南芥和水稻分别少28%和50%。紫萍基因组测序显示,其不存在年代较近的逆转座,但是,大约在9 500万年前发生过两次全基因组的复制,这一事件的发生早于拟南芥和水稻。

图1 浮萍5个属大小比较和3个有根品种实物图
A为浮萍5个属大小比较[5];B为本实验室保存的3个有根浮萍种实物照片:紫萍(Spirodelapolyrhiza),斑萍(Landoltiapunctata),青萍(Lemnaminor)
紫萍线粒体基因组也被完整测序(Accession: JQ804980)[9]。紫萍拥有单子叶植物中最紧凑的线粒体基因组,其大小为228 493 bp。紫萍线粒体基因组共包含57个基因, 3个核糖体RNA和19个tRNA,其中35个基因编码蛋白已知,19个tRNA共识别15个氨基酸。同时,紫萍线粒体基因组中还有约600个预测的RNA编辑位点和3处线性的特异编码蛋白基因丢失。紫萍线粒体基因组中缺乏转座原件的序列,说明其没有核基因组序列的插入,但是,其包含一段来至于叶绿体的DNA。虽然,紫萍线粒体保守蛋白与其它单子叶植物具有相同的起源,但是整体的线粒体基因组却没有共线性。除去这些编码基因和叶绿体来源的DNA片段,紫萍线粒体80%序列的功能和起源都未知。这些特殊性质有助于对单子叶植物线粒体基因组早期进化模式的研究提供帮助。
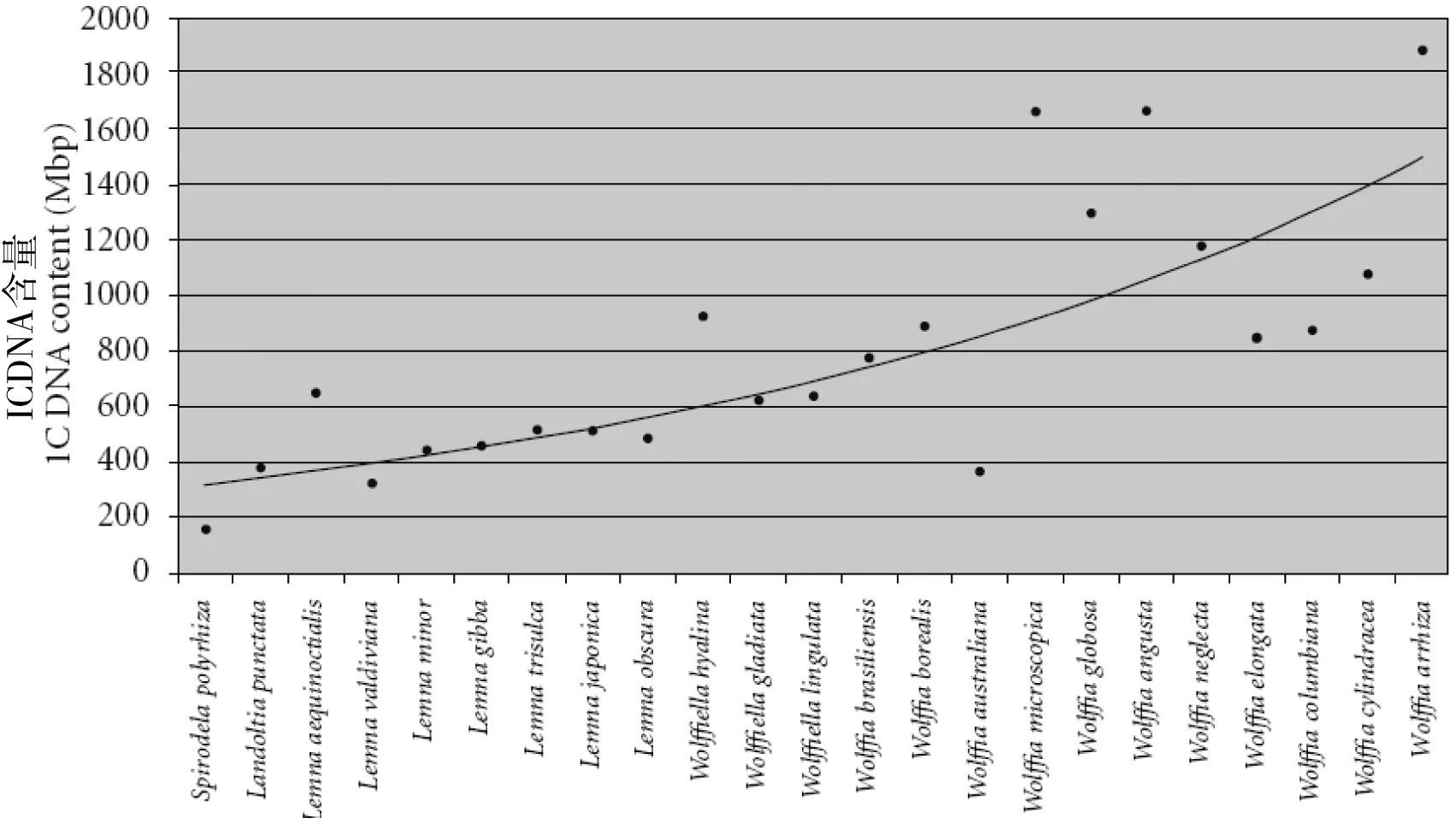
图2 浮萍家族基因组大小渐变趋势图[5]
Average genome sizes (y-axis) of duckweed species negatively parallel with degree of primitivity (x-axis). Duckweed species are arranged on thex-axis from lower to higher evolutionary status, which deduced from primitive and derived morphological traits
到目前为止,浮萍家族中叶绿体被完整测序的有4个种[10,11],覆盖4个属,包括Spirodelapolyrhiza,Lemnaminor,Wolffiellalingulata和Wolffiaaustraliana(表5)。这4种浮萍的叶绿体基因组在基因组成和结构上都非常相似。其基因组都包含112个基因,其中蛋白编码基因78个,tRNA 基因30个,rRNA基因 4个。同时,其都包含一对31 kb左右的反向重复序列,被长度分别为90 kb和10 kb左右的大小单片段所分隔。这些反向重复序列被扩展以至于包含了ycf1和rps15两个基因,这一模式在其它已测序的陆生植物叶绿体中未曾发现。在反向重复序列的边界处,大单片段上下游分别是rps19和trnH,因此,trnH不包含在反向重复序列中,这一模式存在于基部被子植物(basal angiosperms)和真双子叶植物(eudicots) 中,而不存在于其它的单子叶植物中。浮萍叶绿体基因组的另外一个特点是其颠换(transversions)频率大于转换(transitions)频率,而一般情况下,突变都具有转换偏好[10]。

表5 浮萍4个种的叶绿体的基因组对比[10]
4浮萍组织培养和基因转化
早在 19世纪70年代中期,浮萍组培方面的研究就已经开展。Chang等利用含蔗糖、2, 4-D和2-iP的MS培养基实现了L.gibba和L.perpusilla的愈伤诱导和植株再生。Slovin等研究证明,除了2, 4-D之外,利用IAA的激素组合也可以实现L.gibba的愈伤诱导。Frick开发了L.minor愈伤诱导的方法并进一步研究了不同碳源对其愈伤诱导和维持的影响。Stefaniak等后来又进一步研究了L.minor的愈伤诱导和植株再生[12]。
近十几年来,对浮萍组培和基因转化的研究主要有两个团队,一个是美国北加利福利亚州立大学的Stomp团队,另一个是以色列魏兹曼科学研究所的Edelman团队。Stomp团队一开始就把浮萍的组织培养和基因转化结合起来同时研究,他们最初选择的材料是青萍属中的多个种,尤其是L.gibba。他们研究的结果显示,植物材料的基因型(包括不同种之间以及同一种里的不同株系之间),植物激素的种类和浓度,培养基,光照强度,碳源种类和浓度,以及继代时间都会对愈伤的诱导和长期维持产生影响,后续对紫萍和无根萍筛选实验也得到了相同的结果[13,14]。总的说来,高的生长素浓度会导致浮萍叶状体不断分裂,但是其叶状体会畸形化或玻璃化,愈伤的维持可以使用和愈伤诱导相同的培养基,但是生长素浓度要降低。Stomp团队对青萍属建立了完整的组培和基因转化体系[15],但是其用于青萍的条件对紫萍和无根萍完全无效。Edelman团队则主要集中于对斑萍的研究[6,16],他们构建了斑萍2个株系的愈伤诱导和高效基因转化体系,这2个株系为Spirodelaoligorrhiza和spirodelapunctata,但是,现在这两个命名均为斑萍Landoltiapunctata的异名。Edelman团队的研究结果显示,用于Spirodelaoligorrhiza和spirodelapunctata愈伤诱导、维持和分化的条件相差极大,其原因正如上面提到Stomp团队的研究结果,浮萍同一品种里的不同株系之间的基因型都会对其整套组培产生影响。
本实验室在世界范围内首次利用假根悬空法,成功将紫萍假根根尖分生区脱分化获得愈伤组织,并构建了其高效再生体系,同时,初步建立其稳定遗传转化体系 (专利申请号CN201410097053.X)。对于浮萍的组培和转化体系没有统一的模式,不同品种浮萍愈伤诱导和植株再生的条件也千差万别,为了找到诱导紫萍形成愈伤的最佳条件,本实验室选用了4种植物生长素和4种植物细胞分裂素来测试它们对紫萍愈伤诱导的情况。其中每种植物激素设计了8个浓度梯度,测试了所有全阶乘组合4×4×8×8=1024种情况。植物生长素包括:2, 4-二氯苯氧乙酸(2, 4-D, 2, 4-Dichlorophenoxyacetic Acid),1-萘乙酸(NAA, 1-Naphthylacetic Acid),麦草畏(DCB, Dicamba)和对氯苯氧乙酸 (PCA,p-Chlorophenoxy acetic acid)。植物细胞分裂素包括:噻苯隆(TDZ, thidiazuron),6-苄氨基嘌呤(6-BA, 6-Benzylaminopurine),N6-异戊烯腺嘌呤(2iP, N6-(2-Isopentenyl)adenine)和激动素(KT, kineting)。在所有情况下,本实验室同其他实验室一样,未能从紫萍的叶状体上诱导出愈伤组织。其主要原因在于紫萍叶状体对生长素非常敏感,正如Stomp等[7]所得到的结果“紫萍叶状体在较高浓度的2, 4-D上不存活,而在较低浓度下生长不好”(专利申请号CN200910145410.4)。我们在研究中也发现,即使在仅含1 mg/L 2, 4-D的培养基上,紫萍叶状体也会在4周后完全褐化死亡。
5浮萍应用
浮萍虽然小而简单,但是其作用巨大。多年来不仅被广泛应用于植物生理学、遗传学、生态学和环境检测等方面,而且被广泛应用于水体污染的治理。近年来,浮萍被证明是一种研究植物衰老的极佳系统,并在其衰老的分子生物学研究方面取得了一些重要进展[17-19]。作为除草剂筛选系统,浮萍也表现出很大的优越性,正在被用于高效、低毒、环境友好型除草剂的筛选[20, 21]。
目前,浮萍在生物能源的研究和应用方面也表现出了巨大的潜在价值[22-25]。浮萍,因其生长快、可在废水中存活、不争粮、易于采收等优点,而且能够比水藻和其他水生植物更容易地收获,是制造生物燃料的理想原料。美国普林斯顿大学Floudas教授与中科院过程工程研究所研究员肖炘、李杰、曹宏斌,以及北京大学马炯副教授,中石油乔永博士和其石油化工研究院胡徐腾教授等联合完成了以浮萍为廉价原料制生物燃料的研究[26]。中科院成都生物所赵海研究员率领的团队,通过对浮萍的高淀粉品系筛选、淀粉积累机制破解等,已初步建立了浮萍能源转化及规模化培养、废水处理体系。在科技部支撑项目支持下,赵海团队通过与美国罗格斯大学、四川大学、成都固生科技发展有限公司等合作,先后筛选获得了7株高淀粉浮萍品系、建立了稳定培养体系,首次阐明了浮萍的快速积累机制、分析出浮萍木质素含量低而黄酮类成分含量高的原因,有力证明了浮萍是一种高品质的能源植物——具有淀粉积累快、淀粉产量高、木质素含量低三大优良特性[27]。
近年来,浮萍已被开发为一个较好的植物表达系统,在生物制药方面展现出了巨大的潜力[7,28]。目前,青萍(Lemnaminor)和斑萍(Landoltiapunctata)的表达体系已经成功商业化,此两种表达体系的专利原来分别属于美国的Biolex公司和法国的LemnaGene公司。Biolex于2005年收购了LemnaGene,并把此两种浮萍表达体系统一注册为商标Lemna systemTM;而美国的Synthon公司于2012年又收购了Biolex,将其商标更名为SYNLEXTM。所以,目前与浮萍蛋白表达体系相关的所有专利技术都被美国的Synthon公司拥有,我国想在这一领域有所突破,就只能从紫萍、无根萍和扁无根萍着手。笔者认为紫萍是一个最佳选择,因为其基因组最小,其全基因组测序又刚完成[8],遗传背景清晰,有利于后续在分子层面的操作;同时,无根萍和扁无根萍尺寸非常小,在实验室组培操作过程中相对很困难,而紫萍的个头则相对较大,在实验室更好操作。
浮萍之所以能成为一个极具潜力的植物表达系统,是因为其在多个方面具有其它系统不具有的优势。首先,浮萍非常容易培养,使得其生产成本及其低廉,只需要廉价的无机盐和简单的环境条件就能保证浮萍的旺盛生长。可以采用无菌培养模式,植物组培室相对来说建设成本不高,能源消耗方面也只需要普通光照;当然,也可以采用开放培养模式培养,直接利用太阳光照,或者利用温室培养,其建设成本也不高。浮萍培养也不要通气设备,同时其培养的最佳温度在25℃~26℃,基本上接近室内温度,也很容易满足。其它的一些生物反应器系统,如微生物和动物细胞,通常都需要精细的发酵罐或生物反应器来保证严格的生理条件,而浮萍自身是一个整体的植株,能自己提供生理调节,从而不需要诸如此类的精细设备。所以,浮萍培养要求如此简单,平常用于园艺植物的廉价温室水培仪器和方法都能用于浮萍的商业化规模生产。
其次,浮萍的无性繁殖方式能大幅缩短产品从研发到市场的时间。在目前所有的转基因生物表达系统中,浮萍表达系统是唯一一个提供无性繁殖的系统。浮萍具有1~2 d倍增时间的无性繁殖方式,使得其在工业放大时能有效缩短产业化时间,一旦筛选到高表达量的转基因浮萍叶状体,只需要短短的数月就能收获到成吨的浮萍。与其它的作物类表达系统工业放大需要1~2年时间相比,浮萍表达系统快了数倍。作物表达系统的有性繁殖后代和种植的季节性都是影响其工业放大的因素,而无性繁殖却意味着持续的生物质生产而无需考虑季节性。
再次,浮萍表达系统具有很高的产品安全性和环境安全性[7]。在药用重组蛋白生产过程中,动物(细胞)表达系统不能完全避免动物病原体等的污染;而浮萍是植物,其体内不具备动物病原体生长的条件,这能极大限度地减少产品的污染,从而与基于动物的表达系统相比具有更高的安全性。长期以来,浮萍都能被人或者各种动物(家禽、家畜和鱼类等)食用,这一事实说明浮萍自身没有代谢对动物体有毒的物质。很多转基因农作物常遇到的一个问题是常与非转基因农作物混淆,这可能会引起大众的质疑和反对,而浮萍不是农作物,大众也不用担心自己在饭桌上不小心吃到转基因的浮萍。转基因浮萍可以在完全密封的培养环境中生长,这能极大地减少基因逃逸对环境资源的影响。
虽然浮萍表达体系有很多优势,但是,在以下几个方面还需要注意并进一步优化。
首先是转录和翻译水平的调控问题,这会极大地影响重组蛋白的表达量。有大量研究表明,虽然CaMV 35S启动子在双子叶植物中具有组成型启动子特点,但是在很多单子叶植物中,其启动转录的效率并不理想,其中水稻就是一个典型的实例[29]。解决单子叶植物表达外源基因转录效率的一个常用策略就是使用其自身的组成型启动子,ACTIN的启动子就是一个很好的选择。不同物种在翻译水平上还存在密码子偏好,所以,在把外源蛋白的基因转入表达体之前,需要计算出表达体自身的密码子偏好,再根据这一偏好修改外源蛋白的基因密码,使其符合表达体的偏好。
其次,重组蛋白胞外分泌也是浮萍表达体系需要考虑的问题。虽然其它陆生植物表达体系不可能去考虑胞外分泌这一问题,但是,浮萍作为一个水生植物,可以像微生物或动物细胞表达体系一样在封闭的液体培养基中培养,所以,如果其所表达的重组蛋白可以分泌到胞外进入培养基,这能极大限度地减少后续纯化过程,从而降低生产成本。
再次,重组蛋白翻译后修饰会影响到其生物活性、抗原性和循环半衰期等。浮萍作为一个高等植物,和其它高等植物(玉米、水稻和烟草等)表达体系一样,具有像哺乳动物表达体系一样形成复杂蛋白复合体的能力,包括精确的蛋白翻译后折叠、N端和C端的裂解、多亚基组合、亚细胞定位、胞外分泌,以及蛋白糖基化等。但是,高等植物和人体在蛋白翻译后修饰上还是存在诸多差异。重组蛋白糖基化是最值得关注的,尤其是当重组蛋白用于注射治疗时。高等植物细胞N-糖基化模式很复杂,其中已知在几个重要方面和哺乳动物细胞存在差异。高等植物细胞常常产生短而复杂的糖基侧链;同时,高等植物细胞会生成两种哺乳动物细胞不具有的糖基,一种是β(1, 2)-木糖基(连接于β-甘露糖),另一种是α(1, 3)-海藻糖基(连接于氨基葡糖),这些独特的糖基连接常和植物过敏原有关;再者,高等植物细胞在蛋白糖基侧链末端不能加上唾液酸基团,这些末端唾液酸基团一般认为能有效延长蛋白的循环半衰期,缺少末端唾液酸基团的重组蛋白更易被肝脏清除掉。关于植物表达体系中多余的木糖基和海藻糖基问题,Cox等利用RNA干扰技术成功将青萍中β-1, 2-木糖基转移酶和α-1, 3-海藻糖基转移酶沉默掉,并同时表达了单克隆抗体mABs。该单克隆抗体具有单一的糖基侧链模式,同时不具有植物特异糖基,其与中国仓鼠卵巢细胞(CHO)表达的mABs相比,具有更好的抗体依赖性细胞介导的细胞毒作用(antibody-dependent cell-mediated cytotoxicity)和效应细胞的受体结合活性(effector cell receptor binding activities)[30]。
综上所述,浮萍可以说是一种极具魅力和应用前景的小型水生被子植物,可以适用于科研的各个研究领域。随着紫萍基因组测序和其基因转化体系的进一步完善,紫萍也有望成为代表水生植物的一个重要模式植物。相信关于浮萍的研究和应用将会越来越受到社会各界的进一步关注和青睐。
参考文献:
[1]LES D H, CRAWFORD D J, LANDOLT E, et al. Phylogeny and systematics ofLemnaceae, the duckweed family [J]. Systematic Botany, 2002, 27(2): 221-240.
[2]LES D H, LANDOLT E, CRAWFORD D J. Systematics of theLemnaceae(duckweeds):inferences from micromolecular and morphological data [J]. Plant Systematics and Evolution, 1997, 204: 161-177.
[3]中国科学院植物研究所. 成都生物所在植物调节剂调控浮萍高淀粉积累机制研究上获得突破性进展[N]. http://www.cib.cas.cn/xwdt/kydt/201512/t20151201_4481546.html, 2015 .
[4]LES D H, CRAWFORD D J. Landoltia (Lemnaceae), a new genus of duckweeds [J]. Novon, 1999, 9(4): 530-533.
[5]WANG W, KERSTETTER R A, MICHAEL T P. Evolution of genome size in duckweeds (Lemnaceae) [J]. Journal of Botany, 2011, doi:10.1155/2011/570319.
[6]LI J, JAIN M, VUNSH R, et al. Callus induction and regeneration inSpirodelaandLemna[J]. Plant Cell Reports, 2004, 22(7): 457-464.
[7]STOMP A M. The duckweeds: a valuable plant for biomanufacturing [J]. Biotechnology Annual Review, 2005, 11: 69-99.
[8]WANG W, HABERER G, GUNDLACH H, et al. TheSpirodelapolyrhizagenome reveals insights into its neotenous reduction fast growth and aquatic lifestyle [J]. Nature Communications, 2014, doi:10.1038/ncomms4311.
[9]WANG W, WU Y, MESSING J. The mitochondrial genome of an aquatic plant,Spirodelapolyrhiza[J]. Plos One, 2012, 7(10): 135-139.
[10]WANG W, MESSING J. High-throughput sequencing of three Lemnoideae (Duckweeds) chloroplast genomes from total DNA [J]. Plos One, 2011, 6(9): 24670.
[11]MARDANOV A V, RAVIN N V, KUZNETSOV B B, et al. Complete sequence of the duckweed (Lemnaminor) chloroplast genome: structural organization and phylogenetic relationships to other angiosperms [J]. Journal of Molecular Evolution, 2008, 66(6): 555-564.
[13]MOON H K, STOMP A M. Effects of medium components and light on callus induction, growth and frond regeneration inLemnagibba(duckweed)[J]. In Vitro Cell Devel Biol-Plant, 1997, 33: 20-25.
[14]MOON H K, RAJBHANDARI N, STOMP A M. Effect of media components and phytohormones on in vitro frond proliferation ofLemnagibbaG3 and 24 additionalL.gibbastrains[J]. Plant Res, 1998(1): 98-104.
[15]YAMAMOTO Y T, RAJBHANDARI N, LIN X H, et al. Genetic transformation of duckweedLemnagibbaandLemnaminor[J]. In Vitro Cellular & Developmental Biology-Plant, 2001, 37(3): 349-353.
[16]VUNSH R, LI J, HANANIA U, et al. High expression of transgene protein inSpirodela[J]. Plant Cell Reports, 2007, 26(9): 1511-1519.
[17]ZHU Y R, LU X Y, WANG S F, et al. The relationship between photorespiration and senescence ofS.polyrrhizaP143 [J]. Plant Science, 2005, 168(6): 1625-1632.
[18]LIU Q D, ZHU Y R, TAO H L, et al. Damage of PSII during senescence ofSpirodelapolyrrhizaexplants under long-day conditions and its prevention by 6-benzyladenine [J]. Journal of Plant Research, 2006, 119(2): 145-152.
[19]ZHU Y R, TAO H L, LV X Y, et al. High level of endogenous L-serine initiates senescence inSpirodelapolyrrhiza[J]. Plant Science, 2004, 166(5): 1159-1166.
[20]SCHERR C, SIMON M, SPRANGER J, et al. Test system stability and natural variability of aLemnagibbaL. bioassay [J]. Plos One, 2008, 3(9):3133.
[21]XU H, HU X H, ZOU X M, et al. Synthesis and herbicidal activities of novel 3-N-substituted amino-6-methyl-4-(3-trifluoromethylphenyl)pyridazine derivatives [J]. Journal of Agricultural and Food Chemistry, 2008, 56(15): 6567-6572.
[22]CHEN Q, JIN Y, ZHANG G, et al. Improving production of bioethanol from duckweed (Landoltiapunctata) by pectinase pretreatment [J]. Energies, 2012, 5(8): 3019-3032.
[23]XIU S N, SHAHBAZI A, CROONENBERGHS J, et al. Oil production from duckweed by thermochemical liquefaction [J]. Energy Sources Part A:Recovery Utilization and Environmental Effects, 2010, 32(14): 1293-1300.
[24]DUAN P, XU Y, BAI X. Upgrading of crude duckweed bio-oil in subcritical water [J]. Energy and Fuels, 2013, 27(8): 4729-4738.
[25]MURADOV N, FIDALGO B, GUJAR A C, et al. Production and characterization of Lemna minor bio-char and its catalytic application for biogas reforming [J]. Biomass and Bioenergy, 2012, 42: 123-131.
[26]BALIBAN R C, ELIA J A, FLOUDAS C A, et al. Thermochemical conversion of duckweed biomass to gasoline, diesel, and jet fuel: process synthesis and global optimization [J]. Industrial & Engineering Chemistry Research, 2013, 52(33): 11436-11450.
[27]TAO X, FANG Y, XIAO Y, et al. Comparative transcriptome analysis to investigate the high starch accumulation of duckweed (Landoltiapunctata) under nutrient starvation [J]. Biotechnology for Biofuels, 2013, doi: 10.1186/1754-6834-6-72.
[28]朱晔荣, 马荣, 刘清岱, 等. 浮萍相关研究的几方面重要进展 [J]. 生物学通报, 2010, 45(4): 4-6.
[29]MCELROY D, ZHANG W, CAO J, et al. Isolation of an efficient actin promoter for use in rice transformation [J]. The Plant Cell, 1990, 2(2): 163-171.
[30]COX K M, STERLING J D, REGAN J T, et al. Glycan optimization of a human monoclonal antibody in the aquatic plantLemnaminor[J]. Nature Biotechnology, 2006, 24(12): 1591-1597.
The research advance in duckweed
HUANG Ming-xing, ZHU Si-si, ZHANG Qiu-hong
(Department of Biological Engineering, Faculty of Chemical Engineering and Light Industry,Guangdong University of Technology, Guangzhou 510006, China)
AbstractThe Lemnoideae, commonly known as duckweeds, are the smallest, fastest-growing, and simplest of flowering plants. Duckweeds have been extensively used not only in the research of phytophysiology, phytogenetics, plant senescence, ecology and environmental test, but also in the treatment of water contamination, and the screening of herbicides. At present, duckweeds have shown great value in the bio-energy and bio-pharmaceuticals. Based on the studies of our laboratory, the recent researches in the taxology and the genomics of duckweeds were reviewed, and some important breakthroughs in the molecular level and the biopharmaceuticals were pointed out.
Key wordsduckweed; tissue culture; genomic sequencing; plant expression system
收稿日期:2015-05-12;修回日期:2015-06-30
基金项目:广东工业大学博士启动基金(NO. 253141005)资助项目
作者简介:黄明星,实验师,研究方向为生物能源,E-mail: mxhuang82@sohu.com。
中图分类号Q949.71+7.3
文献标识码A
文章编号2095-1736(2016)02-0092-07
doi∶10.3969/j.issn.2095-1736.2016.03.092
