大西洋庸鲽(Hippoglossushippoglossus L.)hipposin抗菌肽在毕赤酵母中的表达及其纯化
2016-06-29李文婧
李文婧, 陶 妍
(上海海洋大学 食品学院 上海水产品加工及贮藏工程技术研究中心,上海 201306)
大西洋庸鲽(HippoglossushippoglossusL.)hipposin抗菌肽在毕赤酵母中的表达及其纯化
李文婧, 陶妍
(上海海洋大学 食品学院 上海水产品加工及贮藏工程技术研究中心,上海 201306)
摘要Hipposin是大西洋庸鲽(Hippoglossus hippoglossus L.)组蛋白H2A的N端衍生物,共含51个氨基酸残基,具有抑制革兰氏阳性和阴性菌的活性。根据毕赤酵母密码子偏爱性对编码hipposin的cDNA(hip)进行密码子优化,并在5′端添加信号肽酶kex 2识别位点的编码序列、3′端添加6×His标签编码序列,两个末端分别添加Xho I和Xba I酶切位点,与表达载体pPICZαA构建重组表达载体pPICZαA-hip;电转至毕赤酵母X-33中,经Zeocin筛选以及对酵母基因组DNA的PCR鉴定,获得高拷贝酵母转化子;将其在30℃,250 r/min培养,使用1%的甲醇诱导表达目的蛋白;采用固化金属离子亲和层析(IMAC)纯化目的蛋白。培养96 h时目的蛋白的表达量最高;Western Blot分析显示,表达产物能与His单克隆抗体发生特异性反应;培养上清经纯化后获得高纯度的重组体HIP,但发现部分产物被蛋白酶降解。研究结果为hipposin抗菌肽的扩大制备奠定了基础。
关键词大西洋庸鲽;Hipposin抗菌肽;毕赤酵母;重组DNA表达
抗菌肽(Antimicrobial peptide,AMP)是生物防御外来病原微生物时在体内迅速合成的具有免疫抗菌活性的肽类物质,对细菌、真菌、病毒等均有杀伤作用,是机体天然免疫系统的重要组成部分[1-3]。抗菌肽具有结构和活性稳定、不易产生耐药性、无药物残留等优点,进而受到越来越广泛的关注。近年来有研究发现,有些抗菌肽的氨基酸序列与组蛋白高度相似,这类抗菌肽是在某种机制作用下由生物体内的组蛋白降解而分泌的。这种组蛋白衍生抗菌肽在低等水生动物、两栖动物和爬行动物等体内广泛存在并发挥重要的作用[4-6]。就鱼类组蛋白衍生抗菌肽的研究而言,Jorge等[7]从虹鳟(Oncorhynchusmykiss)的表皮黏液中分离得到Oncomyncin II,分子质量为7.2 ku,它是由组蛋白H1的C端69个氨基酸残基组成,对滕黄微球菌(Micrococcusluteus)和柠檬色游动球菌(Planococcuscitreus)等革兰氏阳性菌及大肠杆菌(Escherichiacoli)和鳗利斯顿氏菌(Listonellaanguillarum)等革兰氏阴性菌有抑菌活性,且没有溶血作用;Park等[8]从鲶鱼的皮肤黏膜中分离到具有较强抑菌活性的多肽,将其称为Parasin I,它的氨基酸序列与组蛋白H2A的N端完全一致;Bergsson等[9]从大西洋鳕鱼的皮肤黏液中得到与组蛋白H2B非常相似的13.6 ku的多肽,它对巨大芽孢杆菌(Bacillusmegaterium)、白色念珠球菌(Moniliaalbican)和大肠杆菌等都有较强的抑菌作用。
Hipposin抗菌肽是大西洋庸鲽(HippoglossushippoglossusL.)组蛋白H2A的N端衍生物,由Birkemo等[10]在大西洋庸鲽皮肤黏液中分离得到,它含有51个氨基酸残基,等电点12.23,分子质量5.4 ku,含α螺旋和较多的无规则卷曲;hipposin的51个氨基酸残基中含有15个碱性氨基酸,无酸性氨基酸;天然hipposin的N端是被乙酰化的,但研究显示人工合成的N端非乙酰化的hipposin与天然hipposin之间在抑菌活性上并无差别;此外,研究发现,hipposin的N端第1至39号氨基酸残基组成的片段的活性要强于第1至36号的,而第16至36号的要强于第1至19号的[11]。最近研究发现,hipposin的作用机制主要是通过改变细胞膜的通透性杀死细菌,而N端区域的存在会促进对细胞膜的通透作用;hipposin的C端部分是一种穿膜肽,可进入细菌细胞内与细胞内核酸发生作用[12]。虽然在2003年Birkemo等[11]已分离纯化出有活性的天然hipposin,并测定出其核苷酸序列,但迄今为止,关于它的重组DNA表达方面的研究仍属空白。据此,本研究以大西洋庸鲽hipposin为研究对象,参考编码hipposin的天然cDNA序列,根据毕赤酵母的密码子偏爱性对其进行优化合成,与表达载体pPICZαA连接构建真核重组表达载体,以毕赤酵母X-33为工程菌进行重组DNA表达,并通过固化金属离子亲和层析(IMAC)对其进行纯化,以期建立大西洋庸鲽来源的重组体hipposin的基因工程制备方法。
1材料与方法
1.1质粒、菌种和试剂
表达载体pPICZαA和毕赤酵母菌X-33均购自美国Invitrogen公司。XhoI、XbaI和SacI限制性内切酶购自日本TaKaRa公司;质粒小提试剂盒、酵母基因组提取试剂盒、DNA分子量marker、Western Blot试剂盒购自北京天根生物科技有限公司;Zeocin购自美国Invitrogen公司;酵母粉、胰蛋白胨购自英国OXOID公司;抗His标签鼠单克隆抗体、辣根过氧化物酶标记山羊抗小鼠IgG (H+L)、10×TBS-T购自北京康为世纪生物科技公司;蛋白质分子量marker购自北京中科瑞泰生物科技有限公司;Bio-Scale Mini Profinity IMAC Cartridges购自美国Bio Rad公司;其他试剂均为国产分析纯。
1.2Hipposin基因的优化合成
参考编码hipposin的天然cDNA序列(hip),根据毕赤酵母密码子偏爱性对其进行密码子优化,同时在5′端添加XhoI和信号肽酶切位点的编码序列,3′端添加XbaI和6×His标签的编码序列,优化后的hip由上海生工生物工程有限公司合成。
1.3重组表达载体pPICZαA-hip的构建及阳性转化子的筛选和鉴定
将合成的hip与pPICZαA连接构建真核重组表达载体pPICZαA-hip,将其转化至大肠杆菌感受态细胞DH5α中,在含25 μg/mL Zeocin的低盐LB培养基中培养约16 h,离心得到菌体后用质粒小提试剂盒提取重组表达载体pPICZαA-hip;通过双酶切和DNA测序考察其是否构建成功;对筛选到的pPICZαA-hip进行SacI线性化处理,电转至毕赤酵母X-33后,加入600 μL预冷的1 mol/L山梨醇,30℃静置1~2 h,涂布于含100 μg/mL Zeocin的YPDS培养基上,30℃培养至产生单菌落。
选取长势良好的单菌落,提取其酵母基因组DNA为模板,采用pPICZαA上的通用引物5′AOX1(5′-GACTGGTTCCAATTGACAAGC-3′)和3′AOX1(5′-GGCAAATGGCATTCTGACATCCT -3′)进行PCR扩增,检测目的条带,同时以空载体pPICZαA作为对照。
1.4在毕赤酵母中甲醇诱导表达HIP及Tricine-SDS-PAGE分析
选取筛选到的酵母转化子,接种于BMGY液体培养基中,30℃,250 r/min培养至D600 nm=2~6,离心收集菌体,用灭菌水清洗2次后再用BMMY培养基清洗一次,离心后用BMMY液体培养基重悬细胞至D600 nm为1.0,用1%甲醇诱导表达120 h;每隔24 h取样用以Tricine-SDS-PAGE分析,浓缩胶、夹层胶和分离胶浓度分别为4%、10%和16.5%,Tricine浓度为0.1 mol/L,SDS浓度为1%。
1.5Western Blot分析
将经Tricine-SDS-PAGE分离后的蛋白质从凝胶转移至PVDF膜上,将其与封闭液(5%脱脂奶粉)在室温下反应1 h,与抗His标签鼠单克隆抗体孵育2 h,1×TBS-T漂洗后,再与辣根过氧化物酶标记山羊抗小鼠IgG (H+L)孵育1 h,再用1×TBS-T漂洗后,用DAB显色液显色。
1.6重组体HIP的固化金属离子亲和层析(IMAC)纯化
上述通过甲醇诱导表达的酵母培养液经离心后得到的上清用0.22 μm滤膜处理后,采用Profinia蛋白纯化系统,经Ni2+柱(Bio-Scale Mini Profinity IMAC Cartridges)和梯度咪唑捕获目的蛋白,再通过透析脱去盐离子,获得纯化的重组体HIP。
2结果
2.1构建的重组表达载体pPICZαA-hip及其鉴定结果
将密码子优化后的含XhoI和XbaI酶切位点的hip(图1a)与经同样酶处理过的pPICZαA连接,得到重组表达载体pPICZαA-hip(图1b)。为了确定连接是否成功,使用XhoI和XbaI对pPICZαA-hip进行双酶切,经2%琼脂糖凝胶电泳检测,发现有大、小分子量的2个条带,目的片段的分子量为195 bp,与理论相符(图2a)。DNA测序结果进一步证明了目的片段hip与pPICZαA正确连接,未发生任何碱基突变。
2.2酵母阳性转化子的筛选及其鉴定结果
经SacI线性化的pPICZαA-hip电转入毕赤酵母X-33后,在YPDS平板上长出10个单菌落;分别提取这些酵母转化子的基因组DNA,并以此为模板,使用pPICZαA上的通用引物进行PCR,扩增出一条约691 bp的清晰条带(图2b);而以含空载体pPICZαA的酵母基因组DNA为模板的PCR,扩增到的条带约589 bp;两者均与理论值相符,证明pPIZαA-hip已成功整合进酵母基因组中。
2.3HIP在毕赤酵母X-33中的诱导表达结果
上述经筛选鉴定后的酵母转化子在BMMY液体培养基中,采用1%甲醇诱导表达120 h,每24 h取样用于Tricine-SDS-PAGE分析。由图3可见,诱导表达48 h时在4.6 ku与10 ku之间开始出现条带,至96 h时浓度达到最高;目的蛋白HIP的理论分子质量是6.5 ku,但图中显示并非单一条带,可能由于部分目的蛋白被降解所致。而空载体在此位置未见任何条带。
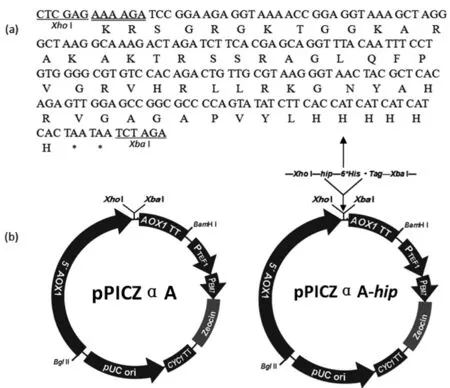
图1 合成的hip(a)及其pPICZαA-hip重组表达载体的构建(b)
单下划线为XhoI和XbaI酶切位点;双下划线为Kex 2识别位点
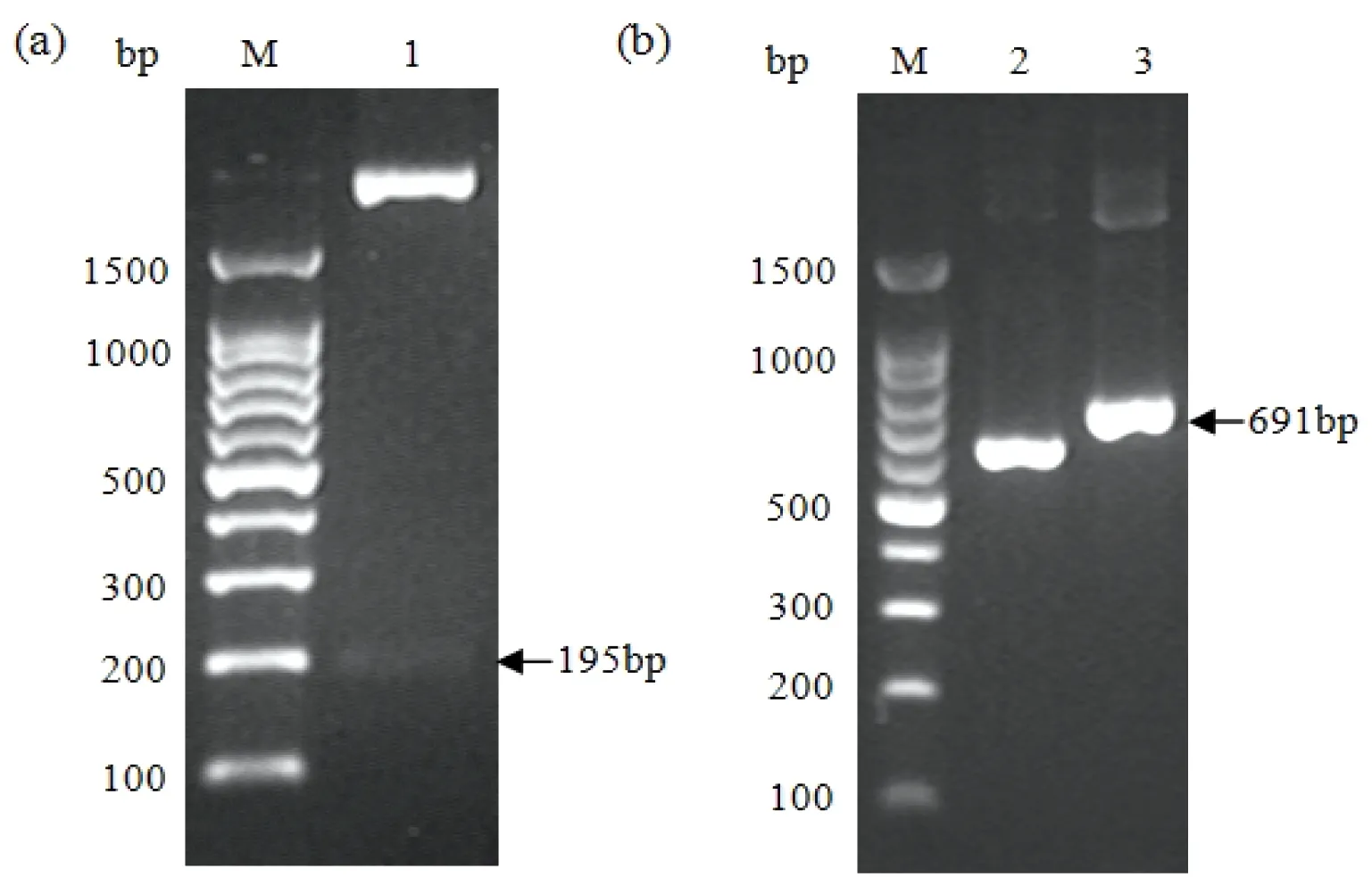
图2 重组表达载体pPICZαA-hip的双酶切鉴定(a)及酵母转化子基因组DNA的PCR鉴定(b)
M:DNA分子量标准;1:双酶切产物;2:含pPICZαA的转化子;3:含有pPICZαA-hip重组表达载体的转化子
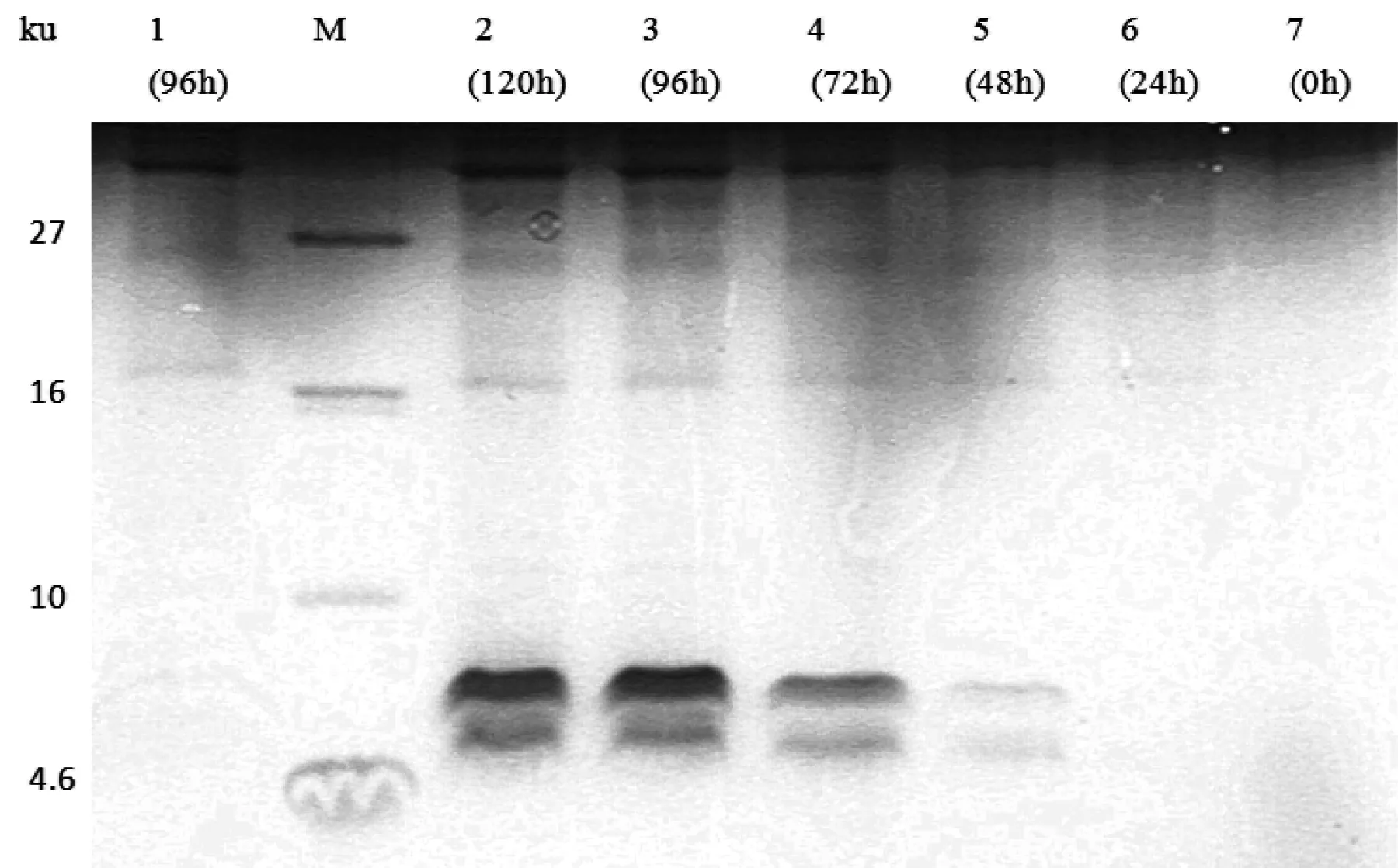
图3 表达不同时间的培养液上清的Tricine-SDS-PAGE分析
M:蛋白质分子量标准;1:含pPICZαA的上清;2~7:含pPICZαA-hip的上清
2.4对重组体HIP的Western Blot分析结果
为了进一步证明图3显示的条带为重组体HIP,选择表达96 h的培养液上清经Tricine-SDS-PAGE分析后(图4a),使用抗His标签的抗体进行了Western Blot分析。结果显示,在4.6 ku与10 ku之间出现一条较宽的条带(图4b),而空白对照并未出现此条带,由此证明在上清中存在分泌表达的重组体HIP。
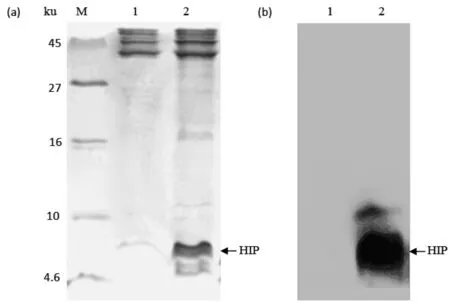
图4 重组体HIP的Tricine-SDS-PAGE分析(a)和 Western Blot分析(b)
M:蛋白分子量标准;1:含pPICZαA的上清;2:含pPICZαA-hip的上清
2.5重组体HIP的分离纯化结果
重组体HIP的羧基端携带6×His标签,可与Ni2+特异性结合,通过固化金属离子亲和层析(IMAC)可将重组体HIP结合在Ni2+柱上,再用高浓度的咪唑进行洗脱,便得到高纯度的目的蛋白。Tricine-SDS-PAGE分析显示,纯化前的培养液上清除了在4.6 ku与10 ku之间显示数个条带之外,还存在大分子量的条带;而纯化后的产物只在4.6 ku与10 ku之间显示条带,证明纯化目的已达到。单一性条带未获得的原因可能因目的蛋白结构不稳定被部分降解所致(图5)。
3讨论
本研究首先根据毕赤酵母的密码子偏爱性对编码大西洋庸鲽hipposin抗菌肽的cDNA进行了优化,确保了目的蛋白在毕赤酵母中的顺利表达。选取pPICZαA作为真核表达载体,因其含有Zeocin抗性基因,可筛选获得高拷贝转化子;因pPICZαA含有AOX1启动子,能通过甲醇诱导表达目的蛋白;此外,该表达载体在开放阅读框的前端带有α-factor信号肽序列,可引导重组体HIP分泌到细胞外,方便了后续的分离纯化[12,13]。Tricine-SDS-PAGE和Western Blot分析的结果证实了在本研究中上述这些目的都已达到。

图5 纯化的重组体HIP的Tricine-SDS-PAGE分析
M:蛋白质分子量标准;1:纯化的重组体HIP;2:未纯化的上清
关于在Tricine-SDS-PAGE和Western Blot分析中未出现单个条带的问题可能源于以下原因:目前为止报道的大多数重组体阳离子抗菌肽如hepcidin、defensins和cathelicidin等均含有多个半胱氨酸残基,在空间上可形成二硫键和反向平行的β折叠结构,以保证它们的结构稳定,且不易被蛋白酶水解[14-16]。本研究的目的蛋白为hipposin,属于组蛋白衍生物类抗菌肽,来源于H2A,虽然在其N端含有丰富的碱性氨基酸而带正电荷,但在它的一级结构中不含半胱氨酸残基,以致其空间结构中不含二硫键,且多数为不规则卷曲,因此,导致了它在结构上的不稳定,在分泌表达的时候易被酵母自身的蛋白酶水解而出现多个条带。在已有的研究报道中,具有抗菌活性的大多数组蛋白衍生抗菌肽是从生物机体中提取或人工合成的。而本研究中获得的hipposin是在毕赤酵母细胞中通过重组DNA表达的外源蛋白,极有可能在表达过程中被宿主细胞中的蛋白酶降解。
本研究成功构建了毕赤酵母真核表达系统,为组蛋白衍生抗菌肽或其他鱼类抗菌肽的基因工程制备奠定了基础。进一步的研究将聚焦于解决重组体HIP在表达过程中的蛋白酶降解问题,初步考虑可采取以下方法进行:1)在培养基中加入适量酪蛋白水解物或富含氨基酸物质的蛋白胨,以此保护目的蛋白不被降解;2)调整培养基的pH值,以抑制蛋白酶的活性,避免培养基的pH值与目的蛋白的pI接近,防止目的蛋白沉淀;3)适当加入几种蛋白酶抑制剂;4)进一步摸索诱导表达的时间,确定一个降解程度最低而产量较高的表达时间。
参考文献:
[1]MASSO-SILVA J A, DIAMOND G. Antimicrobial peptides from fish [J]. Pharmaceuticals, 2014, 7(3): 265-310.
[2]李冠楠, 夏雪娟, 隆耀航, 等. 抗菌肽的研究进展及其应用[J]. 动物营养学报, 2014, 26(1): 17-25.
[3]OYSTON P C, FOX M A, RICHARDS S J, et al. Novel peptide therapeutics for treatment of infections [J]. Journal of Medical Microbiology, 2009, 58(8): 977-987.
[4]LI C, SONG L, ZHAO J, et al. Preliminary study on a potential antibacterial peptide derived from histone H2A in hemocytes of scallopChlamysfarreri[J]. Fish & Shellfish Immunology, 2007, 22(6): 663-672.
[5]SEO J K, LEE M J, GO H J, et al. Purification and antimicrobial function of ubiquitin isolated from the gill of Pacific oyster,Crassostreagigas[J]. Molecular Immunology, 2013, 53(1/2): 88-98.
[6]PARK C B, KIM M S, KIM S C. A novel antimicrobial peptide fromBufobufogargarizans[J]. Biochemical and Biophysical Research Communications, 1996, 218(1): 408-413.
[7]FERNANDES J M, MOLLE G, KEMP G D, et al. Isolation and characterization of oncorhyncin II, a histone H1-derived antimicrobial peptide from skin secretions of rainbow trout,Oncorhynchusmykiss [J]. Developmental and Comparative Immunology, 2004, 28(2): 127-138.
[8]PARK I Y, PARK C B, KIM M S, et al. Parasin I, an antimicrobial peptide derived from histone H2A in the catfishParasilurusasotus[J]. FEBS Letters, 1998, 437(3): 258-262.
[9]BERGSSON G, AGERBERTH B, JÖRNVALL H, et al. Isolation and identification of antimicrobial components from the epidermal mucus of Atlantic cod (Gadusmorhua) [J]. FEBS Journal, 2005, 272(19): 4960-4969.
[10]BIRKEMO G A, LÜDERS T, ANDERSEN Φ, et al.Hipposin, a histon-derived antimicrobial peptide in Atlantic halibut (HippoglossushippoglossusL.) [J].Biochimica et Biophysica Acta, 2003, 1646(1/2): 207-2l5.
[11]BIRKEMO G A, MANTZILAS D, LÜDERS T, et al. Identification and structural analysis of the antimicrobial domain in hipposin, a 51-mer antimicrobial peptide isolated from Atlantic halibut [J]. Biochimica et Biophysica Acta, 2004, 1699(1/2): 221-227.
[12]BUSTILLO M E, FISCHER A L, LABOUYER M A, et al. Modular analysis of hipposin, a histone-derived antimicrobial peptide consisting of membrane translocating and membrane permeabilizing fragments [J].Biochimica et Biophysica Acta, 2014, 1838(9): 2228-2233.
[13]娄瑞娟, 罗利龙, 张霞, 等. 巴斯德毕赤酵母表达系统的研究进展和前景展望[J]. 生物学杂志, 2010, 27(5):73-76.
[14]王 治, 郑 甲, 唐诗哲, 等. 外源蛋白在巴斯德毕赤酵母中高效分泌表达的前沿技术[J]. 基因组学与应用生物学, 2014, 33(3): 689-694.
[15]BOUMAIZA M, EZZINE A, JAOUEN M, et al. Molecular characterization of a novel hepcidin (HepcD) fromCamelusdromedarius. Synthetic peptide forms exhibit antibacterial activity [J]. Journal of Peptide Science, 2014, 20(9): 680-688.
[16]KLÜVER E, ADERMANN K, SCHULZ A. Synthesis and structure-activity relationship of β-defensins, multi-functional peptides of the immune system [J]. Journal of Peptide Science, 2006, 12(4): 243-257.
Expression of Atlantic halibut (Hippoglossus hippoglossus L.) hipposin antimicrobial peptide in Pichia pastoris and its purification
LI Wen-jing, TAO Yan
(Shanghai Engineering Research Center of Aquatic-Product Processing & Preservation,College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China)
AbstractHipposin is the N-terminal derivative of Atlantic halibut (Hippoglossus hippoglossus L.) histone H2A with 51 amino acids, which has a good ability to inhibit gram-positive and gram-negative bacteria. The cDNA encoding hipposin (hip) was optimized and synthesized with reference to the codon preference of Pichia pastoris and its native cDNA sequence, respectively. In this synthesized fragment, nucleotides encoding recognition site for the enzyme (Kex2) cutting α-factor signal peptide and 6×His tag were added to 5′ and 3′ terminals, respectively, and Xho I and Xba I restriction sites were added to the both ends. This fragment was ligated with pPICZαA to construct the recombinant expression vector pPICZαA-hip. The pPICZαA-hip was transformed into P. pastoris X-33. The yeast transformants containing multicopy gene insertion were selected by using Zeocin, and identified by PCR for yeast genomic DNA. Expression was induced by adding 1% methanol at 30℃ and 250 r/min. Immobilized metal affinity chromatography (IMAC) was used to purify the target protein. The most appropriate expression time was 96 h. Western Blot analysis demonstrated that the His monoclonal antibody could be specifically bound to expressed products. The highly purified target protein was obtained from the fermentation supernatant, but it was found that a part of the expressed product was hydrolyzed. The present results provide important initial values for preparation of hipposin by recombinant DNA expression.
Key wordsAtlantic halibut; hipposin antimicrobial peptide; Pichia pastoris; recombinant DNA expression
收稿日期:2015-09-15;修回日期:2015-10-12
基金项目:农业部都市农业(南方)重点实验室开放课题 (No. UA201307)资助;上海市教育委员会产学研合作项目(No. 15CXY30)
作者简介:李文婧,硕士研究生,研究方向为水生动物分子生物学,E-mail: wenjingli111@163.com; 通信作者:陶妍,教授,研究方向为水生动物分子生物学,E-mail:ytao@shou.edu.cn。
中图分类号Q78
文献标识码A
文章编号2095-1736(2016)03-0015-05
doi∶10.3969/j.issn.2095-1736.2016.03.015
