红花木莲组织培养外植体消毒方法初步研究
2016-12-26高宇琼郭春喜田鹏
高宇琼+郭春喜+田鹏

摘 要:该文以红花木莲为试验材料,研究了不同消毒剂、不同消毒时间及不同外植体对红花木莲组织培养外植体的消毒效果的影响。结果表明:用75%酒精浸30s后,以0.1% HgCl2消毒10min,消毒效果最好;腋芽是组织培养的良好材料。研究结果为红花木莲组培快繁提供了依据。
关键词:红花木莲;外植体;消毒剂;组织培养
中图分类号 S79 文献标识码 A 文章编号 1007-7731(2016)20-0017-03
Study on Disinfection for the Explants of Manglietia insignis in Tissue Culture
Gao Yuqiong et al.
(College of Agroforestry Engineering and Planning,Tongren University,Tongren 554300,China)
Abstract:Manglietia insignis was taken as material,the effect of different disinfectants,disinfection time and different explants on Manglietia insignis was studied. The results showed that the most optimal method of sterilization was dipping axillary bud in 75% alcobol for about 30s and then in the solution 0.1% HgCl2 for 10min;the axillary bud was the optimal explant. These results provide the basis for tissue culture and rapid propagation of Manglietia insignis.
Key words:Manglietia insignis;Explant;Disinfectants;Tissue culture
红花木莲(Manglietia insignis(wall)Blume)为木兰科(Magnoliaceae)木莲属常绿阔叶乔木树种中较原始的种类,自然分布于我国云南、广西、贵州等地,尼泊尔、印度东北部、缅甸北部也有零星分布。红花木莲树干通直,树态优美,叶形秀丽,花大呈红色,是优良的城市园林绿化树种[1];其生长迅速,木材纹理通直,结构细密,有光泽、香味,心材耐腐,不翘不裂,加工容易,也是优良的装饰用材和胶合板材树种。但是,由于其分布零星、数量较少,且不断被砍伐,目前遭遇了濒临灭绝的境地,被列为国家三级保护植物[2-3]。组织培养技术已经成为保护和繁殖珍贵树种的有效措施之一,而外植体的消毒是组织培养成功的前提。本文就红花木莲组织培养中的外植体选择和消毒进行了研究,为红花木莲组培提供无菌材料,并为红花木莲组培快繁技术提供实验依据。
1 材料与方法
1.1 试验材料 试验材料取自贵州省铜仁市梵净山自然保护区。选取生长旺盛、健壮、无病害的成年红花木莲植株实生苗植株,取腋芽作为外植体进行消毒试验。
1.2 试验方法
1.2.1 外植体的处理 将采集的外植体用流水冲10min,用洗衣粉浸泡3~4min,漂洗数次,再用流水冲洗30min。
1.2.2 不同消毒剂及消毒浓度试验 在超净工作台上,先用75%的酒精浸泡外植体30s,用无菌水冲洗1次,转入消毒剂中消毒,然后按照下面处理方式对外植体进行消毒试验,以不同浓度的消毒剂设计以下6种处理:(1)0.1%HgCl2消毒剂浸泡8min;(2)0.2%HgCl2消毒剂浸泡8min;(3)3%NaClO消毒剂浸泡8min;(4)4%NaClO消毒剂浸泡8min;(5)9%Ca(ClO)2消毒剂浸泡8min;(6)10%Ca(ClO)2消毒剂浸泡8min。处理后,用无菌水冲洗4~5次,滤纸吸净外植体材料表面多余水分,然后接到启动培养基上。每处理接种30瓶,每瓶接种1个腋芽,试验重复3次,25d后分别观察并统计污染率、杀伤率、存活率。
1.2.3 不同消毒时间试验 以上步试验选出的最宜浓度的消毒剂按照以下时间进行消毒处理,消毒时间分别为2min、4min、6min、8min、10min、12min。每处理接种30瓶,每瓶接种1个腋芽,试验重复3次,25d后分别观察并统计污染率、杀伤率、存活率。
1.2.4 不同外植体消毒试验 分别将红花木莲的嫩叶片、腋芽、带芽的茎段、去皮种子经0.1%HgCl2消毒8min后,用无菌水冲洗4~5次,滤纸吸净外植体材料表面多余水分,将叶片切成1~2cm2的块状、带芽茎段切成2~3cm的段状,然后接到启动培养基上。每种外植体接种30瓶,每瓶接种1个,试验重复3次,25d后分别观察并统计污染率、杀伤率、存活率。
1.3 培养条件 接种培养基为:MS+6-BA 1.5mg·L-1+NAA 1.0mg·L-1+2,4-D 1.0mg·L-1+3%蔗糖+0.7%琼脂的诱导培养基上,培养基灭菌前用1moL·L-1 NaOH将pH调至5.6~6.0。培养基于121℃、1.1kg/cm2条件下灭菌20min,自然冷却凝固后使用。培养温度(25±2)℃,光照强度1 000~2 000Lx,光照时间12h/d。
1.4 数据统计与分析 采用Microsoft Excel统计污染率、杀伤率、存活率。按照下列公式统计污染率及存活率:
污染率(%)=污染数/接种总数×100;
杀伤率(%)=受杀伤数/接种总数×100;
存活率(%)=(接种总数-污染数-受杀伤数)/接种的茎段总数×100
2 结果与分析
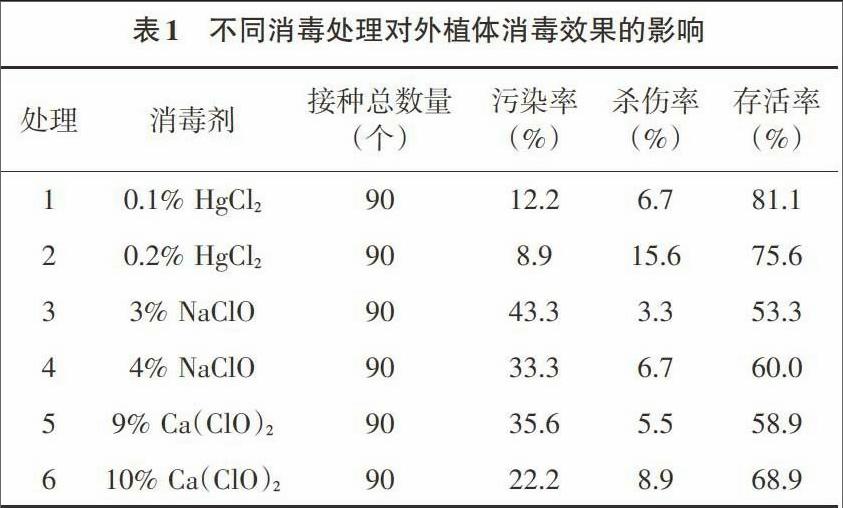
2.1 消毒剂对外植体消毒效果的影响 不同浓度的消毒剂对红花木莲外植体消毒效果的影响,结果见表1。由表1可知:HgCl2比NaClO、Ca(ClO)2的存活率都高,污染率也较其他消毒剂低,经HgCl2处理后的红花木莲腋芽外植体,存活数相对高、污染程度小,但是杀伤数比其他消毒剂大。不同浓度的NaClO、Ca(ClO)2的存活率相差不大,但污染率相差较大。不同浓度的相同消毒剂相比,均是高浓度的消毒效果比低浓度的好,但杀伤率也随之增大。总体来说,3种消毒剂之间HgCl2与NaClO、Ca(ClO)2存在显著差异,消毒效果为HgCl2>Ca(ClO)2>NaClO。在HgCl2两个浓度处理时,随着浓度的增大,污染率随之下降,但杀伤率也提高,存活率反而降低。因此,综合考虑污染率、杀伤率及存活率三者因素,本试验最适宜的消毒处理为处理1即0.1%HgCl2消毒8min的外植体存活率最高,达到81.1%。
2.2 消毒时间对外植体消毒效果的影响 以0.1% HgCl2为消毒剂,进行不同消毒时间对外植体效果的影响,结果见表2。由表2可知,随着消毒时间的增加,红花木莲腋芽外植体的存活率越来越高,在10min时红花木莲腋芽的成活率最高,达到84.4%。消毒时间太短,外植体的杀伤度较轻但其污染个数较多,而消毒时间太长,外植体的杀伤度较重但其污染个数较少。因此选用污染个数较少,杀伤率中等的,成活率相对较高时间,作为红花木莲腋芽外植体消毒时间的适宜时间。
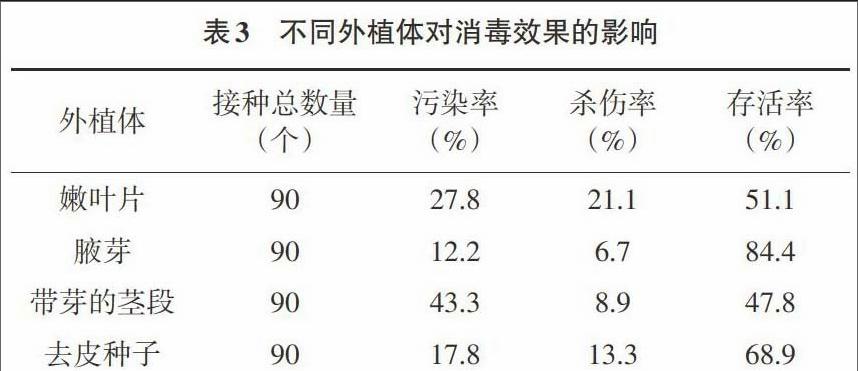
2.3 不同外植体对消毒效果的影响 以0.1% HgCl2消毒时间10min为消毒处理,用红花木莲当年生嫩叶片、腋芽、带芽的茎段、去皮种子进行不同外植体消毒效果试验,结果见表3。由表3可知,腋芽作为外植体时,存活率达到84.4%且能够发生分化,其次是去皮种子,而嫩叶片和带芽的茎段相差不大。这可能是由于腋芽处于生长旺盛时期,腋芽内部带菌较少,因而消毒效果比较好。带芽的茎段存活率低的原因可能是茎段带的细菌较多,以致消毒较难。去皮种子、嫩叶杀伤率较大,可能是消毒时间太长,HgCl2对幼嫩组织杀伤力较大。对于植物幼嫩组织可适当减少消毒时间。
3 结论与讨论
木本植物组织培养中的困难之一是获得无菌材料[4]。因此,外植体消毒成功与否,不仅关系到能否获得无菌材料,更关系到红花木莲组培快繁技术的获得。研究表明:不同的消毒剂对外植体消毒效果有不同的影响。本试验中,用腋芽作外植体时,HgCl2的消毒效果优于NaClO、
Ca(ClO)2,获得的无菌材料最多。这与蛇足石杉[5]、青榨槭[6]、四倍体刺槐[7]、大榕[8]、金银花[9]、麻栎[10]等植物外植体消毒研究结果一致。这是因为Hg2+可与带负电荷的蛋白质相结合,使细菌蛋白变性,酶失活[11]。
不同的消毒时间对于外植体消毒效果有明显影响,随着消毒时间的延长,污染率降低,但杀伤率升高,导致外植体存活率降低。因此,不能靠延长灭菌时间来改善消毒效果,最佳消毒时间确立应在综合考虑污染率、杀伤率基础上,以外植体存活率为最终判定依据[12-13]。本试验得到的最适宜的消毒时间为10min,此时达到了较好的消毒效果,
消毒剂对不同外植体的作用也不相同,这可能与外植体材料的组织部位、植株年龄、取材季节以及植株的生理状态、质量有关系。通过试验结果得出,腋芽是红花木莲外植体消毒最好的外植体,可能是腋芽所带的污染相对较少,且腋芽处于萌动时期,易分化,存活率高。
参考文献
[1]黎明,马焕成,李福秀.红花木莲苗期光合特性研究[J].西部林业科学,2004,33(2):42-45.
[2]傅立国,罗仲春,陈湘健.中国珍稀濒危植物[M].上海:上海教育出版社;1989.
[3]鲁元学,武全安,龚洵,等.红花木莲有性繁殖和生态生物学特性的研究[J].广西植物,1998,19(3):267-271.
[4]陈正华.木本植物组织培养及其应用[J].北京:高等教育出版社,1986.
[5]杨雪飞,罗建平,王瑛.蛇足石杉茎尖灭菌方法与组织培养的研究[J].安徽农业科学,2008,36(12):4947-4948,5025.
[6]赖玉洁,路丙社,陈书明,等.青榨槭外植体消毒方法初步研究[J].河北林果研究,2007,22(2):143-145,158.
[7]郭军战,舒庆艳,王丽玲,等.四倍体刺槐组织培养中的外植体选择和消毒研究[J].西北林学院学报,2002,17(1):15-18.
[8]张金锋,徐美玲,葛胜娟,等.大榕组织培养不同灭菌方法的初步研究[J].浙江农业科学,2010,(3):501-502.
[9]文明玲,乐正碧,徐茜,等.金银花组织培养外植体灭菌方法探索[J].陕西农业科学,2011,(2):50-51.
[10]唐罗忠,赵丹,诸葛强,等.麻栎组织培养外植体选择与灭菌方法[J].江苏林业科技,2010,37(5):22-25.
[11]冯金玲,陈辉,杨志坚,等.锥栗组织培养外植体消毒和选择[J].福建林学院学报,2006,26(1):22-25.
[12]吴林森,冯福娟,张宇,等.西兰花离体快繁外植体消毒技术初探[J].农业与技术,2006,26(3):96-98.
[13]刘进平,吴繁花.木薯外植体表面消毒和启动培养的研究[J].广西热带农业,2004,94(5):1-3. (责编:张宏民)
