叶内型肺隔离症9例
2016-06-27张学习张其刚于正伦
张学习,张其刚,于正伦
(中国医科大学附属第一医院胸外科,辽宁 沈阳 110000)
叶内型肺隔离症9例
张学习,张其刚,于正伦
(中国医科大学附属第一医院胸外科,辽宁 沈阳110000)
摘要:目的总结叶内型肺隔离症的诊断及治疗,提高对叶内型肺隔离症的认识。方法回顾性分析经影像学和(或)手术诊断为叶内型肺隔离症的9例患者临床资料并查阅相关文献。结果9例患者中男性5例,女性4例;年龄14~63岁,平均年龄36.3岁;病程中位数为4.2个月;7例术前诊断为叶内型肺隔离症,1例诊为肺部占位性病变性质待查,1例诊为后纵膈肿物伴肺部炎症。所有患者均行手术治疗,7例行常规开胸手术,1例采用电视辅助胸腔镜手术(VATS),1例采用电视胸腔镜辅助手术。术后病理均证实为叶内型肺隔离症。9例患者均获得随访,随访时间17.4个月,术后均生存良好,均无复发及死亡。结论叶内型肺隔离症是一种少见的先天性肺发育畸形,缺乏特异性症状、体征及影像学特征,容易漏诊及误诊;肺增强CT、三维重建及胸部血管造影有助于诊断;目前多采用VATS病变肺叶切除术,手术的关键是异常供血动脉的处理。
关键词:支气管肺隔离症;诊断,鉴别
肺隔离症(pulmonary sequestration,PS)是一种少见的支气管肺发育畸形,占先天性肺发育畸形的0.2%~6.4%[1-2]。PS的特点是病变肺组织与正常支气管树无交通,血供来源于体循环动脉,形成无功能的囊性肿块。本文回顾性分析了近3年我院9例经影像学和(或)手术诊断为叶内型PS的临床资料,并结合相关文献进行复习,旨在探讨叶内型PS的临床特征、诊断及治疗,以提高临床医生对叶内型PS的认识,减少误诊和漏诊。
1资料与方法
1.1一般资料回顾性分析我院近3年诊断为叶内型PS的9例患者,男性5例,女性4例;年龄14~63岁,平均年龄36.3岁;病程中位数为4.2个月。7例有临床症状,其中咳嗽7例,咳痰6例,咯血1例,痰中带血丝3例,2例无相关临床症状,系体检发现肺部病灶。
1.2方法诊断标准:经影像学和(或)手术病理证实肺部病灶存在来自体循环的动脉供血。收集9例患者的临床资料数据,记录相关的临床特征、影像学特征、术前相关辅助检查结果、术前诊断、手术方式、带管时间、术后并发症和病理结果。
2结果
2.1影像学表现9例患者中,病变位于左肺下叶基底段8例,1例位于右肺下叶基底段。这与相关报道[3]中的PS好发于男性,病变部位左侧多于右侧,且多位于下叶基底段相吻合。
5例行肺增强CT检查;3例行普通肺CT检查,其中1例行胸部血管造影;1例行肺3D-CT检查。6例呈囊性团块或囊实性,多数边缘较光滑,其中1例囊腔内见液平,5例行增强CT者病灶强化后呈囊壁和分割强化或网格样强化;2例呈实质性肿物,密度较均匀,边缘较清晰,无分叶及长短毛刺;1例呈斑片影,伴有大量炎性渗出。5例行肺增强CT者均显示与体循环动脉相连逗点状或条索状血管影进入病灶;1例行肺平扫后三维重建,可清晰显示血管的来源及走行,从而确诊为叶内型PS;1例行胸部血管造影,亦可清晰显示胸主动脉发出分枝进入病灶内。
2.2辅助检查2例行纤维支气管镜检查均未见明显异常;9例均行肺功能检查,其中7例肺功能正常,2例轻度限制性通气功能障碍;9例均行肺癌肿瘤标记物检查,均未见明显异常;9例均行血常规检查,8例大致正常,1例血象升高。
2.3病变部位、异常动脉来源手术证实9例均为叶内型PS患者,8例来源于胸主动脉(图1A),1例来源于腹主动脉(图1B和图1C);其中8例有1枝异常动脉供血,1例有2枝异常动脉供血。
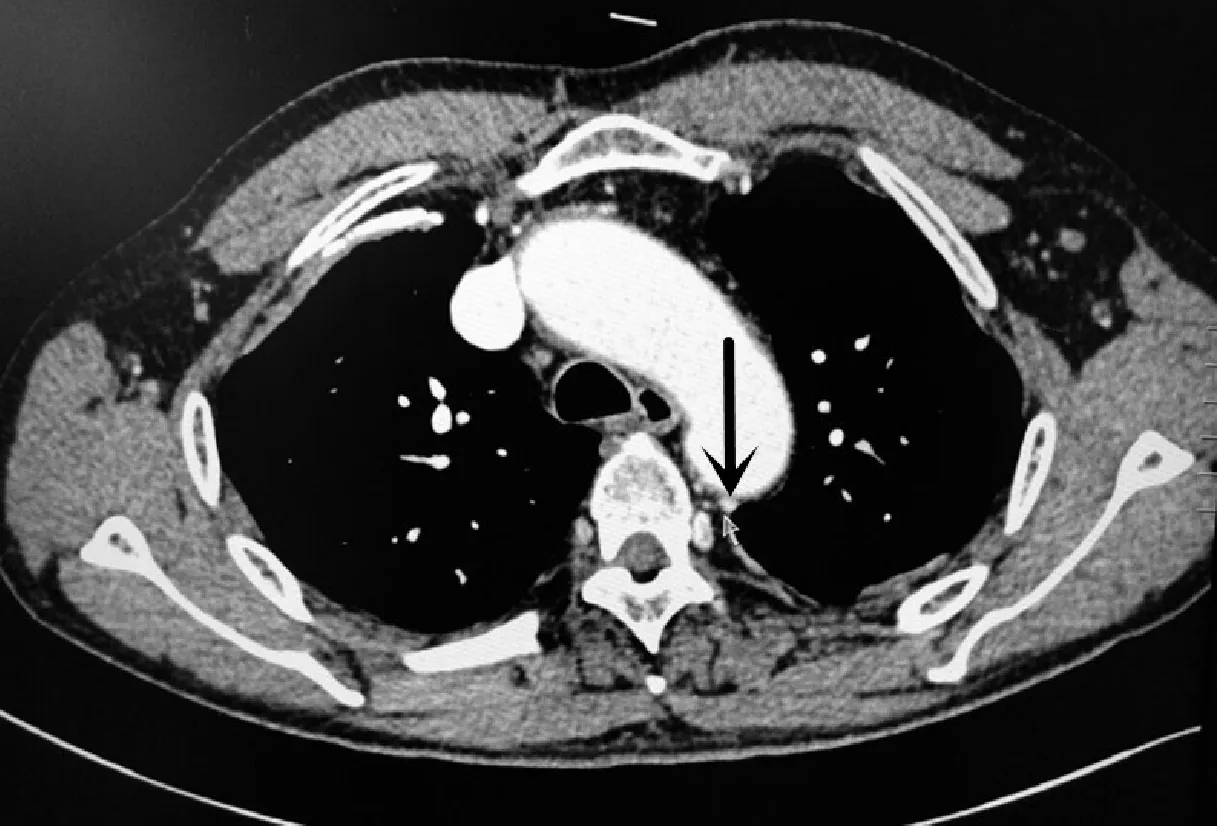
A箭头所示肺异常供血动脉由胸主动脉发出B箭头所示肺异常供血动脉由腹主动脉发出C箭头所示肺异常供血动脉由腹主动脉发出
图1异常动脉来源
2.4术前诊断9例叶内型PS患者,7例术前诊断为叶内型PS,其中5例是由肺增强CT确诊,1例由肺3D-CT确诊,1例由肺部血管造影确诊;1例诊断为肺部占位性病变性质待查;1例诊断为后纵膈肿物伴肺部炎症。
2.5治疗、带管时间及术后并发症9例叶内型PS患者均行肺叶切除术,其中7例采用常规开胸手术,1例采用VATS下病变肺叶切除术,1例采用胸腔镜辅助下病变肺叶切除术。术后均恢复良好,无死亡。术后带管时间4、3、2 d分别为3例、4例和2例,平均带管时间3.1 d;其中2例带管时间为2天的患者分别为VATS及胸腔镜辅助手术的患者。术后并发症2例均为常规开胸手术者,心律失常及胸腔积液各1例,心律失常患者给予对症药物治疗,胸腔积液患者行胸穿抽液及抗炎治疗,此2例经治疗均好转出院。
2.6病理检查9例患者异常供血动脉直径在4.0~11.5 mm之间,平均7.4 mm。9例患者手术切除的病灶直径在3.0~9.0 cm之间,平均6.2 cm。病灶境界较清楚,呈不均质纤维化及实变的肺组织,其内可见大小不等的囊腔,囊内壁光滑,其内可见黄绿色黏稠分泌物。
术后病理组织镜下可见大多数患者肺结构紊乱,肺发育不良,由末端细支气管、肺泡管及肺泡组成。细支气管呈囊性扩张,形状不规则,其内含有大小不等的囊腔,囊腔内壁光滑,被覆柱状上皮细胞,囊腔内可见黄绿色脓性黏稠分泌物;肺泡管及肺泡扩大,被覆单层立方上皮细胞;肺泡间隔区可见大片纤维化伴慢性炎症,其内可见血管及淤血。其中1例可见局部上皮异型性增生。
3讨论
PS属于一种先天性发育异常,有血管发育不全学说[4]、牵引学说[5]等多种学说。其中牵引学说被广泛接受。牵引学说认为胚胎发育初期原肠及肺芽周围有许多内脏毛细血管与背主动脉相连,当肺组织分离时相应的血管也逐渐减退消失,但由于某些原因一些血管减退消失不良成为主动脉的异常分支动脉,牵引一部分肺形成PS。PS分为叶内型及叶外型[6]。叶内型PS与正常的肺组织具有相同的脏层胸膜;叶外型PS具有独立的脏层胸膜。本研究中9例患者均为叶内型PS。
叶内型PS通常表现为反复发作的咳嗽、咳痰、咯血、发热、胸痛等症状。本组病例中7例有咳嗽,6例反复咳痰,1例反复咯血,3例痰中带血丝,2例无相关临床症状,也有报道表现为大咯血、血胸急诊开胸手术者[7]。由于叶内型PS缺乏特异性临床特征,临床上容易漏诊或误诊为肺部感染性疾病。影像学检查发现来自体循环的异常动脉供血是本病诊断的关键。以往血管造影被认为是术前诊断叶内型PS的金标准。随着影像学技术的发展肺增强CT、肺血管造影及三维成像技术能准确显示异常动脉的起源、走行及数目,并能显示局部病灶的范围及大小,已逐步成为叶内型PS诊断的首选检查[8]。本组术前确诊的7例,5例行肺增强CT,1例行肺平扫后三维重建,1例行胸部血管造影,均发现肺部病灶由异常体循环动脉供血。5例行增强CT的患者均为行肺平扫CT发现下肺多发囊性、囊实性病灶及发现逗点状或索条状炳与体循环相连接后进一步行肺增强CT确诊的患者。因此临床上行肺平扫CT发现下肺多发囊性、囊实性病灶,特别是肺平扫CT发现逗点状或索条状炳与体循环相连接时,应当进一步行肺增强CT、三维成像及肺血管造影检查,提高叶内型PS的诊断率,减少叶内型PS的漏诊及误诊。此外,为提高叶内型PS的诊断率,减少不必要的误诊及漏诊,本病还应与先天性支气管扩张、异常血管瘤等疾病相鉴别。支气管扩张患者典型的临床表现为慢性咳嗽、脓痰及咯血;合并感染时咳嗽及痰量明显增多,可成黄绿色脓痰,重者每日可达数百毫升。支气管扩张的肺CT表现为轨道征、环征、支气管可呈囊性扩张,其内可见液平,但病变部位无异常体循环动脉供血。由于支气管扩张的临床表现及影像学特征与叶内型PS有许多相似之处,因此临床上应加以鉴别诊断,避免误诊。
叶内型PS常可以引起反复肺部感染、高热及咯血等症状,并可以继发肺部真菌感染、病变区细胞异型性改变甚至癌变,因此对于明确诊断或高度怀疑叶内型PS的患者首选手术治疗。临床上通常采用病变肺叶切除为主;也有报道[9]采用异常血管栓塞术,通常用于体质较弱的青少年或婴幼儿。手术治疗不但可以切除病变的肺组织而且可以解除肺部左向右分流,从而减轻心脏的负担,避免心衰的发生。叶内型PS手术通常在肺部感染症状控制1~2周后进行[10]。叶内型PS手术的关键是异常供血动脉的处理,术前肺增强CT、三维成像及胸部血管造影明确异常供血动脉的位置、走行及数目对术中异常动脉的处理具有较大的帮助。肺隔离症异常供血动脉主要来自于降主动脉,包括横膈上的胸主动脉及横膈下的腹主动脉,其他还有少数来肋间动脉、锁骨下动脉等,大多数肺隔离症异常供血动脉为1支,但也有少数患者具有多支异常动脉。异常供血动脉通常走行于肺韧带内,由于异常动脉内存在左向右分流肌肉纤维较正常供血动脉少且常伴有动脉粥样硬化,术中易破裂出血。因此在分离肺韧带寻找异常供血动脉时操作应轻柔,切忌强行牵拉和盲目处理肺下韧带以免异常供血动脉破裂引起致命性大出血。本研究中9例患者均采用病变肺叶切除术,其中7例行常规开胸手术,1例采用VATS下病变肺叶切除术,1例采用电视胸腔镜辅助下病变肺叶切除术。VATS是一种完全采用电视辅助胸腔镜的微创手术方式;电视胸腔镜辅助手术是一种在电视胸腔镜辅助下的小切口手术,通常电视胸腔辅助手术切口较VATS手术切口稍大,但较常规开胸手术切口小。通过分析本组患者及复习相关文献资料可知,传统开胸手术具有创伤大、出血多、切口大、术后恢复时间长、术后并发症多等缺点;而VATS具有损伤小、切口小、出血少、术后恢复较快、术后并发症少等优点。对于有条件的医疗机构叶内型PS的患者推荐采用VATS下病变肺叶切除术。
综上所述,叶内型PS是一种少见的支气管肺发育畸形;肺增强CT、肺血管三维成像及胸部血管造影对本病的诊断具有较大的价值;目前大多采用VATS下病变肺叶切除术,手术的关键是异常供血动脉的处理。
参考文献
[1]Savic B,Birtel FJ,Tholen W,et al.Lung sequestration:report of seven cases and review of 540 published cases [J].Thorax,1979,34:96-101.
[2]Montjoy C,Hadique S,Graeber G,et al.Intralobar bronchopulmonary sequestra in adults over age 50:case series and review [J].West VirginiaMedical Journal,2012,108(5):8-13.
[3]邓伟吾,时国朝.实用临床呼吸病学[M].北京:中国协和医科大学出版社,2004:944.
[4]Smith RA.A theory of the origin of intralobar sequestration of lung [J].Thorax,1956,11(1):10-24.
[5]Carter R.Pulmonary sequestration[J].Ann Thorac Surg,1969,7(1):68-88.
[6]Frazier AA,Rosado de Christenson ML,Stocker JT,et al.Intralobar sequestration:radiologic-pathologic correlation[J].Radio-Graphics,1997,17(3):725-745.
[7]Hofman FN,Pasker HG,Speekenbrink RGH.Hemoptysis and massive hemothorax as Presatation of intralobar sequestration[J].Ann Thorac Surg,2005,80(6):2343-2344.
[8]Toya SP,Marouso D,Periklis T,et al.Pulmonary sequestration diagnosed by multidetector computed tomographic angiography[J].Eur J Cardiothorac Surg,2007,32(3):535-537.
[9]张珩,张绍明,徐小平,等.肺隔离症的诊断和手术治疗分析[J].中国临床医学,2009,16(4):534-535.
[10] Gonzalez D,Garcia J,Ficira E,et al.Video-assisted thoracoscopic lobectomy in the treatment of intralobar pulmonary sequestration[J].Interact Cardiovasc Thorac Surg,2011,12(1):77-79.
通信作者:张其刚,男,教授,博士生导师,研究方向:肺癌的早期诊断及微创治疗,E-mail:zqg6256@163.com
doi:10.3969/j.issn.1009-6469.2016.05.037
(收稿日期:2016-03-11,修回日期:2016-04-28)
