内镜下黏膜剥离术治疗胃钙化纤维性肿瘤4例临床分析
2016-06-27陈明锴余保平
肖 勇,陈明锴,刘 军,余保平
武汉大学人民医院消化内科/消化内镜中心,湖北省消化疾病微创诊治医学临床研究中心,湖北武汉430060
内镜下黏膜剥离术治疗胃钙化纤维性肿瘤4例临床分析
肖 勇,陈明锴,刘 军,余保平
武汉大学人民医院消化内科/消化内镜中心,湖北省消化疾病微创诊治医学临床研究中心,湖北武汉430060
目的 探讨胃钙化纤维性肿瘤(calcifying fibrous tumor,CFT)的内镜下特点及内镜下黏膜剥离术(endoscopic submucosal dissection,ESD)治疗胃CFT的临床疗效。方法 回顾性分析2015年1月-2015年7月于武汉大学人民医院消化内镜中心行ESD治疗的260例患者病理结果及其中4例CFT的临床资料(包括消化内镜、超声内镜、ESD治疗及随访情况)。结果 4例CFT患者中,平均年龄(48.75±9.14)岁,临床无特异性表现。4例CFT患者病灶均为单发,大小0.6~2.5 cm。超声内镜特点为起源于固有肌层的低回声病灶。4例患者均行ESD治疗,病灶均完整切除,病理主要为纤维结缔组织中夹杂少量纤维母细胞及散在的砂砾体形成;免疫组织化学显示纤维母细胞Vimenti阳性。术后无出血、穿孔等并发症,随访半年无复发。结论 胃CFT以单发表现,中老年常见,内镜下ESD治疗胃CFT安全、有效,可一次性完整切除病灶,术后并发症少,复发率较低。
钙化性纤维性肿瘤;内镜下黏膜剥离术;回顾性分析
钙化性纤维性肿瘤(calcifying fibrous tumor,CFT)是一种良性纤维性肿瘤,以大量胶原化的纤维组织内伴钙化为特征,间质内常伴散在的慢性炎细胞浸润[1]。CFT多位于四肢、躯干、腹股沟及头颅部皮下或深部软组织内,少数病例位于胸膜、纵隔和腹腔、盆腔等[2];而关于胃CFT的报道更为少见[1]。既往报道胃CFT的治疗多采用外科腹腔镜的方法治疗。内镜下黏膜剥离术(endoscopic submucosal dissection,ESD)可一次性完整剥离较大的消化道病变,避免组织残留、复发等,现已在消化道早癌、癌前病变治疗中有广泛应
用[3]。因此,本文回顾性分析了2015年1月-2015年7月于武汉大学人民医院消化内镜中心的ESD患者临床资料,以期探讨胃CFT的临床特点、超声内镜特点及ESD的疗效。
1 资料与方法
1.1 一般资料 分析2015年1月-2015年7月武汉大学人民医院消化内镜中心收治的260例ESD患者的临床资料及病理资料,共发现胃CFT 4例。
1.1 仪器 胃镜采用Olympus GIF Type XQ240或O⁃lympus GIF XQ260型或Fujinon EC⁃590ZW型。患者在常规消化道准备(禁食、电解质清理肠道等)后进行相关检查或治疗。
1.2 超声内镜检查 超声内镜采用GF⁃UMQ 240型超声内镜,360°环形扫描,探头工作频率7.5~20 MHz。回声性质参照消化道第3层(高回声)和第4层(低回声),依据病变大小、影像特征及起源于病灶累及胃壁层次作出影像学诊断。
1.3 ESD治疗方法 所有患者均行ESD,首先,于病变边界0.5 cm处用针形刀作环周标记,在病变基底部黏膜下注射含美兰及盐酸肾上腺素的生理盐水抬高病灶,然后用针刀沿标记外缘进行环周切开,再用一次性高频切开刀(Dual Knife)和IT刀于黏膜下层分离,完整剥离病灶;术后用一次性高频治疗钳和氩气处理创面,喷射生物止血流体膜以预防出血,必要时采用钛夹封闭创面,术后标本送检行病理检查。
1.4 术后标本处理 标本经4%甲醛固定24 h后,每隔3 mm行全程病检,常规石蜡切片,HE染色,必要时行免疫组化检查,由专业病理医师进行读片。
2 结果
2.1 确诊为CFT患者的一般情况 2015年1月-2015年7月在武汉大学人民医院消化内镜中心行ESD患者260例,追踪病理结果,最终诊断为胃CFT的患者4例,平均年龄(48.75±9.14)岁,其中男1例,61岁;女3例,平均年龄(44.67±5.03)岁。4例患者中,1例因例行常规胃镜检查发现病灶,其余3例分别因上腹胀、上腹隐痛、反酸行胃镜检查发现病灶(见表1)。
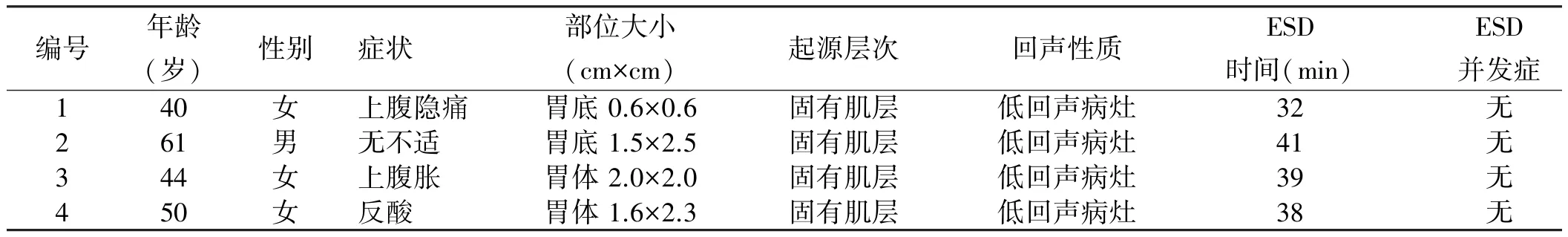
表1 胃CFT临床特征及消化内镜治疗情况Tab 1 Clinical characteristics of gastric CFT and its diagnosis and treatment in gastroscopy
2.2 病灶的基本特征 4处病灶中,2处为胃体,2处为胃底,大小0.6~2.5 cm,表面尚光滑,边界清楚,超声内镜下均为起源于固有肌层的低回声病灶。
2.3 内镜下表现 4处病灶,在白光内镜下表现为胃体或胃底隆起病灶,超声内镜下显示为起源于固有肌层低回声病灶,内镜下行ESD可完整剥除病灶,无出血、穿孔等并发症发生,术后随访半年未见复发。HE染色下可见切除标本固有肌层中大量纤维结缔组织生成,其中夹杂少量纤维母细胞,间质内可见多少不等的淋巴细胞浸润,部分区域可见散在的砂砾体形成(见图1)。
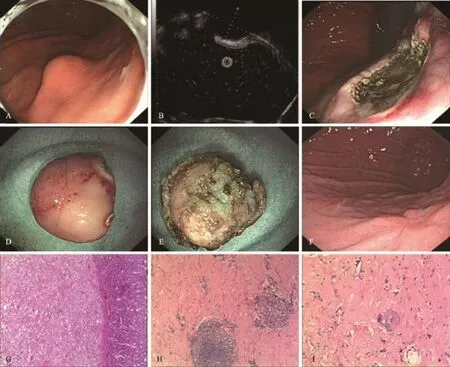
图1 胃CFT内镜表现 A:胃体大弯侧偏后壁隆起病灶;B:超声内镜胃体大弯侧偏后壁起源于固有肌层的低回声病灶,大小1.6 cm×2.3 cm;C:内镜下ESD剥除病灶后创面;D~E:ESD术后标本;F:术后半年内镜随访,胃体大弯侧偏后壁ESD后瘢痕;G~I:HE染色下可见胃黏膜层,在固有肌层中大量纤维结缔组织构生成,其中夹杂少量纤维母细胞(G,40×),间质内可见多少不等的淋巴细胞浸润(H,100×),部分区域见砂砾体(I,100×)Fig 1 Endoscopic features of the gastric CFT A:The greater curvature of the gastric body eminence lesions;B:The greater curvature of the gastric body hypoecho lesions originating from the muscularis propria layer by EUS,1.6 cm×2.3 cm;C:The lesion after ESD;D~E:The specimen after ESD;F:Half years later,the greater curvature of the gastric body scars after ESD;G~I:HE staining showed large fibrous connective tissue in the gastric muscularis propria layer which mixed with a small amount of fibroblasts(G,40×),varying amounts of lym⁃phocytes was seen in the mesenchymal(H,100×),psammoma bodies was also seen(I,100×)
2.4 病理结果 本研究中4例患者病灶切除标本呈球形或不规则结节状,切面灰白质硬,部分有沙粒感;显微镜下为大量透明变性的纤维结缔组织构成,其中夹杂少量纤维母细胞,间质内可见多少不等的浆细胞和淋巴细胞,部分区域可见散在的砂砾体形成,病变累及黏膜下固有肌层,与超声内镜判定一致。进一步行免疫组织化学检查,组织标本表达纤维母细胞Vimenti(见图2);而SMA、DES、S⁃100、CD34、CD117和DOG1均无表达。
2.5 随访复查胃镜 4例患者中,于术后半年复查胃镜,结果显示无复发情况。
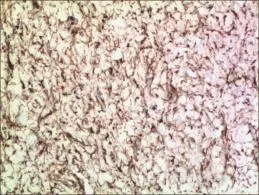
图2 CFT免疫组织化学(100×)Fig 2 Immunohistochemistry of the the gastric CFT(100×)
3 讨论
CFT是一种罕见的良性纤维性病变,美国凯斯西储大学学者Rosenthal和Abdul⁃Karim于1988年首次报道[4],全身任何解剖部位均可发生,以皮下及深部软组织最常见,而胃CFT报道较少。检索2000年-2015年万方和PubMed数据库,文献共报道胃CTF共26例,为罕见病例[1,5]。究其机制,有学者认为,胃壁CFT起源于炎性肌纤维母细胞瘤;也有学者发现,CFT病变镜下玻璃样变的胶原组织呈瘢痕疙瘩样图像,病变中炎细胞为多克隆性,以T细胞占优势,尤其CD8占优,进而推测CFT可能与免疫性修复相关[5]。CFT临床多表现为局部缓慢生长的无痛性肿块,胃CFT多无特异性表现,通常在行胃镜检查时发现,我们报道的4例均属于此。超声胃镜检查后初步考虑为胃间质瘤,后经病理证实为胃CFT。本消化内镜中心2015年1月-2015年7月共行ESD者260例,发现CET 4例(1.54%),发病率低;而既往有关胃CFT的报道多为个案,因而对胃CTF的诊疗仍无共识。因此,对我院ESD治疗的临床结果进行分析,以期初步了解胃CFT在消化内镜(包括普通内镜、超声内镜等)下的特点及ESD对胃CFT的疗效。
现已明确,胃壁CFT呈良性临床经过,是否需要内镜下干预仍存在争议。当前报道的胃CFT病例中,有学者采用腹腔镜下局部切除胃壁进行治疗,也有内镜下病灶切除。ESD是近年来开展的内镜新技术,可针对早期肿瘤行内镜治疗。随着内镜技术提高,ESD可以对黏膜下层病变进行剥离切除,也可以切除固有肌层病变。本研究中,4例患者均行ESD治疗,术中无出血、穿孔等并发症,术后患者恢复良好,随访半年无复发情况。因此,ESD治疗CFT安全、有效,与之前报道一致[6⁃7]。此外,通过对ESD技术行黏膜剥离后标本进行病检,可以进一步明确病灶的性质。4例ESD术后标本HE染色后显微镜下可见大量透明变性的纤维结缔组织,间质内可见多少不等的浆细胞和淋巴细胞,部分区域可见散在的砂砾体形成,病变累及黏膜下固有肌层;免疫组织化学结果显示纤维母细胞Vimenti表达阳性,SMA、DES、S⁃100、CD34、CD117和DOG1均无表达,诊断成立。
通过对ESD病理结果的回顾,对比内镜下表现,本研究结果显示,胃CFT内镜下常表现为黏膜局部隆起,切面为黏膜下界限清楚的结节,表面光滑,无明显包膜,有时可见点状灰黄区;超声内镜下为起源于黏膜下的低回声团块,内部回声均匀,有时可见钙化的高回声灶。胃CFT临床无特异性表现,镜下需与以下病变鉴别:首先,胃肠间质瘤(gastrointestinal stromal tumor,GIST)病变,本研究中4例患者在超声内镜下初步考虑均为GIST,后经病理鉴别。GIST可表现为黏膜下境界清楚的结节状肿块,但GIST细胞成分丰富,免疫组织化学CD117、CD34、nestin为阳性,而CFT不表达CD117,据此与GIST鉴别[8]。其次,需与平滑肌瘤鉴别,平滑肌瘤多发生于食管,胃平滑肌瘤相对少见,组织学上肿瘤内胶原较丰富,可见钙化灶,免疫组化可鉴别,平滑肌瘤SMA、desmin均表达阳性,而CFT均为阴性[9]。此外,还需与炎症性纤维性息肉(inflammatoryfibroidpolyp,IFP)和炎性肌纤维母细胞瘤(inflammatory myofibroblastic tumor,IMT)鉴别[10⁃11],前者为一种主要集中在黏膜下层的黏膜隆起性病变,以纤维母细胞围绕血管呈洋葱皮样增生为特征,有较多嗜酸性粒细胞浸润,CD34呈阳性;后者与CFT免疫表型有差异,IMT呈ALK阳性染色,SMA不同程度阳性,desmin可为阳性。还需与异位胰腺、黏膜下脂肪瘤等鉴别,异位胰腺可表现为半球形肿块,约85%发生于黏膜下层,其余可发生于肌层,多数位于胃窦和幽门,病理可进一步鉴别[12]。
综上,胃CFT为少见病,最终诊断主要靠病理结果,消化内镜下ESD是治疗胃CFT安全、有效的方法。ESD在切除病灶的同时,提供精确的病理情况,值得推广。该技术难度大,主要并发症是出血和穿孔,需做好充分准备。
[1]Larson BK,Dhall D.Calcifying fibrous tumor of the gastrointestinal tract[J].Arch Pathol Lab Med,2015,139(7):943⁃947.
[2]闫伟涛,陈保平,马振峰,等.胃钙化性纤维性肿瘤一例报告并文献复习[J].中华肿瘤防治杂志,2014,21(9):718⁃720.Yan WT,Chen BP,Ma ZF,et al.Case report of gastric calcifying fi⁃brous tumor and literature review[J].Chin J Cancer Prev Treat,2014,21(9):718⁃720.
[3]Bhatt A,Abe S,Kumaravel A,et al.Indications and techniques for endoscopic submucosal dissection[J].Am J Gastroenterol,2015,110(6):784⁃791.
[4]Rosentyal NS,Abdul⁃Karim FW.Childhood fibrous tumor with psam⁃ moma bodies.Clinicopathologic features in two cases[J].Arch Pathol Lab Med,1988,112(8):798⁃800.
[5]刘霞,古丽米拉·巴依坦,师艺,等.胃钙化纤维性肿瘤四例报告并文献复习[J].中华肿瘤防治杂志,2015,22(10):800⁃805.Liu X,Bayitan G,Shi Y,et al.Case report of gastric calcifying fibrous tumor and literature review[J].Chin J Cancer Prev Treat,2015,22(10):800⁃805.
[6]Shi Q,Xu MD,Chen T,et al.Endoscopic diagnosis and treatment of calcifying fibrous tumors[J].Turk J Gastroenterol,2014,25(Suppl 1):153⁃156.
[7]Ogasawara N,Izawa S,Mizuno M,et al.Gastric calcifying fibrous tumor removed by endoscopic submucosal dissection[J].World J Gas⁃trointest Endosc,2013,5(9):457⁃60.
[8]Sugár I,Forgács B,István G,et al.Gastrointestinal stromal tumors(GIST)[J].Hepatogastroenterology,2005,52(62):409⁃413.
[9]Attila T,Chen D,Gardiner GW,et al.Gastric calcifying fibrous tumor[J].Can J Gastroenterol,2006,20(7):487⁃489.
[10]HillKA,Gonzales⁃CrussiF,ChouPM.Calcifyingfibrous pseudotumorversusinflammatorymyofibroblastictumor:a histological and immunohistochemical comparison[J].Mod Pathol,2001,14(8):784⁃790.
[11]Agaimy A,Bihl MP,Tornillo L,et al.Calcifying fibrous tumor of the stomach:Clinicopathologic and molecular study of seven case with literature review and reapprisal of histogenesis[J].Am J Surg Pathol,2010,34(2):271⁃278.
[12]肖勇,付雪琼,刘军,等.内镜超声诊断胃异位胰腺20例临床分析[J].胃肠病学和肝病学杂志,2009,18(8):702⁃704.Xiao Y,Fu XQ,Liu J,et al.Analysis of 20 cases with gastric hetero⁃topicpancreasbyendoscopicultrasonography[J].ChinJ Gastroenterol Hepatol,2009,18(8):702⁃704.
(责任编辑:陈香宇)
Clinical analysis of endoscopic submucosal dissection for 4 cases of gastric calcifying fibrous tumors
XIAO Yong,CHEN Mingkai,LIU Jun,YU Baoping
Department of Gastroenterology,Department of Digestive Endoscopy,Renmin Hospital of Wuhan University,Clinical Research Center of Minimally Invasive Digestive Disease Diagnosis and Treatment,Wuhan 430060,China
Objective To investigate the endoscopic performance and features of the calcifying fibrous tumor(CTF),and evaluate the value of endoscopic submucosal dissection(ESD)treatment for it.Methods A total of 4 gas⁃tric CFT who were treated with ESD the endoscopic center of Renmin Hospital,Wuhan University from Jan.2015 to Jul.2015 were retrospectively analyzed.Endoscopic ultrasound(EUS)was used to assess whether endoscopy treatment was suitable.Tumor characteristics,complications,the enbloc resection rate,and the local recurrence rate were evaluated.Results Of the 4 patients,the median age was(48.75±9.14)years old.The maximum size of the lesions was from 0.6 cm to 2.5 cm.The EUS features of the lesions included a mass in the muscularis propria of the gastric wall and a hetero⁃geneous hypoechoic.All of the endoscopic treatments were completed successfully.The enbloc resection rate was 100%.Confirmed diagnosis was made by pathologic results.No local recurrence or complications were observed during the fol⁃low⁃up period(ranging from 6 to 8 months).Conclusion ESD treatment appears to be a feasible and safe procedure for CFT with relatively few complications and low mortality.
Calcifying fibrous tumor;Endoscopic submucosal dissection;Retrospective analysis
R735.2
B
1006-5709(2016)12-1404-04
2015⁃12⁃20
10.3969/j.issn.1006⁃5709.2016.12.027
肖勇,博士,主治医师,研究方向:消化道疾病的内镜下微创诊治及消化动力性疾病的基础与临床。E⁃mail:xiaoyue0831@163.com
