雏番鸭基因IX型禽1型副黏病毒分离鉴定及F基因序列分析
2016-06-27傅光华程龙飞温名根施少华陈翠腾傅秋玲陈红梅万春和刘荣昌林群群
傅光华,程龙飞,温名根,施少华,陈翠腾,傅秋玲,陈红梅,万春和,刘荣昌,林群群,黄 瑜
(1.福建省农业科学院畜牧兽医研究所,福建福州350013;2.福建省禽病防治重点实验室,福建福州350013;3.福建省畜禽疫病防治工程技术研究中心,福建福州350013;4.江西省吉安县畜牧兽医局,江西吉安343100)
雏番鸭基因IX型禽1型副黏病毒分离鉴定及F基因序列分析
傅光华1,2,3,程龙飞1,2,3,温名根4,施少华1,2,3,陈翠腾1,2,3,傅秋玲1,2,3,陈红梅1,2,3,万春和1,2,3,刘荣昌1,2,3,林群群1,黄瑜1,2,3
(1.福建省农业科学院畜牧兽医研究所,福建福州350013;2.福建省禽病防治重点实验室,福建福州350013;3.福建省畜禽疫病防治工程技术研究中心,福建福州350013;4.江西省吉安县畜牧兽医局,江西吉安343100)
摘要:自发病死亡雏番鸭中分离到一株(XBT14株)基因Ⅸ型禽1型副黏病毒,该病毒可引起雏鸭明显神经症状及急性死亡,致死率达44.4%;病毒融合(F)蛋白裂解位点处具有强毒株特有的多碱性氨基酸序列(112RRQRR↓F117),与GenBank数据库中已发布的基因IX型毒株核苷酸序列同源性高达99.7%~99.9%,与基因VII型毒株核苷酸序列同源性为85.5%~86.6%。该分离株与近来报道的GD09-2等基因IX型毒株处于同一进化分支。以上结果表明对水禽致死性的禽1型副黏病毒呈现基因型多样性,水禽禽1型副黏病毒病的防控日益严峻。
关键词:雏番鸭;禽1型副黏病毒;基因Ⅸ型;分离鉴定;F基因
禽1型副黏病毒(Avian Paramyxovirus type 1,APMV-1)又被称为新城疫病毒(Newcastle disease virus,NDV),是禽类最为重要的烈性传染性病病原之一。APMV-1可感染鸟目中大多数的物种,其中以火鸡、鸡及鸽子最易感[1]。尽管所有AP⁃MV-1分离株均为同一个血清型,但不同毒株间有显著遗传差异性。根据病毒基因组长度及核酸序列可将现有的APMV-1分成I类和II类(Class I和Class II),I类分离毒株多为低毒力毒株。基于病毒F基因47-421位核酸序列差异的遗传进化分析,II类病毒可分为11种基因型(基因I-XI型)[2]。基因IX型APMV-1最早于1946年在中国鸡群中分离获得,其代表毒株是F48E8毒株。近年来该基因型的病毒在鸡群和鸭群中的分离报道日渐增多[2-4],此外在野生鸟类也分离报道[5],不同毒株的致病性差异明显。本研究室对分离自某肉鸭场17日龄病死番鸭的一株基因IX 型APMV-1进行了血清学鉴定及病原RT-PCR鉴定,并测定了该病毒毒力及毒力相关基因序列,为深入了解基因Ⅸ型APMV-1的生物学特性及基因组分子特征提供科学依据。
1 材料和方法
1.1实验动物和血清等9日龄SPF鸡胚及1日龄SPF鸡,购自福州大北农生物技术有限公司;7日龄雏番鸭,购自非免疫种鸭场,经检测APMV-1及其抗体均为阴性;禽流感病毒(H5、H7和H9亚型)、APMV-1标准阳性血清,购自哈尔滨维科生物技术开发公司,减蛋综合征病毒高免血清由本实验室制备保存。基因VII型APMV-1鸭源分离株FP1/02由本研究室分离保存。
1.2主要试剂DNA/RNA抽提试剂盒、Fast Pfu DNA聚合酶,购自全式金生物技术有限公司,Su⁃perscript III反转录试剂盒,购自Invitrogen公司,PCR产物回收试剂盒,购自QIAGEN公司。
1.3样品处理及病毒分离无菌采集发病鸭胰腺和肝脏,按常规方法[6]制备成含抗生素的悬液后,接种9日龄SPF鸡胚,无菌收集24~120 h死亡鸡胚尿囊液,分别在37℃和4℃下测定病毒对鸡红细胞、鸭红细胞、绵羊红细胞的血凝活性,病毒保存于-80℃备用。
1.4病毒的鉴定参照文献[6]进行微量血凝(HA)测定,然后以4个血凝单位的分离毒分别与NDV阳性血清,AIV H5亚型、H7亚型、H9亚型阳性血清及EDSV-76等标准阳性血清进行微量血凝抑制试验(HI)。参照DNA/RNA抽提试剂盒说明书提取样品含毒尿囊液核酸,以此作为模板进行病原检测。参照文献[7]对样品检测番鸭细小病毒、小鹅瘟病毒、产蛋下降综合症病毒、鸭瘟病毒、禽流感病毒、新城疫病毒、鸭甲肝病毒、鸭坦布苏病毒和鸭呼肠孤病毒。扩增产物经琼脂凝胶纯化后,回收PCR产物直接送生工上海生物工程有限公司进行测序。
1.5病毒毒力及雏鸭致病性测定参照OIE于2012年颁布的APMV-1毒力评估标准方法,测定毒株XBT14对1日龄SPF雏鸡脑内接种致病指数(ICPI),以此评估该毒株的毒力[8]。7日龄番鸭75只随机分成3组,每组25只,攻毒组雏鸭通过肌注途径分别接种0.5 mL毒株XBT14d或毒株FP1/ 02(含病毒5×106EID50);对照组鸭通过肌注途径接种无菌PBS缓冲液,0.5 mL/只。各试验组动物进行隔离饲养,连续观察14 d,每天对各组动物进行观察,及时记录其发病情况、临床症状及剖检病变。
1.6病毒融合(F)蛋白序列测定与分析运用Primer Premier 5.0软件,根据GenBank上已发布的基因IX型禽1型副黏病毒F48E8毒株(FJ436302),GD09-2毒株(HQ317394)和JS/1/97/Ch(FJ436305)基因组序列,设计F基因特异性扩增引物,上游为:5′-GTT AGC TCA CCT GTC TAT CGA GT-3′;下游为:5′-TCA CCC AAA TCC GGT AGT T-3′。引物由上海生工生物科技有限公司合成。
按照DNA/RNA抽提试剂盒使用说明提取病毒RNA,用6碱基随机引物按照Transcript III试剂盒说明书进行反转录合成第一互补链cDNA,获得的cDNA用1.6.1设计的引物进行序列扩增。反应程序参照Liu等[2]提供方法进行,PCR产物直接送至生工上海生物工程公司测序。应用Lasergene 7.0软件对该病毒基因片段测定结果进行拼接编辑。使用Lasergene 7.0软件分析扩增的F基因核苷酸及推导氨基酸序列的分子特征等;采用MEGA 4.1软件包中NJ程序分析XBT14株F基因与GenBank已发布的47株不同基因型的APMV-1的F基因序列同源性、遗传距离,并构建系统进化树。
2 结果
2.1病毒的分离鉴定病料接种SPF鸡胚48 h后开始出现死亡,死亡鸡胚胚体全身出血,肝脏肿大、表面散布出血点,至96 h后5枚鸡胚全部死亡。该分离毒可凝集鸡、鸭和绵羊红细胞,HA效价分别为25,26和25;血清学试验表明,该病毒血凝活性可被APMV-1标准阳性血清所抑制,HI效价为27,而不被其他阳性血清所抑制;经PCR检测为APMV-1。
2.2XBT14毒株毒力及对鸭致病性结果表明XBT14毒株对1日龄SPF鸡的ICPI值为1.67,参照OIE 2012颁布的毒力评估标准[8],即当分离毒株的ICPI介于1.5~2时,所测定毒株为强毒力AP⁃MV-1,毒株XBT14为强毒力毒株。雏番鸭接种XBT14后40 h~48 h出现强直性颤抖及偏瘫等神经症状,60 h后陆续出现死亡。剖检病死番鸭可见胰腺表面散布大量针尖状白色坏死点或出血点,肠粘膜、脑膜等出血明显,14 d后25只番鸭死亡了12只,死亡率为44.4%。基因VII型分离株FP1/02感染雏鸭后引起的临床症状与病理变化与XBT14株相似,但雏鸭致死率较XBT14株高,为55.6%。
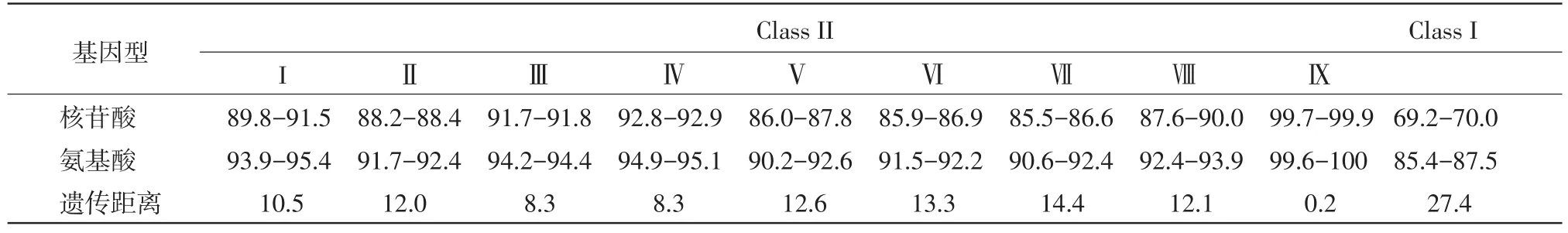
表1 不同基因型禽1型副黏病毒F基因序列比对分析 (%)
2.3病毒F基因序列特征克隆获得的XBT14毒株F基因组全长1 792 nt,与GenBank中发布的基因IX型其他毒株进行比较发现,F基因的起始序列为ACGGGTAGAA,终止序列为TTAAGAAAAAA,这与基因IX型其他分离株相同。F基因开放阅读框架为1 662 nt,编码553个氨基酸残基,其蛋白裂解位点氨基酸序列为112 RRQRR↓F117,为强毒力毒株氨基酸基序,这与病毒毒力测定结果一致。应用SignalP 4.0和TMHMM Server V2.0对F基因推导氨基酸序列分析表明,该蛋白的前31个氨基酸序列(1-31aa)为蛋白的信号肽序列,503-525位的氨基酸残基构成了该病毒的跨膜锚定区。在F蛋白胞外区存在5个潜在的糖基化位点(85NRT87,191NNT193,366NTS368,447NIS449,471NNS473),F蛋白151-171位的氨基酸残基序列(ILRLKESIAAT⁃NEAVHEVTDG)是APMV-1高度保守的具有中和活性的抗原表位[9]。
2.4序列同源性、遗传距离及系统进化分析将XBT14株与GenBank已发布的47株不同基因型APMV-1的F基因进行比对分析。结果发现该毒株与GD09-2等基因IX型毒株的F基因核苷酸及氨基酸序列同源性均在99.6%以上,各毒株间的遗传距离仅为0.2%;与II类APMV-1其他基因型毒株F基因核苷酸同源性在85.5%~92.9%之间,氨基酸同源性在90.2%~95.4%之间,其中与早期基因型(III型和IV型)毒株的核苷酸序列同源性在91.6%~91.9%之间,遗传距离均为8.3%,与基因II型的疫苗毒La Sota株F基因核苷酸同源性为87.8%,与晚期基因型(如Ⅶ型)毒株的核苷酸同源性最低,仅在85.5%~86.6%之间,遗传距离为14.4%;与I类APMV-1 F基因核苷酸同源性在69.2%~70.0%之间,遗传距离则高达27.4%,不同基因型APMV-1 F基因序列比对分析详见表1。
基于XBT14株及47株病毒F基因47-420nt区域片段的系统进化分析表明,XBT14毒株与GD09-2等IX型的毒株处于同一个系统进化分支,与基因I -IV型的早期基因型(Early genotype)病毒株共同构成一个大的遗传进化分支,而基因V-VIII型等晚期基因型(Late genotype)毒株则构成了另外一个遗传进化分支(见图1)。
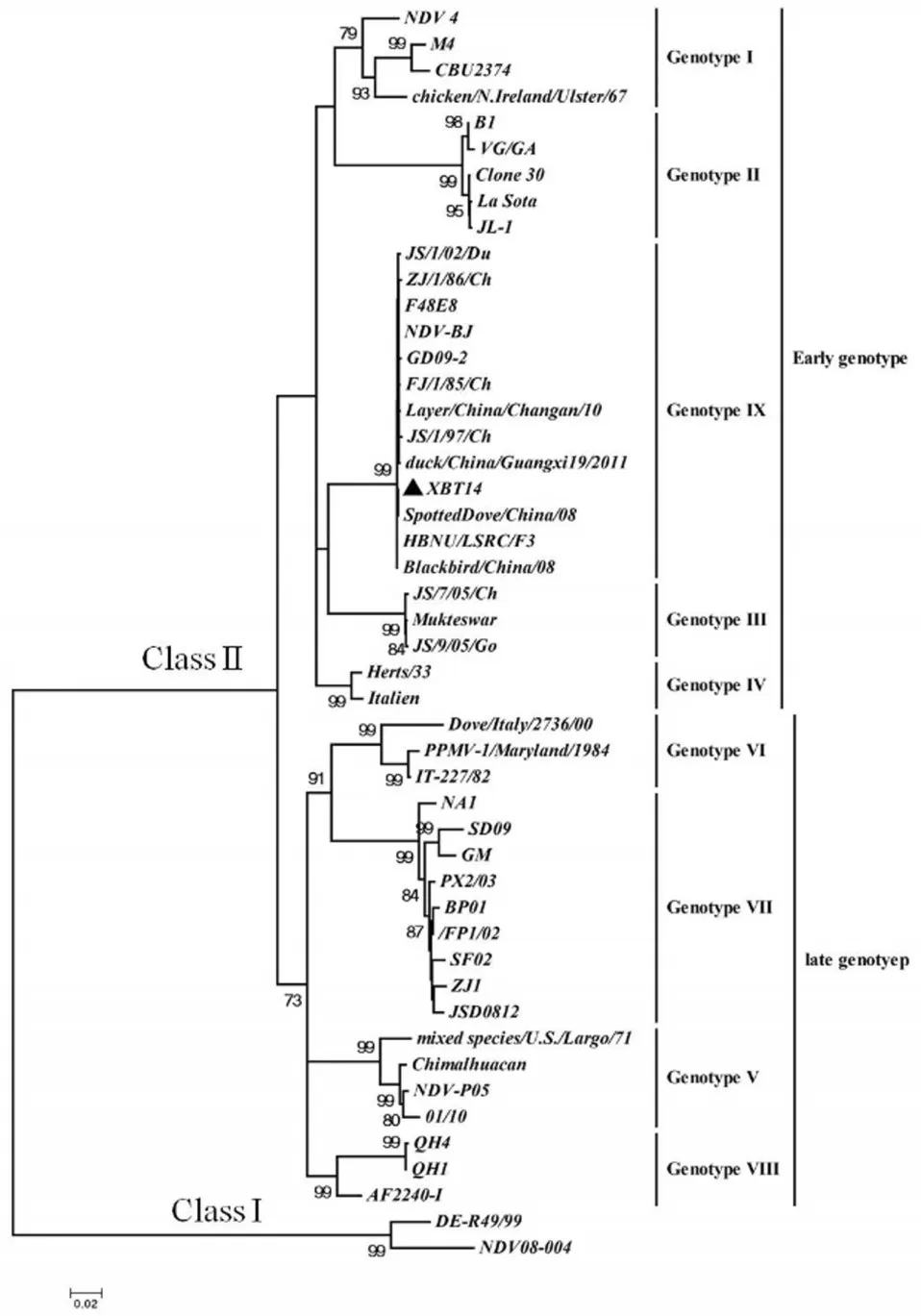
图1 APMV-1 F基因的系统进化分析
3 讨论
目前OIE采用病毒对1日龄SPF鸡脑内接种致病指数(ICPI)和病毒F基因裂解位点的氨基酸序列等指标来评价所分离的APMV-1毒力,强毒力毒株的F基因裂解位点为多碱性氨基酸序列,其ICPI指数均在1.5以上,即对1日龄SPF鸡表现为高致病性[1]。有学者认为ICPI指数并不适合用于流行病学监测过程中从健康家禽分离的AP⁃MV-1毒株毒力的评价[8]。现有研究表明,所有的基因Ⅸ型APMV-1分离株F基因裂解位点均为多碱性氨基酸序列,但大多数的分离株对鸭致病性不强[2-4],对鸡致病性也高低不一[2,3,5,10]。本研究所分离的番鸭源基因Ⅸ型毒株XBT14的F基因裂解位点为多碱性氨基酸序列,对1日龄SPF鸡的ICPI值为1.67,仍然符合OIE的强毒力株判定标准,且动物实验表明不仅可导致大量的鸡急性死亡,还引起44.4%感染番鸭死亡,即对番鸭具有很强的致病性,致病性稍弱于同期感染的基因VII型毒株FP1/02。Zhang等[10]也报道1株基因IX型GD09-2毒株对北京鸭具有中等致病性,可引起北京鸭明显的临床症状及组织的病理变化,发病率达40%,病死率为10%。由此可见,当前在鸭群中流行的APMV-1,除了基因VII型的毒株感染可引起鸭死亡外,部分基因IX型的毒株在遗传演变过程中也逐步获得了致死鸭的能力,这种致病性改变的分子基础有待于进一步深入分析。Yu等[11]研究表明,低毒力的水禽源APMV-1在鸡体内连续传代后可显著增强病毒毒力,这就预示着AP⁃MV-1在自然界的鸡群和鸭群中交叉往复传播过程中会出现毒力和致病性发生变异的可能。在我国农村鸡、鸭和鹅混养的现象较为普遍,这为APMV-1发生适应性变异提供了极为有利的生态条件。因此,加强家禽尤其是水禽中APMV-1的监测,实时了解和掌握该病毒流行的优势基因型及其分子变异特点,对我国家禽禽1型副黏病毒病的防控极其重要。
参考文献:
[1] Alexander D J & Senne D A . Newcastle Disease,Other Avian Paramyxoviruses,and Pneumovirus Infections . In:Diseases of Poultry,12th ed . Y . M,Saif,eds . Iowa State University Press,Ames,Iowa.2008.pp.75-116.
[2] Liu X F,Wan H Q,Ni X X,et al . Pathotypical and genotypical characterization of strains of Newcastle disease virus isolated from outbreaks in chicken and goose flocks in some regions of China during 1985-2001.Arch Virol.2003;148(7):1387-1403.
[3] Kang Y,Li Y,Yuan R,et al . Phylogenetic relationships and pathogenicity variation of two Newcastle disease viruses isolated from domestic ducks in Southern China. Virology Journal . 2014;11(1):1-13.
[4]袁远华,王俊峰,蔡丽丽,等.一株基因Ⅸ型鸭源新城疫病毒F基因的克隆及序列分析[J].中国畜牧兽医,2012,39(6):61-64.
[5] Duan X . Zhang P,Ma J,et al . Characterization of genotype IX Newcastle disease virus strains isolated from wild birds in the northern Qinling Mountains,China.Virus Genes 48:48-55.2013.
[6]殷震,刘景华动物病毒学[M].2版.北京:科学出版社,1997:343-354.
[7]傅光华,陈红梅,黄瑜,等.雏番鸭胰腺型鸭1型甲肝病毒分离鉴定及VP1基因分析.福建农业学报,2012,27(9):945-950.
[8] [OIE] World Organization for Animal Health.Chapter 2.3.14.Newcastle disease.In:Manual of diagnostic tests and vaccines for terrestrialanimals.Availablefrom:http://www.oie.int/fileadmin/Home/ eng/Health_standards/tahm/2.03.14_NEWCASTLE_DIS.pdf.2016.
[9] Mase M,Murayama K,Karino A,et al.Analysis of the fusion pro⁃tein gene of Newcastle disease viruses isolated in Japan . J . Vet. Med.Sci.2011,73(1),47-54.
[10] Zhang S,Wang X,Zhao C,et al . Phylogenetic and pathotypical analysis of two virulent Newcastle disease viruses isolated from domestic ducks in China.PLoS One.2011;6(9):e25000.
[11] Yu S,Noriko K,Hiroshi I,et al.Generation of velogenic Newcas⁃tle disease viruses from a nonpathogenic waterfowl isolate by pas⁃saging in chickens.Virology.2002;301(2):206-211.
Identification of genotype IX avian paramyxovirus type-1 and sequenceanalysis of theviral fusion gene
FU Guang-hua1,2,3,CHENG Long-fei1,2,3,WEN Ming-gen4,SHI Shao-hua1,2,3,CHEN Cui-teng1,2,3,FU Qiu-ling1,2,3,CHEN Hong-mei1,2,3,WAN Chun-he1,2,3,LIU Rong-chang1,2,3,LIN Qun-qun1,HUANG Yu1,2,3
(1.Institute of Animal Husbandry and Veterinary Medicine,Fujian Academy of Agricultural Sciences,Fuzhou 350013,China;
2.Fujian Provincial Key Laboratory for Avian Diseases Control and Prevention,Fuzhou 350013,China;3.Fujian Animal
Diseases Control Technology Development Center,Fuzhou 350013,China;4.Bureau of Animal Husbandry and
Veterinary Medicine of Zhaosu County of Jiangxi,Ji′an 343100,China)
Abstract:Recently,an avian paramyxovirus type 1(APMV-1)strain XBT14 was isolated from a dead duck.Animal experi⁃ment showed that this isolate could cause obvious clinical signs with acute death in seven-day old Muscovy duckling,with a mortal⁃ity rate of 44.4% . Sequence analysis showed that Fusion gene of the strain XBT14 contains multiple basic amino acids(112 RRQRR↓F117)at the cleavage site that implies the high pathogenic characteristics of the virus isolate.Homology analysis showed that the XBT14 shared 99.7% to 99.9% nucleotide acid identity with those of genotype IX viruses,while shared 85.5% to 86.6% homology with those of genotype VII strains(the currently dominant genotype in poultry). Phylogenetic analysis showed that the XBT14 strain was clustered with a genotype IX virus strain GD09-2.Our data indicate that the genotypic diversity of APMV-1 vir⁃ulent to waterfowl is increasing,and this will post a heavy threat on the disease prevention and controls.
Key words:duckling;avian paramyxovirus;genotype IX;isolation and identification;Fusion gene
中图分类号:S852.65+9.5
文献标志码:A
文章编号:0529-6005(2016)05-0006-04
收稿日期:2016-02-26
基金项目:国家自然科学基金(30972203);现代农业水禽产业技术体系专项(CARS-43);福建省农科院青年英才计划项目(YC2015-13);福建省农科院“双百”行动项目(sbmn1626,sb⁃mx160)
作者简介:傅光华(1977-),男,副研究员,博士,主要从事动物病毒学研究,E-mail:fuyuan163@163.com
通讯作者:黄瑜,E-mail:huangyu_815@163.com
Corresponding author:HUANG Yu
