甜味剂莱鲍迪苷A的致突变作用试验
2016-06-27郝褔星郑玲敏周泽伟陈秀云张雨梅扬州大学兽医学院江苏扬州2250092江苏畜牧兽医职业技术学院江苏泰州225300江苏省动物重要疫病与人兽共患病防控协同创新中心江苏扬州225009
郝褔星,郑玲敏,周泽伟,陈秀云,张雨梅,3(.扬州大学兽医学院,江苏扬州225009;2江苏畜牧兽医职业技术学院,江苏泰州225300;3.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏扬州225009)
甜味剂莱鲍迪苷A的致突变作用试验
郝褔星1,2,郑玲敏1,周泽伟1,陈秀云1,张雨梅1,3
(1.扬州大学兽医学院,江苏扬州225009;2江苏畜牧兽医职业技术学院,江苏泰州225300;3.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏扬州225009)
摘要:为了评价甜菊糖苷中的主要成分之一莱鲍迪苷A的致突变作用,在2 500~4 μg /皿范围内,对莱鲍迪苷A(含量≥97%)进行了Ames试验,灭菌水作为阴性对照;以5.0 g/kg体重、2.5 g/kg体重和1.25 g/kg体重剂量进行了小鼠骨髓细胞微核试验和小鼠精子畸形试验,以40 mg/kg环磷酰胺为阳性对照,生理盐水为阴性对照。结果Ames试验中,莱鲍迪苷A对TA97、TA98、TA100和TA102菌株的回变菌落数均小于阴性对照组的两倍,且未见剂量-反应关系,Ames试验阴性;小鼠骨髓细胞微核试验和小鼠精子畸形试验均为阴性。表明莱鲍迪苷A在试验剂量下无致突变作用。
关键词:莱鲍迪苷A;Ames试验;微核试验;精子畸形试验
甜菊糖是从原产南美巴拉圭东北部的菊科小灌木甜叶菊(stevia rebaudiana bertoni)的叶子中提取出的一类天然的低热量的高倍甜味剂,其甜度是蔗糖的250~300倍,热量仅为蔗糖的1/250左右[1-2]。目前为止,已从甜叶菊中分离得到8种不同甜度的糖苷[3-4]分别为:甜菊糖苷(stevioside)、甜菊醇双糖苷(steriolbioside)、莱鲍迪苷A(rebaudioside A)、莱鲍迪苷B(rebaudioside B)、莱鲍迪苷C(rebaudioside C)、莱鲍迪苷D(rebaudioside D)、莱鲍迪苷E(rebaudiosideE)、杜尔可苷A(dulcoside A)。其中甜菊糖苷是主要成分,占60%~70%,甜度为蔗糖的300倍;其次是莱鲍迪苷A,占15%~20%,甜度为蔗糖的450倍,甜味较纯正,且甜味最接近蔗糖,其他组分含量都较少。甜菊糖苷类高甜度低热量的特点,作为蔗糖的替代品在食品中应用越来越多,在饲料中作为甜味剂也有应用。
由于甜菊糖苷类的规格资料不足,代谢物甜菊醇体外实验中表现出致突变性[5-6],对其应用安全性存在着争议[7]。至2008年,在联合国粮农组织(FAO)、世界卫生组织食品添加剂专家委员会(JECFA)第69届会议上,确定了甜菊糖苷每日允许摄入量(ADIS)为0~4 mg/kg体重(以甜菊醇表示)[8]。同年,美国药品食品管理局(FDA)批准允许在食品中使用甜叶菊提取物莱鲍迪苷A。2012年,法国成为欧盟第一个批准在食品和饮料产品内使用高纯度莱鲍迪苷A(97%)的国家[9]。但目前国内对莱鲍迪苷A的深入研究和其在食品中的应用还相对较少。本文通过鼠伤寒沙门菌回复突变试验(Ames试验)、小鼠骨髓细胞微核试验和小鼠精子畸形试验,研究莱鲍迪苷A在体内体外的致突变作用,为莱鲍迪苷A作为天然甜味剂在食品或饲料中的应用的安全性评价积累资料。
1 材料与方法
1.1受试物及试剂莱鲍迪苷A,含量≥97%,批号2012-002P,由某生物技术公司生产。
2-氨基芴(2-AF),纯度>99%,日本东京化成工业株式会社;敌克松,纯度98.8%,美国DIMA技术有限公司;4-硝基喹啉-N-氧化物、甲基磺酸甲酯,纯度均大于98%,美国Amresco公司;多氯联苯(Aroclor1254),美国Crescent Chemical有限公司。
莱鲍迪甙A试液配制:称取适量溶于水,临用前用无菌蒸馏水配制并梯度稀释至所需浓度,现配现用。阳性对照物均用二甲基亚砜(DMSO)配制。
1.2实验菌株TA97、TA98、TA100和TA102菌株,由江苏省疾病控制中心提供,-80℃保存。试验菌株生物学特性按GB 15193.4-2003标准方法鉴定符合试验要求。
1.3实验动物ICR小鼠,体重24~28 g;Wistar大鼠,体重180~200 g,由扬州大学比较医学中心提供,动物生产许可证号:SCXK(苏)2012-0004,使用许可证号:SYXK(苏)2012-0029。饲喂经60Co照射饲料,24±2℃,湿度60±20%,自由采食和饮水,饮水为符合城市饮用水标准的自来水。试验前在实验环境中适应3 d,灌胃前停食12 h,不限制饮水。
1.4Ames试验
1.4.1大鼠肝微粒体酶的诱导和S9的制备选择健康雄性成年Wistar大鼠2只,采用多氯联苯(Aroclor1254)(200 mg/mL玉米油溶液,按500 mg/ kg体重)腹腔注射作为诱导剂。按GB 15193.4-2003方法制备S9,生物活性鉴定合格后,-80℃保存备用。
1.4.2平板掺入法Ames试验以鼠伤寒沙门菌突变株TA97、TA98、TA100和TA102菌株为试验菌。采用平板掺入法进行试验。根据预试验结果,受试物莱鲍迪苷A的剂量设置分别为:2500 μg /皿、500 μg /皿、100 μg /皿、20 μg /皿、4 μg /皿;另设阴性(溶剂)对照组和阳性对照组,每个处理组分加S9(+S9)和不加S9(-S9)两个系列,每个系列设3个平行平皿。阳性对照:加S9时四菌株均用2-氨基芴(2-AF),浓度为100 μg/mL(10 μg/100 μL·皿);不加S9时TA97、TA98用敌克松,浓度为0.5 mg/mL(50 μg/100 μL·皿),TA100用4-硝基喹啉-N-氧化物,浓度为5 μg/mL(0.5 μg/ 100 μL·皿),TA102用甲基磺酸甲酯,浓度为10 μg /mL(1.0 μg/100 μL·皿)。
双盲法记录每皿回变菌落数。按GB 15193.4-2003法规定的标准判定Ames试验结果为阴性或阳性。
1.5小鼠骨髓细胞微核试验莱鲍迪苷A配制成各试验浓度的水溶液。采用灌胃染毒,灌胃体积为0.2 mL/10 g。
瑞鲍迪苷A分为5.0 g/kg体重、2.5 g/kg体重和1.25 g/kg体重3个剂量组;另以40 mg/kg体重环磷酰胺腹腔注射为阳性对照和蒸馏水为阴性对照。每组10只小鼠,雌雄各半。各组染毒二次,时间间隔24 h。于第二次给予受试物后6 h处死小鼠,骨髓制片。按农业部1147号公告“兽药小鼠骨髓细胞微核试验指导原则”进行微核率的检查并判定微核试验的结果。
1.6小鼠精子畸形试验莱鲍迪苷A精子畸形试验剂量组同微核试验。每组10只雄性ICR小鼠,每天染毒1次,连续5 d。于第1次给予受试物后35天脱颈椎处死小鼠,按农业部1147号公告“兽药小鼠精子畸形试验指导原则”进行精子畸形检查。每只小鼠检查1 000个精子,计数畸形精子数并进行分类。
1.7统计分析数据统计采用SPSS12.0,显著性比较采用χ2分析。
表1 莱鲍迪苷A鼠伤寒沙门菌回复突变试验 (±SD)
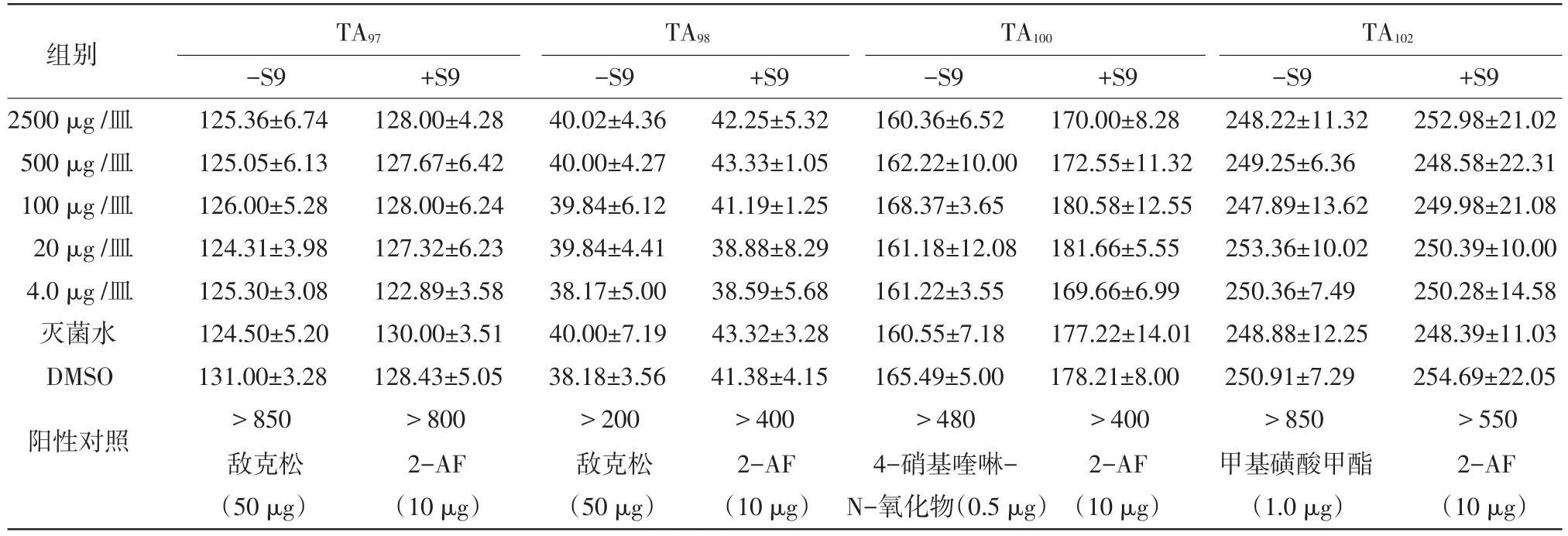
表1 莱鲍迪苷A鼠伤寒沙门菌回复突变试验 (±SD)
TA97TA98TA100TA102组别 -S9 +S9 -S9 +S9 -S9 +S9 -S9 +S9 2500 μg /皿 125.36±6.74 128.00±4.28 40.02±4.36 42.25±5.32 160.36±6.52 170.00±8.28 248.22±11.32 252.98±21.02 500 μg /皿 125.05±6.13 127.67±6.42 40.00±4.27 43.33±1.05 162.22±10.00 172.55±11.32 249.25±6.36 248.58±22.31 100 μg /皿 126.00±5.28 128.00±6.24 39.84±6.12 41.19±1.25 168.37±3.65 180.58±12.55 247.89±13.62 249.98±21.08 20 μg /皿 124.31±3.98 127.32±6.23 39.84±4.41 38.88±8.29 161.18±12.08 181.66±5.55 253.36±10.02 250.39±10.00 4.0 μg /皿 125.30±3.08 122.89±3.58 38.17±5.00 38.59±5.68 161.22±3.55 169.66±6.99 250.36±7.49 250.28±14.58灭菌水 124.50±5.20 130.00±3.51 40.00±7.19 43.32±3.28 160.55±7.18 177.22±14.01 248.88±12.25 248.39±11.03 DMSO 131.00±3.28 128.43±5.05 38.18±3.56 41.38±4.15 165.49±5.00 178.21±8.00 250.91±7.29 254.69±22.05 >850 >800 >200 >400 >480 >400 >850 >550阳性对照 敌克松 2-AF 敌克松 2-AF 4-硝基喹啉- 2-AF 甲基磺酸甲酯 2-AF (50 μg) (10 μg) (50 μg) (10 μg) N-氧化物(0.5 μg)(10 μg) (1.0 μg) (10 μg)
表2 莱鲍迪苷A小鼠骨髓细胞微核试验及精子畸形试验结果 (±SD)
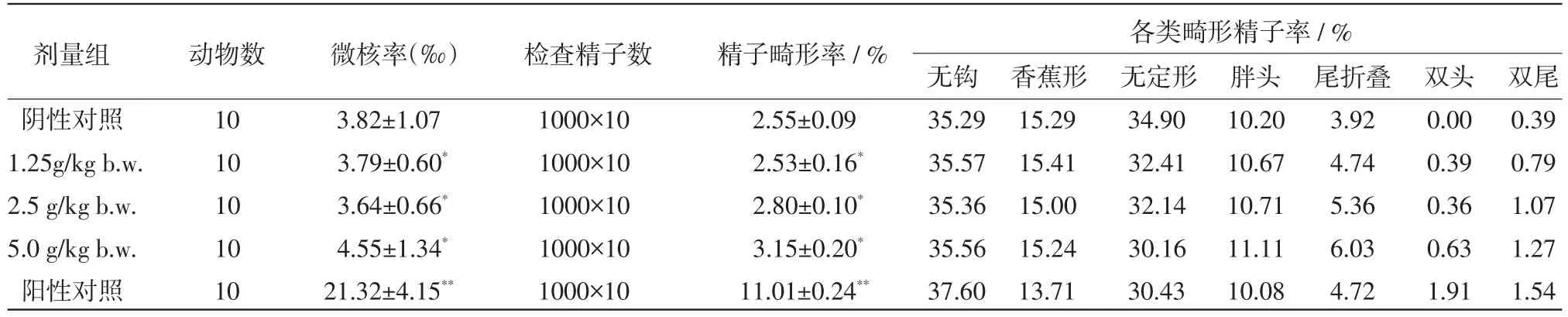
表2 莱鲍迪苷A小鼠骨髓细胞微核试验及精子畸形试验结果 (±SD)
注:与阴性对照比较,*:P<0.05;**:P<0.01
各类畸形精子率/ %剂量组 动物数 微核率(‰) 检查精子数 精子畸形率/ % 无钩 香蕉形 无定形 胖头 尾折叠 双头 双尾阴性对照 10 3.82±1.07 1000×10 2.55±0.09 35.29 15.29 34.90 10.20 3.92 0.00 0.39 1.25g/kg b.w. 10 3.79±0.60* 1000×10 2.53±0.16* 35.57 15.41 32.41 10.67 4.74 0.39 0.79 2.5 g/kg b.w. 10 3.64±0.66* 1000×10 2.80±0.10* 35.36 15.00 32.14 10.71 5.36 0.36 1.07 5.0 g/kg b.w. 10 4.55±1.34* 1000×10 3.15±0.20* 35.56 15.24 30.16 11.11 6.03 0.63 1.27阳性对照 10 21.32±4.15** 1000×10 11.01±0.24** 37.60 13.71 30.43 10.08 4.72 1.91 1.54
2 结果
2.1Ames试验实验中4种试验用鼠伤寒沙门菌株菌苔生长正常,阳性对照试验各菌株反应合格。莱鲍迪苷A每皿剂量在2 500 μg~4.0 μg范围内,有或无S9时,平均回变菌落数均小于阴性(溶剂)对照组的两倍,未见剂量-反应关系(见表1),且两次重复试验结果一致。表明莱鲍迪苷A的Ames试验结果为阴性。
2.2小鼠骨髓细胞微核试验莱鲍迪苷A小鼠骨髓细胞微核试验微核率见表2。各试验组PCE/ NCE比值在正常范围内。阳性对照组的微核率与阴性对照组比较差异极显著(P<0.01)。莱鲍迪苷A高、中、低剂量组与阴性对照组相比,均无显著性差异(P>0.05),且各试验组微核率之间无剂量-反应关系。可判定莱鲍迪苷A的小鼠骨髓细胞微核试验结果为阴性。
2.3小鼠精子畸形试验莱鲍迪苷A小鼠精子畸形试验结果见表2。阳性对照组精子畸形率显著高于阴性对照组(P<0.01)。受试物3个剂量组的精子畸形率与阴性对照组比较,无显著性差异(P>0.05)。精子畸形类别以无钩、无定形较多,香蕉形、胖头次之,尾折叠较少,双头和双尾的则更少。莱鲍迪苷A小鼠精子畸形试验结果为阴性,表明对小鼠的生殖细胞无致突变性。
3 结论与讨论
在试验条件下,莱鲍迪苷A的鼠伤寒沙门菌突变试验结果为阴性;对小鼠骨髓细胞微核试验及对小鼠精子畸形试验均为阴性,说明该受试物在试验剂量范围内无致突变作用。
虽然历史上对甜菊糖的安全性存在过争议,但随着对甜菊糖的毒理研究深入,加上JECFA已制定了甜菊糖的的每日允许摄入量为4mg/kg,FDA及法国等允许莱鲍迪苷A用于食品,说明莱鲍迪苷A在低于ADI的浓度下食用是安全的。
莱鲍迪苷A在甜菊糖苷中含量较高,一般占混合糖苷的30 %~70 %,经过纯化处理去除了带异味的其他糖苷的影响,使其甜度高、味质好,可作为甜菊糖的精加工高端产品,是较理想的天然甜味剂,可较完全地替代蔗糖,甜度成本也比蔗糖低,使用中配比方便,因此在食品工业中将得到越来越广泛的应用。此外,这种低热量的甜味剂更适合肥胖症和糖尿病患者等对甜品的需求,
符合现代食品的发展方向。莱鲍迪苷等甜菊糖苷作为饲料添加剂在乳猪料等中添加,也具有较低的甜度成本,作为饲料添加剂应用具有潜在的广阔市场。
参考文献:
[1]胡献丽,董文宾,郑丹,等.甜菊及甜菊糖研究进展[J].食品研究与开发,2005,26(1):36-38.
[2]孙传范,李进伟.甜菊糖苷研究进展[J].食品科学,2010,31 (9):338-340.
[3] Brahmachari G,Mandal L C,Roy R,et al.Stevioside and related compounds-molecules of pharmaceutical promise:a critical over⁃view [J].Archiv der Pharmazie,2011,344(1):5-19.
[4] Lemus-Mondaca R,Vega-Gálvez A,Zura-Bravo L,et al.Stevia rebaudiana Bertoni,source of a high-potency natural sweetener:A comprehensive review on the biochemical,nutritional and func⁃tional aspects [J].Food Chemistry,2012,132(3):1121-1132.
[5] Suttajit M,Vinitketkaumnuen U,Meevatee U,et al.Mutagenicity and human chromosomal effect of stevioside,a sweetener from ste⁃via rebaudiana bertoni [J] . Environ Health Perspectives,1993,101:53-561.
[6] Matsui M,Matsui K,Kawasaki Y,et al.Evaluation of the genotox⁃icity of stevioside and steviol using six in vitro and one in vivo mutagenicity assays[J].Mutagenesis,1996,11:573.
[7]李晓瑜.甜菊糖苷的安全性研究进展.中国食品添加剂,2003,3:5-11.
[8] JECFA/69/SC,Joint FAO/WHO Expert Committee on Food Addi⁃tives Sixty-ninth meeting,Summary and conclusion Rome,Italy,2008.
[9]法国提高食品中添加甜菊糖苷的限量[J].饲料工业,2010,13(2):6.
中图分类号:TS201.7
文献标志码:B
文章编号:0529-6005(2015)05-0104-03
收稿日期:2014-04-03
基金项目:江苏高校优势学科建设工程项目资助;扬州大学“新世纪人才工程”资助
作者简介:郝褔星(1982-),男,讲师,硕士,从事兽医临床教学及农技推广工作,E-mail:330848219@ qq.com
通讯作者:张雨梅,E-mail:zym@yzu.edu.cn
