单中心心房颤动射频消融术后患者抗凝治疗现状及其影响因素
2016-06-27夏驭龙周菁蒋捷霍东坡王梓凝谢秋芬霍勇
夏驭龙 周菁 蒋捷 霍东坡 王梓凝 谢秋芬 霍勇
·临床研究·
单中心心房颤动射频消融术后患者抗凝治疗现状及其影响因素
夏驭龙周菁蒋捷霍东坡王梓凝谢秋芬霍勇
100034北京,北京大学第一医院心内科北京大学第一医院心血管疾病研究所
【摘要】目的描述单中心心房颤动(房颤)射频消融术后患者长期抗凝治疗的现状,探讨决定抗凝治疗策略的影响因素。方法选取2012年1月至2015年8月就诊于北京大学第一医院因房颤行射频消融治疗并于门诊随访的患者144例,收集并描述患者手术前基线资料、随访期间口服抗凝药物(OAC)使用情况及血栓栓塞和大出血事件的发生情况。根据射频消融3个月后是否中断抗凝治疗将患者分为两组,采用二元logistic回归分析射频消融术后患者长期抗凝治疗决策的影响因素。结果144例房颤患者共行158次射频消融术,中位随访时间为17.5(12.0,29.8)个月。根据基线CHA2DS2-VASc评分,血栓栓塞高危患者共92例(63.9%)。1次射频消融术后12个月内房颤复发共53例(36.8%)。随访过程中,共140例(97.2%)患者按计划抗凝治疗至术后3个月,4例(2.8%)患者提前终止抗凝治疗。按计划抗凝治疗至术后3个月的140例患者中,CHADS2≥2分的46例患者中有17例(37.0%)、CHA2DS2-VASc≥2分的89例患者中有32例(36.0%)患者持续OAC;射频消融3个月后,共104例(74.3%)患者中断OAC,其中34例(32.7%)术后12个月内房颤复发,复发患者中有17例重新开始OAC。多因素二元logistic回归分析显示,术后12个月内房颤复发是影响是否持续抗凝的独立危险因素(OR 2.88,95% CI 1.22~6.79,P=0.016)。在校正了CHA2DS2-VASc评分后发现,术后12个月内房颤复发仍是影响是否持续抗凝的独立危险因素(OR 2.88,95% CI 1.21~6.81,P=0.016)。血栓栓塞事件共发生4例(2.8%),均发生于停用OAC后,根据术前血栓栓塞评分,4例患者CHA2DS2-VASc≥2分,仅2例患者CHADS2≥2分;其中3例患者术后12个月内无房颤复发。大出血事件共发生2例(1.4%),均发生于持续服用OAC过程中。结论射频消融术后12个月内房颤复发是除CHA2DS2-VASc外决定患者长期抗凝治疗的主要因素。
【关键词】心房颤动;射频消融;危险分层;血栓栓塞;大出血;口服抗凝
心房颤动(房颤)是临床上最常见的心律失常之一,年龄≥65岁人群的患病率约为6.5%[1]。它不仅增加卒中风险,同时增加死亡率[2]。射频消融和手术消融是药物难治性房颤的主要治疗手段,但其术后的血栓栓塞风险尚不明确[3]。2010年欧洲心脏病学会房颤管理指南[3]建议射频消融术后应至少坚持口服抗凝药物(OAC)3个月,之后根据患者的卒中风险评分指导OAC使用(Ⅱa类推荐,C级证据)。值得注意的是,对于血栓栓塞高危患者,指南并不推荐停用OAC。
然而临床实践中,在射频消融3个月后,医师对是否继续使用OAC仍存在不同的处理方式,尤其是对无房颤复发的患者。为此,本研究对北京大学第一医院房颤随访门诊中射频消融术后患者长期抗凝治疗的现状进行回顾,分析影响医师抗凝决策的因素,并总结发生血栓栓塞与大出血事件患者的病例特点,现报道如下。
1对象与方法
1.1研究对象
选取2012年1月至2015年8月就诊于北京大学第一医院因房颤行射频消融治疗并于门诊随访的患者144 例。
1.2临床资料收集及风险评估
患者的临床信息由患者住院病历及房颤门诊随访记录获得,并对部分随访时间短于12个月的患者补充电话随访,获取年龄、性别、身高、体质量、合并疾病、房颤类型、基线超声心动图参数(左心房前后径及左心室射血分数)、动态心电图(Holter)、抗凝中断与否、房颤复发情况、抗凝药物类型及主要并发症(死亡、血栓栓塞事件及大出血事件)等相关临床信息。所有患者基线的血栓栓塞风险使用CHA2DS2-VASc[4]及CHADS2[5]法评估,血栓栓塞风险低危、中危、高危分别对应CHA2DS2-VASc或CHADS2的0、1及≥2分;出血风险使用HAS-BLED[6]法评估,出血风险低危、中危、高危分别为HAS-BLED的≤1、2及≥3分。
1.3射频消融及围术期管理
所有患者按照房颤射频消融术前常规,除外心房和左心耳血栓,并接受围术期抗凝治疗。射频消融术式均采用肺静脉隔离[7],部分患者同时行心房基质消融和(或)线性消融。
1.4术后随访及管理
射频消融术后,患者于房颤门诊定期随访,详细询问并记录心律失常症状,指导患者监测心率,行12导联心电图(ECG)检查。此外,在术后3、6及12个月行Holter检查。患者感觉到可疑房颤发作症状时,随时行ECG和Holter检查。
射频消融术后,常规服用抗心律失常药物(AAD)3个月,使用华法林或新型口服抗凝药物3个月;服用华法林时国际标准化比值(INR)需控制在2~3。术后3个月,由心电生理专科医师根据患者病情决定下一步AAD及OAC使用方案。
1.5相关定义
(1)阵发性房颤是指发作后7 d内能够自行终止或干预后终止的房颤。(2)持续性房颤是指持续时间超过7 d的房颤[8]。(3)房颤复发定义为射频消融3个月后发生的房颤/心房扑动(房扑)/房性心动过速(房速),持续时间≥30 s[9]。(4)血栓栓塞事件定义为射频消融1个月后新发生的血栓栓塞[10],包括缺血性卒中、短暂性脑缺血发作(TIA)及外周动脉血栓栓塞。缺血性脑卒中定义为急性发作的局灶神经功能受损,持续时间超过24 h,或影像学证实有责任缺血性病灶[11]。TIA定义为急性发作的局灶神经功能受损,持续时间小于24 h[11]。外周动脉血栓栓塞是指发生在脑、心脏及眼睛外的血栓栓塞事件[12]。确诊缺血性脑卒中或TIA的患者均行颅脑影像学相关检查,并由一名高年资神经内科医师确定诊断。(5)大出血事件包括血红蛋白下降20 g/L,需要输血至少2个单位,以及重要脏器或部位的出血[13]。(6)抗凝(至少3个月)中断是指至末次随访期间曾经停用OAC。抗凝持续是指至末次随访期间持续OAC。
1.6统计学方法
2结果
2.1患者资料
144例房颤患者共行158次射频消融术(12例患者行2次射频消融术,1例患者行3次射频消融术),其中,女41例(28.5%),持续性房颤59例(41.0%)。根据基线CHADS2评分,血栓栓塞高危患者共48例(33.3%);根据基线CHA2DS2-VASc评分,血栓栓塞高危患者共92例(63.9%)。根据基线HAS-BLED评分,出血高危患者共21例(14.6%)。1次射频消融术后12个月内房颤复发共53例(36.8%)。
2.2随访过程中抗凝治疗情况
中位随访时间为17.5(12.0,29.8)个月。射频消融术后127例(88.2%)患者使用华法林抗凝,17例(11.8%)患者选择口服达比加群抗凝。有3例(2.1%)患者更换抗凝药物,1例由华法林更换为达比加群;2例由达比加群更换为华法林,其中1例患者因服达比加群期间出现眼底出血、血尿而更换。
140例(97.2%)患者按计划抗凝治疗至术后3个月。4例(2.8%)患者提前终止抗凝治疗,其中3例患者因为出血停用;1例患者在口服华法林1个月后因恶心停用,仅服阿司匹林,该患者CHADS2与CHA2DS2-VASc评分均为0分,随访12个月内未出现复发,且随访期间均未发生血栓栓塞事件。
按计划抗凝治疗至术后3个月的140例患者中,根据基线CHADS2评分,血栓栓塞高危患者共46例(32.9%),其中有17例(37.0%)患者持续OAC;根据基线CHA2DS2-VASc评分,血栓栓塞高危患者共89例(63.6%),其中有32例(36.0%)患者持续OAC。射频消融3个月后,共104例(74.3%)患者中断OAC,其中34例(32.7%)患者术后12个月内房颤复发,复发患者中有17例重新开始OAC,与未重新开始OAC的患者相比,两组的CHADS2≥2分(P=0.714)、CHA2DS2-VASc≥2分(P=0.086)及HAS-BLED≥3分(P=0.145)患者比例的差异均无统计学意义;共36例(25.7%)患者持续OAC,其中16例(44.4%)在射频消融术后12个月内无复发,这些患者中15例患者CHA2DS2-VASc≥2分。
2.3随访过程中抗凝持续的影响因素
对140例按计划抗凝治疗至术后3个月的患者,根据手术3个月后是否中断抗凝治疗分为抗凝中断组104例和抗凝持续组36例,两组患者的高血压病史、脑卒中/TIA病史、脂代谢紊乱史、左心房前后径、术后12个月内房颤复发等比较,均P<0.1(表1)。将以上因素纳入多因素二元logistic回归分析显示,除了脑卒中这一CHADS2与CHA2DS2-VASc评分的重要组成成分,术后12个月内房颤复发是影响是否持续抗凝的独立危险因素(OR2.88,95%CI1.22~6.79,P=0.016,表2)。校正CHA2DS2-VASc评分后行多因素二元logistic回归发现,术后12个月内房颤复发仍是影响是否持续抗凝的独立危险因素(OR2.88,95%CI1.21~6.81,P=0.016,表3)。
2.4射频消融术后血栓栓塞和大出血事件
6例患者在随访期间发生血栓栓塞及大出血事件(表4):(1)血栓栓塞事件共发生4例(2.8%),其中3例为新发缺血性脑卒中,1例为TIA。4例血栓栓塞事件均发生于停用OAC后,根据术前血栓栓塞评分,4例患者CHA2DS2-VASc≥2分,2例患者CHADS2≥2分。术后12个月内无房颤复发患者中,3例出现血栓栓塞事件;有房颤复发患者中,1例出现血栓栓塞事件。(2)大出血事件共发生2例(1.4%),其中消化道出血1例,脑出血1例。脑出血患者合并皮肌炎,长期口服糖皮质激素,且依从性差,INR控制不佳,脑出血2 d前INR为4.4,最终死亡。

表1 手术3个月后抗凝中断与抗凝持续患者的资料比较
注:房颤,心房颤动;TIA,短暂性脑缺血发作
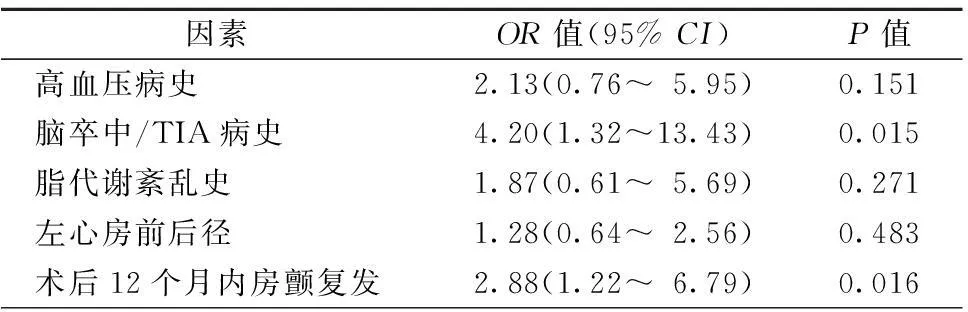
表2 抗凝持续与相关因素的多因素
注:TIA,短暂性脑缺血发作;房颤,心房颤动

表3 抗凝持续与相关因素在校正CHA2DS2-VASc
注:房颤,心房颤动
3讨论
本研究有以下主要发现:(1)CHA2DS2-VASc≥2分患者比例较高,但术后血栓栓塞高危患者持续服用OAC的比例不高;(2)射频消融术后12个月内房颤复发是除CHA2DS2-VASc外,医师决定患者长期抗凝治疗的主要依据;(3)射频消融术后12个月内未复发的患者仍存在较高的血栓栓塞事件风险,发生事件的患者基线血栓栓塞风险采用CHADS2评分时部分为中危,采用CHA2DS2-VASc评分时均为高危。
虽然2010年欧洲心脏病学会房颤管理指南[3]建议在房颤射频消融术后,血栓栓塞高危患者仍应长期口服OAC,但在随访过程中发现,血栓栓塞高危患者在随访过程中持续OAC的比例并不高。既往的研究也发现,在房颤治疗中,OAC使用不足的现象十分常见[14]。另一方面,对指南的这一推荐也一直存在争议。首先,Lin等[12]的研究表明,与口服AAD相比,成功的射频消融显著降低缺血性卒中/TIA发生率,这使得持续OAC的获益减少。其次,多项研究表明成功的射频消融治疗后,在血栓栓塞高危患者中暂停抗凝药物是可行的,而且持续口服OAC带来更多的出血风险。Themistoclakis等[15]进行的一项多中心、非随机对照研究发现,对于射频消融成功的患者,术后持续抗凝与3~6个月后中断抗凝相比,两组血栓栓塞事件的差异无统计学意义,而前者的主要出血事件显著多于后者[13例(2%)比1例(0.04%),P<0.0001];此外,中断抗凝组中CHADS2≥2分的患者在平均随访(28±13)个月后,无一例发生血栓栓塞事件。Karasoy等[16]的研究也得到了类似的结论。需要指出的是,在Lin等[12]的研究中,CHADS2≥2分的患者比例很低,大部分患者本不需要持续OAC治疗。而Themistoclakis等[15]的研究由于并未记录INR,所以抗凝治疗的效力存在疑问。本研究中血栓栓塞高危患者比例较高,且随访较完整。随访过程中,4例血栓栓塞事件均出现在抗凝中断组,这提示对术后血栓栓塞高危的患者停用OAC仍需慎重。尽管抗凝持续组发生了2例大出血,但其中1例为合并特殊疾病的高危患者,另外1例经积极治疗恢复,长期抗凝的安全性可以接受,但应该加强监测以及个体化治疗。

表4 发生血栓栓塞及大出血事件患者的临床特点
注:房颤,心房颤动;TIA,短暂性脑缺血发作
Karasoy等[16]的研究发现,术后复发与射频消融后血栓栓塞风险增加显著相关。在本研究中,术后12个月内是否复发也是决定患者长期抗凝治疗决策的主要因素之一。本研究中发生血栓栓塞事件的患者仅1例出现术后12个月内房颤复发,3例无房颤复发的患者中有1例在术后3个月即出现缺血性脑卒中,这提示无症状房颤复发的可能性。事实上,这也是电生理医师不赞同在血栓栓塞高危患者射频消融术后停用OAC的主要理由之一[17]。而这些患者的CHA2DS2-VASc评分均≥2分,提示射频消融术后的长期抗凝治疗需依据术前血栓栓塞评分,这也支持本研究的结论。与此同时,本研究有2例患者血栓栓塞事件发生在随访12个月后,其中1例在血栓栓塞事件前出现房颤远期复发,另1例在出现脑卒中后也有记录到房颤远期复发。Schreiber等[18]近5年的随访研究指出,单次射频消融的长期成功率仅20.1%。这说明只有更长时间的密切随访,才有可能记录到房颤的远期复发。此外,本研究也发现,因无房颤复发已经停用抗凝药物的患者,一旦房颤复发,很高比例的患者未能重新开始抗凝治疗,这是长期治疗中存在的缺陷。在本中心房颤门诊规律随访的前提下,这些情况的出现,提示在房颤射频消融术后,为实现真正长期、规范、有效的随访,需要采用敏感性更高的监测手段判断房颤是否复发,以及需要更为严格的流程管理,以真正达到改善患者预后的目的。
本研究中发生血栓栓塞事件的4例患者,CHA2DS2-VASc均≥2分,但其中仅2例CHADS2评分≥2分。对于CHADS2及CHA2DS2-VASc评分在评估房颤射频消融术后血栓栓塞风险中的价值,既往文献有不同的报道。Karasoy等[16]的研究发现,CHA2DS2-VASc评分并不能很好地区分射频消融术后血栓栓塞高危与低危的患者。而Chao等[19]和Jacobs等[20]的研究发现,CHADS2与CHA2DS2-VASc评分都可以很好地预测射频消融术后血栓栓塞事件的发生。其中,Chao等[19]针对中国台湾人群的研究指出,尽管CHADS2与CHA2DS2-VASc评分在预测血栓栓塞及死亡事件的差异无统计学意义(P=0.116),将射频消融术后CHADS2评分≤1分的患者以CHA2DS2-VASc=2分为界值分为两组,两组间事件发生率的差异有统计学意义(7.1%比1.1%,P=0.003)。Jacobs等[20]的研究也发现,在预测房颤复发及房颤相关并发症方面,CHA2DS2-VASc评分要比CHADS2评分更好。尽管本研究样本量较小,但现有的资料也提示CHA2DS2-VASc评分在射频消融术后的抗凝决策中可能具有更好的指导作用。
本研究是一个单中心回顾性研究,尽管本中心房颤射频消融术的手术量中等,但大部分患者来自外埠,为获得准确的用药和事件信息,仅纳入于本院房颤门诊规律随访的患者,因而限制了该研究的样本量,尚不足以从统计学上获得长期抗凝策略与患者预后之间明确的因果关系结论。
参考文献
[1] Go AS, Hylek EM, Phillips KA, et al. Prevalence of diagnosed atrial fibrillation in adults: national implications for rhythm management and stroke prevention: the AnTicoagulation and Risk Factors in Atrial Fibrillation (ATRIA) Study. JAMA, 2001, 285(18):2370-2375.
[2] Benjamin EJ, Wolf PA, D'Agostino RB, et al. Impact of atrial fibrillation on the risk of death: the Framingham Heart Study. Circulation, 1998, 98(10):946-952.
[3] European Heart Rhythm A, European Association for Cardio-Thoracic S, Camm AJ, et al. Guidelines for the management of atrial fibrillation: the task force for the management of atrial fibrillation of the European Society of Cardiology (ESC). Eur Heart J, 2010, 31(19):2369-2429.
[4] Lip GY, Nieuwlaat R, Pisters R, et al. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-based approach: the euro heart survey on atrial fibrillation. Chest, 2010, 137(2):263-272.
[5] Gage BF, Waterman AD, Shannon W, et al. Validation of clinical classification schemes for predicting stroke: results from the National Registry of Atrial Fibrillation. JAMA, 2001, 285(22):2864-2870.
[6] Olesen JB, Lip GY, Hansen PR, et al. Bleeding risk in 'real world' patients with atrial fibrillation: comparison of two established bleeding prediction schemes in a nationwide cohort. J Thromb Haemost, 2011, 9(8):1460-1467.
[7] Haissaguerre M, Jais P, Shah DC, et al. Electrophysiological end point for catheter ablation of atrial fibrillation initiated from multiple pulmonary venous foci. Circulation, 2000, 101(12):1409-1417.
[8] 黄从新,张澍,黄德嘉,等. 心房颤动:目前的认识和治疗建议-2015. 中华心律失常学杂志, 2015, 19(5):321-383.
[9] Calkins H, Kuck KH, Cappato R, et al. 2012 HRS/EHRA/ECAS Expert Consensus Statement on Catheter and Surgical Ablation of Atrial Fibrillation: recommendations for patient selection, procedural techniques, patient management and follow-up, definitions, endpoints, and research trial design. Europace, 2012, 14(4):528-606.
[10] Oral H, Chugh A, Ozaydin M, et al. Risk of thromboembolic events after percutaneous left atrial radiofrequency ablation of atrial fibrillation. Circulation, 2006, 114(8):759-765.
[11] 中华医学会神经病学分会脑血管病学组. 中国急性缺血性卒中诊治指南2014. 中华神经科杂志, 2015, 48(4):246-257.
[12] Lin YJ, Chao TF, Tsao HM, et al. Successful catheter ablation reduces the risk of cardiovascular events in atrial fibrillation patients with CHA2DS2-VASc risk score of 1 and higher. Europace, 2013, 15(5):676-684.
[13] Connolly SJ, Ezekowitz MD, Yusuf S, et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med, 2009, 361(12):1139-1151.
[14] Ogilvie IM, Newton N, Welner SA, et al. Underuse of oral anticoagulants in atrial fibrillation: a systematic review. Am J Med, 2010, 123(7):638-645.
[15] Themistoclakis S, Corrado A, Marchlinski FE, et al. The risk of thromboembolism and need for oral anticoagulation after successful atrial fibrillation ablation. J Am Coll Cardiol, 2010, 55(8):735-743.
[16] Karasoy D, Gislason GH, Hansen J, et al. Oral anticoagulation therapy after radiofrequency ablation of atrial fibrillation and the risk of thromboembolism and serious bleeding: long-term follow-up in nationwide cohort of Denmark. Eur Heart J, 2015, 36(5):307-314.
[17] Verma A, Champagne J, Sapp J, et al. Discerning the incidence of symptomatic and asymptomatic episodes of atrial fibrillation before and after catheter ablation (DISCERN AF): a prospective, multicenter study. JAMA Intern Med, 2013, 173(2):149-156.
[18] Schreiber D, Rostock T, Frohlich M, et al. Five-year follow-up after catheter ablation of persistent atrial fibrillation using the stepwise approach and prognostic factors for success. Circ Arrhythm Electrophysiol, 2015, 8(2):308-317.
[19] Chao TF, Lin YJ, Tsao HM, et al. CHADS(2) and CHA(2)DS(2)-VASc scores in the prediction of clinical outcomes in patients with atrial fibrillation after catheter ablation. J Am Coll Cardiol, 2011, 58(23):2380-2385.
[20] Jacobs V, May HT, Bair TL, et al. The impact of risk score (CHADS2 versus CHA2DS2-VASc) on long-term outcomes after atrial fibrillation ablation. Heart Rhythm, 2015, 12(4):681-686.
Oral anticoagulation therapy after radiofrequency ablation of atrial fibrillation and influencing factors on continuation of OAC therapy
XIAYu-long,ZHOUJing,JIANGJie,HUODong-po,WANGZi-ning,XIEQiu-fen,HUOYong.
DepartmentofCardiology,PerkingUniversityFirstHospital,CardiovascularDiseasesInstitute,Beijing100034,ChinaCorrespondingauthor:ZHOUJing,Email:zhoujing1232004@sina.com
【Abstract】ObjectiveTo describe the long-term condition of oral anticoagulation (OAC) therapy after radiofrequency ablation (RFA) of atrial fibrillation (AF), identify factors that have impact on decision of continuation of OAC therapy. Methods144 patients diagnosed with atrial fibrillation underwent RFA in our department from January, 2012 to August, 2015 were enrolled in the study. Patient data were collected and risk profiles were evaluated by CHADS2 and CHA2DS2-VASc score. The long-term condition of OAC therapy after RFA of AF and risk factors of OAC strategy were analyzed by statistical methods including univariate and multivariate logistic regression. ResultsThe study included 144 patients who underwent 158 RFA procedures of AF. According to the CHA2DS2-VASc score, 92(63.9%) high-risk cases were identified. 53(36.8%) patients experienced recurrence of AF within 1 year after single RFA procedure. During a median follow-up of 17.5 months (IQR: 12.0-29.8), 140(97.2%) cases continued OAC beyond 3 months after RFA while 4(2.8%) cases stopped within 3 months after RFA. For those who continued OAC therapy beyond 3 months, 17(37.0%) cases with a CHADS2≥2 and 32(36.0%) with a CHA2DS2-VASc≥2 continued OAC therapy till the end of follow-up or the study end point. 104(74.3%) patients discontinued OAC therapy during the follow-up, among them 34(32.7%) experienced recurrence of AF within 1 year after RFA and only 17 restarted OAC therapy after the recurrence was identified. OAC continuation was significantly associated with recurrence of AF within 1 year after RFA [OR=2.88(1.22-6.79), P=0.016] in multivariate analysis,even after adjustment with CHA2DS2-VASc score [OR=2.88(1.21-6.81), P=0.016]. 4(2.8%) patients who discontinued OAC therapy experienced embolization events. All of them had a CHA2DS2-VASc≥2 while only 2 had a CHADS2≥2, and recurrence of AF within 1 year after RFA were seen in only 1 patient. 2(1.4%) patients who continued OAC therapy experienced major bleeding events. ConclusionsIn patients post RFA of AF, long term OAC therapy was prescribed based on the status of of AF recurrence within 1 year besides the CHA2DS2-VASc score.
【Key words】Atrial fibrillation;Radio frequency ablation;Risk stratification;Thromboembolism;Major bleeding;Oral anticoagulation
DOI:10.3969/j.issn.1004-8812.2016.05.001
通信作者:周菁,Email:zhoujing1232004@sina.com
【中图分类号】R541.75
(收稿日期:2016-02-05)
