Dishevelled2在鼻咽癌顺铂耐药中的作用研究*
2016-06-24顾秀辉彭辽天曾国丹朱力
罗 科,顾秀辉,彭辽天,曾国丹,刘 静,张 坤,朱力
1.成都医学院 基础医学院(成都 610500);2.成都医学院 生物医学系(成都 610500);3.成都医学院第一附属医院 耳鼻咽喉头颈外科(成都 610500)
Dishevelled2在鼻咽癌顺铂耐药中的作用研究*
罗科1,顾秀辉1,彭辽天2,曾国丹2,刘静2,张坤2,朱力3△
1.成都医学院 基础医学院(成都610500);2.成都医学院 生物医学系(成都610500);3.成都医学院第一附属医院 耳鼻咽喉头颈外科(成都610500)
【摘要】目的探讨散乱蛋白2(Dishevelled2,DVL2)对鼻咽癌顺铂化疗敏感性的影响,为进一步研究DVL2在肿瘤化疗耐药中的作用机制奠定前期基础。方法转染pcDNA3.1-DVL2至鼻咽癌细胞5-8F,并用不同浓度(0,1,2,4,8,10,20 μmol/L)的顺铂处理细胞,MTT检测过转染DVL2对5-8F顺铂抑制率及半数抑制浓度(IC50)的影响,流式检测DVL2高表达对顺铂的5-8F细胞凋亡的影响,Western blotting检测DVL2对Wnt/β-catenin信号的影响。结果过表达DVL2明显降低了顺铂对5-8F的抑制率,提高了其IC50,同时过表达DVL2明显降低了顺铂诱导的5-8F细胞的凋亡,进一步研究显示,过表达DVL2明显增加了β-catenin及其靶基因P-gp和Survivin的蛋白表达。结论过表达DVL2可通过上调Wnt/β-catenin信号增强耐药相关蛋白P-gp、Survivin的表达,从而诱发鼻咽癌顺铂耐药。
【关键词】散乱蛋白2;顺铂;鼻咽癌;耐药性
鼻咽癌(nasopharyngeal carcinoma,NPC)是我国南方头颈部最常见的恶性肿瘤之一,多数鼻咽癌分化差,95%为低分化鳞癌,恶性程度高[1]。目前,鼻咽癌的临床治疗主要以放疗和化疗为主,5年生存率约50%~70%[2]。顺铂是鼻咽癌临床化疗的一线用药,但在化疗过程中常诱发鼻咽癌耐药,严重影响鼻咽癌的治疗效果及预后[3]。因此,探明鼻咽癌顺铂耐药的机制,提高铂类药物的疗效,是鼻咽癌治疗的研究热点。
散乱蛋白(Dishevelled,DVL)是Wnt/β-catenin信号通路中位于中上游的一个非常关键的正向调节因子。在Wnt/β-catenin信号通路中,活化后的DVL可促使β-catenin在胞质内积聚和核转移,从而激活转录因子TCF/LEF诱导靶基因的表达[4-5]。研究[6-8]发现,DVL蛋白在乳腺癌、间皮瘤和脑胶质瘤中高表达并参与其恶性行为。 目前,国内外鲜有关于DVL家族各成员的表达与鼻咽癌细胞对顺铂化疗耐药的研究报道。因此,本研究旨在探明DVL2对鼻咽癌顺铂耐药的影响,为进一步研究DVL2在肿瘤化疗耐药中的具体作用机制及为有效逆转鼻咽癌耐药奠定前期基础。
1材料与方法
1.1材料
人鼻咽癌5-8F细胞株购自长沙赢润生物技术有限公司;RPMI-1640培养基、胎牛血清(FBS)和胰蛋白酶购自美国Hyclone公司;四甲基偶氮唑盐(MTT)、Lipofectamine3000购自美国Invitrogen公司;顺铂(cisplatin)、二甲基亚砜(DMSO)购自美国Sigma公司;鼠抗人单克隆抗体DVL2、鼠抗人单克隆抗体β-catenin、兔抗人单克隆抗体P-gp和兔抗人单克隆抗体Survivin均购自美国SANTA CRUZ公司;兔抗小鼠单克隆抗体GAPDH、羊抗鼠二抗、羊抗兔二抗、RIPA裂解液、BCA蛋白浓度测定试剂盒和Annexin-V/PI凋亡试剂盒均购自中国碧云天公司;PVDF膜、ECL化学发光检测试剂盒均购自美国Millipore公司;质粒pcDNA3.1与pcDNA3.1-DVL2由本实验室保存。
1.2方法
1.2.1细胞培养5-8F细胞接种于含10%FBS、1%青/链霉素的RPMI-1640培养基中,置于37 ℃、饱和湿度95%、体积分数5%CO2的无菌恒温培养箱内培养,待细胞融合度达80%~90%时,0.25%胰蛋白酶消化传代。
1.2.2细胞转染和分组转染前1 d消化收集对数生长期的5-8F细胞,以每孔7×105个细胞接种于细胞培养六孔板中,用不含抗生素的正常培养液进行培养,24 h内细胞融合度达80%左右时进行转染。参照Liopfectamine3000产品说明书,分别将质粒pcDNA3.1与pcDNA3.1-DVL2转染至5-8F细胞中。根据转染质粒不同分为:未转染质粒组(Mock组),阴性对照组转染质粒pcDNA3.1 (pcDNA3.1组),过表达组转染质粒pcDNA3.1-DVL2(pcDNA3.1-DVL2组)。
1.2.3Western Blotting实验转染后48 h消化收集细胞,加入RIPA裂解液,充分裂解30 min,4 ℃, 13 800×g,离心15 min,收集上清液为细胞总蛋白。严格按照蛋白定量试剂盒操作说明进行蛋白定量,并取样本加入上样缓冲液,100 ℃变性10 min, 然后进行免疫印迹分析。顺序按SDS-PAGE电泳、转膜、封闭、分别加入一抗(鼠抗人单克隆抗体DVL2、鼠抗人单克隆抗体β-catenin、兔抗人单克隆抗体P-gp、兔抗人单克隆抗体Survivin和兔抗小鼠单克隆抗体GAPDH)4 ℃过夜、二抗室温孵育90 min、ECL显色。以GAPDH为内参。
1.2.4MTT实验消化收集对数生长期的5-8F细胞,以每孔3×103个细胞接种于96孔培养板中,并同时将质粒pcDNA3.1与pcDNA3.1-DVL2分别转染至5-8F细胞中,置于培养箱培养,分组同1.2.2。24 h后,各组细胞均分别加入顺铂,并调整其终浓度为(0,1,2,4,8,10,20 μmol/L),顺铂处理48 h后,每孔分别加入20 μL的MTT溶液(5 mg/mL), 继续孵育4 h后弃上清液,每孔加入150 μL DMSO,置于震荡仪上震荡10 min,使结晶物充分溶解。酶标仪上选择波长492 nm,检测各孔OD值,计算细胞抑制率(IR)。抑制率(IR)={1-[(药物组-空白对照组)/(阴性对照组-空白对照组)]}×100%。以药物作用浓度与相应抑制百分数作散点图,得到浓度-抑制率拟合曲线,通过线性回归分析求出抑制率为50%细胞所需的药物浓度(50% inhibitory concentration,IC50)。
1.2.5流式细胞分析消化收集对数生长期的5-8F细胞,以每孔2×105个细胞接种于12孔培养板中,置于培养箱培养24 h,分别将质粒pcDNA3.1与pcDNA3.1-DVL2转染至5-8F细胞中继续培养24 h,然后加入顺铂(终浓度10 μmol/L)作用24 h后,消化收集细胞,4 ℃ PBS 洗2次,离心弃上清。按试剂盒说明书要求,加入500 μL Binding Buffer悬浮细胞,调节细胞密度约为1×106个/mL。在细胞悬液中加入5 μL Annexin V和5 μL碘化丙锭溶液(PI)双染,避光反应10 min左右,1 h内进行流式细胞术检测细胞凋亡。
1.3统计学方法

2结果
2.1pcDNA3.1-DVL2质粒在5-8F细胞中的表达鉴定
与pcDNA3.1组相比,5-8F转染pcDNA3.1-DVL2后,DVL2的蛋白含量明显增加,提示:pcDNA3.1-DVL2在5-8F细胞中过表达成功(图1)。

图1Western Blotting鉴定过表达DVL2在5-8F细胞中的表达效应
注:5-8F细胞转染pcDNA3.1与pcDNA3.1-DVL2 48 h后收集细胞总蛋白,Western Blotting检测DVL2蛋白表达变化
2.2DVL2降低鼻咽癌细胞对顺铂的敏感性
不同浓度顺铂(0,1,2,4,8,10,20 μmol/L)处理5-8F细胞后,MTT检测结果显示:顺铂对5-8F细胞的抑制率随浓度增加而增加,而转染pcDNA3.1-DVL2后,顺铂对5-8F细胞的抑制率明显降低(图2)。与pcDNA3.1组相比(IC50=6.11 μmol/L),转染pcDNA3.1-DVL2后的顺铂对5-8F细胞的IC50增加到14.55 μmol/L(表1)。
2.3DVL2降低顺铂诱导的5-8F细胞凋亡
流式细胞检测结果发现:0 μmol/L顺铂诱导的未转染质粒的5-8F细胞的凋亡率为(0.10±0.04)%(图3A);10 μmol/L顺铂诱导的未转染质粒的5-8F
细胞的凋亡率为(43.37±0.57)%(图3B);转染pcDNA3.1后,10 μmol/L顺铂诱导的5-8F细胞的凋亡率为(45.70±0.95)%,差异无统计学意义(P=0.059)(图3C);而转染pcDNA3.1-DVL2后,10 μmol/L顺铂诱导的5-8F细胞的凋亡率减少到(28.37±1.20)%,差异有统计学意义(P=0.007)(图3D)。
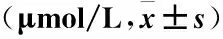
表1 顺铂在Mock、pcDNA3.1与pcDNA3.1-DVL2
注:pcDNA3.1与pcDNA3.1-DVL2的组间数据运用独立样本方差分析,pcDNA3.1-DVL2与pcDNA3.1相比,P=0.001,*P<0.01
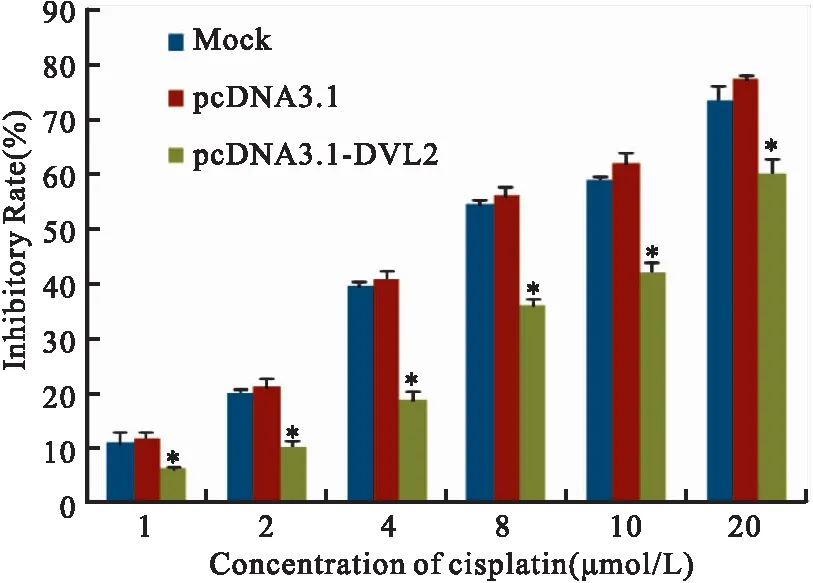

注: 在5-8F细胞中转染pcDNA3.1与pcDNA3.1-DVL2,24 h后加入不同浓度的顺铂(0,1,2,4,8,10,20 μmol/L)处理48 h后,MTT检测顺铂对细胞抑制率(在相同顺铂浓度下,pcDNA3.1-DVL2组与pcDNA3.1组相比:顺铂1 μmol/L,P=0.001;顺铂2 μmol/L,P=0.003;顺铂4 μmol/L,P=0.006;顺铂8 μmol/L,P=0.005;顺铂10 μmol/L,P=0.006;顺铂20 μmol/L,P=0.009)

图3Annexin V/PI双染色流式细胞检测DVL2对顺铂诱导的5-8F细胞凋亡的影响
注:5-8F细胞中转染pcDNA3.1与pcDNA3.1-DVL2,24 h后加入顺铂(10 μmol/L),继续作用24 h后利用Annexin V/PI双染色流式细胞检测细胞凋亡率。 A: 0 μmol/L顺铂;B: 10 μmol/L顺铂;C: pcDNA3.1+10 μmol/L顺铂;D: pcDNA3.1-DVL2+ 10 μmol/L顺铂
2.4DVL2增强P-gp及Survivin的蛋白表达
转染pcDNA3.1-DVL2后,5-8F细胞中Wnt/β-catenin信号下游重要靶基因P-gp和Survivin的蛋白表达明显上调(图4)。

图4Western Blotting分析过表达DVL2对5-8F细胞中P-gp及Survivin蛋白水平的影响
注:5-8F细胞转染pcDNA3.1与pcDNA3.1-DVL2 48 h后收集细胞总蛋白,Western Blotting检测P-gp及Survivin蛋白表达变化
2.5DVL2增强β-catenin的蛋白表达转染pcDNA3.1-DVL2后,5-8F细胞中β-catenin的蛋白表达明显上调(图5)。

图5Western Blotting分析过表达DVL2对5-8F细胞中β-catenin蛋白水平的影响
注:5-8F细胞转染pcDNA3.1与pcDNA3.1-DVL2 48h后收集细胞总蛋白,Western Blotting检测β-catenin蛋白表达变化
3讨论
鼻咽癌是一种多基因遗传性肿瘤,在中国南方发病率和死亡率均居头颈部恶性肿瘤之首,严重危害当地群众生命健康。化疗是目前治疗鼻咽癌重要的手段之一,但在化疗过程中鼻咽癌常会对化疗药物产生拮抗,导致化疗失败。因此,化疗耐药是鼻咽癌现阶段治疗中难以取得实质性进展的主要障碍。鼻咽癌耐药主要分为先天性耐药和获得性耐药,前者表现为肿瘤细胞对化疗药物的天然不敏感性;后者是肿瘤细胞因抗癌药物诱导或其他因素的激活而产生的耐药性[9]。目前,鼻咽癌耐药的具体分子机制尚不完全清楚。
Wnt/β-catenin信号通路是调控细胞生长发育和分化的关键通路之一。其信号传导通路的主要成员包括细胞外因子(Wnt蛋白)、跨膜受体(frizzled)、DVL、β连环蛋白(β-catenin)及核内转录因子(TCF/LEF)等[10-11]。研究[11-12]发现,Wnt/β-catenin信号通路的异常激活与肿瘤发生发展密切相关。目前,在人和小鼠中已鉴定3个DVL基因(DVL1、DVL2和DVL3),3者均包含高度保守的DIX、PDZ和DEP结构域。DVL是Wnt/β-catenin信号通路中位于β-catenin上游的正向调节因子,对该通路激活具有关键调控作用。无论有无Wnt信号情况下,活化后的DVL均可阻断GSK3β/β-catenin毁灭复合物形成,促使β-catenin在细胞内积累并与转录因子TCF/LEF结合,从而激活Wnt下游靶基因的转录[13]。
DVL蛋白在多种肿瘤中高表达并参与其恶性行为[6-8]。但目前该基因与肿瘤耐药的相关性鲜有报道。在鼻咽癌细胞5-8F中转染pcDNA3.1-DVL2表达质粒后发现,过表达DVL2明显降低了顺铂对5-8F细胞的抑制率,提示DVL2与顺铂耐药相关。此外,过表达DVL2也降低了顺铂诱导的细胞凋亡,提示DVL2可以通过细胞抗凋亡途径来上调顺铂耐药。
为分析DVL2诱发5-8F细胞顺铂耐药的原因,本研究检测了过表达DVL2对5-8F细胞中多药耐药蛋白(P-gp)、抗凋亡蛋白(Survivin)的影响。P-gp是一种依赖ATP具有跨膜转运功能的糖蛋白,它通过外排化疗药物,降低药物在细胞内聚集而导致细胞耐药[14-15]。本研究发现,过表达DVL2后P-gp的蛋白表达量明显上调,提示DVL2可能通过上调P-gp的表达来促进顺铂外排产生耐药。既往研究[16-17]提示,肿瘤耐药不仅受药物外排机制调控,而且与细胞抗凋亡作用密切相关。Survivin是凋亡抑制蛋白家族的重要成员,具有强大的抗凋亡活性,在许多恶性肿瘤组织中发现有Survivin的表达增高。抑制Survivin的表达可以增强肿瘤细胞对化疗药物的敏感性[18]。本研究检测了DVL2对Survivin的影响,结果发现,Survivin蛋白表达随DVL2的含量增高而增高,提示DVL2可以通过上调Survivin的表达增强鼻咽癌抗凋亡作用。以上结果提示,DVL2可通过上调P-gp和Survivin的表达来降低鼻咽癌对顺铂化疗的敏感性从而增强其耐药。
研究[19-20]发现,Wnt/β-catenin信号通路的下游重要靶基因P-gp、Survivin参与了肿瘤化疗耐药的外排化疗药物、抗凋亡过程。β-catenin是Wnt/β-catenin信号通路中的关键调控因子。为进一步探明DVL2是如何调控P-gp及Survivin的蛋白表达,本研究通过Western blotting检测过表达DVL2后5-8F细胞中β-catenin的蛋白表达变化。结果表明,过表达DVL2明显上调β-catenin的蛋白表达,提示DVL2可通过上调β-catenin增强P-gp、Survivin的表达。
以上研究结果表明,DVL2表达增高可增强鼻咽癌对顺铂的耐受,抑制顺铂诱导的细胞凋亡。一方面可能是因为其活化Wnt/β-catenin信号上调P-gp的表达,导致化疗药物外排;另一方面通过活化Wnt/β-catenin信号上调Survivin的表达,减少细胞发生凋亡。综上所述,DVL2的表达量与鼻咽癌顺铂耐药成正相关,这为解决鼻咽癌顺铂耐药问题提供了新视野。
参考文献
[1]Cao SM,Simons MJ,Qian CN.The prevalence and prevention of nasopharyngeal carcinoma in China[J].Chin J Cancer,2011,30(2):114-119.
[2]Jemal A,Bray F,Center MM,etal.Global cancer statistics[J].CA: A Cancer Journal for Clinicians,2011,61(2):69-90.
[3]Yu WM,Hussain SS.Incidence of nasopharyngeal carcinoma in Chinese immigrants,compared with Chinese in China and South East Asia: review[J].The Journal of Laryngology & Otology,2009,123(10):1067.
[4]Gao C,Chen YG.Dishevelled: The hub of Wnt signaling[J].Cell Signal,2010,22(5):717-727.
[5]Bikkavilli RK,Malbon CC.Mitogen-activated protein kinases and Wnt/beta-catenin signaling: Molecular conversations among signaling pathways[J].Commun Integr Biol,2009,2(1):46-49.
[6]Nagahata T,Shimada T,Harada A,etal.Amplification,up-regulation and over-expression of DVL-1,the human counterpart of the Drosophila disheveled gene,in primary breast cancers[J].Cancer Sci,2003,94(6):515-518.
[7]Uematsu K,Kanazawa S,You L,etal.Wnt pathway activation in mesothelioma: evidence of Dishevelled overexpression and transcriptional activity of beta-catenin[J].Cancer Res,2003,63(15):4547-4551.
[8]李健,郭庚,万大海,等.Dishevelled蛋白在人脑胶质瘤中的表达及意义[J].中华临床医师杂志(电子版),2013,7(14):6254-6257.
[9]Yoshizaki T,Ito M,Murono S,etal.Current understanding and management of nasopharyngeal carcinoma[J].Auris Nasus Larynx,2012,39(2):137-144.
[10] Johnson ML,Kamel MA.The Wnt signaling pathway and bone metabolism[J].Curr Opin Rheumatol,2007,19(4):376-382.
[11] Lustig B,Behrens J.The Wnt signaling pathway and its role in tumor development[J].J Cancer Res Clin Oncol,2003,129(4):199-221.
[12] Herr P,Hausmann G,Basler K.WNT secretion and signalling in human disease[J].Trends Mol Med,2012,18(8):483-493.
[13] Wallingford JB,Habas R.The developmental biology of Dishevelled: an enigmatic protein governing cell fate and cell polarity[J].Development,2005,132(20):4421-4436.
[14] 朱宝英,黄静,王永林,等.P-糖蛋白及肿瘤多药耐药的逆转[J].中国药房,2011,22(6):550-552.
[15] Amin ML.P-glycoprotein inhibition for optimal drug delivery[J].Drug Target Insights,2013,19(7):27-34.
[16] Brustmann H,Hinterholzer S,Brunner A.immunohistoche-mical expression of survivin and γ-H2AX in vulvar intraepithelial neoplasia and low-stage squamous cell carcinoma[J].Int J Gynecol Pathol,2011,30(6):583-590.
[17] Ge QX,Li YY,Nie YQ,etal.Expression of survivin and its four splice variants in colorectal cancer and its clinical significances[J].Med Oncol,2013,30(2):535.
[18] Shen X,Zheng JY,Shi H,etal.Survivin knockdown enhances gastric cancer cell sensitivity to radiation and chemotherapy in vitro and in nude mice[J].Am J Med Sci,2012,344(1):52-58.
[19] Lim JC,Kania KD,Wijesuriya H,etal.Activation of beta-catenin signalling by GSK-3 inhibition increases p-glycoprotein expression in brain endothelial cells[J].J Neurochem,2008,106(4):1855-1865.
[20] Lechler P,Renkawitz T,Campean V,etal.The antiapoptotic gene survivin is highly expressed in human chondrosarcoma and promotes drug resistance in chondrosarcoma cells in vitro[J].BMC Cancer,2011,11:120.
The Role of Dishevelled2 in Cisplatin-based Chemotherapy in Nasopharyngeal Carcinoma
LuoKe1,GuXiuhui1,PengLiaotian2,ZengGuodan2,LiuJing2,ZhangKun2,ZhuLi3△.
1.SchoolofBasicMedicalSciences,ChengduMedicalCollege,Chengdu610500,China;2.SchoolofBiomedicalSciences,ChengduMedicalCollege,Chengdu610500,China;3.DepartmentofOtorhinolaryngologyHeadandNeckSurgery,TheFirstAffiliatedofChengduMedicalCollege,Chengdu610500,China
【Abstract】ObjectiveTo explore the effect of Dishevelled2(DVL2) on chemotherapy sensitivity of nasopharyngeal carcinoma 5-8F cells to cisplatin,and provide a basis for the research on the mechanism of DVL2 in tumor resistance.MethodsThe 5-8F cells were transfected by pcDNA3.1-DVL2 and then treated by various concentration of cisplatin.The effects of DVL2 on the cisplatin-mediated inhibition and apoptosis of 5-8F cells were detected by MTT and Flow cytometric assays respectively.The effects of DVL2 on Wnt/β-catenin signaling was examined by Western blotting assay. ResultsThe results showed that the cisplatin-mediated inhibition and apoptosis of 5-8F cells were decreased by overexpression of DVL2, and that the protein levels of β-catenin,P-gp and Survivin were increased by overexpression of DVL2.ConclusionThe overexpression of DVL2 enhances the resistance of nasopharyngeal carcinoma to cisplatin via upregulation of P-gp and Survivin by Wnt/ β-catenin signaling.
【Key words】Dishevelled2;Cisplatin;Nasopharyngeal carcinoma;Drug resistance
doi:10.3969/j.issn.1674-2257.2016.02.001
*基金项目:国家自然科学基金资助项目(No:81301919);四川省科技厅应用基础研究基金(No:2015JY0256)
通信作者:△朱力,E-mail:1968403299@qq.com
【中图分类号】R739.63
【文献标志码】A
网络出版地址:http://www.cnki.net/kcms/detail/51.1705.R.20160406.1542.014.html
·论著·
