葫芦素E抑制多发性骨髓瘤细胞增殖及与阿霉素的协同效应*
2016-06-24杨玛丽伍忠军曹小华王莎莎李敏惠
杨玛丽,肖 翠,魏 榕,伍忠军,曹小华,王莎莎,阳 泰,李敏惠,刘 进△
1.成都医学院 检验医学院(成都 610500);2.成都医学院 生物医学系(成都 610500);3.成都医学院 科研实验中心(成都 610500)
葫芦素E抑制多发性骨髓瘤细胞增殖及与阿霉素的协同效应*
杨玛丽1,肖翠2,魏榕2,伍忠军2,曹小华2,王莎莎2,阳泰3,李敏惠3,刘进3△
1.成都医学院 检验医学院(成都610500);2.成都医学院 生物医学系(成都610500);3.成都医学院 科研实验中心(成都610500)
【摘要】目的研究葫芦素E对人多发性骨髓瘤细胞增殖和凋亡的影响,并观察葫芦素E与阿霉素的协同效应。方法采用CCK-8测定葫芦素E对4种多发性骨髓瘤细胞MM1.S、MM1.R、U266和RPMI8226的半数生长抑制率(GI50),并通过CalcuSyn协同效应分析软件,计算药物合用指数(CI),评价葫芦素E与阿霉素协同抗多发性骨髓瘤作用;流式细胞术检测葫芦素E对MM1.S、MM1.R的细胞周期、线粒体膜电位和细胞凋亡的影响;Western blot检测凋亡相关蛋白Caspase-3和PARP的变化,以及葫芦素E对IL-10刺激的RPMI8226细胞STAT3蛋白磷酸化的抑制作用。结果葫芦素E对4种多发性骨髓瘤细胞的GI50均在(12.3~161.7) nM范围内;葫芦素E导致多发性骨髓瘤细胞的SubG1期细胞比例、凋亡细胞比例和线粒体膜电位下降细胞比例均明显增加,并出现凋亡相关的活化蛋白如Cleaved Caspase-3 和Cleaved-PARP。葫芦素E能有效抑制IL-10诱导的RPMI8226细胞STAT3磷酸化,并能与阿霉素协同抗多发性骨髓瘤。结论葫芦素E通过抑制STAT3蛋白磷酸化,诱导多发性骨髓瘤细胞凋亡,并能协同阿霉素抗多发性骨髓瘤。
【关键词】葫芦素E;阿霉素;STAT3;多发性骨髓瘤;凋亡;协同效应
葫芦素E(Cucurbitacin E,CuE)是从葫芦科等植物中分离得到的一种四环三萜类化合物,具有保肝、抗炎、抗肿瘤等多种生物学活性。在20世纪70~80年代,我国已研发出葫芦素片(含葫芦素B和CuE),用于肝炎和肝癌的治疗[1]。CuE可抑制RAW264.7细胞的NF-κB核转位,发挥抗炎作用[2];CuE能阻滞乳腺癌细胞周期在G2/M期,并诱导凋亡,通过抑制肿瘤细胞迁移和侵袭,从而抑制乳腺肿瘤转移[3-4]。另外,CuE还能通过抑制VEGFR2介导的JAK2-STAT3信号通路,抑制肿瘤血管生成[5]。
多发性骨髓瘤(multiple myeloma,MM)是一种浆细胞系恶性肿瘤,目前无法完全治愈,但近年来,通过传统化疗药物与新型靶向药物联合用药,极大地改善了MM的治疗效果[6]。有文献[7]报道,CuE能增加阿霉素在M5076卵巢肉瘤细胞中的浓度,但不会增加阿霉素的毒副反应。因此,研究CuE对MM细胞的增殖抑制及与阿霉素的协同效应,可为阿霉素联合用药抗MM提供参考。
1材料与方法
1.1主要试剂与仪器
CuE(纯度 ≥ 98%)购自成都瑞芬思生物科技有限公司;阿霉素和线粒体膜电位试剂盒购自美国Sigma公司;CCK-8试剂盒购自日本Dojindo公司;细胞周期即时检测试剂盒购自南京凯基生物有限公司;细胞凋亡检测试剂盒购自美国Roche公司;IL-10购自美国Ebioscience公司;兔抗人Caspase-3、PARP抗体以及辣根过氧化物酶(HRP)标记的羊抗兔二抗购自CST公司;RIPA细胞裂解液、PVDF膜和ECL化学发光试剂购自Millipore公司;美国Becton Dickinson公司Accuri C6流式细胞仪;美国Biotek公司PowerWave XS全波长酶标仪。
1.2细胞培养
MM1.S、MM1.R、U266和PRMI8226 4种人MM细胞购自ATCC(美国标准生物品收藏中心)。MM细胞于5% CO2和37 ℃环境中,使用含10%胎牛血清,100 U/L青霉素和100 μg /L硫酸链霉素的RPMI1640培养基培养。
1.3CCK-8法检测细胞增殖
测定CuE对细胞增殖的抑制率。MM1.S、MM1.R、U266以及PRMI8226 4种人MM细胞按照200 μL,5 × 104个/孔细胞密度,接种于96孔平底细胞培养板,不同浓度梯度CuE作用48 h后,加入10 μL CCK-8,培养6 h后,使用酶标仪测定在450 nm波长光吸收值。药物对肿瘤细胞生长抑制率按照美国国家癌症研究所标准计算:当Ti≥Tz,肿瘤细胞存活率=[(Ti-Tz)/(C-Tz)]×100;当Ti < Tz,肿瘤细胞存活率=[(Ti-Tz)/Tz]×100(Ti为药物组培养48 h后,测定的OD值;Tz为不含药物组,起始培养测定的OD值;C为不含药物组,培养48 h后测定的OD值)。
1.4CuE与阿霉素协同抗MM1.S细胞作用检测
将MM1.S细胞按照200 μL/孔,5 × 104个/孔细胞密度,接种于96孔平底细胞培养板,CuE与阿霉素设置25、50、100、200 nM 4个浓度梯度。设置CuE单独加药组、阿霉素单独加药组和联合用药组(CuE与阿霉素浓度相同)。药物作用72 h后,按照1.3所述步骤,测定肿瘤细胞存活率。使用CalcuSyn协同效应分析软件,计算CuE与阿霉素的合用指数(CI)值(CI>1,为拮抗作用;CI=1,为相加作用;CI<1,为协同作用)。
1.5细胞周期、细胞凋亡与线粒体膜电位检测
MM1.R和MM1.S细胞按照1×106个/mL,2 mL/孔,加入12孔细胞培养板,CuE药物浓度为200、100 nM和50 nM。药物作用8 h后,收集细胞,使用线粒体膜电位检测试剂盒检测细胞线粒体膜电位。药物作用24 h后,收集细胞,使用细胞周期检测试剂盒和Annexin V/PI细胞凋亡检测试剂盒,分别检测细胞周期和细胞凋亡。按照试剂盒说明书进行操作,使用BD公司Accuri C6流式细胞仪进行检测,每个样品采集10 000个细胞,使用BD Accuri C6 software 1.0.264.21分析实验数据。
1.6Western blot检测Caspase-3、PARP、p-STAT3和STAT3蛋白
MM1.R和MM1.S细胞按照1×106个/mL,4 mL/孔, 加入6孔细胞培养板,CuE 作用浓度为 100 nM和 50 nM,培养 6 h,收集细胞,冰上裂解30 min, 使用BCA蛋白定量试剂盒测定蛋白浓度。SDS-PAGE电泳,80 μg/泳道,PVDF膜湿转300 mA, 1 h。5%脱脂奶粉37 ℃封闭1 h,加入一抗(Caspase-3、Cleaved Caspase3、p-STAT3、STAT3和PARP),4 ℃孵育过夜,TBST清洗3次;加入二抗(HRP标记的羊抗兔),37 ℃孵育1 h,TBST清洗3次,使用化学发光成像仪检测。
1.7统计学分析
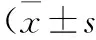
2结果
2.1CuE对4种人MM细胞增殖的抑制作用
不同浓度梯度CuE作用4种人MM细胞48 h后,通过CCK-8测定CuE对人MM细胞的GI50。CuE对MM1.S、MM1.R、U266和RPMI8226 4种细胞表现出明显的增殖抑制作用,GI50均在12.3~161.7 nM范围内(图1B)。
2.2CuE与阿霉素协同抗MM
通过CCK-8测定各组药物作用MM1.S细胞72 h后的细胞存活率,CuE与阿霉素合用组的细胞存活率均低于CuE或阿霉素单独用药组(图1C)。
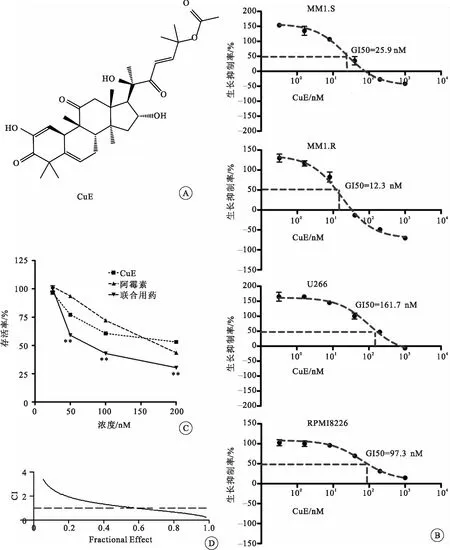
图1葫芦素E抑制4种人MM细胞增殖并能与阿霉素产生协同作用
注:A.CuE化学结构式;B.CuE对4种人MM细胞生长抑制曲线和GI50;C.CuE、阿霉素以及两种药物合用时,MM1.S细胞的存活率(**P<0.01);D.CuE与阿霉素联合用药抗MM1.S细胞的协同效应
使用混合药物分析软件Calcusyn计算CuE与阿霉素的药物CI值。当Fractional Effect>0.6时,CI<1, 说明CuE与阿霉素具有协同作用(图1D)。
2.3CuE对MM1.S和MM1.R细胞周期的影响
MM1.S与MM1.R细胞经CuE 100 nM作用24 h后,检测细胞周期,结果表明,CuE处理后,细胞周期处于 SubG1期的细胞比例明显增加。MM1.S的SubG1期细胞比例由2.0%增加为15.1%,MM1.R的SubG1期细胞比例由2.1%增加为25.2%(图 2)。
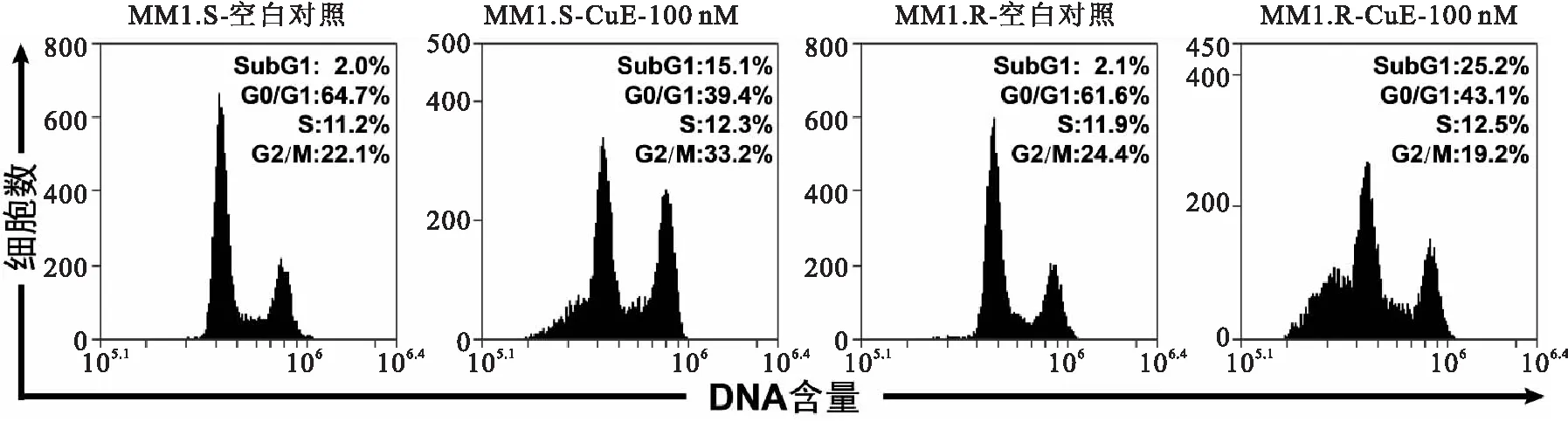
图2CuE对MM1.S和MM1.R细胞周期的影响
2.4CuE诱导MM1.S和MM1.R细胞凋亡
MM1.S与MM1.R细胞经不同浓度CuE作用24 h后,通过Annexin-V和PI双染检测细胞凋亡。CuE浓度为50、100、200 nM时,均能诱导MM1.S与MM1.R细胞发生凋亡,凋亡和死亡细胞比例明显增加(图 3)。
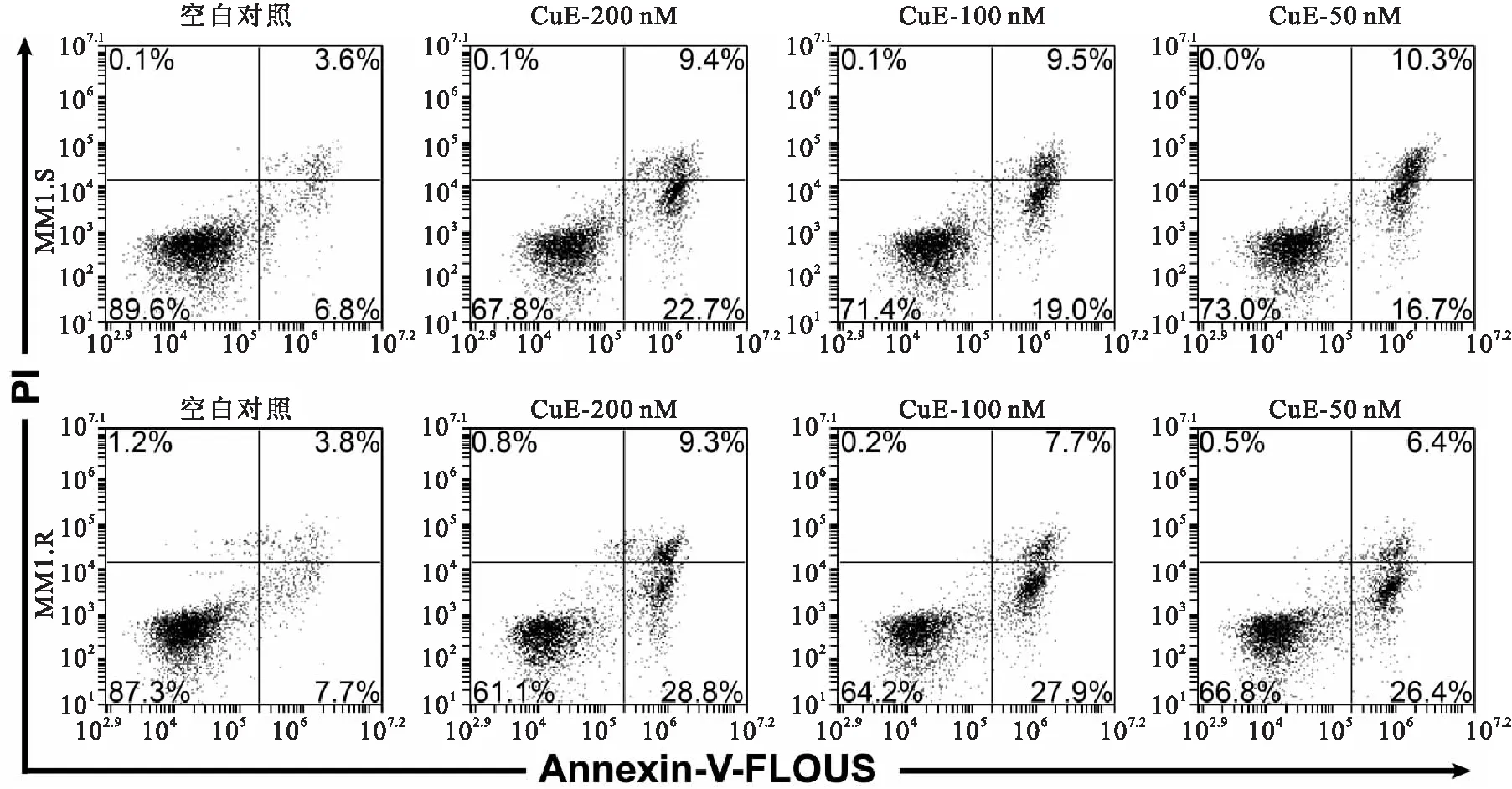
图3CuE诱导MM1.S和MM1.R细胞凋亡
2.5CuE降低MM1.S和MM1.R的线粒体膜电位
MM1.S与MM1.R细胞经不同浓度CuE作用8 h后,使用JC-1检测细胞线粒体膜电位。与空白对照组相比,经CuE 200 nM作用的MM1.S与MM1.R细胞,线粒体膜电位降低的细胞比例明显增加,缬氨霉素为阳性对照(图 4)。
2.6CuE导致MM细胞激活Caspase-3和产生PARP剪切体
MM1.S与MM1.R细胞经不同浓度CuE作用6 h后,收集并裂解细胞,制备蛋白样品。Western blot检测Caspase-3和PARP蛋白。经CuE处理后的细胞,出现了明显的Cleaved Caspase-3和Cleaved PARP蛋白条带(图 5)。
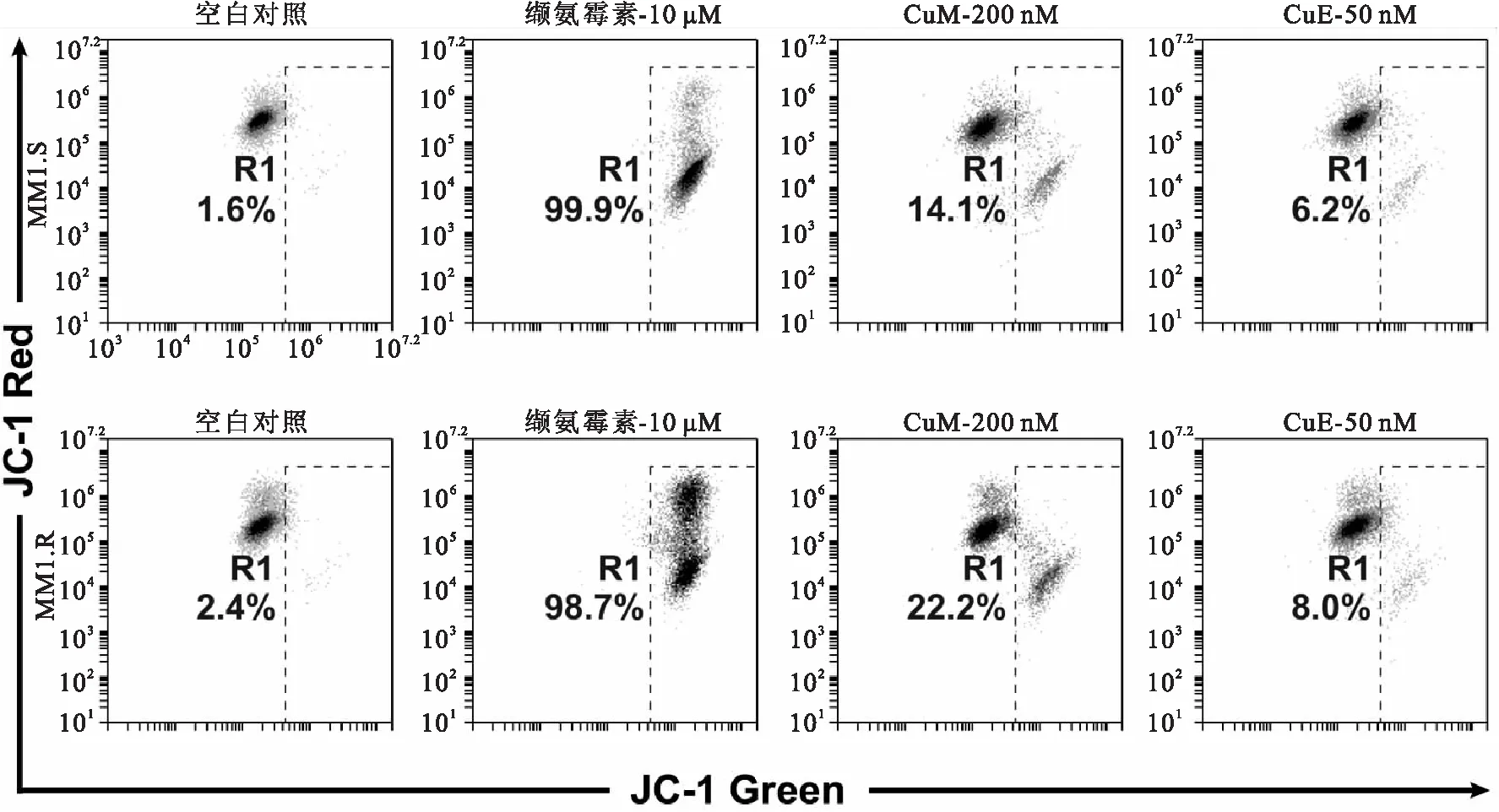
图4CuE对MM1.S和MM1.R细胞线粒体膜电位的影响
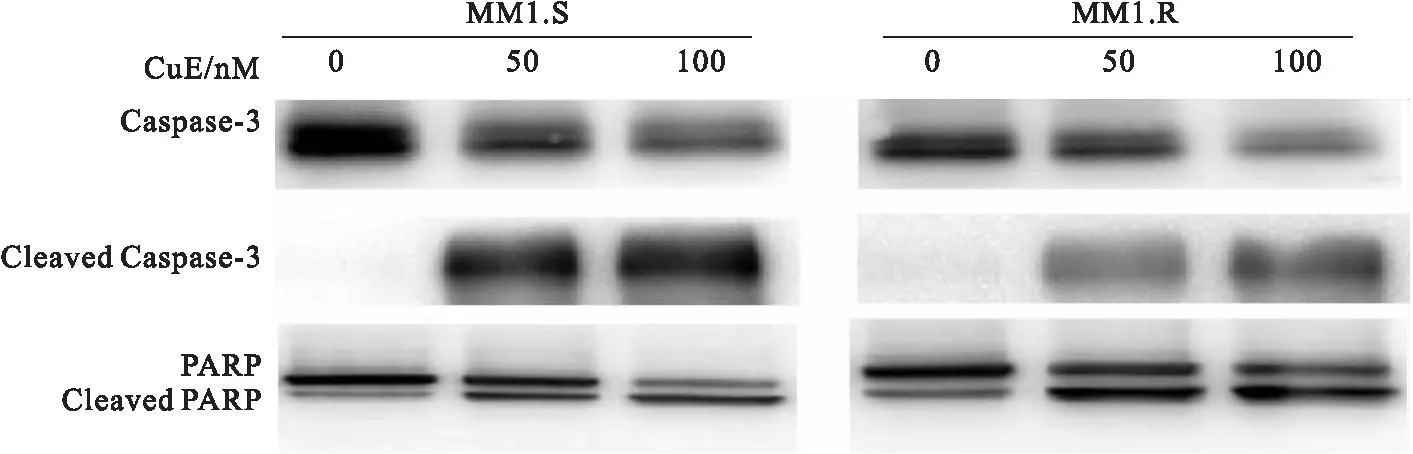
图5CuE导致MM1.S和MM1.R细胞激活Caspase-3并产生PARP剪切体
2.7CuE抑制IL-10诱导的细胞STAT3磷酸化
RPMI8226细胞经CuE作用6 h后,加入IL-10刺激10 min,收集细胞制备蛋白样品。Western blot检测,CuE 浓度为1 μM能明显抑制STAT3磷酸化,浓度5 μM能完全抑制STAT3磷酸化。Ruxolitinib作为STAT3抑制剂对照[8](图 6)。
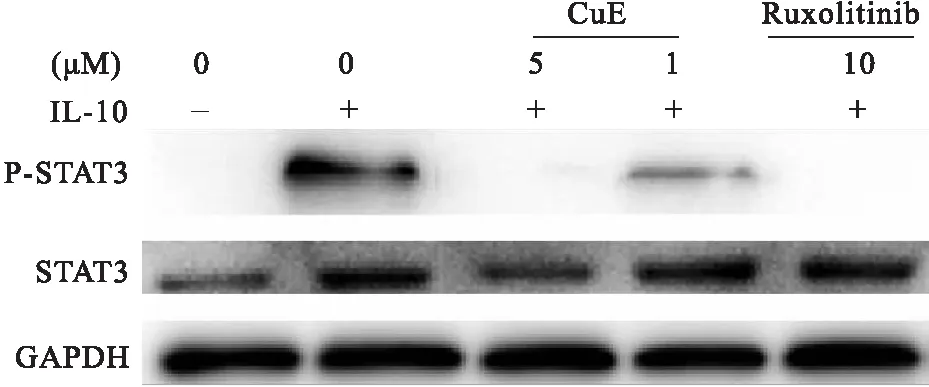
图6CuE抑制RPMI8226细胞STAT3磷酸化
3讨论
CuE对4种人MM细胞MM1.S、MM1.R、U266和RPMI8226均有较好的抑制活性,GI50在12.3~161.7 nM范围内。在有效浓度范围内,测定CuE对MM细胞的细胞周期、细胞凋亡、线粒体膜电位、Caspase-3、PARP和STAT3蛋白的影响,结果显示:CuE处理组与空白对照组相比,SubG1期细胞比例、凋亡细胞比例和线粒体膜电位下降细胞比例均明显增加。经CuE处理后,可在MM细胞中检测到Cleaved Caspase-3和Cleaved PARP蛋白。以上结果表明,CuE通过激活Capase和降低线粒体膜电位,诱导MM细胞凋亡,而细胞凋亡导致胞内DNA降解,形成亚二倍体细胞,SubG1期细胞比例增加。
本研究还发现,CuE可以抑制IL-10诱导的RPMI8226细胞STAT3磷酸化。既往研究[9]发现,克拉屈滨与STAT3抑制剂联用比单用两种药
物更能明显诱导U266、RPMI8226和 MM1.S 3种MM细胞凋亡。这与本研究发现类似,阿霉素与CuE合用抗MM,比单用阿霉素或CuE作用更强。推测CuE与阿霉素的协同作用可能和CuE抑制STAT3磷酸化有关。另外,CuE与阿霉素的协同作用还可能和CuE增加肿瘤细胞中阿霉素的浓度有关[7]。
综上所述,CuE能通过抑制STAT3活性,激活Capase和降低线粒体膜电位,诱导MM细胞凋亡。由于CuE的抗MM细胞增殖活性及与阿霉素的协同效应,CuE有可能被用于阿霉素联合用药治疗MM。
参考文献
[1] Chen X,Bao J,Guo J,etal.Biological activities and potential molecular targets of cucurbitacins: a focus on cancer[J].Anticancer Drugs,2012,23(8):777-787.
[2] Qiao J,Xu LH,He J,etal.Cucurbitacin E exhibits anti-inflammatory effect in RAW 264.7 cells via suppression of NF-κB nuclear translocation[J].Inflamm Res,2013,62(5):461-469.
[3] Kong Y,Chen J,Zhou Z,etal.Cucurbitacin E induces cell cycle G2/M phase arrest and apoptosis in triple negative breast cancer[J].PLoS One,2014,9(7):e103760.
[4] Zhang T,Li J,Dong Y,etal.Cucurbitacin E inhibits breast tumor metastasis by suppressing cell migration and invasion[J].Breast Cancer Res Treat,2012,135(2):445-458.
[5] Dong Y,Lu B,Zhang X,etal.Cucurbitacin E,a tetracyclic triterpenes compound from Chinese medicine,inhibits tumor angiogenesis through VEGFR2-mediated Jak2-STAT3 signaling pathway[J].Carcinogenesis,2010,31(12):2097-2104.
[6] 中国抗癌协会临床肿瘤学协作专业委员会抗淋巴瘤联盟,中国抗癌协会淋巴瘤专业委员会,中华血液学会白血病淋巴瘤组,等.脂质体阿霉素治疗恶性淋巴瘤及多发性骨髓瘤的中国专家共识[J].中国肿瘤临床,2014,41(24):1550-1555.
[7] Sadzuka Y,Hatakeyama H,Sonobe T.Enhancement of doxorubicin concentration in the M5076 ovarian sarcoma cells by cucurbitacin E co-treatment[J].International Journal of Pharmaceutics,2010,383(1-2):186-191.
[8] Pattison MJ,MacKenzie KF,Arthur JS.Inhibition of JAKs in Macrophages Increases Lipopolysaccharide-Induced Cytokine Production by Blocking IL-10-Mediated Feedback[J].The Journal of Immunology,2012,189(6):2784-2792.
[9] Ma J,Wang S,Zhao M,etal.Therapeutic potential of cladribine in combination with STAT3 inhibitor against multiple myeloma[J].BMC Cancer,2011,11(1):255.
The Antiproliferative Effect of Cucurbitacin E on Human Multiple Myeloma Cells and Its Synergistic Effect in Combination with Adriamycin
YangMali1,XiaoCui2,WeiRong2,WuZhongJun2,CaoXiaohua2,WangShasha2,YangTai3,LiMinhui3,LiuJin3△.
1.SchoolofLaboratoryMedicine,ChengduMedicalCollege,Chengdu610500,China; 2.SchoolofBiomedicalSciences,ChengduMedicalCollege,Chengdu610500,China; 3.CenterforScientificResearch,ChengduMedicalCollege,Chengdu610500,China
【Abstract】ObjectiveTo detect the effect of cucurbitacin E (CuE) on the proliferation and apoptosis of human mulitiple myeloma (MM) cells,and to investigate the synergistic effect of CuE combined with adriamycin on MM cells. MethodsThe CCK-8 assay was used to measure the growth inhibition of 50%(GI50)of CuE on the four MM cell lines including MM1.S,MM1.R,U266 and RPMI8226.The synergistic effect of CuE combined with Adriamycin on MM cells was assessed by calculating combination index (CI) with the help of CalcuSyn software (Biosoft,Cambridge,UK). The flow cytometer was used to measure the effect of CuE on cell cycles, mitochondrial membrane potential and cell apoptosis, and the Western-blot was adopted to detect the changes of Caspase-3 and PARP and the inhibition effect of CuE on STAT3 phosphorylation induced by IL-10. ResultsThe GI50 of CuE on the four MM cell lines ranged from 12.3 nM to 161.7 nM. CuE significantly increased the number of the cells in the subG1 phase and the percentage of apoptotic cells, but reduced the mitochondrial membrane potential of MM cells. Meanwhile, Cleaved Caspase-3 and cleaved PARP were detected in MM cells. CuE had a great inhibition effect on the STAT3 phosphorylation in MM cells induced by IL-10 and a synergistic effect on human multiple myeloma in combination with Adriamycin. ConclusionCuE can induce the apoptosis of MM cells by inhibiting the phosphorylation of STAT3, and have a synergistic effect of anti-multiple myeloma by working with Adriamycin.
【Key words】Cucurbitacin E; Adriamycin; STAT3; Multiple myeloma; Apoptosis; Synergistic effect
doi:10.3969/j.issn.1674-2257.2016.02.003
基金项目:*国家自然科学基金项目(No:81201668);四川省教育厅基金项目(No:15ZB0234);四川省卫生厅基金项目(No:130302);四川省大学生创新创业训练计划项目(No:201413705032)
通信作者:△刘进,E-mail:jinliu19871987@163.com
【中图分类号】R733.3
【文献标志码】A
网络出版地址:http://www.cnki.net/kcms/detail/51.1705.R.20160406.1557.032.html
·论著·
