亳芍产芍药苷内生真菌的筛选
2016-06-23程孝中葛永斌燕傲蕾刘西岭
程孝中, 许 勇, 葛永斌, 魏 磊, 燕傲蕾, 张 宇, 刘西岭, 徐 娟, 郭 慧
(1.亳州学院,安徽亳州 236800;2.安徽省医学科学研究院,安徽合肥 230061)
亳芍产芍药苷内生真菌的筛选
程孝中1, 许 勇2*, 葛永斌1, 魏 磊1, 燕傲蕾1, 张 宇1, 刘西岭1, 徐 娟1, 郭 慧1
(1.亳州学院,安徽亳州 236800;2.安徽省医学科学研究院,安徽合肥 230061)
摘要[目的]筛选亳芍产芍药苷内生真菌。[方法]采用组织块法从亳芍的根部分离内生真菌;从内生真菌发酵液中抽提芍药苷;然后通过薄层层析、高效液相色谱分析和基质辅助激光解吸电离飞行时间质谱对内生真菌所产芍药苷进行鉴定。[结果]从亳芍中分离到22株内生真菌,其中1株为产芍药苷内生真菌,经形态学初步鉴定为细脚棒束孢种(Isaria tenuipes)。[结论]从亳芍中分离到了一株产芍药苷内生真菌R12,可作为芍药苷药物工业化生产的候选菌株。
关键词亳芍;内生真菌;芍药苷;筛选
植物内生真菌(Endophytic fungi)是指在某一时期生活在植物体内,但对寄主植物组织并不引起明显病害症状的真菌[1],“内共生理论”认为内生真菌可产生与其宿主相同或相似的代谢物质,1993年美国蒙大拿州立大学Strobel首次从短叶红豆杉的韧皮部分离到一株具有合成与宿主相同抗癌药物——紫杉醇的内生真菌[2]。随后,许多科研工作者相继从不同植物体内分离得到产生抗癌活性物质、抗菌活性物质等其他药用物质的内生真菌[3-5]。
芍药苷(paeoniflorin)为芍药的主要活性成分,能够抑制肾脏中的ICAM-1、IL-1、TNF-α等细胞因子,起到抗炎症、抗氧化作用[6]。芍药苷通过调节腺苷A1受体减少痛疼,抑制前列腺素E2、白三烯B4来减少炎症反应,促进淋巴细胞增殖和分化来实施免疫保护[7];在抑制血管发生[8]、抗过敏[9]等方面均发挥了重要的作用。但芍药生长周期较长(3~4 a)[10],原产地种植率下降,地道的亳芍产量急剧下降,加上芍药苷化学合成较难,芍药苷的市场来源越来越困难,因此通过微生物发酵方法生产芍药苷具有重要意义。笔者采用组织块法从亳芍的根部分离内生真菌,从内生真菌发酵液中抽提芍药苷,然后通过薄层层析(TLC)、高效液相色谱(HPLC)分析和基质辅助激光解吸电离飞行时间质谱(MALDI-TOF)对内生真菌所产芍药苷进行鉴定,筛选能够产芍药苷的内生真菌,为微生物发酵生产芍药苷提供候选菌株。
1材料与方法
1.1材料
1.1.1试验材料。亳芍采自亳州学院中药园(3年生),取植株的根部位。
1.1.2仪器与试剂。SD25-12DTDN超声波清洗机(宁波新芝生物科技有限公司);DIIG-9141A电热鼓风干燥箱(上海精宏试验设备有限公司);GI54DWS 高压蒸汽灭菌锅(厦门致微仪器有限公司);SW-CJ-2FD净化工作台(AIRTECH);ZXSD-A1160培养箱(上海智诚分析仪器制造有限公司);E2695高效液相色谱仪(美国沃特世公司);基质辅助激光解析飞行时间质谱仪(New ultrafleXtreme MALDI TOF,Bruker Daltonics)。芍药苷标准品为阿拉丁产品;2,5-二羟基苯甲酸(DHB)为Sigma-Aldrich产品,其他试剂均为国产分析纯。
1.2方法
1.2.1内生真菌的分离与纯化。取亳芍根部位,洗洁精漂洗1遍,流动水洗至无泡沫。在超净工作台上,用75%酒精消毒1 min,无菌水洗涤3遍,0.1%升汞消毒6 min,再用无菌水洗涤3遍,无菌滤纸吸干残留水分,剪切成0.5 cm×0.5 cm小片接种于马铃薯葡萄糖培养基(PDA)平皿上,置于28 ℃培养箱培养3~6 d,即可见小片切割边缘长出菌丝,挑取菌丝接种于另一PDA斜面上备用。对照组使用未切割的小片,其余操作同试验组,证明所分离的菌是来源于植物体内而非表面附生菌。
1.2.2产芍药苷菌株的筛选。液体培养基采用PDA液体培养基,挑取备用的菌丝接种于100 mL PDA液体培养基中,接种5瓶,28 ℃摇床,120 r/min培养7 d。收集发酵液,经过滤、冻融后,加入等体积氯仿萃取,有机相浓缩得到内生真菌的粗提物。
1.2.3薄层层析(TLC)检测[10]。展开剂为氯仿∶甲醇(3∶1),显色剂为5%香草醛硫酸乙醇溶液,显色后记录芍药苷标准品和样品的Rf值。
1.2.4高效液相色谱分析(HPLC)。色谱柱C18(150 mm×4.6 mm,5 μm);流动相为乙腈和含0.1%三氟乙酸的水(14∶86);流速1 mL/min;检测波长230 nm。以芍药苷标准品为参考。
1.2.5基质辅助激光解吸电离飞行时间质谱(MALDI -TOF)分析。取样品1 μL点靶,等样品风干后,再取基质DHB 1 μL点在样品上面,自然风干形成结晶后进行打靶。
1.2.6菌株的初步鉴定。形态学分类依据内生真菌的菌落外部形态进行分类[11]。
2结果与分析
2.1内生真菌活性产物芍药苷的鉴定
2.1.1TLC检测。利用TLC法对22株内生真菌发酵液提取物进行鉴定发现,菌株R12粗提物中出现一个斑点与芍药苷标准品的迁移率最接近,标准品和R12粗提物的Rf值分别为0.54、0.51(图1),混合点显示样品点与标准品点重合完好。
2.1.2 HPLC分析。对菌株R12粗提物进行HPLC分析,R12菌株提取物中最高峰出峰时间为7.773 min,芍药苷标准品出峰时间为7.801 min(图2),二者出峰时间非常接近,表明R12粗提物中含有芍药苷,菌株R12为产芍药苷内生真菌。根据峰面积计算出R12菌株菌液中芍药苷浓度为0.44 mg/L。
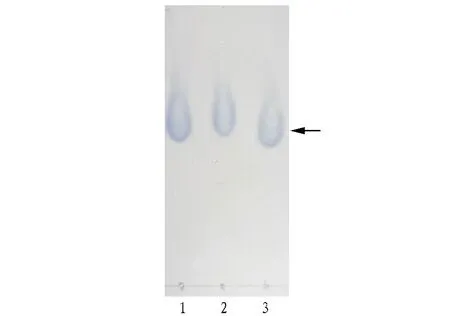
注:1为标准品;2为R12粗提物;3为混合点。Note: 1. Paeoniflorin standard;2. Extracts from strain R12;3. Mixture of paeoniflorin standard and extracts from strain R12.图1 内生真菌R12菌株产芍药苷的TLC分析Fig. 1 The TLC analysis of endophytic fungi R12 producing paeoniflorin
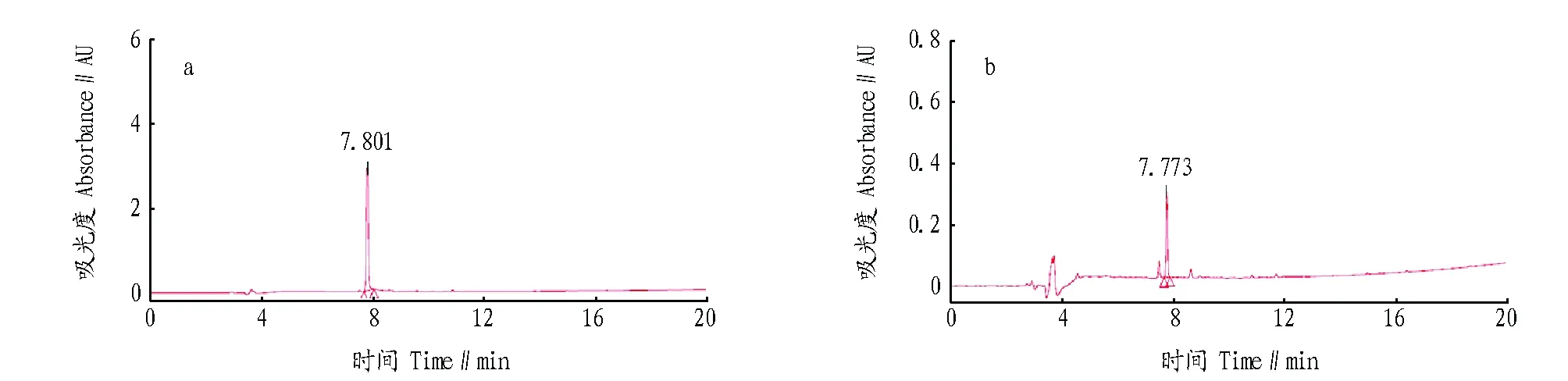
图2 芍药苷标准品(a)和R12提取物(b)的HPLC分析Fig.2 HPLC analysis of standard paeoniflorin(a) and fungal paeoniflorin from R12(b)
2.1.3MALDI -TOF分析。为了进一步确定HPLC中7.773 min出峰的物质,收集7.773 min的物质进行质谱分析,结果发现,芍药苷分子量为480.46,质谱图中出现2个离子峰(图3),分别为503.157(M+Na+)和519.127(M+K+),进一步证明菌株R12的代谢产物中含芍药苷,菌株R12为产芍药苷内生真菌。

图3 R12提取物的MALDI-TOF分析Fig. 3 MALDI-TOF of fungal paeoniflorin from strain R12

图4 产芍药苷内生真菌R12的菌落形态Fig. 4 The colony morphology of paeoniflorin-producing endophytic fungi strain R12
2.2种属初步鉴定产芍药苷内生真菌R12在PDA培养基上培养7 d,菌落直径为3 cm左右,绒毛状,白色,菌落疏松,不规则形,背面呈暗棕色,不易挑取,延长培养产生孢梗束,液体培养5 d后,菌丝球达3~5 mm,菌液黄色(图4)。与《中国真菌志》(第四十三卷)[11]棒束孢属(Isaria)细脚棒束孢种(Isaria tenuipes)菌落形态描述极为相似。
3结论与讨论
在分离内生真菌过程中,利用未切割的亳芍根部组织做同样的培养,发现并没有真菌生长,证明试验组分离到的22株真菌均为内生真菌。内生真菌分布比较广泛,植物不同部位均有分布,且次生代谢产物十分丰富[12],由于亳芍以根部入药,故该试验中是从亳芍根部分离内生真菌,分离到的内生真菌只是亳芍内生真菌的一部分,接下来的试验可以从亳芍叶、茎等部位分离更多的内生真菌,可能会筛选到产量更高的产芍药苷内生真菌。
R12菌株是首次从亳芍根部分离到的能够产芍药苷的内生真菌,在鉴定R12提取物时,除了传统方法TLC和HPLC分析外,该试验采用了MALDI-TOF对提取物进行分子量验证,MALDI-TOF是近年来发展起来的一种新型软电离质谱技术,其检测和鉴定具有快速、准确、灵敏等优点,对样品的量要求较少[13],试验数据进一步证明了R12菌株是产芍药苷内生真菌。
在鉴定R12菌株方面,根据形态学初步鉴定为棒束孢属(Isaria)细脚棒束孢种(Isaria tenuipes)。进一步鉴定和确认R12菌株方面,还需要利用分子生物学扩增保守序列并结合生物信息学,构建生物分类系统进化树。
该试验中产芍药苷菌株R12初步发酵产量为0.44 mg/L,未进行发酵条件优化,下一步可以进行R12发酵条件的探索,以提高芍药苷发酵产量,为工业化提供更成熟的发酵条件。在提高发酵产量方面,还可以通过代谢工程对芍药苷代谢途径进行控制,但目前芍药苷生物合成途径研究较少,对于芍药苷上下游产物以及关键合成酶研究尚不深入,基础研究的不足限制了芍药苷发酵产量的优化,将来这些代谢节点的研究均可为芍药苷代谢途径控制提供基础。
参考文献
[1] PETRINI O.Fungal endophytes of tree leaves[M]//ANDREWS J H,HIRANO S S,Microbial ecology of leaves.New York:Springer-Verlag,1991:179-197.
[2] STROBEL G.A proposed new taxon for a bulbilliferous hyphomycetes associated with pacific yew(Taxusbrevifolia)[J].Mycotaxon,1993,47:71-80.
[3] 李桂玲,王建峰,黄耀坚,等.植物内生真菌抗肿瘤活性菌株的筛选[J].菌物系统,2001,20(3):387-391.
[4] 杨显志,郭仕平,张玲琪,等.鬼臼类植物产鬼臼毒素内生真菌的筛选[J].天然产物研究与开发,2003,15(5):419-422.
[5] YA W,QING G Z,ZHI B Z,et al. Isolation and characterization of endophytic huperzine A-producing fungi fromHuperziaserrata[J].J Ind Microbiol Biotechnol,2011,38:1267-1278.
[6] WU Y G, REN K J,CHAO L,et al.Renoprotective effect of total glucosides of opaeony (TGP) and its mechanism in experimental diabetes[J].J Pharmacol Sci,2009,109:78-87.
[7] HE D Y, DAI S M.Anti-inflammatory and immunomodulatory effects ofPaeonialactifloraPall.a traditional chinese herbal medicine[J].Frontiers in pharmacology,2011,2(2):10.
[8] DENG H,YAN C,XIAO T,et al.Total glucosides ofPaeonialactifloraPall inhibit vascular endothelial growth factor-induced angiogenesis[J].J Ethnopharmacol,2010,127(3):781-785.
[9] LEE B,SHIN Y W,BAE E A,et al.Antiallergic effect of the root ofPaeonialactifloraand its constituents paeoniflorin and paeonol[J].Arch Pharm Res, 2008,31(4):445-50.
[10] 凌庆枝,董丽辉,章聪敏,等.中药白芍愈伤组织的培养及其中芍药苷的测定[J].安徽农业科学,2013,41(11):4705-4708.
[11] 中国科学院中国孢子植物志编辑委员会.中国真菌志:第四十三卷[M].北京:科学出版社,2013:103-117.
[12] 梁宗琦.真菌次生代谢产物多样性及其潜在应用价值[J].生物多样性,1999,7(2):145-150.
[13] 曹艳,黄一灵,徐艳玲,等.MALDI-TOF MS技术在临床微生物检验领域的应用进展分析[J].临床与病理杂志,2015,35(1):123-127.
Screening of Producing Paeoniflorin Endophytic Fungi fromPaeonialactiflora
CHENG Xiao-zhong1,XU Yong2*,GE Yong-bin1et al
(1. Bozhou University,Bozhou,Anhui 236800; 2. Anhui Academy of Medical Sciences,Hefei,Anhui 230061)
Abstract[Objective] To isolate paeoniflorin-producing endophytic fungi strains from Paeonia lactiflora. [Method] The endophytic fungi were isolated from the root of Paeonia lactiflora using tissue explants;The paeoniflorin from endophytic fungi were confirmed by thin layer chromatography(TLC), high performance liquid chromatography(HPLC) and matrix-assisted laser desorption/ionization time of flight mass spectrometry(MALDI-TOF). [Result] A total of 22 endophytic fungi were isolated from the root of Paeonia lactiflora.1 strain was recognized as an endophytic fungi capable of producing paeoniflorin and classified asIsaria tenuipes. [Conclusion]The separated endophytic fungi,strain R12,can be a candidate for paeoniflorin production.
Key wordsPaeonia lactiflora; Endophytic fungi; Paeoniflorin; Screening
基金项目安徽省高校自然科学基金项目(KJ2014A167)。
作者简介程孝中(1983-),男,安徽安庆人,讲师,在读博士,从事中草药组织培养和内生菌研究。*通讯作者,助理研究员,硕士,从事分子生物学及生物化学研究。
收稿日期2016-03-28
中图分类号Q 813.1
文献标识码A
文章编号0517-6611(2016)11-162-03
