传染性鼻气管炎病毒gE基因的表达与免疫原性
2016-06-23齐晓雪倪宏波
王 欣,齐晓雪,毕 莹,倪宏波
(黑龙江八一农垦大学食品学院,黑龙江大庆 163319)
传染性鼻气管炎病毒gE基因的表达与免疫原性
王 欣,齐晓雪,毕 莹,倪宏波*
(黑龙江八一农垦大学食品学院,黑龙江大庆 163319)
摘要[目的] 对牛传染性鼻气管炎病毒(IBRV)gE基因表位进行原核表达,并对表达产物进行免疫原性鉴定。[方法] 利用PCR扩增出gE基因2段表位(gE-A、gE-B),并构建原核表达重组质粒pET-32a-gE。将其转化BL21(DE3)表达菌中,IPTG诱导表达。表达的gE重组蛋白经亲和层析纯化后,进行Western blot分析。[结果]重组表达质粒pET-32a-gE经过PCR、双酶切及测序证明成功构建重组质粒。SDS-PAGE结果表明,gE蛋白在大肠埃希菌中高效表达,表达的重组蛋白相对分子量约52 ku,与预期蛋白分子量一致。纯化后的gE重组蛋白浓度为0.254 mg/mL。免疫印迹结果表明,纯化后的gE重组蛋白能与IBR标准阳性血清发生特异性反应,说明其免疫原性良好。[结论]成功表达了gE基因表位蛋白,该蛋白具有良好的免疫原性,可作为检测IBRV的gE抗体的候选抗原。
关键词牛传染性鼻气管炎病毒;gE基因;重组蛋白;免疫原性
牛传染性鼻气管炎病毒(Infectious bovine rhinotracheitis virus,IBRV)可引起牛发生急性、热性、接触性传染病——牛传染性鼻气管炎(Infectious bovine rhinotracheitis,IBR)[1],主要症状为呼吸道和生殖道感染[2-3]。IBRV 主要的基因包括gB、gC、gD、gE和TK基因[4],gE基因所编码的蛋白虽然在病毒的复制过程中是非必需的,但其能够以一种细胞特异性的方式对病毒从感染细胞中的释放进行影响。gE基因的缺失还可对病毒在感染细胞间的传播途径进行干扰,同时gE基因缺失疫苗在临床实践中已得到了广泛应用,并取得了良好的免疫效果[5],因此gE可作为检测IBRV的候选抗原[6]。笔者通过大肠杆菌表达IBRV 的gE基因2段表位(gE-A和gE-B),旨在为今后建立其诊断方法奠定基础。
1材料与方法
1.1细胞、病毒和质粒牛肾细胞(MDBK)、IBRV分离株、原核表达载体pET-32a(+)、DH 5α菌种、BL21(DE3)菌种,均由黑龙江八一农垦大学食品学院实验室保存。
1.2血清与抗体牛传染性鼻气管炎的标准阴性血清和阳性血清均购自中国兽药监察所;辣根过氧化物酶(HRP)标记兔抗牛IgG,购自德国Sigma公司。
1.3主要试剂和酶Trizol Reagent和蛋白纯化试剂均购自加拿大MBI Fermentas公司;DMEM培养基、胎牛血清和胰蛋白酶,均购自四季青生物工程材料有限公司(杭州);BamH I和Hind Ⅲ限制性内切酶、T4连接酶、DNA快速提取剂盒与质粒提取试剂盒,均购自北京博凌科为生物科技有限公司;胶回收试剂盒,购自西诺远大科技有限公司(北京);低分子质量蛋白质Marker和预染低分子质量蛋白质Marker,均购自赛默飞世尔(Thermo Scientific)科技有限公司。
1.4引物的设计与合成根据GenBank数据库中已发表的BHV-1 gE蛋白的基因序列,利用DNAStar和Prime 5.0设计2对引物,并在引物的 5′端加入相应的酶切位点和保护性碱基,用于扩增gE基因的2个抗原表位,由试剂公司合成。PCR反应的引物和产物大小如表1所示。

表1 PCR反应的引物和产物大小
1.5PCR 扩增及基因克隆采用上述特异性引物对gE-A和gE-B分别进行PCR扩增,PCR反应体系为常规反应体系。gE基因PCR扩增反应条件为:98 ℃预变性3 min;98 ℃ 10 s,57 ℃ 10 s,72 ℃ 1 min,35 个循环;72 ℃总延伸10 min。将PCR产物分别在1%琼脂糖凝胶上电泳分离后,紫外灯下切割目的条带,用DNA胶回收试剂盒回收PCR产物。
1.6重组表达质粒的构建用BamH I和Hind Ⅲ双酶切重组质粒pMD-gE和原核表达载体pET-32a(+),连接后转化BL21(DE3)感受态菌,通过PCR和限制性内切酶酶切进行筛选和鉴定,并送交生工生物工程(上海)股份有限公司测序。
1.7重组蛋白的诱导表达 将阳性克隆质粒转化BL21(DE3)感受态,获得重组阳性菌,用于蛋白表达。挑取单个阳性菌落在含有Amp+的LB液体培养基中37 ℃振荡培养。当OD600值为0.6 时,加入 IPTG至终浓度为1.0 mmol/L进行诱导。同时设置表达载体对照组,20 ℃诱导表达后14 h取菌液,12 000 r/min 离心1 min,保存沉淀。PBS重悬菌体沉淀,超声裂解后,10 000 r/min 离心20 min,收集上清和沉淀进行SDS-PAGE电泳,鉴定目的蛋白是否表达和表达方式。
1.8表达产物的纯化、复性及浓度测定取50 mL经过IPTG诱导表达的菌液,离心后,弃上清。5 mL PBS悬浮,超声破碎。用等量结合缓冲液(Binding buffer)悬浮,过柱前经0.45 μm滤膜过滤,与1 mL 50% slurry(即镍柱中加入等体积Binding buffer)混合后于室温低速振荡孵育1 h。用1 mL结合缓冲液洗涤2次,0.5 mL 洗脱液(Elution buffer)洗脱,分管收集洗脱液,即得纯化蛋白。纯化蛋白以12 000 r/min离心1 min后取上清,加入截留相对分子量为8 000~14 000的透析袋中,于4 ℃下以PBS流动缓冲液透析12 h,每隔2 h换1次缓冲液。进行脱盐复性。吸取出透析袋中蛋白以12 000 r/min离心1 min,取上清用超滤法浓缩,于-80 ℃下冻存。使用BCA蛋白定量试剂盒测定蛋白浓度。
1.9Western blot 检测 将纯化后的gE蛋白样品经处理后,进行SDS-PAGE凝胶电泳,经电转印至NC膜上,用5%的脱脂奶粉在37 ℃水平摇床上封闭2 h;用5%的脱脂乳对一抗所用的IBR标准阳性血清按1∶300倍进行稀释,于37 ℃水平摇床上作用1 h;酶标二抗兔抗牛IgG用5%的脱脂乳以1∶5 000倍稀释,37 ℃水平摇床上作用1 h;用DAB显色观察结果。
2结果与分析
2.1gE基因的PCR扩增结果PCR产物在1%琼脂糖凝胶上电泳,在约129和372 bp处可见明显的基因片段,与预期大小相符(图1)。

注:1.DNA Marker;2.gE-A表位扩增结果;3.gE-B表位扩增结果;4.阴性对照。Note: 1. DNA Marker; 2. Amplification result of gE-A epitope; 3. Amplification result of gE-B; 4. Negative control. 图1 RT-PCR扩增结果Fig.1 Amplification result of RT-PCR
2.2重组原核表达质粒的双酶切鉴定构建的pET-32a-gE重组表达载体经BamH I/Hind Ⅲ 双酶切可以切出约501 bp的目的片段(图2)。

注:1.DL 10 000 DNA Marker;2.pET-28a-gE 酶切产物。Note: 1. DL 10 000 DNA Marker; 2. pET-28a-gE enzyme-digested products.图2 重组表达载体的酶切鉴定Fig.2 Enzyme identification of recombinant plasmid
2.3gE重组蛋白的SDS-PAGE检测将诱导的重组菌和空载体进行SDS-PAGE检测,结果表明诱导的重组菌有特异性条带,其分子量为52 ku,与预期蛋白分子量相符,而诱导的空载体却没有该特异性条带,且主要以可溶性蛋白的形式表达(图3)。
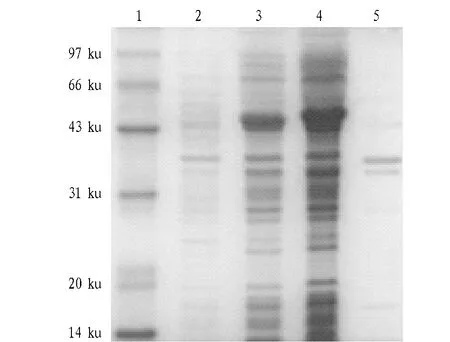
注:1.标准蛋白Marker;2.gE未诱导;3.gE超声前全菌体;4.gE超声后上清;5.gE超声后沉淀。Note: 1. Protein Marker; 2. non-induced gE; 3. Whole cell before gE ultrasound; 4. Supernatant after gE ultrasound; 5. Precipitation after gE ultrasound. 图3 pET-32a-gE诱导表达Fig.3 Induction expression of pET-328a-gE
2.4gE重组蛋白的纯化将可溶性蛋白过Ni柱纯化后,可见目的条带明显。蛋白浓度采用BCA法测定,纯化后的gE重组蛋白浓度为0.254 mg/mL(图4)。

注:1.标准蛋白Marker;2.纯化后的gE重组蛋白。Note: 1. Protein Marker; 2. gE recombinant protein after purification. 图4 纯化后的gE重组蛋白检测Fig.4 The detection of gE recombinant protein after purification
2.5gE重组蛋白的Western blot检测将纯化后的gE蛋白转印到NC膜上,进行Western blot 分析检测,结果表明表达的融合蛋白在52 ku处出现阳性条带,且所表达的蛋白具有良好的免疫学活性,由此判定所表达的蛋白为gE融合蛋白(图5)。

注:1.标准蛋白预染Marker;2.纯化的gE重组蛋白。Note: 1. Protein Marker; 2. gE recombinant protein after purification. 图5 纯化的gE蛋白的Western blot检测Fig.5 Western blot analysis of the purified recombinant gE protein
3讨论
利用分子生物学软件对gE全基因及其编码的氨基酸进行分析,通过分析目的基因的酶切位点和预测目的蛋白的跨膜区、信号肽序列及抗原表位等分子生物学特性,在参考相关文献[7]的基础上,选取抗原决定簇较集中且具有良好的抗原性和亲水性的基因序列。在gE基因上随机选取2段线性表位,应用引物设计软件设计了2对特异性引物,成功扩增出2段目的片段。
扩增出IBR gE部分抗原表位基因,并将其定向克隆到原核表达载体上,并成功表达,经亲和层析柱纯化后,得到了具有良好抗原性且纯度较高的gE融合蛋白;Western blot检测结果表明,重组的融合蛋白与IBR标准阳性血清能够发生特异性反应,说明得到的重组蛋白具有良好的抗原性,能够作为IBRV检测的优势抗原使用[8],为牛传染性鼻气管炎的检测和防疫提供了便利的条件,同时也为针对该病的诊断试剂盒的研制提供一定的物质基础。
4结论
该研究克隆了IBRV的gE部分抗原表位基因,并在大肠杆菌中成功表达,经Western blot检测证实该蛋白具有良好的免疫原性。
参考文献
[1] RAAPERI K,ORRO T,VILTROP A.Epidemiology and control of bovine herpesvirus 1 infection in Europe[J].Vet J,2014,201(3):249-256.
[2] GRISSETT G P,WHITE B J,LARSON R L.Structured literature review of responses of cattle to viral and bacterial pathogens causing bovine respiratory disease complex[J].J Vet Intern Med,2015,29(3):770-780.
[3] MAHAJAN V,BANGA H S,DEKA D,et al.Comparison of diagnostic tests for diagnosis of infectious bovine rhinotracheitis in natural cases of bovine abortion[J].J Comp Pathol,2013,149(4):391-401.
[4] EL-KHOLY A A,ABDELRAHMAN K A.Genetic characterisation of the Egyptian vaccinal strain Abu-Hammad of bovine herpesvirus-1[J].Rev Sci Tech,2006,25(3):1081-1095.
[5] CASTRUCCI G,FERRARI M,SALVATORI D,et al.Vaccination trials against bovine herpesvirus-1[J].Vet Res Commun,2005,2:229-231.
[6] EL-KHOLY A A,RADY D I,ABDOU E R,et al.Construction,characterization and immunogenicity of a glycoprotein E negative bovine herpesvirus-1.1 Egyptian strain "Abu-Hammad"[J].J Virol Methods,2013,194(1/2):74-81.
[7] SCHROEDER C,HORNER S,BÜRGER N,et al.Improving the sensitivity of the IBR-gE ELISA for testing IBR marker vaccinated cows from bulk milk[J].Berl Munch Tierarztl Wochenschr,2012,125(7/8):290-296.
[8] BISWAS S L,BANDYOPADHYAY S,DIMRI U,et al.Bovine herpesvirus-1(BHV-1)- a re-emerging concern in livestock:A revisit to its biology,epidemiology,diagnosis,and prophylaxis[J].Vet Q,2013,33(2):68-81.
Expression and Immunogenicity of GenegEof Infectious Bovine Rhinotracheitis Virus
WANG Xin, QI Xiao-xue, BI Ying, NI Hong-bo*
(College of Food Science, Heilongjiang Bayi Agricultural University, Daqing, Heilongjiang 163319)
Abstract[Objective] To express gene gE of infectious bovine rhinotracheitis virus, and to identify the immunogenicity of expression products. [Method] Two epitopes (gE-A, gE-B) of gene gE were amplified by PCR amplification. Prokaryotic expression recombinant plasmid pET-32a-gE was constructed, and transformed to BL21(DE3)expression fungus. After induced by IPTG, the expressed recombinant protein gE was purified by nickel ion affinity chromatography and analyzed by Western blot. [Result] The recombinant plasmid was confirmed by PCR, restriction analysis and sequencing. SDS-PAGE showed that gene gE showed high-level expression in Escherichia coli, with the relative molecular weight of expressed recombinant protein being about 52 ku, which was consistent with the predicted molecular weight. The concentration of the purified recombinant protein was 0.254 mg/mL for gE. The fusion protein specifically reacted with IBRV polyclonal antibody from mice, indicating good immunogenicity. [Conclusion] Gene gE epitope protein is successfully expressed. This protein has good immunogenicity and can be used as the candidate antigen for prevention of IBR.
Key wordsIBRV; gE gene; Recombination protein; Immunogenicity
基金项目黑龙江省农垦总局“十二五”重点科技攻关项目(HNK125B-11-10A,HNK125B-11-02)。
作者简介王欣(1972- ),女,黑龙江密山人,讲师,硕士,从事微生物学方面的研究。*通讯作者,教授,博士,从事动物病原学与免疫学研究。
收稿日期2016-03-25
中图分类号S 852.6
文献标识码A
文章编号0517-6611(2016)11-126-03
