联合外用干扰素软膏和曲安奈德软膏抑制兔耳瘢痕增生的实验研究
2016-06-21杨正兵
乔 柱,熊 浩,杨正兵
(雅安市人民医院烧伤整形科 四川 雅安 625000)
联合外用干扰素软膏和曲安奈德软膏抑制兔耳瘢痕增生的实验研究
乔 柱,熊 浩,杨正兵
(雅安市人民医院烧伤整形科 四川 雅安 625000)
[摘要]目的:本实验研究联合外用干扰素软膏和曲安奈德软膏对兔耳增生性瘢痕组织的抑制作用。方法:健康新西兰大耳白兔100只,建立兔耳增生性瘢痕模型,每只兔耳造模一个,筛选80只达到实验要求的增生性瘢痕模型。随机分为5组,每组16只计瘢痕32个,A组为实验组联合外用干扰素软膏和曲安奈德软膏,B组为单用干扰素软膏,C组为单用曲安奈德软膏,D组为联合肌注曲安奈德和干扰素,E组为空白对照组。用药3周后对瘢痕进行大体观察,切取瘢痕组织计算瘢痕增生指数,masson染色胶原纤维的形态分布及成纤维细胞数量。结果:A组与D组差异无统计学意义(P>0.05);A组与B、C组差异有统计学意义(P<0.05); A组与E组差异显著(P<0.01)。结论:实验认为干扰素软膏和曲安奈德软膏联合外用能有效抑制兔耳瘢痕增生,比单用药效果更佳,与肌注法比较操作方便,减少并发症,减少组织坏死,可为增生性瘢痕的治疗提供一种新方法。
[关键词]干扰素;曲安奈德;增生性瘢痕;成纤维细胞;实验研究
增生性瘢痕(hypertrophic scar, HS)发生机制复杂,目前尚未完全明了,其发生存在种族差异,具有明显的家族遗传倾向,其遗传模式为常染色体显性遗传,不完全外显[1],其中P53[2]、Fas基因存在外显子突变[3-4]。增生性瘢痕极大影响患者肢体功能及外观,甚至可能癌变[5-6],因此给患者生活工作带来巨大的痛苦,但至今无良好的治疗措施,是整形修复外科领域的难点和热点。单一手术切除瘢痕复发率很高[7],常联合其它方法如按摩[8-9]、药物注射、加压[10]、冷冻、激光[11]、超声波、硅凝胶膜[12]等。目前主要采取手术切除,辅以激素注射等综合治疗[13]。一些学者业已证明曲安奈德和干扰素注射对抑制瘢痕增生效果明确,联合肌注效果更佳。但曲安奈德长期肌注副作用大,如皮肤萎缩、溃疡坏死、易产生耐药性等;干扰素肌注量难以把握,操作复杂,疼痛剧烈,长期应用影响机体的免疫系统等以及其他并发症。依此提出外用药物治疗,研究联合外用干扰素软膏和曲安奈德软膏对兔耳增生性瘢痕组织的抑制作用。
1 材料和方法
1.1实验动物
由四川农业大学动物实验中心提供兔100只兔耳完好,雌雄不计,年龄8~12月,体重为2.0~2.5kg。由四川农业大学动物实验中心代为饲养。
1.2主要仪器及试剂
动物实验手术器械包(四川农业大学动物实验中心),三星数码相机(自备),干扰素a-2b软膏(商品名:里亚美,哈药集团生物工程有限公司),曲安奈德软膏(北京曙光药业有限责任公司),干扰素a-2b(哈药集团生物工程有限公司),曲安奈德(北京曙光药业有限责任公司)。
1.3兔耳瘢痕模型制作
本实验动物模型的制作是依据李荟元[14]研究设计的制作方法,术后第4周可见瘢痕形成,瘢痕组织不超过手术区域。
1.4实验动物分组
实验共80只兔耳模型分5组,每组16只(100只实验兔筛选81只达到实验要求的瘢痕模型,随机切取一只兔左右耳的瘢痕组织予以病理组织学检查)。A组为实验组联合外用干扰素软膏和曲安奈德软膏,B组为单用干扰素软膏,C组为单用曲安奈德软膏,D组为联合肌注曲安奈德和干扰素,E组为空白对照组。
1.5用药方法
术后第28天兔耳瘢痕形成后,予以A组16只兔共32耳瘢痕创面均匀涂抹干扰素软膏与曲安奈德软膏(以1:1的比例混合),每日一次,每次涂抹在瘢痕创面上,然后适当的按揉瘢痕1~2min帮助药物吸收,共计3周。同样方法B组单用干扰素软膏,C组单用曲安奈德软膏。D组注射干扰素与曲安奈德(1:1),每3d一次,每次注射至兔耳瘢痕发白为止,共3周。E组空白对照组。
1.6取标本及处理
实验第50d,利用空气栓塞法处死实验兔子,无菌条件下切取兔耳标本,瘢痕周边带有部分正常皮肤软组织及软骨膜。将标本固定在10%的甲醛溶液里,用石蜡包埋,送病理科进行HE染色及Msson染色。
2 观察指标
2.1大体观察
大体表现:采用温哥华瘢痕评分标准[15]:每天观察创面的外观,手术区情况,肉芽生长情况,瘢痕组织的颜色、质地、大小、厚度等,并每日拍照记录创面愈合情况及瘢痕形成情况,用药后各组瘢块的变化,如颜色、质地、大小等。
2.2瘢痕增生指数HI
依据Morris等[16]提出的公式HI=A/B,A为瘢痕凸起最高点到兔耳软骨表面的垂直距离,B为瘢痕周缘正常皮肤皮缘到兔耳软骨表面的垂直距离。
2.3成纤维细胞计数FBI
依据Weidner等[17]对瘢痕组织的成纤维细胞计数方法,首先在低倍镜下寻找HE染色标本中清楚显示并且成纤维细胞数最多的区域,再通过高倍镜下观察计数4个不同区域,结果取均数,此数为该实验动物的成纤维细胞数目。
3 统计方法
本实验采用PASW Statistics18(SPSS18.0)软件进行统计分析,组间比较采用了t检验,并且按检验水准a=0.05,P<0.05为差异具有统计学意义,P>0.05则差异无统计学意义,可认为实验组与对照组对瘢痕的抑制作用无明显差异。
4 结果
4.1一般观察
A,D给药组肉眼可见瘢痕明显变平,变软,颜色变淡,斑块体积明显变小;B、C给药组瘢痕较用药前有所变平,变软,颜色变淡,斑块有所缩小;E组空白组无明显变化。
4.2Masson染色观察
A、D组胶原纤维排列整齐,形态纤细;B、C组胶原纤维排列欠整齐,形态较A、D组粗;E组胶原纤维蓝染颜色深,纤维排列紊乱,粗大。
4.3瘢痕增生指数及成纤维细胞计数比较
通过对表1及表2数据进行软件分析,认为A、D组对瘢痕有明显的抑制作用,P>0.05差异无统计学意义;A、D组与B、C组比较P<0.05,差异有统计学意义;A、D组与E组比较P<0.01,差异有统计学意义,非常显著;B、C组与E组比较P<0.05,差异有统计学意义(见表1~2)。
表1 瘢痕增生指数(Hl)比较 (±s)
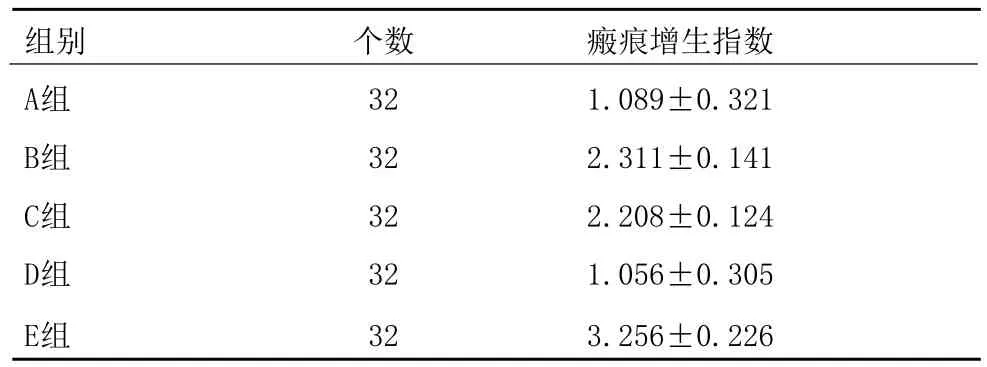
表1 瘢痕增生指数(Hl)比较 (±s)
注:A、D之间比较P>0.05差异无统计学意义,对兔耳瘢痕增生的抑制作用相似;A、D组与B,C组比较P<0.05,差异有统计学意义,A、D组对兔耳瘢痕增生的抑制作用强于B、C组;A、D组与E组比较P<0.01,差异有统计学意义,A、D组对兔耳瘢痕增生的抑制作用明显强于E组;B、C组与E组比较P<0.05,差异有统计学意义,B、C组对兔耳瘢痕增生的抑制作用强于E组
组别 个数 瘢痕增生指数A组 32 1.089±0.321 B组 32 2.311±0.141 C组 32 2.208±0.124 D组 32 1.056±0.305 E组 32 3.256±0.226
表2 成纤维细胞计数比较 (±s)
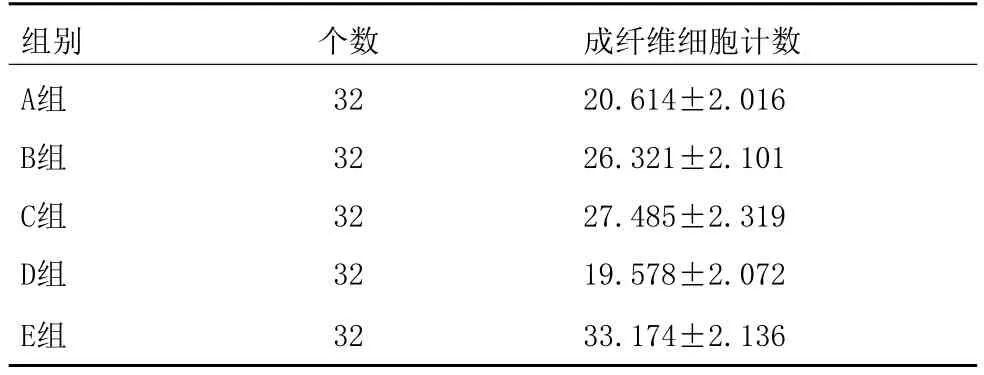
表2 成纤维细胞计数比较 (±s)
组别 个数 成纤维细胞计数A组 32 20.614±2.016 B组 32 26.321±2.101 C组 32 27.485±2.319 D组 32 19.578±2.072 E组 32 33.174±2.136
注:A、D组比较P>0.05,差异无统计学意义,A、D组成纤维细胞计数相似;A、D组与B、C组比较P<0.05,差异有统计学意义,A、D组成纤维细胞计数少于B、C组;A、D组与E组比较P<0.01,差异有统计学意义,A、D组成纤维细胞计数明显少于B、C组;B、C组与E组比较P<0.05,差异有统计学意义,B、C组成纤维细胞计数少于E组
5 讨论
近几年对瘢痕的实验研究中,可见大量关于干扰素与曲安奈德的文献报道。干扰素是一种分泌蛋白,诱导细胞分化,抑制成纤维细胞增殖,抑制胶原合成,促进胶原降解,拮抗TGF-β的作用,抑制α-SMA的合成,从而抑制瘢痕增生。曲安奈德可以抑制前胶原基因的表达,减少透明质酸的含量及胶原酶抑制剂,抑制胶原蛋白的合成,促进胶原纤维降解,减少胶原纤维含量,使瘢痕变软;曲安奈德还可以抑制毛细血管以及成纤维细胞的增生,减少纤维和细胞基质的形成,对纤维母细胞DNA有直接抑制作用,抑制肉芽组织形成[18],最终达到抑制瘢痕形成的作用。可见瘢痕的形成重要的因素之一是成纤维细胞,而干扰素和曲安奈德通过不同的原理,不同的机制最终影响成纤维细胞,从而抑制瘢痕增生。本实验即依据两种药的不同机理联合应用抑制瘢痕增生,强化药物的作用,比单一应用效果更明显,达到抑制瘢痕增生的作用。
本实验联合外用干扰素软膏与曲安奈德软膏抑制兔耳瘢痕增生,从大体及组织病理学方面与单用药法比较差异有统计学意义,证明联合外用干扰素软膏与曲安奈德软膏对兔耳瘢痕增生有更明显抑制作用,使瘢痕组织变软、变平、颜色变浅,抑制瘢痕组织成纤维细胞增生,显著降解兔耳增生性瘢痕组织中的胶原纤维。另外与肌注法比较,外用法操作方便,减少并发症,减少组织坏死等优势,可为增生性瘢痕的治疗提供一种操作简单且有效的方法。但用药的最佳剂量及用药频次以及联合应用时两种药的最佳配比和进入临床实验需下一步深入研究。
[参考文献]
[1]Chen Y,Gao JH,Liu Xj,et al.Characteristics of occurrence for Han Chinese familial keloids[J].Burns,2006,32(8):1052-1059.
[2]Lu F,Gao J,Ogawa R,et al.Biological differences between fibroblasts derived from peripheral and central areas of keloid tissues[J]. Plast Reconstr Surg,2007,120(3):625-630.
[3]刘旺,将游晖,李友良,等.瘢痕疙瘩成纤维细胞p53基因突变的研究[J].中华烧伤杂志,2004,20(2):85-87.
[4] Kryger ZB,Sisco M,Roy NK,et al. Temporal expression of the transforming growth factor-beta pathway in the rabbit ear model of wound healing and scarring[J]. J Am Coll Surg,2007,205(1):78.
[5]郭瑞珍,王娟,陈世玖,等.Cx42、Survivin、PTEN在皮肤瘢痕及瘢痕癌中的表达[J].肿瘤防治研究,2010,37(1):81-4.
[6]Zhang Y,Chang C,Gehling DJ,et al.Regulation of Smad degraduation and activity by Smurf2,an E3 ubiquitin ligase[J]. Proc Natl Acad Sxci USA,2011;98(3):974-9.
[7]陶灵,李世荣,刘剑毅,等. JAK-STATs通路在CTGF刺激人增生性瘢痕成纤维细胞增殖分化中的作用[J].中国美容医学,2008,17(11):1642-1644.
[8]黄泽春,李慧,晏丹,等.按摩配合抗疤药膜治疗早期增生性瘢痕的疗效观察[J].中国美容医学,2011,20(10):1623-1625.
[9] Philp L,Umraw N,Cartotto R.Late outcomes after grafting of the severely burned face:a quality improvement initiative[J].J Bum Care Res,2012,33(1):46-56.
[10]刘银平,黄东.压力治疗增生性瘢痕的分子机制研究进展[J].广东医学,2011,32(22):3001-3004.
[11]范燕芳,刘祥厦.微剥脱和像素模式铒激光治疗瘢痕临床体会[J].中国美容医学,2011,20(11):1775-1776.
[12]翟燕,高艳,栗艳丽,等.局部封闭与使用硅凝胶瘢痕贴片加压治疗瘢痕组织的疗效分析[J].临床医学,2011,7(31):98-100.
[13]刘杜鹃,张可佳,丁玉红,等.病理性瘢痕综合治疗的研究进展[J].中国老年学杂志,2013,4(33):1731-1732.
[14]李荟元.创伤研究动物模型-兔耳瘢痕模型的建立与应用[M].西安:第四军医大学出版社,2005:42-45.
[15]Sullivan T,Smith J,Kermode J,et al.Rating the burn scar[J].J Burn Care Rehabil,1990,11(3):256-260.
[16]Morris DE,Wu L,Zhao LL,et al.Acute and chronic animal models for excessive dermal scarring:quantitative studies[J].Plast Reconstr Surg,1997,100:674-681.
[17]Weinder N,Semp le J,WelchWR,et al.Tumor angiogenesis and metastasis relation in invasive breast carcinoma[J].N Eng J Med,1991,324(1):1.
[18]钟水军,王鸿静,邵琼,等.手术切除加曲安奈德局部注射治疗耳垂瘢痕疙瘩的临床体会[J].中国初级卫生保健,2012,26(3) :112-113.
编辑/张惠娟
•皮肤美容•
The experimental study about using topical interferon ointment and triamcinolone acetonide ointment to inhibit hypertrophic scar in the rabbit ears
QIAO Zhu,XIONG Hao,YANG Zheng-bing
(Department of Burn and Plastic Surgery,Ya’an People’s Hospital, Ya’an 625000,Sichuan,China)
Abstract:Objective The experiment studies inhibition on hypertrophic scar in the rabbit ears combined with topical interferon ointment and triamcinolone acetonide ointment. Methods 100 healthy white New Zealand rabbits were used to establish the hypertrophic scar model of rabbit ears, and 80 models of the hypertrophic scar was selected. They were randomly divided into 5 groups (each group 16 ), experimental group A was combined with topical interferon ointment and triamcinolone acetonide ointment, group B used single interferon ointment, group C used triamcinolone acetonide ointment and group D was injected triamcinolone acetonide and interferon, E group was blank control group. After 3 weeks of treatment, the scars were observed in general, the scar tissue was cut and calculated the number of fibroblasts, and the distribution of collagen fibers in Masson staining was observed. Results There was no significant difference between group A and group D (P>0.05); the difference between group A and group B and C was statistically significant (P<0.05); group A and group E were significantly different (P<0.01). Conclusion Combined with topical interferon ointment and triamcinolone acetonide ointment can effectively inhibit the hypertrophic scar of rabbit ear,was more effectively than single use and more convenient operation than intramuscular injection, it reduces complications and the necrosis, it provides a new method for hypertrophic scar treatment.
Key words:interferon; triamcinolone acetonide; hypertrophic scar; fibroblast; experimental study
[中图分类号]R619+.6
[文献标志码]A
[文章编号]1008-6455(2016)05-0060-03
基金项目:雅安市人民医院院级课题(ysy2015005)
[收稿日期]2016-03-02 [修回日期]2016-04-28
