粳稻超亲变异系籽粒谷氨酰胺合成酶基因表达特性及序列变异分析
2016-06-17徐振华曲莹刘海英朱立楠张忠臣金正勋
徐振华 曲莹 刘海英 朱立楠 张忠臣 金正勋,*
(1东北农业大学 农学院, 哈尔滨 150030;2黑龙江省农业科学院 五常水稻研究所,黑龙江 五常 150229; *通讯联系人,E-mail:zxjin326@hotmail.com)
粳稻超亲变异系籽粒谷氨酰胺合成酶基因表达特性及序列变异分析
徐振华1,2曲莹1刘海英1,2朱立楠1张忠臣1金正勋1,*
(1东北农业大学 农学院, 哈尔滨 150030;2黑龙江省农业科学院 五常水稻研究所,黑龙江 五常 150229;*通讯联系人,E-mail:zxjin326@hotmail.com)
徐振华, 曲莹, 刘海英, 等. 粳稻超亲变异系籽粒谷氨酰胺合成酶基因表达特性及序列变异分析. 中国水稻科学, 2016, 30(3): 304-312.
摘要:选用籽粒蛋白质含量有显著差异的亲本和杂种后代超亲变异系,比较分析灌浆过程中籽粒蛋白质积累特性、谷氨酰胺合成酶(GS)活性变化、GS基因mRNA表达量变化和基因碱基序列。结果表明,杂交后代通过籽粒蛋白质含量的连续定向选可获得超亲变异系,籽粒蛋白质积累量与基因型紧密相关;灌浆过程中籽粒GS活性呈单峰曲线变化,籽粒蛋白质含量与籽粒GS活性密切相关,而且籽粒GS活性也能产生超亲变异;在灌浆过程中籽粒蛋白质含量不同的亲本及超亲变异系籽粒GS1.3 和GS2 基因的mRNA表达量变化趋势基本一致,即随灌浆进程mRNA表达量逐渐增加,到抽穗后15~20d表达量最高,随后逐渐下降,呈单峰曲线变化;GS1.3 和GS2 基因mRNA表达量与籽粒蛋白质含量关系密切,GS基因mRNA表达量高的基因型籽粒蛋白质含量也高,而且超亲表达;尽管不同品种GS1.3 和GS2 基因碱基序列保守性很高,但不同品种水稻GS1.3 和GS2 基因的碱基序列和蛋白质氨基酸序列并不完全一致,存在着个别碱基不同的基因多态性,品种间有性杂交后代在基因分离和稳定过程中通过碱基的替换仍然能发生碱基的随机性变化及三联体密码和氨基酸的变化。
关键词:粳稻; 超亲变异系; 籽粒; GS基因表达; 序列变异
谷氨酰胺合成酶(GS)是无机态氮转化为有机态氮过程和植物体内氨同化的关键酶之一,是氮代谢途径中具有多功能的酶,参与调控多个氮代谢过程[1-3]。谷氨酰胺合成酶活性的降低可影响植物体内氮代谢及糖代谢过程。在水稻籽粒灌浆过程中,不同品种间GS活性变化与籽粒蛋白质含量和蒸煮食味品质间的关系甚密[4-8]。GS在水稻中有2个同工型酶,即GS1和GS2,其中GS1是由OsGS1.1、OsGS1.2、OsGS1.3共同编码。OsGS1.1和OsGS1.2在所有组织中均表达,但OsGS1.1偏向于在NH4+不足的环境中表达,而OsGS1.2则更偏向于在NH4+充足的环境中表达,OsGS1.3主要在穗中检测到表达[8-9];GS2基因的主要功能是将叶绿体以及光呼吸中再合成的NH4+合成为谷氨酰胺[10]。Jacek和Andrej等的研究结果表明,谷氨酰胺合成酶是植物氮同化的关键酶,此酶在进化中是相当保守的[11]。
有性杂交后代在数量性状上产生超亲遗传变异是生物界普遍存在的现象。品种间有性杂交仍然是目前乃至将来培育水稻新品种的主要途径之一。因此,本研究以籽粒蛋白质含量为选择指标,从F2代起连续定向选择培育成的籽粒蛋白质含量有显著差异的F10超亲变异系,比较分析灌浆成熟过程中籽粒GS基因的表达特性及其基因序列,旨在为阐明水稻GS活性和基因表达量与蛋白质含量的关系以及杂种后代籽粒蛋白质含量产生超亲遗传变异的分子机理提供理论依据。
1材料与方法
1.1供试材料和试验方法
2002年选用籽粒蛋白质含量不同的2个亲本系选1号(蛋白质含量为9.52%)和通769(8.27%)配制单交组合,以籽粒蛋白质含量为选择指标,从F2起逐代按高、低两个方向进行连续的定向选择至F10,从中选择蛋白质含量有显著差异且超亲变异的2个品系东农1101(7.81%)和东农1124(10.18%)。
2013年选用上述亲本及超亲变异系进行盆栽试验,盆的规格为长60 cm、宽40 cm、高60 cm。4月1-15日按供试材料的生育期进行分期播种,大棚盘育苗,单粒等距离点播催芽籽,旱育秧管理,5月15日插秧,每个品种插3盆,每盆等距离插长势一致的秧苗24棵,待缓苗后定植12棵苗,正常肥水管理。
抽穗时每个供试材料选取同日抽出且大小基本一致的穗挂牌标记,待抽穗后第10 d、15 d、20 d、25 d、30 d分别取挂牌标记的稻穗8个,迅速放入液氮中,然后各稻穗中选取灌浆一致的穗中部籽粒20粒,在低温下去壳去胚后放入冻存管里,置于-80℃冰柜保存备用。
1.2谷氨酰胺合成酶活性及基因mRNA表达量测定
参照金正勋等[4]方法测定谷氨酰胺合成酶活性。采用RT-PCR方法测定GS基因mRNA表达量。用冷饱和酚法[12]提取籽粒总RNA,以无RNase的DNaseⅠ进行处理,消除基因组DNA污染,取1 μg 处理后的RNA用于反转录。
根据NCBI(http://www.ncbi.nlm.nih.gov/)上已公布的水稻GS基因序列,利用Premier 5.0软件设计同工型基因的RT-PCR引物(表1)。以Actin基因为内标设计1对特异引物,其中,正向引物为5’-GGAACTGGTATGGTCAAGGC-3’;反向引物为5’-AGTCTCATGGATACCCGCAG-3’。
按照Promega公司的M-MLV逆转录试剂盒说明进行第1链cDNA的合成。以反转录得到的cDNA为模板,对5个时期的供试材料同时进行PCR扩增内参基因,利用Quantity one 7.0.5软件分析条带亮度,调整cDNA浓度直至扩增内参基因条带亮度一致。以调整浓度后的cDNA为模板扩增目标基因。扩增程序如下: 95℃下预变性10 min;95℃下变性30 s,55℃下退火30 s,72℃下45 s,共进行30个循环;对扩增产物用1%琼脂糖凝胶进行电泳,利用Quantity one 7.0.5软件对扩增谱带进行表达丰度的比对分析。
1.3谷氨酰胺合成酶基因cDNA克隆及全序列分析
1.3.1质粒与细菌菌株
用于基因克隆及构建的质粒载体有Peasy-T1(购自TransGen Biotech公司),主要用于PCR产物的克隆。所有的质粒扩增及其克隆操作都在大肠杆菌(E.coli)菌株Trans1-T1感受态细胞中进行。
1.3.2PCR扩增谷氨酰胺合成酶基因全长cDNA
参考NCBI上已公布的水稻谷氨酰胺合成酶基因GS1.3和GS2的核苷酸序列,设计并合成引物(表1),通过NCBI中BLAST的同源比对功能,对设计的引物特异性进行评价,用PCR方法从合成的水稻籽粒cDNA库中扩增谷氨酰胺合成酶基因全长cDNA片段。
表1PCR实验所用引物
Table 1. PCR primers used in the study.

引物名称 Primername 引物序列号Primersequencenumber引物序列(5'-3')Primersequence(5'-3')RT-GS1-3-SAB180689CTCCACCCTCAAGCCATCTRT-GS1-3-AACGACGCCAGCAATCTCART-GS2-SX14246GGAACCCATCCCTACTAACART-GS2-ATCACCTCAAATCCTCCATCTOs-GS1-3-AAB180689CTCACTTGCCGTTGGATTOs-GS1-3-SATTGATAGCCTGTGCGTCTCOs-GS2-SX14246GTTGGTGATTATCTGTAGGGGOs-GS2-AAAGGTGGCGTGGTTTTCT
表2灌浆不同时期水稻籽粒蛋白质含量比较
Table 2. Comparison of protein content in rice grains during grain filling.

%
数据后跟不同小写字母表示在5%水平上差异显著。下同。
Values followed by different lowercase letters mean significant difference at 0.05 level.The same as below.
PCR条件如下:95℃下10 min;95℃下1 min;55℃下1 min;72℃下5 min,共30个循环,最后在72℃下延伸15 min。
1.3.3PCR产物的克隆鉴定
PCR产物在0.7%琼脂糖凝胶电泳上分离后,用NucleoTrap 胶回收试剂盒 (Clontech) 回收目的片段,并连接到Peasy-T1载体中转化大肠杆菌DH5a感受态细胞。然后通过IPTG和X-gal进行蓝白斑筛选,提取质粒DNA,并进行酶切鉴定。
1.3.4cDNA序列分析
克隆在Peasy-T1载体中的谷氨酰胺合成酶基因cDNA,委托上海英潍捷基贸易有限公司测定全核苷酸序列,双向重复测定。利用网站NCBI分析核苷酸序列及其推导的氨基酸序列,序列比较分析在DNAMAN数据库中进行。
2结果与分析
2.1灌浆不同时期亲本及超亲变异系籽粒蛋白质积累特性比较
灌浆不同时期亲本及超亲变异系籽粒蛋白质含量多重比较结果列于表2。
由表2可见,后代东农1124的精米蛋白质含量显著高于高亲系选1号,而后代东农1101的精米蛋白质含量显著低于低亲通769;在灌浆各时期,籽粒蛋白质含量高的后代及亲本积累的蛋白质含量均高于蛋白质含量低的后代及亲本。说明有性杂交后代通过籽粒蛋白质含量的连续定向选择能获得籽粒蛋白质含量显著高的超亲变异系。
2.2灌浆不同时期亲本及超亲变异系籽粒GS酶活性比较
灌浆不同时期亲本及超亲变异系籽粒谷氨酰胺合成酶活性多重比较结果列于表3。
亲本及超亲变异系在灌浆过程中籽粒GS活性变化趋势基本一致,均呈单峰曲线变化,即随着灌浆进程酶活性逐渐上升,达到峰值后逐渐降低(表3)。但不同材料的酶活性达到峰值的时间有差异,其中,亲本系选1号和后代东农1124在抽穗后15 d达到峰值,亲本通769和后代东农1101则在抽穗后20 d达到峰值。说明抽穗后15~20 d是籽粒GS活性最强的时期,其中高蛋白品种达到酶活性峰值的时间要早于低蛋白品种,籽粒蛋白质的合成与积累主要在灌浆前中期。
由表3还可知,灌浆各时期籽粒蛋白质含量高的后代东农1124的GS活性显著或略高于蛋白质含量低的后代;而且高蛋白质含量后代的GS活性显著强于高亲,低蛋白质含量后代的GS活性显著或略低于低亲。说明籽粒蛋白质含量与籽粒GS活性密切相关,而且籽粒GS活性能产生超亲变异。

DAH-抽穗后天数。下同。
DAH,Days after heading. The same as below.
图1灌浆不同时期亲本及杂种后代籽粒GS基因mRNA转录表达量变化
Fig. 1. Expression of genes involved in GS in grains of tested parents and their derived progenies at various days after heading.
2.3灌浆过程中亲本及超亲变异系籽粒GS基因mRNA表达量变化
灌浆不同时期亲本及超亲变异系籽粒GS酶同工型基因GS1.3和GS2的mRNA表达量变化示于图1。
由图1可见,亲本及超亲变异系在灌浆过程中籽粒GS1.3和GS2基因的mRNA表达量变化趋势基本一致,随着籽粒灌浆进程2个同工型基因的mRNA表达量逐渐增加,达到峰值后又逐渐下降,呈单峰曲线变化,峰值出现在抽穗后15~20 d。与GS1.3基因相比,GS2基因的谱带亮度普遍大,说明在灌浆过程中籽粒GS2基因的mRNA表达量大于GS1.3基因,在籽粒GS同工型基因中GS2基因是主要表达的基因,在籽粒谷氨酰胺合成酶活性中起主要作用。
以系选1号的GS基因表达量为基准,计算灌浆不同时期亲本及超亲变异系籽粒GS1.3和GS2基因的mRNA相对表达量,并进行多重比较,其结果列于表4。
表3灌浆不同时期亲本及后代籽粒谷氨酰胺合成酶活性比较
Table 3. Comparison of grain glutamine synthetase activity during grain filling for parents and hybrid progenies.OD·grain-1min-1

供试材料Material10DAH15DAH20DAH25DAH30DAH系选1号Xixuan10.39a0.90b0.88c0.78b0.58b通769Tong7690.47a0.95b0.99b0.60c0.50b东农1101Dongnong11010.38a0.71c0.83c0.53c0.54b东农1124Dongnong11240.41a1.25a1.06a0.97a0.87a
表4灌浆不同时期亲本及超亲变异系籽粒GS1.3和GS2基因mRNA相对表达量比较
Table 4. Relative expression levels of GS genes in parents and hybrid progenies after heading.OD·grain-1min-1

供试材料Material10DAHGS1.3GS215DAHGS1.3GS220DAHGS1.3GS225DAHGS1.3GS2系选1号Xixuan11.00Bc1.00Dd1.00Aa1.00Bb1.00Aa1.00Bb1.00Cc1.00Cc通769Tong7690.98Bc2.87Bb0.71Bc1.06Bb0.96Aa0.90Bc1.32Aa2.16Aa东农1101Dongnong11011.20Ab1.76Cc0.83Bb0.33Cc0.69Bb0.72Cd1.15Bb0.84Dd东农1124Dongnong11241.35Aa3.08Aa0.76Bc2.16Aa0.97Aa1.43Aa1.00Cc1.80Bb
数据后跟不同大小写字母表示在0.01和0.05水平上差异显著。
Values flanked by different uppercase and lowercase letters mean significant difference at 0.01 and 0.05 levels.
由表4可见,抽穗后10 d,籽粒蛋白质含量高的东农1124的GS1.3和GS2基因的mRNA相对表达量极显著高于高亲系选1号;籽粒蛋白质含量低的后代东农1101的GS2基因的mRNA相对表达量极显著低于低亲通769,但GS1.3基因的mRNA相对表达量极显著高于低亲;抽穗后15 d,籽粒蛋白质含量高的东农1124的GS2基因的mRNA相对表达量极显著高于高亲系选1号,而GS1.3基因的mRNA相对表达量极显著低于高亲;籽粒蛋白质含量低的东农1101的GS1.3和GS2基因的mRNA相对表达量极显著低于低亲通769;抽穗后20~25d,籽粒蛋白质含量高的东农1124的GS2基因的mRNA相对表达量极显著高于高亲系选1号,而GS1.3基因mRNA相对表达量与高亲之间没有显著差异;籽粒蛋白质含量低的东农1101的GS1.3和GS2基因的mRNA相对表达量极显著低于低亲通769。说明灌浆不同时期籽粒蛋白质含量与GS1.3和GS2基因的mRNA表达量有密切关系,在灌浆不同时期籽粒蛋白质含量高的品种其GS基因的mRNA表达量也高,而且杂交后代能超亲表达。
2.4亲本及超亲变异系籽粒GS基因克隆及相似性比较
由基因测序结果可知,亲本及超亲变异系籽粒GS1.3和GS2基因的cDNA全序列长分别为1113 bp和1287 bp,分别编码371个和429个氨基酸,包含了全部的编码区序列,与预期结果完全相符。现将其中的亲本系选1号籽粒GS1.3基因和GS2基因的cDNA全长核苷酸序列及推导出的氨基酸序列分别示于图2~3。
将测得的供试材料GS1.3-系选1号、GS1.3-通769、GS1.3-东农1101、GS1.3-东农1124和GS2-系选1号、GS2-通769、GS2-东农1101、GS2-东农1124基因cDNA全序列与GenBank中已发表的日本晴GS1.3和GS2的核苷酸序列AB180689和X14246进行比较,其结果如图4所示。
由图4可见,与日本晴相比,亲本系选1号和通769及超亲变异系东农1101和东农1124的GS1.3同源性分别为99.7%、99.8%、99.6%、99.6%,GS2同源性分别为99.9%、99.9%、100%、100%,证明本研究已成功克隆GS1.3和GS2的cDNA,并说明籽粒蛋白质含量不同的水稻品种间谷氨酰胺合成酶基因序列差异很小,具有非常高的保守性,并且GS2的保守性大于GS1.3。
2.5亲本及超亲变异系籽粒GS基因全长cDNA序列比较
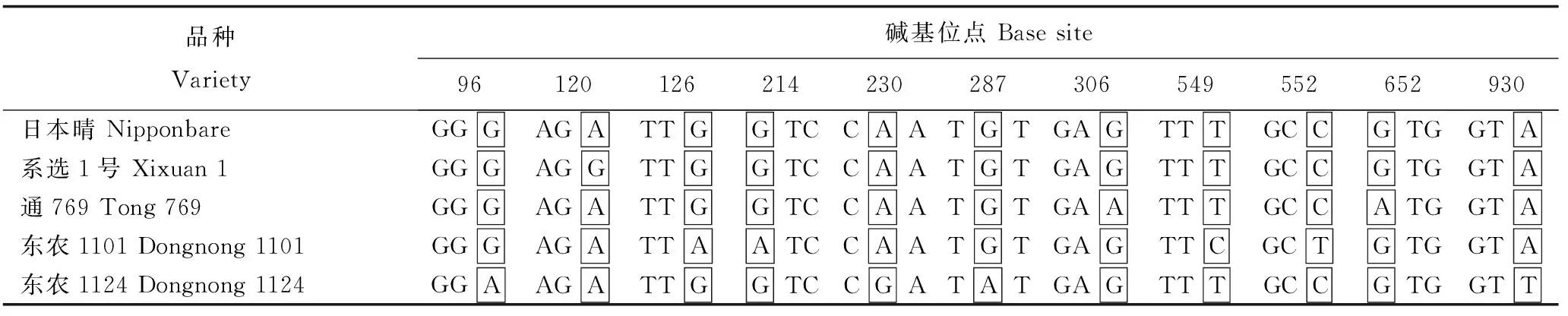
现将日本晴和亲本及超亲变异系籽粒GS1.3基因cDNA全序列碱基和三联体密码变异位点比较结果列于表5。
由表5可见,超亲变异系东农1101与母本系选1号相比,有5个位点的碱基发生变化,其中120位点和126位点的碱基G转换成A,三联体密码由AGG和TTG分别变成AGA和TTA,都为精氨酸(R)和亮氨酸(L);214位点的碱基G转换成A,三联体密码GTC变成ATC,由缬氨酸(V)变成异亮氨酸(I);549位点的碱基T和552位点的碱基C分别转换成C和T,三联体密码TTT和GCC分别变成TTC和GCT,都为苯丙氨酸(F)和丙氨酸(A)。与父本通769相比,有6个位点的碱基发生变化,其中126位点和214位点的碱基G转换成A,三联体密码TTG和GTC分别变成TTA和ATC,前者都为亮氨酸,后者由缬氨酸(V)变成异亮氨酸(I);306位点和652位点的碱基A转换成G,三联体密码由GAA和ATG分别变成GAG和GTG,前者都为谷氨酸(E),后者由甲硫氨酸(M)变成缬氨酸(V);549位点的碱基T和552位点的碱基C分别转换成C和T,三联体密码由TTT和GCC分别变成TTC和GCT,前者都为苯丙氨酸(F),后者都为丙氨酸(A)。与父母本同时相比,超亲变异系东农1101有4个位点的碱基与双亲不同,其中126位点、549位点、552位点的碱基变化和三联体密码的变化没引起氨基酸的变化,只有214位点的碱基变化和三联体密码的变化导致了氨基酸的变化。

图2系选1号籽粒GS1.3基因的cDNA全长序列(上)及推导出的氨基酸序列(下)
Fig. 2. Deduced cDNA sequence(top) and amino acid sequence(bottom) of grain GS1.3 gene in Xixuan 1.

图3系选1号籽粒GS2基因CDNA全序列(上)及推导出的氨基酸序列(下)
Fig. 3. CDNA sequence(top) and deduced amino acid sequence(bottom) of grain GS2 gene in Xixuan 1.

1-日本晴; 2 系选1号; 3-通769; 4-东农1101; 5-东农1124。
1, Nipponbare; 2, Xixuan 1; 3, Tong 769; 4, Dongnong 1101; 5, Dongnong 1124.
图4供试材料间GS1.3(A)和GS2(B)基因序列的同源性
Fig. 4. Comparison of homology between GS1.3(A) and GS2(B) gene sequences for the tested materials.
表5日本晴、供试亲本及超亲变异系籽粒GS1.3基因cDNA全序列三联体密码比较
Table 5. Comparison of triplets for gene cDNA sequence of GS1.3 in grains of Nipponbare, tested parents and their derived progenies.
品种Variety碱基位点Basesite96120126214230287306549552652930日本晴NipponbareGGGAGATTGGTCCAATGTGAGTTTGCCGTGGTA系选1号Xixuan1GGGAGGTTGGTCCAATGTGAGTTTGCCGTGGTA通769Tong769GGGAGATTGGTCCAATGTGAATTTGCCATGGTA东农1101Dongnong1101GGGAGATTAATCCAATGTGAGTTCGCTGTGGTA东农1124Dongnong1124GGAAGATTGGTCCGATATGAGTTTGCCGTGGTT
超亲变异系东农1124与母本系选1号相比,有5个位点的碱基发生变化,其中96位点和120位点的碱基G转换成A,三联体密码由GGG和AGG分别变成GGA和AGA,都为甘氨酸(G)和精氨酸(R);230位点的碱基A和287位点的碱基G分别转换成G和A,三联体密码由CAA和TGT分别变成CGA和TAT,由原来的谷氨酰胺(Q)和半胱氨酸(C)分别变成精氨酸(R)和酪氨酸(Y);930位点的碱基A颠换成T,三联体密码GTA变成GTT,都为缬氨酸(V)。与父本通769相比,有6个位点的碱基发生变化,其中96位点和287位点的碱基G转换成A,三联体密码由GGG和TGT分别变成GGA和TAT,前者都为甘氨酸(G),后者由半胱氨酸(C)变成酪氨酸(Y);306位点、230位点、652位点的碱基A转换成G,三联体密码由GAA、CAA、ATG分别变成GAG、CGA、GTG,前者都是谷氨酸(E),后两者分别由谷氨酰胺(Q)变成精氨酸(R),甲硫氨酸(M)变成缬氨酸(V);930位点的碱基A颠换成T,三联体密码GTA变成GTT,都为缬氨酸(V)。与父母本同时相比,超亲变异系东农1124有4个位点的碱基与双亲不同,其中96位点和930位点的碱基变化和三联体密码的变化没引起氨基酸的变化,但230位点和287位点的碱基变化和三联体密码的变化导致了氨基酸的变化。
将超亲变异系东农1101和东农1124相互比较可知,两个变异系间有8个位点的碱基和三联体密码不同,其中96位点、126位点、549位点、552位点及930位点的三联体密码变化没导致氨基酸的变化,而214位点、230位点、287位点的三联体密码变化导致了氨基酸的变化。
由亲本和超亲变异系间的籽粒GS2基因的全长cDNA核苷酸序列比较可知,2个超亲变异系东农1101和东农1124的核苷酸序列完全一致,但与母本系选1号相比,两个超亲变异系只有在784位点的碱基A转换成G,三联体密码由ATC变成GTC,由异亮氨酸(I)变成缬氨酸(V)。与父本通769相比,两个超亲变异系也只有在700位点的碱基A转换成G,三联体密码由ACA变成GCA,由苏氨酸(T)变成丙氨酸(A)。
由以上碱基序列比较结果可知,碱基发生变异后既能形成只与母本或父本单亲一样的序列或不一样的序列,也能形成与双亲都不一样的序列,而且变异后既能形成同义的三联体密码,也能形成突变的三联体密码。通过杂交产生的后代在基因分离和稳定过程中通过某位点的碱基变化,可形成个别碱基不同的多态性基因和改变蛋白质氨基酸序列的突变基因。
2.6亲本及超亲变异系籽粒GS氨基酸序列保守功能域比较
GS序列保守功能域包括谷氨酰胺合成酶ATP结合功能域、谷氨酰胺合成酶催化功能域、谷氨酰胺合成酶铵离子集合功能域。本研究根据日本晴氨基酸序列预测的保守功能域对亲本及超亲变异系间的谷氨酰胺合成酶氨基酸序列保守功能域进行比较分析,其结果分别列于表6和表7。
由表6可见,超亲变异系东农1101和东农1124与母本系选1号和父本通769相比,GS1.3氨基酸序列保守功能域氨基酸起始和终止位置及谷氨酰胺合成酶ATP结合功能域的氨基酸序列完全一致;在谷氨酰胺合成酶催化功能域中,超亲变异系东农1101和东农1124与母本系选1号的氨基酸序列完全一致,但与父本通769相比,两个超亲变异系在第108位氨基酸上由甲硫氨酸(M)变成缬氨酸(V);在谷氨酰胺合成酶铵离子集合功能域中,双亲的氨基酸序列完全一致,但超亲变异系东农1101与双亲相比,在第72位氨基酸上由缬氨酸(V)变成异亮氨酸(I),超亲变异系东农1124与双亲相比,分别在第77位和第96位氨基酸上由谷氨酰胺(Q)变成精氨酸(R),半胱氨酸(C)变成酪氨酸(Y)。
由表7可见,超亲变异系东农1101和东农1124与母本系选1号和父本通769相比,GS2氨基酸序列保守功能域氨基酸起始和终止位置及谷氨酰胺合成酶ATP结合功能域和谷氨酰胺合成酶铵离子集合功能域的氨基酸序列完全一致;在谷氨酰胺合成酶催化功能域中,超亲变异系东农1101和东农1124的氨基酸序列完全一致,但与母本系选1号相比,在第273位氨基酸上由异亮氨酸(I)变成缬氨酸(V);与父本通769相比,在第234位氨基酸上由苏氨酸(T)变成丙氨酸(A)。
表6GS1.3保守功能域氨基酸序列比较
Table 6. Conserved domain analysis of the GS1.3 sequence.

功能域Domain氨基酸序列位置Positionsequence起始Start终止End系选1号Xixuan1通769Tong769东农1101Dongnong1101东农1124Dongnong1124谷氨酰胺合成酶ATP结合功能域GSATPbindingdomain239255————谷氨酰胺合成酶催化功能域GScatalyticdomain105357VMM→VM→V谷氨酰胺合成酶铵离子集合功能域GSbeta-graspdomain1999——V→IQ→RC→Y
“—” 表示氨基酸序列一致。下同。
‘—’ means the identical amino acid sequence. The same as below.
表7GS2保守功能域氨基酸序列比较
Table 7. Conserved domain analysis of the GS2 sequence.

功能域Domain氨基酸序列位置Positionsequence起始Start终止End系选1号Xixuan1通769Tong769东农1101Dongnong1101东农1124Dongnong1124谷氨酰胺合成酶ATP结合域GSATPbindingdomain294305————谷氨酰胺合成酶催化功能域GScatalyticdomain159411ITI→VT→AI→VT→A谷氨酰胺合成酶铵离子集合功能域GSbeta-graspdomain73154————
由上比较结果可知,与亲本相比超亲变异系的GS1.3和GS2基因碱基序列中个别碱基的变化导致了该酶催化功能域和铵离子集合功能域的氨基酸序列变化。
3讨论
关于灌浆过程中GS活性与蛋白质合成积累的关系,国内外已有较多报道。Xie等[13]研究结果表明,籽粒GS活性的变化对籽粒蛋白质合成影响较小,籽粒GS活性与籽粒蛋白质含量的相关性较小。朱红梅等[12]研究结果表明,水稻高蛋白质含量基因型品种功能叶的GS活性明显高于低蛋白质含量基因型品种。唐湘如等[14]研究结果表明,水稻产量和蛋白质含量均高的品种超丰早1号成熟后期叶片和籽粒的全氮、蛋白氮和非蛋白氮含量及GS活性较高,籽粒蛋白质含量和产量增加。本研究的供试材料是在同一个杂交组合分离群体中通过籽粒蛋白质含量的连续定向选择获得的籽粒蛋白质含量有显著差异的超亲变异系,而且试验是在严格控制环境条件的盆栽里进行,试验结果可靠性很高。由本研究结果可知,在灌浆过程中籽粒GS1.3和GS2基因的mRNA表达量及GS活性变化趋势非常一致,都是单峰曲线变化,峰值都出现在抽穗后15~20d,而且籽粒蛋白质含量与GS1.3和GS2基因的mRNA表达量及GS活性变化又是同步变化关系,即籽粒蛋白质含量高的超亲变异系的GS1.3和GS2基因的mRNA表达量及GS活性显著大于蛋白质含量低的超亲变异系,并且mRNA表达量和GS活性也表现出超亲变异,因此笔者认为蛋白质含量与籽粒GS基因mRNA表达量和活性有很密切的关系。由基因碱基序列和氨基酸序列比较分析还可知,籽粒蛋白质含量、GS酶活性及GS2基因mRNA表达量有显著差异的超亲变异系东农1101和东农1124间的GS2基因编码序列和氨基酸序列却完全一致。由于氨基酸序列相同的蛋白质,其结构与功能也应相同。因此,GS基因mRNA表达量变化导致的酶活性变化是超亲变异系间籽粒蛋白质含量表现显著差异的内在原因。基因mRNA表达量变化主要受基因调控因子的影响,即基因启动子、转录因子等因素的控制。这也许是各研究者对籽粒蛋白质含量与GS活性关系上得到不同结果的原因之一。所以,今后的GS活性与籽粒蛋白质含量的关系研究应该重视GS基因调控因子的结构变异和功能变异,这对阐明有性杂交产生数量性状的超亲遗传变异分子机制及GS 在籽粒蛋白质合成积累上的作用都具有重要意义。
研究表明,在植物体内蕴藏着大量的自然等位基因变异,这些基因序列变异直接导致表型变异[15]。功能上有差异的突变主要有以下几种可能:一是基因重要功能域内的非同义突变,导致酶活性中心重要氨基酸取代而影响其功能;二是在启动子区域上下游存在的其他顺式元件中发生变异,从而影响基因对调控信息的响应与基因表达[16]。基因内部不同位点上的碱基发生变化是生物界形成复等位基因和基因多态性的内在原因。由本研究结果可知,虽然籽粒蛋白质含量不同的亲本及超亲变异系间GS1.3和GS2基因编码区碱基序列同源性很高,氨基酸序列保守性很强,序列相似度高达99%以上,甚至GS2基因在两个超亲变异系东农1101和东农1124中序列相似度达到了100%,但水稻不同品种间GS1.3和GS2基因的碱基序列和蛋白质氨基酸序列并不完全一致,与亲本相比,通过有性杂交定向选择培育的籽粒蛋白质含量超亲变异系仍然在个别碱基位点上发生变化,甚至改变蛋白质功能域上的氨基酸。这就说明,品种间有性杂交后代在基因分离和重组过程中通过碱基转换或颠换产生个别碱基和氨基酸有差异的等位基因和同工型酶,是生物界基因产生多态性和表型性状产生遗传变异的内在分子机制和重要途径。已有研究结果也表明,单核苷酸多态性(SNPs)和小的插入缺失是大多数生物基因组中最丰富的变异[17]。由本研究结果还可知,基因碱基序列的变化是不同品种间等位基因产生多态性的内在基础,但由于三联体密码的简并现象而并不是每个碱基的变化都能导致氨基酸序列的变化和蛋白质功能的变化。因此,从DNA水平上检测分析得到的基因多态性信息不一定能准确反映不同品种间等位基因遗传功能的多样性,这也许是根据DNA分子标记遗传距离选配亲本得不到理想遗传变异的内在原因。
参考文献:
[1]Cren M, H irel B Glulamine synthetase in higher plant: Regulation of gene and protein expression from the organ to the cell.PlantCellPhysiol, 1999.40: 1187-1193.
[2]Hill J, Phylip L H. Bacterial aspartic proteinases.FEBSLet, 1997, 409(3): 357-360.
[3]Ochs G, Schoth G,Trischler M, et al. Complexity and expression of the glutamine synthetase multigene family in the amphidiploid cropBrassicanapus.PlantMolBiol, 1999,39: 395-405.
[4]金正勋, 钱春荣, 杨静,等.水稻灌浆成熟期籽粒谷氨酰胺合成酶活性变化及其与稻米品质关系的初步研究. 中国水稻科学.2007,21(1):103-106.
Jin Z X, Qian C R, Yang J, et al. Changes of activity of glutamine synthetase during grain filling and its influence on rice grain quality.ChinJRiceSci, 2007,21:103-106.
[5]Paulam M, Ligia M L, Isabel M S. Expression of he plastid located luta mine synt hetase of medicago t run catula.PlantPhysiol, 2003, 132(1): 390-399.
[6]黄星,李晓光,刘洪亮,等. 水稻籽粒蛋白质含量选择对杂交后代蛋白质含量及氮代谢关键酶活性的影响. 中国水稻科学,2009,23(6):657-660.
Huang X, Li X G, Liu H L, et al. Effects of grain protein content selection on protein content and key enzymes activities for nitrogen metabolism in rice hybrid progenies.ChinJRiceSci, 2009,23:657-660
[7]莫良玉, 吴良欢, 陶勤南. 高等植物GS/GOGAT循环研究进展. 植物营养与肥料学报, 2001, 7(2): 223-231.
Mo L Y, Wu L H, Tao Q N. Research advances on GS/GOGAT cycle in higher plants.PlantNutFerSci, 2001,7(2):223-231.
[8]Tabuchi M, Sugiyama K, Ishiyama K, et al. Severe reduction in growth rate and grain filling of ricemutants lacking OsGS1:1, a cytosolic glutamine synthetase1:1.PlantJ, 2005, 42: 641-651.
[9]Tabuchi M, Abiko T, Yamaya T. Assimilation of ammonium ions andreutilization of nitrogen in rice (OryzasativaL.).JExpBot, 2007, 58: 2319-2327.
[10]Miflin B J,Lea P J. Ammonia assimilation //The Biochemistry of Plants. New York: Academic Press,1980:169-202.
[11]Jacek B, Andrzej B L. Evolution of the glutamine synthetase gene in plants.PlantSci, 2011,28:51-58.
[12]朱红梅, 荣湘民, 刘强. 等. 不同基因型水稻籽粒蛋白质含量差异的研究:Ⅰ.两个常规早稻品种籽粒蛋白质含量差异. 湖南农业大学学报,2001, 27(1): 13-16.
Zhu H M, Rong X M, Liu Q, et al. Differences in contents of grain protein of different genotype rice varieties: Ⅰ. Differences in contents of grain protein between two varieties of early convention rice.JHunanAgricUniv,2011,27(1):13-16.
[13]Xie Z J, Jiang D, Cao W X, et al. Effects of post anthesis soil water status on the key regulatory enzymes of starch and protein accumulation in wheat grains.JPlantPhysiolMolBiol,2003, 29(4): 309-316.
[14]唐湘如, 余铁桥. 密度对饲用杂交稻几种酶活性的影响及其与产量和蛋白质含量的关系. 杂交水稻,1999, (6):47-50.
Tang X R, Yu T Q. Effects of density on activities of several enzymes in fodder hybrid rice and its relation to protein content and yield.HybridRice,1999, (6):47-50.
[15]吴永生, 李新海,郝转芳,等. 玉米Gln1-4的gDNA序列、基因结构、保守功能域与等位变异. 作物学报,2009, 35(6):983-991.
Wu Y S, Li X H, Hao Z F, et al. Genomic DNA sequence, gene structure, conserved domains, and natural alleles of Gln1-4 gene in maize.ActaAgronSin, 2009, 35(6):983-991.
[16]Reddy A. Alternative splicing of pre-messenger RNAs in plants in the genomic era.AnnuRevPlantBiol, 2007, 58: 267-294.
[17]Kruglyak L. The use of a genetic map of biallelic markers in linkage studies.NatGenet, 1997, 17: 21-24.
Expression Characteristics and Sequence Variation Analysis of Glutamine Synthetase Gene in Grain ofjaponicaRice with Transgressive Variation
XU Zhen-hua1,2, QU Ying1, LIU Hai-ying1,2, ZHU Li-nan1, ZHANG Zhong-chen1, JIN Zheng-xun1,*
(1Northeast Agricultural University, Harbin 150030, China;2Wuchang Rice Research Institute, Heilongjiang Academy of Agricultural Sciences, Wuchang 150229, China;*Corresponding author, E-mail:zxjin326@hotmail.com)
XU Zhenhua, QU Ying, LIU Haiying, et al. Expression characteristics and sequence variation analysis of glutamine synthetase gene in grain ofjaponicarice with transgressive variation. Chin J Rice Sci, 2016, 30(3): 304-312.
Abstract:The transgressive variants derived from rice varieties with significant difference in grain protein content were used to investigate the expression level and structure of glutamine synthetase gene(GS), activity of glutamine synthetase and protein accumulation characteristics during grain filling. The results showed that transgressive variants could be obtained through successive directive selection of grain protein content, because the grain protein content was closely related to corresponding genotype. During grain filling, the activity of glutamine synthetase followed a single-peak curve, highly correlated with grain protein content and significantly differed between parents and progenies. GS1.3 and GS2 genes, in transgressive variants and their parents with different protein content, exhibited similar transcription trend during grain filling, that is, the transcription level increased 15-20 days before heading and then decreased gradually. Moreover, the grain protein content was closely related to GS1.3 and GS2 expression levels. The varieties with higher GS transcription level showed higher protein content compared with their parents. In addition, although GS1.3 and GS2 gene sequences showed high conservation, the gene sequence and protein sequence of GS1.3 and GS2 were not completely identical in different varieties, and there are some single nuclear polymorphisms. Random base variation as well as changes in codon and amino acids might occur because inter-variety sexual hybridization causes base substitution during segregation and stability.
Key words:japonica rice; transgressive variant; grain; GS gene expression; sequence variation
DOI:10.16819/j.1001-7216.2016.5150
收稿日期:2015-10-19; 修改稿收到日期: 2015-12-23。
基金项目:科技部科技支撑计划资助项目(2015BAD23B05); 东北农业大学学科团队建设项目。
中图分类号:Q786;S511.032
文献标识码:A
文章编号:1001-7216(2016)03-0304-09
中国水稻科学(Chin J Rice Sci),2016,30(3):304-312
http://www.ricesci.cn
