水稻迟抽穗突变体dth9的遗传分析与基因定位
2016-06-17叶卫军胡时开吴立文郭龙彪钱前
叶卫军 胡时开 吴立文 郭龙彪 钱前
(1浙江大学 农业与生物技术学院, 杭州 310058; 2中国水稻研究所, 杭州 310006;3 中国农业科学院 深圳农业基因组研究所, 广东 深圳 518120;#共同第一作者; *通讯联系人, E-mail: qianqian188@hotmail.com)
水稻迟抽穗突变体dth9的遗传分析与基因定位
叶卫军1,2,#胡时开2,3,#吴立文2郭龙彪2钱前2,3,*
(1浙江大学 农业与生物技术学院, 杭州 310058;2中国水稻研究所, 杭州 310006;3中国农业科学院 深圳农业基因组研究所, 广东 深圳 518120;#共同第一作者;*通讯联系人, E-mail: qianqian188@hotmail.com)
叶卫军, 胡时开, 吴立文, 等. 水稻迟抽穗突变体dth9的遗传分析与基因定位. 中国水稻科学, 2016, 30(3): 232-238.
摘要:在EMS诱变的93-11突变体库中筛选到一个稳定遗传的迟抽穗突变体dth9 (days to heading 9)。该突变体的抽穗期比野生型延长了50d左右,其他农艺性状基本无异。遗传分析表明迟抽穗性状受一个隐性核基因控制。以突变体dth9与日本晴和武运粳7号杂交构建的F2分离群体作为定位群体,利用SSR标记和新开发的8个InDel标记,将DTH9定位在第9染色体着丝粒附近D9-9和D9-17之间240 kb的区间内,该区域尚未发现与抽穗期有关的基因。此外,实时荧光定量PCR结果表明,在突变体dth9中与抽穗期相关基因的表达量显著降低。
关键词:水稻;抽穗期; 遗传分析; 基因定位
水稻(OryzasativaL.) 作为世界上最主要的粮食作物之一,其产量和品质受到多种因素的影响。抽穗期是水稻重要农艺性状之一,抽穗期的长短直接决定了水稻品种适宜种植区域和种植时间。此外,适当的抽穗期可以使水稻在特定的生态条件下高效地利用当地的光热资源,决定了水稻品种的增产潜力和米质。所以,抽穗期的长短不仅决定了水稻品种的种植区域,也关系到水稻的产量和品质,是水稻育种的重要目标之一[1]。
抽穗期属于数量性状,其遗传基础较为复杂,受主效基因和微效多基因的共同控制[2]。但也有研究发现水稻抽穗期既有表现为连续变异的数量性状遗传,也表现为质量性状遗传[3],且不同品种可能会表现出不同的遗传特性,而同一品种的抽穗期在不同光温条件下也表现各异,这些都使得抽穗期遗传机制更为复杂。近年来,随着新的分子标记技术的开发和应用,国内外科研工作者对水稻抽穗期的研究取得了重大进展。目前,已有618个与水稻抽穗期相关的位点被定位到各个染色体上,其中,第3染色体上最多,最少的是第10染色体[4](http://archive.gramene.org/db/qtl),并表现为区域分布。这些基因已有部分先后被克隆,如Hd1、Hd3a、Ehd1、Hd6、Ehd3、Ehd4、Ghd7、Ghd8[5-12]等(http://www.ricedata.cn/gene/index.htm)。这些基因的发现和功能分析为充分认识水稻抽穗期的遗传机理奠定了坚实的基础。
尽管目前已经在水稻抽穗期的研究工作中获得了巨大的进步,但水稻抽穗期受到内部复杂的基因调控网络和外界环境条件的共同作用,其调控机制相当复杂,目前我们所了解的还很少,尤其是内部的调控网络以及基因间的互作关系,这些都需要进一步的深入研究。而更多相关基因的克隆将会完善水稻抽穗期的遗传调控网络,加深对水稻抽穗期的认识,并对品种改良和扩大品种适宜种植区域有着重要的参考价值。本研究从籼稻93-11的突变体库中筛选获得一个稳定遗传的迟抽穗突变体dth9 (daystoheading9),我们对该突变体的表型及主要农艺性状进行考查,并对dth9进行遗传分析和基因定位,将该基因定位在第9染色体的着丝粒附近,以期为该基因的克隆、功能分析及应用提供参考。
1材料与方法
1.1实验材料
以甲基磺酸乙酯(ethylmethanesulphonate,EMS)诱变93-11种子,在M2代获得一个迟抽穗表型突变体dth9,经多代自交后稳定遗传,迟抽穗性状在杭州和海南都能稳定表现,表明该性状可稳定遗传。材料种植于中国水稻研究所试验基地,常规水肥管理。
1.2突变体表型分析
突变体dth9和野生型93-11于2013年种植于中国水稻研究所试验基地和海南南繁基地。抽穗期的调查方法:当株系中50%植株抽穗即认定为其抽穗,从播种到抽穗的天数记为抽穗期。在成熟期对突变体和野生型的株高、单株有效穗数、穗长、一次枝梗数、二次枝梗数等重要的农艺性状进行调查,每个性状至少3次重复,并利用MicrosoftExcel软件进行统计分析。
1.3遗传分析
2013年夏季在杭州将突变体dth9与野生型品种93-11进行正反交杂交配组,同年冬季将F1种植于海南陵水,并观察两个组合的F1表型。自交获得F2种子,2014年夏季将这两个F2群体种植于杭州富阳,并分别调查野生型表型和突变体表型植株数目,考查性状分离比。
1.4迟抽穗基因定位
2013年夏季在杭州将突变体dth9与粳稻品种日本晴和武运粳7号杂交,同年冬季将F1种植于海南陵水,并观察两个组合的F1表型。自交获得F2种子,2014年夏季将这两个F2群体种植于杭州富阳,收取F2群体中全部迟熟表型单株的叶片,用于基因定位。具体实验过程如下:从突变体dth9与日本晴衍生F2群体中首先挑选出21株表型为迟抽穗的单株用于dth9的连锁分析。利用本实验室均匀分布于12条染色体上的163对公共引物进行多态性筛选,共获得140对在亲本间多态性表现较好的引物。利用这些引物及21株单株初步确定目的基因所在的染色体位置。在与目标基因连锁的标记附近设计引物并获得了8对多态性较好的InDel标记(表1)。用F2群体中542株表现出突变体表型的单株对DTH9进行进一步的定位。为了缩小定位区间,从突变体和武运粳7号杂交获得的F2分离群体中获得了832株表型为突变体表型的单株,用于基因的精细定位。亲本、F1及F2遗传群体植株的总DNA提取采用CTAB法[13]。10μL的PCR体系包括:DNA模板1μL,10×PCR缓冲液1μL,正反向引物(10μmol/L)各0.5μL,dNTPs1μL,rTaq酶0.05μL,加ddH2O补足10μL。PCR扩增程序如下:94℃下预变性4min;94℃下变性30s,55℃~60℃下退火30s(温度因引物不同而异),72℃下延伸30s,40个循环;最后72℃下延伸5min。PCR产物用4%琼脂糖凝胶电泳,电泳结束后在凝胶成像仪拍照并读胶。
1.5抽穗期相关基因的表达分析
用总RNA提取试剂盒(Axygen)提取突变体和野生型幼穗分化前的叶片总RNA。以经过DNaseⅠ处理过的总RNA为模板,采用实时PCR用cDNA合成试剂盒 (TOYOBO)反转录合成cDNA第1 链。然后利用实时定量PCR(qRT-PCR)方法分析各基因在野生型和突变体中的表达量。以基因Actin1(Os03g0718100)作为内参基因。20 μL 实时荧光定量PCR体系包括cDNA模板1 μL,2×SYBR qPCR Mix (TOYOBO) 10 μL,正反引物(10 μmol/L) 各1 μL,ddH2O补足至20 μL。PCR扩增程序如下:95℃下预变性1.5 min;95℃下 10 s,60℃下 30 s,72℃下20 s,40个循环。以 2-ΔΔCT法计算各基因的相对表达量[14]。用于检测与抽穗期相关基因表达量的引物见表2。
表1本研究中精细定位所用引物
Table 1. Primers used for fine mapping in the study.

分子标记Marker正向引物(5'-3')Forwardprimer(5'-3')反向引物(5'-3')Reverseprimer(5'-3')大小Size/bp物理位置Physicalposition/MbD9-4AGCCTCATACCTCCCACACGCCTGGAAGACAATCAA1513.047D9-7AAAGATTCTCAAGGCCAGTCTATCTAGATCGTGGCCCA1723.583D9-8TTGCATGGTCACGTTCCTTGATTGCGGAGTGATGAG2603.608D9-9CCAATGTAGCAGCCGTAACGTTGAGGATTCAGTGGT1293.983D9-17AATCGGTGAATGTCCTTGGAAACATCCATGCCTTGC1244.223D9-19TCCATCGCATTTGAGTGTAAGTTAGTAGGCGGAAGG2234.332D9-12GGGGTGATGCTGGTTTATAAGGGTCTCATCTGGAAAA2554.354D9-2GGCTTCTCAACCAAGGTAAACGCATCAAATCAGGCAC2054.554RM444GCTCCACCTGCTTAAGCATCTGAAGACCATGTTCTGCAGG1625.925
PCR产物大小和物理位置参考日本晴的序列。
The sizes of PCR products and the markers’ physical positions are based on the sequence of Nipponbare.
表2抽穗期相关基因表达量分析引物
Table 2. Primers used for qRT-PCR analysis of genes associated with heading date.

分子标记 Marker 正向引物(5'-3')Forwardprimer(5'-3')反向引物(5'-3')Reverseprimer(5'-3')Ghd7AGGTGCTACGAGAAGCAAATCCGGGCCTCATCTCGGCATAGGhd8CGTGCAATGGTTTAGACTAAAGAACAGCATCAGCATCAACAAHd6ACGTGAAGCTATGGCACATCTGTGGTCGTGCTCTGCTATTHd3aGCTAACGATGATCCCGATCCTGCAATGTATAGCATGCHd1CGTTTCGCCAAGAGATCAGAGATAGAGCTGCAGTGGAGAACRFT1CGTCCATGGTGACCCAACACCGGGTCTACCATCACGAGTEhd1AATCGATTCCAACAACAAGCAATGTCGAGAGCGGTGGATGAOsMADS51GTCGGCAAGCTCTACGAGTACTCGCGAATTGCTGATAGCGATCAOsActin1GCTATGTACGTCGCCATCCAGGACAGTGTGGCTGACACCAT
2结果与分析
2.1突变体的表型分析
与野生型93-11相比,突变体dth9的抽穗期延长了50 d左右。在苗期和分蘖期,野生型和突变体的表型基本无差异。但当93-11抽穗时,DTH9仍处于分蘖期;当93-11处于成熟期时,DTH9处于孕穗期(图1-A)。突变体dth9在浙江杭州(长日照)的抽穗期要长于海南陵水(短日照),表明该基因在长日照下对抽穗期的影响可能更大。其他主要农艺性状与野生型相比无显著差异(表 3)。
2.2突变体的遗传分析

2.3迟抽穗基因定位

A-93-11和突变体的植株表型,标尺=20 cm。B-DTH9成熟期表型,标尺=20 cm。
A, Phenotypes of the wild-type and the heading-delayed mutantDTH9, bar=20 cm. B, Phenotype ofDTH9 at mature stage, bar=20 cm.
图1野生型和迟抽穗突变体dth9的表型
Fig. 1. Phenotypes of the wild-type and the heading-delayed mutantdth9.
表3野生型和突变体的主要农艺性状比较(浙江杭州,2013年)
Table 3. Comparison of major agronomic traits between the wild-type and the mutant (Hangzhou, Zhejiang, 2013).
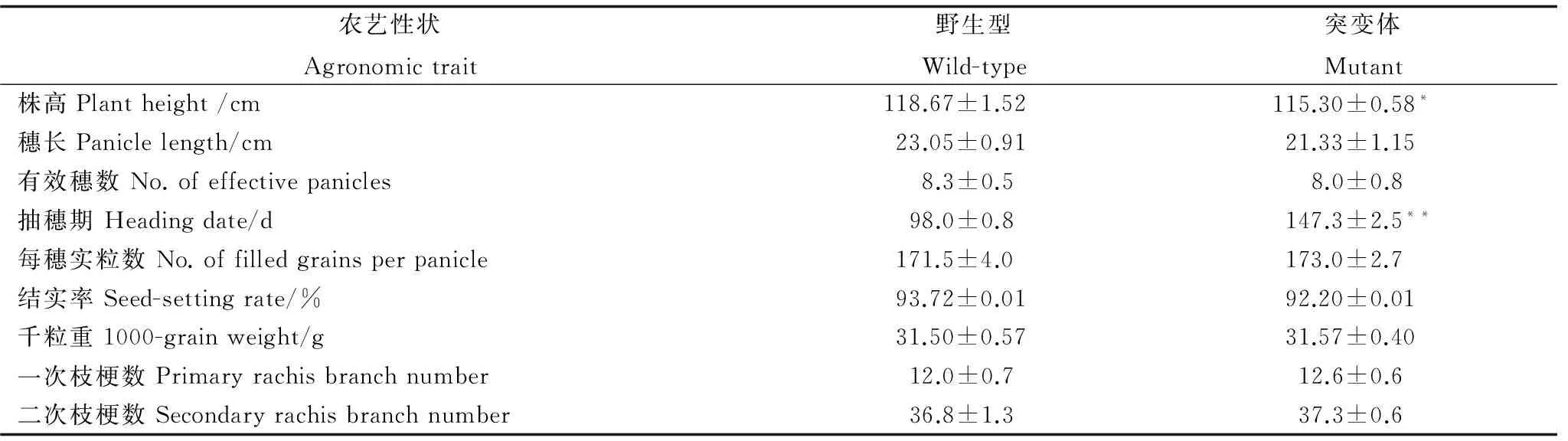
农艺性状Agronomictrait野生型Wild-type突变体Mutant株高Plantheight/cm118.67±1.52115.30±0.58*穗长Paniclelength/cm23.05±0.9121.33±1.15有效穗数No.ofeffectivepanicles8.3±0.58.0±0.8抽穗期Headingdate/d98.0±0.8147.3±2.5**每穗实粒数No.offilledgrainsperpanicle171.5±4.0173.0±2.7结实率Seed-settingrate/%93.72±0.0192.20±0.01千粒重1000-grainweight/g31.50±0.5731.57±0.40一次枝梗数Primaryrachisbranchnumber12.0±0.712.6±0.6二次枝梗数Secondaryrachisbranchnumber36.8±1.337.3±0.6
数据用平均数±标准差表示(n=3)。*,**分别表示在0.05和0.01水平上差异显著(t检验)。
Figures are shown as mean ±SD(n=3).*,**Significant at 0.05 and 0.01 levels byt-test, respectively.
表4迟抽穗突变体dth9的遗传分析
Table 4. Genetic analysis of the dth9 mutant.
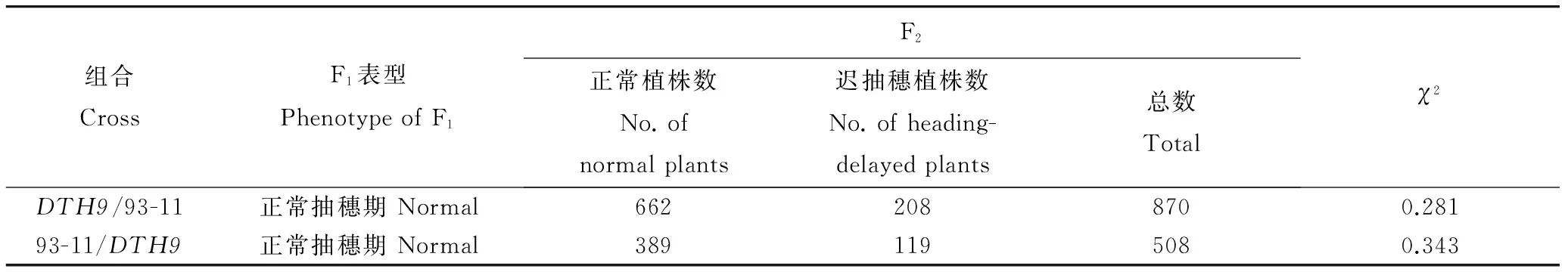
组合CrossF1表型PhenotypeofF1F2正常植株数No.ofnormalplants迟抽穗植株数No.ofheading-delayedplants总数Totalχ2DTH9/93-11正常抽穗期Normal6622088700.28193-11/DTH9正常抽穗期Normal3891195080.343

1-日本晴; 2-93-11; 3-F1; 4~24-F2群体中突变体表型的单株; 7-单交换单株。
1, Nipponbare; 2, 93-11; 3, F1; 4-24, Individuals with mutant phenotype in the F2population; 7, Single crossing-over plant.
图2利用标记RM444对F2群体中21个突变体单株进行基因型分析
Fig. 2. Genotype analysis of the 21 F2plants with mutant phenotype using the marker RM444.

图3DTH9基因的精细定位
Fig. 3. Fine mapping of DTH9.
从dth9与日本晴杂交获得的F2群体中,随机挑选21株迟抽穗表型的单株,并筛选了140对在亲本间多态表现较好的引物用于DTH9的连锁分析。发现第9染色体着丝粒附近SSR标记RM444与DTH9表现出连锁现象(图2)。在连锁标记附近设计引物获得了1对多态性良好的InDel连锁标记D9-4。用这两对引物对F2群体中93株迟抽穗表型的单株进行基因型分析, 结果发现在两个标记处都有交换发生,但没有单株在两个标记处同时发生交换。因此,我们将DTH9初步定位在标记D9-4和RM444中间。为了进一步精细定位DTH9基因,我们在D9-4和RM444标记之间开发了7对有多态性的InDel标记。从dth9和日本晴以及dth9和武运粳7号杂交衍生的F2群体中共获得了1374个迟抽穗表型的单株,利用这些单株最终将该基因精细定位在D9-9和D9-17之间大约240 kb的区间内,横跨AP005590 和AP005738 这两个BAC(图3)。
2.4抽穗期相关基因的表达分析
为了研究该基因突变后对其它抽穗期相关基因表达的影响。我们通过荧光定量PCR技术对Hd1、Hd3a、Ghd7等与抽穗期相关基因的表达进行分析。结果显示,与野生型相比,所有检测基因的表达量在突变体中都明显下调(图4)。其中,Hd6在野生型和突变体中的表达差异达到了显著水平,Ghd7、Ghd8、Hd3a、Hd1、RFT1、Ehd1和OsMADS51的表达差异达到了极显著水平,且Hd1、RFT1、OsMADS51在突变体中几乎不表达。说明DTH9的突变影响其他抽穗期相关基因的表达。
3讨论
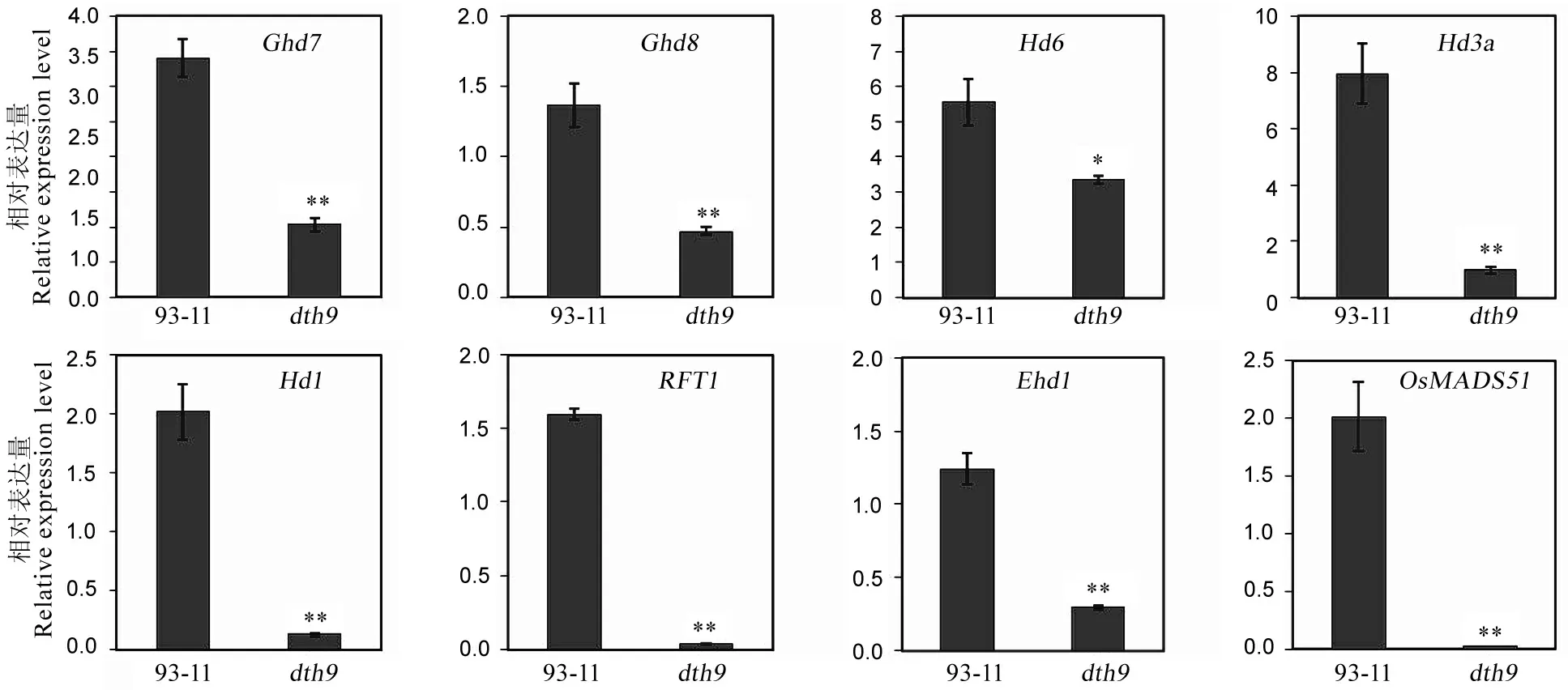
数据用平均数±标准差表示(n=3)。*,**分别表示在0.05和0.01水平上差异显著(t检验)。
Figures were shown as mean ± SD (n=3).*,**Significant at 0.05 and 0.01 levels byt-test, respectively.
图4抽穗期相关基因在dth9和野生型中的表达差异
Fig. 4. Expression levels of genes associated with heading date in the dth9 mutant and the wild-type.
水稻是重要的粮食作物,且作为单子叶的模式植物,其功能基因组学研究受到越来越来越多科研工作者的关注[15]。抽穗期是水稻重要的农艺性状之一,适宜的抽穗期对扩大水稻品种的种植区域和提高产量有着重要意义。更多水稻抽穗期相关基因的克隆对充分认识抽穗期的遗传机制和品种改良都有重大意义。迄今已克隆了20多个水稻抽穗期基因,还精细定位了9个抽穗期QTL[16],如dth.1a、Hd9、Hd8、Hd16、Hd3b、Hd4、Hd2[17-23]。Hd1是水稻中第一个通过图位克隆方法克隆的水稻抽穗期基因,编码与拟南芥CO同源的基因,表现为短日照下促进开花,长日照下抑制开花[5]。Hd3a编码一个与拟南芥中促进开花的FLOWERINGLOCUST(FT)基因高度相似的基因。在短日照条件下,Hd3a的转录水平直接影响水稻的抽穗期,且Hd3a的表达受到Hd1的调控[6]。Ehd1编码一种B型反应调节子,与水稻中未知的组蛋白激酶形成双组分信号级联传递通路,调控水稻的开花,且Ehd1能独立于Hd1调控水稻抽穗期[7]。水稻抽穗期基因除了直接调控抽穗期外,部分基因还表现出一因多效的现象。Ghd7是一个同时控制株高、每穗粒数和抽穗期的基因,编码一个CCT结构域蛋白。研究表明,在长日照条件下增强Ghd7的表达,能延长抽穗期,增加株高,使稻穗变大[11]。Ghd8编码转录因子CCAAT盒结合蛋白的HAP3亚基,同时调控水稻产量、株高和抽穗期,并在长日照下下调Ehd1和Hd3a的转录水平[12,24]。此外,Ghd8上调水稻分蘖和侧枝发生基因MOC1的表达,从而调控水稻的分蘖数、一次枝梗数和二次枝梗数,进而影响产量[24]。另外,也有科研工作者将水稻抽穗期基因应用于育种实践[25]。中国科学院遗传和发育生物学研究所林少杨研究组将Hd1导入到越光品种中,新品种Koshihikari H3号的种植区域由原品种的北纬35.0°~37.5°延伸至北纬10°,且产量增加了30%。
本研究从93-11为背景的突变体库中筛选到一个迟抽穗突变体dth9,并进行了遗传分析和精细定位。遗传分析表明该性状受一对隐性核基因控制,并将DTH9定位在第9染色体着丝粒附近,位于标记D9-9和D9-17之间约240 kb的区间内。该区段内未见抽穗期相关基因的报道。因此,DTH9是一个新的抽穗期基因。由于该区段靠近着丝粒,因此需要更大的定位群体进行进一步的精细定位。通过对突变体和野生型中抽穗期相关基因表达的分析,发现所有检测基因的表达量在突变体中均下调,表明该基因的突变影响了其他相关基因的表达。本研究为该基因的进一步克隆和功能分析提供参考。该突变体也可作为种质资源来改良水稻品种抽穗期,比如解决杂交配组时抽穗期差异太大而无法配组的问题。
参考文献:
[1]刘广林, 罗群昌, 陈远孟, 等. 水稻种质资源抽穗扬花期耐冷性鉴定评价. 西南农业学报, 2013, 26(2): 395-398.
Liu G L, Luo Q C, Chen Y M, et al.Analysis and evaluation on cold tolerance for rice germplasm resources at flowering stage.SouthwestChinaJAgricSci, 2013, 26(2): 395-398.(in Chinese with English abstract)
[2]邱磊, 蒋海潮, 冯玉涛, 等.控制水稻抽穗期和株高的QTL定位及遗传分析. 基因组学与应用生物学, 2014, 33(4): 828-835
Qiu L, Jiang H C,Feng Y T, et al.Mapping and genetic analycis of QTL for heading date and plant height in rice.GenonmApplBiol,2014,33(4):828-835.(in Chinese with English abstract)
[3]邓晓建, 周开达, 李仁端, 等. 水稻完全显性早熟性的发现和基因定位. 中国农业科学, 2001, 34(3): 233-239.
Deng X J, Zhou K D, Li R D, et al. Identification and gene mapping of completely dominant earliness in rice (OryzasativaL.).SciAgricSin, 2001, 34 (3): 233-239.(in Chinese with English abstract)
[4]胡时开, 苏岩, 叶卫军, 等. 水稻抽穗期遗传与分子调控机理研究进展. 中国水稻科学, 2012, 26(3): 373-382.
Hu S K, Sun Y, Ye W J, et al. Advances in genetic analysis and molecular regulation mechanism of heading date in rice (OryzasativaL.).ChinJRiceSci, 2012, 26(3): 373-382.(in Chinese with English abstract)
[5]Yano M, Katayose Y, Ashikari M, et al.Hd1, a major photoperiod sensitivity quantitative trait locus in rice, is closely related to theArabidopsisflowering time geneCONSTANS,PlantCell, 2000, 12 (12): 2473-2484.
[6]Kojima S, Takahashi Y, Kobayashi Y, et al.Hd3a, a rice ortholog of theArabidopsisFTgene, promotes transition to flowering downstream ofHd1 under short-day conditions.PlantCellPhysiol, 2002, 43(10): 1096-1105.
[7]Doi K, Izawa T, Fuse T, et al.Ehd1, a B-type response regulator in rice, confers short-day promotion of flowering and controls FT-like gene expression independently ofHd1.Genes&Dev, 2004, 18(8): 926-936.
[8]Takahashi Y, Shomura A, Sasaki T, et al.Hd6, a rice quantitative trait locus involved in photoperiod sensitivity, encodes the alpha subunit of protein kinase CK2.ProcNatlAcadSciUSA, 2001, 98(14): 7922-7927.
[9]Matsubara K, Yamanouchi U, Nonoue Y, et al.Ehd3, encoding a plant homeodomain finger-containing protein, is a critical promoter of rice flowering.PlantJ, 2011, 66 (4): 603-612.
[10]Gao H, Zheng X M, Fei G, et al.Ehd4 encodes a novel andOryza-genus-specific regulator of photoperiodic flowering in rice.PlosGenet, 2013, 9(2): e1003281.
[11]Xue W, Xing Y, Weng X, et al. Natural variation inGhd7 is an important regulator of heading date and yield potential in rice.NatGenet, 2008, 40(6): 761-767.
[12]Wei X, Xu J, Guo H, et al.DTH8 suppresses flowering in rice, influencing plant height and yield potential simultaneously.PlantPhysiol, 2010, 153(4): 1747-1758.
[13]Wu K S, Tanksley S D. Abundance, polymorphism and genetic mapping of microsatellites in rice.MolGenGenet, 1993, 241(1): 225-235.
[14]Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod.Methods, 2001, 25: 402-408.
[15]Hirochika H, Guiderdoni E, An G, et al. Rice mutant resources for gene discovery.PlantMolBiol, 2004, 54(3): 325-334.
[16]郭梁, 张振华, 庄杰云. 水稻抽穗期QTL及其与产量性状遗传控制的关系. 中国水稻科学, 2012, 26(2): 235-245.
Guo L, Zhang Z H, Zhuang J Y. Quantiative trait loci for heading date and their relationship with the genetic control of yield traits in rice (Oryzasativa).ChinJRiceSci, 2012, 26(2): 235-245.(in Chinese with English abstract)
[17]Thomson M J, Edwards J D, Septiningsih E M, et a1. Substitution mapping ofdth1.1, a flowering-time quantitative trait locus (QTL) associated with transgressive variation in rice, reveals multiple sub-QTL.Genetics, 2006, 172: 2501-2514.
[18]Lin H, Ashikari M, Yamanouchi U, et a1. Identification and characterization of a quantitative trait locus,Hd9, controlling heading date in rice.BreedingSci, 2002, 52(1): 35-41.
[19]Takeuchi Y, Lin S Y, Sasaki T, et a1. Fine linkage mapping enables dissection of closely linked quantitative trait loci for seed dormancy and heading in rice.TheorApplGenet, 2003, 107(7): 1174-1180.
[20]Matsubara K, Kono I, Hori K, et a1. Novel QTLs for photoperiodic flowering revealed by using reciprocal backcross inbred lines from crosses betweenjaponicarice cultivars.TheorApplGenet, 2008, 117(6): 935-945.
[21]Monna L, Lin H X, Kojima S, et a1. Genetic dissection of a genomic region for a quantitative trait locus,Hd3, into two loci,Hd3aandHd3b, controlling heading date in rice.TheorApplGenet, 2002, 104(5): 772-778.
[22]Lin H, Liang Z W, Sasaki T, et a1. Fine mapping and characterization of quantitative trait lociHd4 andHd5 controlling heading date in rice.BreedingSci, 2003, 53(1): 51-59.
[23]Yamamoto T, Kuboki Y, Lin S Y, et a1. Fine mapping of quantitative trait lociHd-1,Hd-2 andHd-3, controlling heading date of rice, as single Mendelian factors.TheorApplGenet, 1998, 97(1): 37-44.
[24]Yan W H, Wang P, Chen H X, et al. A major QTL,Ghd8, plays pleiotropic roles in regulating grain productivity, plant height, and heading date in rice.MolPlant, 2011, 4(2): 319-330.
[25]杜雪树, 戚华雄, 廖世勇, 等.水稻抽穗期分子生物学研究进展. 湖北农业科学, 2013,52(24): 5958-5962.
Du X S,Qi H X,Liao S Y, et al.Advances on the molecular biology of rice heading date.HubeiAgricSci,2013,52(24):5958-5962.(in Chinese)
Genetic Analysis and Gene Mapping of a Heading-delayed Mutantdth9 in Rice (OryzasativaL.)
YE Wei-jun1,2, #, HU Shi-kai2, 3,#, WU Li-wen2, GUO Long-biao2, QIAN Qian2,3,*
(1College of Agriculture & Biotechnology, Zhejiang University, Hangzhou 310058, China;2China National Rice Research Institute, Hangzhou 310006, China;2Agricultural Genomics Institute, Chinese Academy of Agricultural Sciences, Shenzhen 518120, China;#These authors contributed equally to this work;*Corresponding author, E-mail: qianqian188@hotmail.com)
YE Weijun, HU Shikai, WU Liwen, et al. Genetic analysis and gene mapping of a heading-delayed mutantdth9 in rice (OryzasativaL.). Chin J Rice Sci, 2016, 30(3): 232-238.
Abstract:A heading-delayed mutant, dth9 (days to heading 9)was identified from an ethyl methylsulfonate (EMS)-induced 93-11 mutant library. The heading date of dth9 delayed about 50 days compared to the wild-type and there was no significant difference in other agronomic traits. Genetic analysis showed that the phenotype of dth9 was controlled by a single recessive nuclear gene. To map this gene, two F2populations were generated by crossing the dth9 mutant with Nipponbare or Wuyunjing 7 as mapping populations. By using SSR markers and eight new designed InDel markers, DTH9 was narrowed to a 240kb interval between the markers D9-9 and D9-17 near the centromere of chromosome 9, there were no reports about genes associated with heading date in this interval. In addition, the expression levels of genes related to heading date were significantly decreased in dth9 by quantitative real-time PCR analysis.
Key words:rice; heading date; genetic analysis; gene mapping
DOI:10.16819/j.1001-7216.2016.5156
收稿日期:2015-10-26; 修改稿收到日期: 2015-12-19。
基金项目:国家自然科学基金资助项目(31501279,31521064,31271700); 国家973计划资助项目(2013CBA01405); 中国博士后科学基金资助项目(2015M570181); 深圳市科技计划资助项目(JCYJ20150630165133402)。
中图分类号:Q343.5;S511.01
文献标识码:A
文章编号:1001-7216(2016)03-0232-07
中国水稻科学(Chin J Rice Sci),2016,30(3):232-238
http://www.ricesci.cn
