云南汉族人群CD6基因多态性与HCV慢性感染的关系*
2016-06-17刘城秀沈云松李桃意檀林萍姚月婷俞建昆姚宇峰
刘城秀, 沈云松, 李桃意, 张 禹, 檀林萍, 姚月婷, 俞建昆, 姚宇峰, 史 荔**
(1.中国医学科学院&北京协和医学院 医学生物学研究所, 云南 昆明 650118; 2.云南省重大传染病疫苗研发重点实验室, 云南 昆明 650118; 3.云南省第一人民医院&昆明理工大学附属医院, 云南 昆明 650032)
云南汉族人群CD6基因多态性与HCV慢性感染的关系*
刘城秀1,2, 沈云松3, 李桃意1,2, 张禹1,2, 檀林萍1,2, 姚月婷1,2, 俞建昆1,2, 姚宇峰1,2, 史荔1,2**
(1.中国医学科学院&北京协和医学院 医学生物学研究所, 云南 昆明650118; 2.云南省重大传染病疫苗研发重点实验室, 云南 昆明650118; 3.云南省第一人民医院&昆明理工大学附属医院, 云南 昆明650032)
[摘要]目的: 探讨云南汉族人群中CD6基因多态性与慢性丙型肝炎病毒(HCV)感染的关系。方法: 随机抽取云南地区汉族人群HCV慢性感染患者434例,健康对照人群444例;采用TaqMan探针基因分型方法对2组人群的CD6基因3个SNPs(rs17824933、rs12360861、rs11230563)进行基因分型,构建CD6基因单倍型,评估上述3个SNPs与HCV慢性感染的关系。结果: 两组人群CD6基因SNP-rs17824933 (C>G)、 SNP-rs12360861 (G>A)和SNP-rs11230563 (C>T)基因型频率和等位基因频率比较,差异无统计学意义(P>0.05);2组人群的SNP-rs17824933 (C>G)、 SNP-rs12360861 (G>A)和SNP-rs11230563 (C>T)单倍型频率比较,差异无统计学意义(P>0.05)。结论: 此次调查的云南汉族群体的CD6基因SNP-rs17824933 (C>G)、 SNP-rs12360861 (G>A)和SNP-rs11230563 (C>T)与HCV慢性感染无关。
[关键词]肝炎,丙型,慢性; 多态性单核苷酸; 基因,CD6; 云南
丙型肝炎病毒(hepatitis C virus,HCV)属黄病毒科,为单股正链RNA病毒,基因组全长约9.6 kb。我国HCV感染率约为3.2%,感染者已达3 800万人[1]。感染HCV后,约20%急性感染者可自发清除HCV,其余发展为慢性持续感染,继而发展成肝纤维化、肝硬化甚至肝细胞癌[2]。因此,宿主免疫系统遗传因素在HCV感染后的清除或持续感染中可能起到的作用研究一直是该方向的热点之一。有研究发现我国不同人群中的HLA-B与慢性HCV感染关系密切[3-6]。CD6在T细胞的活化和增殖过程中起着重要作用。CD6基因位于人类染色体11q13,编码一个分子量为100~130 kDa跨膜糖蛋白,这个跨膜糖蛋白包含3个富含半胱氨酸结构域的清道夫受体(scavenger receptor cysteine-rich,SRCR)和1个活化白细胞黏附分子(activated leukocyte cell adhesion molecule,ALCAM)的结合位点[7]。CD6主要表达在CD4+和CD8+T细胞,胸腺细胞,某些B细胞和自然杀伤细胞亚群上以及脑的某些区域[8]。但是,目前国内外研究者对CD6基因多态性与HCV慢性感染的相关性研究并没有得到明确结论。本研究对云南地区汉族人群CD6基因内含子区域SNP-rs17824933 (C>G)和编码区域SNP-rs12360861 (G>A)、SNP-rs11230563 (C>T)位点进行分析,探讨这3个位点多态性与HCV慢性感染的关系。
1对象与方法
1.1对象
随机抽取云南省434名HCV慢性感染者为病例组,诊断依据中华医学会肝病学分会和中华医学会感染病学分会2015年制定的《丙型肝炎防治指南》[9],血清ALT、AST、抗HCV、HCV-RNA阳性,排除其他肝炎的患者。随机抽取同时期云南省正常健康个体444名为对照组,纳入标准为受试者血清ALT、AST、抗HCV、HCV-RNA正常。所有受试者均为居住于云南地区的彼此无血缘关系汉族个体并签署知情同意书,允许其样本与临床资料用于本次研究。病例组,年龄(43.27±10.23)岁,男性250(57.60%)例,女性184例(42.40%);对照组,年龄(42.74±9.07)岁,男性227例(51.13%),女性217例(48.87%)。两组受试者基础资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2方法
1.2.1样本采集采集受试者空腹静脉血5 mL,用EDTA抗凝,置-80 ℃保存,按照Qiagen血基因组DNA提取试剂盒说明书提取外周血基因组DNA,置-20 ℃保存。1.2.2CD6基因SNP位点基因分型采用实时荧光定量PCR法进行SNP分型,由Applied Biosystems公司合成检测rs17824933 (C>G),rs12360861 (G>A)及rs11230563 (C>T)位点的引物及TaqMan探针。针对每个SNP位点所设计的两条探针分别用VIC和FAM进行荧光标记。罗氏LightCycler 480实时荧光定量PCR仪检测SNP位点,并用LCS480 1.5.1.62软件进行基因分型。PCR反应体积为20 μL,反应条件为95 ℃ 10 min预变性,92 ℃变性15 s、60 ℃退火1 min(共40个循环),40 ℃延伸 5 min。以3个已知基因型(野生纯合子、突变纯合子、杂合子)的样品作为标准对照(均为本课题组经基因测序样本验证,SNP-rs17824933(C>G)样本其野生纯合子、突变纯合子、杂合子的基因型分别是CC、GG及CG,SNP-rs12360861(G>A)为GG、AA及AG;SNP-rs11230563 (C>T)为CC、TT及CT)。
1.3统计学方法
采用Hardy-Weinberg平衡检验基因型频率的代表性。χ2检验检测对照组与病例组3个SNP基因型、等位基因频率差异。SHEsis软件程序计算连锁不平衡,根据连锁不平衡(Linkage Disequilibrium , LD)结果构建单倍型;两位点间的LD关系用 D′表示,D′>0.8认为位点间强连锁[10-11]。P<0.05为差异有统计学意义。
2结果2.1CD6多态性位点的等位基因频率与基因型频率
CD6基因3个SNP位点rs17824933 (C>G)、rs12360861 (G>A)及rs11230563 (C>T)的基因型分布在病例组和对照组中均符合Hardy-Weinberg平衡(P>0.05)。CD6基因3个SNP位点rs17824933 (C>G)、rs12360861 (G>A)及rs11230563 (C>T)的等位基因频率与基因型频率在病例组和对照组中的分布比较,差异无统计学意义(P>0.05),见表1~3。
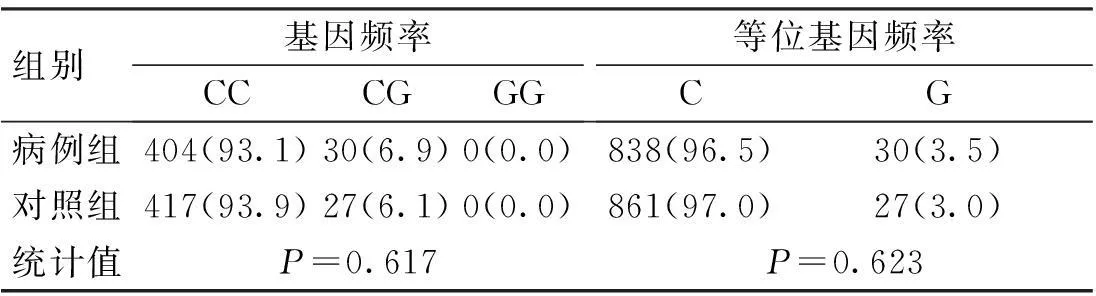
表1 CD6基因rs17824933位点的基因
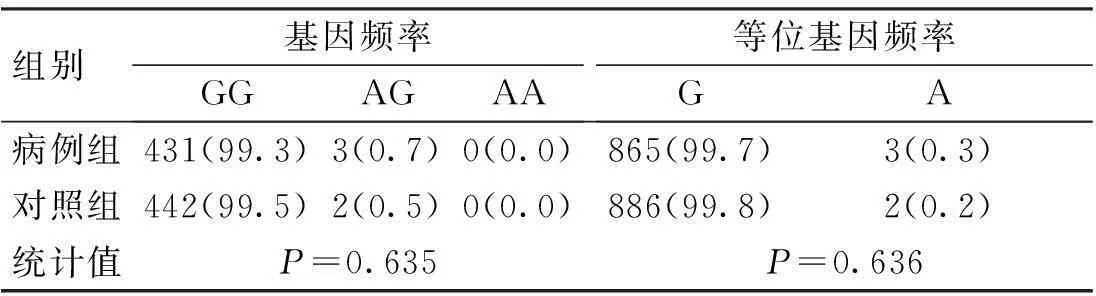
表2 CD6基因rs12360861位点的基因
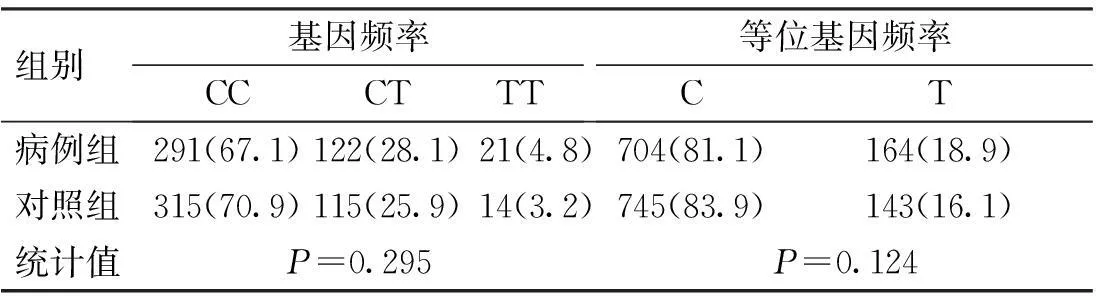
表3 CD6基因rs11230563位点的基因
2.2连锁不平衡
CD6基因3个SNP位点rs17824933 (C>G)、rs12360861 (G>A)及rs11230563 (C>T)的连锁不平衡分析结果显示rs17824933 (C>G)、rs12360861 (G>A)及rs11230563 (C>T)位点之间存在强连锁不平衡,见表4。
2.3CD6基因多态性位点的单倍型构建及频率
构建CD6基因3个SNP位点的单倍型结果显示,单倍型的频率在病例组和对照组中的分布比较,差异无统计学意义(P>0.05),见表5。
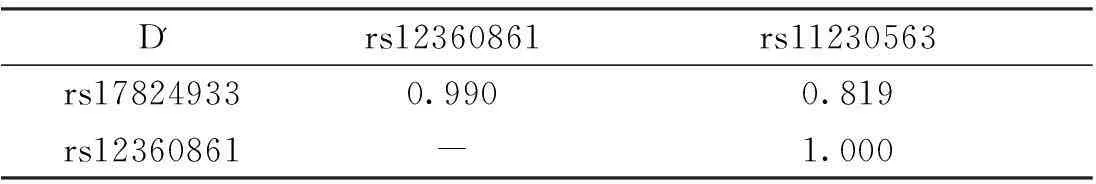
表4 CD6基因3个SNP位点连锁不平衡分析
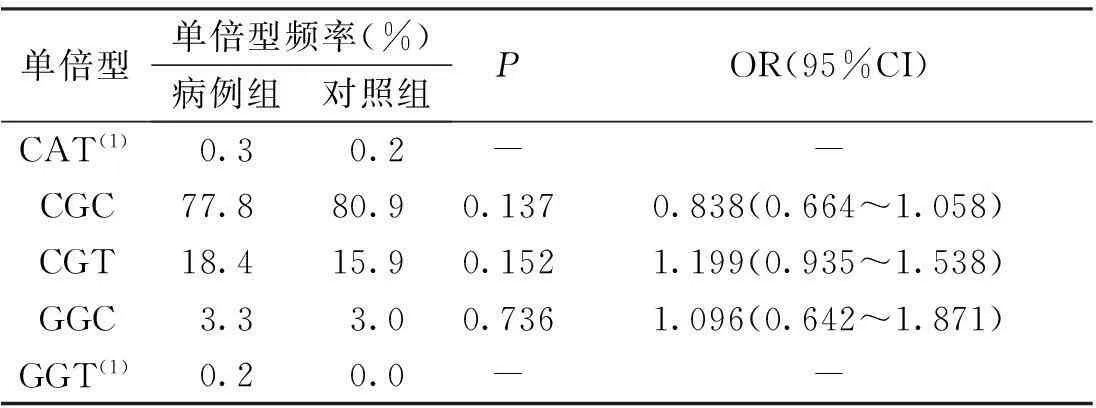
表5 病例组和对照组CD6基因3个
(1)SHEsis软件程序忽略分析频率<0.03的单倍型,不作统计分析
3讨论
感染HCV是引起丙型肝炎发生的主要因素之一。HCV感染的主要方式有输血传播、静脉吸毒传播、性传播和母婴传播。近年来,新发感染与静脉吸毒和不洁注射有关。在云南,静脉用药人群中的77.7%可以检测到抗-HCV抗体[12]。因此本研究选取云南汉族人群研究对象。
CD6是富含半胱氨酸结构域的SRCR超家族的成员,参与T细胞的活化和增殖、调节细胞间磷蛋白的表达和前炎性细胞活素的产生[13-14]。CD6刺激在维持T细胞活化过程中起重要作用,因阻断与其配体ALCAM的相互作用而导致T细胞增殖的减少[15]。而且,由于CD6与中央超分子活化簇(central supramolecular activation cluster,cSMAC)区域的结合,会使CD6参与到免疫突触的突变[16]。有研究表明,CD6基因多态性可能影响CD6的表达和功能,从而改变免疫应答水平而引起疾病的发生。De Jager等[17]发现,CD6基因多态性与多发性硬化症(Multiple sclerosis,MS)有关。其中,CD6基因中的SNP-rs12360861 (G>A)位于第2富含半胱氨酸结构域的SRCR第5外显子,编码CD6与其配体ALCAM的结合位点;同时也处于叫做外显子剪接增强子(exonic splicing enhancer,ESE)的顺式作用元件中[18],通过无义突变、错义突变或同义突变,ESE被破坏而影响mRNA的正确的持续合成能力[19]。因此,有学者提出假设认为G取代A会导致ESE被破坏,ALCAM与CD6配体受体结合减少,可能引起限制自体反应的T淋巴细胞通过血脑屏障的转移,这样对发生MS起保护作用[20]。Baratte等[21]的研究也表明第5 外显子的选择性剪接作用对调节T细胞的活化起到重要作用。Wagner等[20]对波兰人群的研究发现,携带AA基因型的个体患MS的的风险比携带GG基因型的低3倍。CD6基因的另一个SNP-rs11230563 (C>T)位点位于第2富含半胱氨酸结构域的SRCR的第4 外显子。Swaminathan等[8]对西班牙人群的研究发现,SRCR区域的非同义突变SNP-rs11230563可能引起CD6表达水平的改变以及与其配体结合能力或者信号传导的改变;运用流式细胞荧光分析技术对MS患者的淋巴细胞进行实验,所得结果发现初始的CD4+和CD8+T细胞比效应性和中心性记忆T细胞更容易受CD6单倍型的影响。CD6在胸腺细胞中的高表达并且认为有助于阳性选择和抵抗细胞凋亡[22]。 SNP-rs17824933 (C>G)位于CD6基因第1内含子。Swaminathan等[23]研究表明SNP-rs17824933 (C>G)位点的G等位基因可能是罹患MS的危险因素。Kofler等[24]首次做了与疾病相关的CD6基因SNP 位点rs17824933与T细胞功能关系的研究,研究结果表明在CD6基因上的MS的风险等位基因与CD4+T细胞的异常增殖相关,并且证明了与疾病相关的等位基因在免疫学特性上的影响。rs12360861第1036位碱基G>A,引起第271个氨基酸由非极性脂肪族氨基酸突变为极性中性氨基酸,rs11230563第898位碱基C>T,引起第225个氨基酸由碱性氨基酸突变为芳香族氨基酸,均为错义突变;rs17824933是在CD6基因非编码区的第1内含子中发生了碱基的颠换。
本研究选取云南省汉族人群,研究CD6基因内含子区域SNP-rs17824933 (C>G)和编码区域SNP-rs12360861 (G>A)、SNP-rs11230563 (C>T)3个位点与HCV慢性感染的关系,这些SNP与HCV慢性感染的无直接关联。参照Ensembl网站SNP位点的基因频率,在亚洲人群中rs17824933(C>G)等位基因G的基因频率约为3%,而在欧洲人群中G的基因频率高达23%;rs12360861(G>A)等位基因A在亚洲人群中频率极低约为0.1%,本研究为0.3%,与此对比在欧洲人群中A的基因频率为19%;rs11230563(C>T)的等位基因T在亚洲人群中的基因频率约为17%,而在欧洲人群中该基因频率为36%,但并未找到关于这3个SNP位点在亚洲、欧洲正常人群中和HCV感染者之间的关系研究。本研究未观察到基于基因频率的关联性,需要在以后的研究中进一步开展病例分层分析,同时增加其他多态位点的检测。
4参考文献
[1] Zhang C, Wu N, Liu J. HCV subtype characterization among injection drug users: implication for a crucial role of Zhenjiang in HCV transmission in China [J]. PLoS One, 2011(6): e16817.
[2] Sebastiani G, Gkouvatsos K, Pantopoulos K. Chronic hepatitis C and liver fibrosis [J]. World J Gastroenterol, 2014(20): 11033-11053.
[3] Zuniga J, Romero V, Azocar J. Protective KIR-HLA interactions for HCV infection in intravenous drug users [J]. Mol Immunol, 2009(46): 2723-2727.
[4] Knapp S, Warshow U, Hegazy D. Consistent beneficial effects of killer cell immunoglobulin-like receptor 2DL3 and group 1 human leukocyte antigen-C following exposure to hepatitis C virus [J]. Hepatology, 2010(51): 1168-1175.
[5] 戎霞, 黄杰庭, 熊华平. 广州献血人群HLA多态性与慢性HCV感染的关联研究 [J]. 中国输血杂志, 2014(27):1116-1119.
[6] 刘铮, 康轶青, 张丽. 河南人群病毒性丙型肝炎与HLA多态性的关联研究 [J]. 免疫学杂志, 2015(31):790-794.
[7] Bodian DL, Skonier JE, Bowen MA. Identification of residues in CD6 which are critical for ligand binding [J]. Biochemistry, 1997(36): 2637-2641.
[8] Swaminathan B, Cuapio A, Alloza I. Fine mapping and functional analysis of the multiple sclerosis risk gene CD6 [J]. PLoS One, 2013(8): e62376.
[9] 陈红松, 窦晓光, 段钟平. 丙型肝炎防治指南(2015年更新版) [J]. 临床肝胆病杂志, 2015(31):1961-1979.
[10]Shi YY, He L, SHEsis.a powerful software platform for analyses of linkage disequilibrium, haplotype construction, and genetic association at polymorphism loci [J]. Cell Res, 2005(15): 97-98.
[11]Li Z, Zhang Z, He Z. A partition-ligation-combination-subdivision EM algorithm for haplotype inference with multiallelic markers: update of the SHEsis (http://analysis.bio-x.cn) [J]. Cell Res, 2009(19): 519-523.
[12]Zhou YH, Yao ZH, Liu FL. High prevalence of HIV, HCV, HBV and co-infection and associated risk factors among injecting drug users in Yunnan province, China [J]. PLoS One, 2012(7): e42937.
[13]Hassan NJ, Barclay AN, Brown MH. Frontline: Optimal T cell activation requires the engagement of CD6 and CD166 [J]. Eur J Immunol, 2004(34): 930-940.
[14]Oliveira MI, Goncalves CM, Pinto M. CD6 attenuates early and late signaling events, setting thresholds for T-cell activation [J]. Eur J Immunol, 2012(42): 195-205.
[15]Zimmerman AW, Joosten B, Torensma R. Long-term engagement of CD6 and ALCAM is essential for T-cell proliferation induced by dendritic cells [J]. Blood, 2006(107): 3212-3220.
[16]Castro MA, Oliveira MI, Nunes RJ. Extracellular isoforms of CD6 generated by alternative splicing regulate targeting of CD6 to the immunological synapse [J]. J Immunol, 2007(178): 4351-4361.
[17]De Jager PL, Jia X, Wang J. Meta-analysis of genome scans and replication identify CD6, IRF8 and TNFRSF1A as new multiple sclerosis susceptibility loci [J]. Nat Genet, 2009(41): 776-782.
[18]Desmet FO, Hamroun D, Lalande M. Human Splicing Finder: an online bioinformatics tool to predict splicing signals [J]. Nucleic Acids Res, 2009(37): e67.
[19]Baralle D, Baralle M. Splicing in action: assessing disease causing sequence changes [J]. J Med Genet, 2005(42): 737-748.
[20]Wagner M, Bilinska M, Pokryszko-Dragan A. ALCAM and CD6-multiple sclerosis risk factors [J]. J Neuroimmunol, 2014(276): 98-103.
[21]da Gloria VG, Martins de Araujo M, Mafalda Santos A. T cell activation regulates CD6 alternative splicing by transcription dynamics and SRSF1 [J]. J Immunol, 2014(193): 391-399.
[22]Singer NG, Fox DA, Haqqi TM. CD6: expression during development, apoptosis and selection of human and mouse thymocytes [J]. Int Immunol, 2002(14): 585-597.
[23]Swaminathan B, Matesanz F, Cavanillas ML. Validation of the CD6 and TNFRSF1A loci as risk factors for multiple sclerosis in Spain [J]. J Neuroimmunol, 2010(223): 100-103.
[24]Kofler DM, Severson CA, Mousissian N. The CD6 multiple sclerosis susceptibility allele is associated with alterations in CD4+ T cell proliferation [J]. J Immunol, 2011(187): 3286-3291.
(2016-01-06收稿,2016-03-25修回)
中文编辑: 吴昌学; 英文编辑: 赵毅
The Association between CD6 Polymorphisms and Chronic HCV Infection of Han Population in Yunnan Province
LIU Chengxiu1,2, SHEN Yunsong3, LI Taoyi1,2, ZHANG Yu1,2, TAN Linping1,2,YAO Yueting1,2, YU Jiankun1,2, YAO Yufeng1,2, SHI Li1,2
(1.InstituteofMedicalBiology,ChineseAcademyofMedicalSciences&PekingUnionMedicalCollege,Kunming650118,>Yunnan,China; 2.YunnanKeyLaboratoryofVaccineResearch&DevelopmentonSevereInfectiousDisease,Kunming650118,Yunnan,China; 3.TheFirstPeople'sHospitalinYunnanProvince&theAffiliatedHospitalofKunmingScienceandTechnologyUniversity,Kunming650032,Yunnan,China)
[Abstract]Objective: To investigate the association between CD6 gene polymorphism and chronic HCV chronic infection of Han population in Yunnan province. Methods: 434 HCV chronic infectious patients and 444 healthy individuals of Han Chinese population in Yunnan province were recruited for this study. Three single nucleotide polymorphisms (SNPs) of SNP-rs17824933, SNP-rs12360861 and SNP-rs11230563 of CD6 gene were determined by real-time TaqMan polymerase chain reaction and the haplotypes were constructed. Then evaluating the association correlation of these SNPs and haplotypes with HCV chronic infection. Results: The comparison of frequencies of allele and genotype of both groups of SNP-rs17824933 (C>G) , SNP-rs12360861 (G>A) and SNP-rs11230563 (C>T) showed that differences were not statistically significant (P>0.05). The frequency of haplotypes constructed by SNP-rs17824933 (C>G), SNP-rs12360861 (G>A) and SNP-rs11230563 (C>T) showed no significant difference (P>0.05). Conclusion: SNP-rs17824933 (C>G), SNP-rs12360861 (G>A) and SNP-rs11230563 (C>T) in the CD6 were not associated with HCV chronic infection in the Han population in Yunnan province.
[Key words]hepatitis C,chronic; polymorphism,single nucleotide; gene,CD6; Yunnan
*[基金项目]国家自然科学基金(81160197); 吴阶平医学基金(320.6750.13395)
[中图分类号]R512.6
[文献标识码]A
[文章编号]1000-2707(2016)05-0527-05
DOI:10.19367/j.cnki.1000-2707.2016.05.008
**通信作者 E-mail:shili.imb@gmail.com
网络出版时间:2016-05-13网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160513.2015.006.html
