干扰素诱导蛋白204抑制大鼠血管外膜成纤维细胞增殖*
2016-06-17龙向淑田茂波
龙向淑, 黄 晶, 吴 强**, 田茂波, 宋 方, 肖 燕
(1.贵州医科大学附属人民医院 心内科, 贵州 贵阳 550002; 2.贵州医科大学 内科学教研室, 贵州 贵阳 550004)
·专题研究·
干扰素诱导蛋白204抑制大鼠血管外膜成纤维细胞增殖*
龙向淑1, 黄晶1, 吴强1**, 田茂波1, 宋方1, 肖燕2
(1.贵州医科大学附属人民医院 心内科, 贵州 贵阳550002; 2.贵州医科大学 内科学教研室, 贵州 贵阳550004)
[摘要]目的: 探讨干扰素诱导蛋白204(p204)对大鼠血管外膜成纤维细胞(VAFs)增殖的影响及可能机制。方法: 将大鼠VAFs分为空白对照组(N组)、非特异性小干扰RNA(siRNA)转染组(control组)、IFN-α干预组(IFN-α组)及Ifi204 siRNA转染组(Ifi204 siRNA组),给予相应处理;应用Real Time qRT-PCR法检测p204 mRNA表达, MTT比色法测定细胞活力,流式细胞仪分析细胞周期, Western blot 检测p204、Ras蛋白表达及Raf与Erk磷酸化水平。结果: 与N组比较,IFN-α组p204 mRNA和蛋白表达上调(P<0.05),细胞活力下降,细胞周期G1/S转换下调(P<0.05),伴Ras蛋白表达减少,Raf及Erk磷酸化水平下降(P<0.05);Ifi204 siRNA组p204 mRNA及蛋白表达下调(P<0.05),细胞活力增高,G0/G1期细胞减少,S期细胞增多(P<0.05),Ras蛋白表达增多,Raf及Erk磷酸化水平升高(P<0.05);而control组上述指标与N组相比,差异无统计学意义(P>0.05)。结论: p204表达可抑制大鼠VAFs增殖,Ras信号通路可能参与p204对VAFs增殖的调控。
[关键词]干扰素诱导蛋白204; 成纤维细胞; 增殖; Ras信号通路; 大鼠,Sprague-Dawley
血管外膜成纤维细胞(vascular adventitial fibroblasts, VAFs)是血管外膜最主要的细胞成分。既往认为,在物理损伤、炎症反应及化学刺激等因素诱发的血管重塑过程中,VAFs仅对血管壁起着营养和支持作用;近期研究显示,当血管内膜损伤病变发生时,VAFs首先被激活,活化的VAFs增殖、迁移和合成细胞外基质的能力增强,同时分泌细胞因子、生长因子等促进血管平滑肌细胞(vascular smooth muscle cells, VSMCs)和血管内皮细胞(vascular endothelial cells,VECs)增殖,共同参与动脉粥样硬化、冠状动脉成形术后再狭窄及高血压等血管重塑性疾病(vascular remodeling disease,VRD)的发生、发展[1-4]。干扰素(interferon,IFN)诱导蛋白204(interferon inducible protein 204,p204)是IFN诱导蛋白200(interferon inducible protein 200,p200)家族的鼠类蛋白成员。p204或其同源蛋白IFN诱导蛋白16(interferon inducible protein 16, IFI16)对血管壁细胞生物学功能影响的前期研究显示p204和IFI16分别表达于大鼠和人VAFs并通过影响P53/P21表达而抑制VAFs增殖和迁移[5-7];p204在大鼠VSMCs表达并可能通过抑制Ras信号通路激活而影响VSMCs增殖,但Ras信号通路是否参与p204对大鼠VAFs增殖的调控尚未明了。本研究旨在探讨p204对大鼠VAFs增殖及Ras信号通路的影响,为临床防治VRD提供新思路。
1材料和方法
1.1材料
清洁级6周龄SD大鼠(雌性1只,雄性1只),体质量100~120 g,购自第三军医大学实验动物中心。IFN-α购自北京三元基因工程有限公司。DMEM高糖型细胞培养液和胎牛血清(fetal bovine serum,FBS)购自Hyclone公司。即用型细胞免疫组化试剂盒和显色试剂盒购自武汉博士德公司。非特异性小干扰RNA(small interferon RNA,siRNA)和p204抗体购自Santa Cruz公司;p204基因(Ifi204 )siRNA由宝生物工程(大连)有限公司合成,其序列为:F 5′-AGG CAA CCA AAG UUA GUG UTG-3′,R5′-ACA CUA ACA UUG GUU GCC UAG-3′。LipofectamineTM 2000 Reagent 购自Invitrogen公司。四甲基偶氮唑盐[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide, MTT]购自Sigma公司。细胞周期检测试剂盒和Tubulin抗体购自碧云天公司。TRNzol 总RNA提取试剂购自北京天根公司;RT-PCR两步法试剂盒购自TaKaRa公司。PCR扩增引物由宝生物工程有限公司合成(大连)。Vimentin、Ras、磷酸化Raf(p-Raf)及磷酸化细胞外信号调节激酶44/42(p-Erk 44/42)抗体购自Abcam公司。
1.2方法
1.2.1VAFs培养及实验分组采用组织块贴壁法培养SD大鼠原代主动脉VAFs,经传代反复采用差速贴壁法去除VSMCs而纯化VAFs。采用Vimentin抗体按细胞免疫组化试剂盒说明书操作鉴定VAFs。取第3~5代细胞用于实验。实验分4组:空白对照组(N组)、非特异性siRNA转染组(Control组)、Ifi204 siRNA转染组(Ifi204 siRNA组)和IFN-α干预组(IFN-α组)。调整细胞浓度为2×105个/孔接种于6孔板中,每组设3个复孔。Control组与Ifi204 siRNA组按脂质体转染试剂说明书操作分别同步转染非特异性siRNA及Ifi204 siRNA干预6 h,IFN-α组用终浓度为2×106U /L的IFN-α干预6 h,N组予按时更换培养液,培养至48 h收集细胞。
1.2.2p204 mRNA的检测Real Time qRT-PCR检测p204 mRNA表达。收集各组细胞,按TRzol总RNA提取试剂盒说明提取总RNA,取总RNA 1 μg 按反转录试剂盒说明书操作反转录合成cDNA,取cDNA产物3 μL进行PCR循环,以β-actin作为内参对照,采用2﹣ΔΔCt法计算p204 mRNA相对含量。引物序列及扩增长度,p204F 5′-TCA TGG TCC CAA ACA AGT GA-3′,R 5′-ACC CAT TGC ACC CAA AAT AA-3′,扩增长度200 bp;β-actin F 5′-TGG CAC CAC ACC TTC TAC AAT G-3′,R 5′-TCA TCT TCT CGC GGT TGG C-3′,扩增长度103 bp。PCR扩增条件:预变性95 ℃ 30 s,变性95 ℃ 5 s,60 ℃ 34 s延长,扩增40个循环。
1.2.3p204、Ras蛋白表达及Raf与Erk磷酸化水平的检测Western blot 检测p204和Ras蛋白表达及Raf与Erk磷酸化水平。用细胞裂解液裂解各组细胞提取总蛋白,BCA法定量蛋白并按每组样品60 μg/孔上样,用10% SDS-PAGE分离,电转至PVDF膜,用5%脱脂奶粉封闭2 h,去除封闭液,加入1∶500稀释的一抗, 4 ℃孵育过夜;TBST洗膜3次,加入按1∶5 000稀释的二抗(辣根过氧化物酶标记),摇床孵育2 h(常温),收集二抗,TBST摇床漂洗3次。取ECL化学发光试剂覆盖PVDF膜,X光胶片曝光、显影及定影后扫描,用图像软件根据信号强弱对条带进行灰度分析。
1.2.4VAFs细胞活力检测MTT比色法测定细胞活力。收集对数增殖期细胞,按细胞数3×103个/孔接种于96孔板,按上述分组进行相应干预,每组设3个复孔。采用平板离心机离心沉淀细胞后吸尽上清液,每孔加入150 μL 二甲基亚砜,置旋转摇床上低速振荡10 min,酶联免疫仪490 nm波长检测各孔吸光度A值。
1.2.5VAFs细胞周期检测按细胞周期检测试剂盒说明书操作检测细胞周期。首先消化细胞,离心,1 000 r/min,5 min,弃旧的培养基,加入冰浴预冷的PBS 1 mL,重悬,再次离心;再加入冰上预冷的70 %乙醇1 mL,重悬并混匀,4 ℃固定24 h,离心,1 000 r/min,5 min,加入冰浴预冷的PBS 1 mL,重悬并离心;每个实验组的样品中加入500 μL碘化丙啶染色液,重悬并混匀,在37 ℃的水浴箱中,避光水浴30 min;然后用200钼过滤网过滤各组细胞;用流式细胞仪进行VAFs细胞周期的检测。
1.3统计学方法
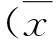
2结果
2.1p204 mRNA和蛋白表达
与N组比较,IFN-α组p204 mRNA和蛋白表达增多,Ifi204 siRNA组p204 mRNA和蛋白表达减少(P<0.05);而Control组与N组之间p204 mRNA和蛋白表达的差异无统计学意义,表1。
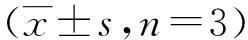
表1 各组VAFs p204 mRNA和
(1)与N组比较,P<0.05
2.2VAFs活力及细胞周期
与N组比较,IFN-α组的MTT吸光度A值降低(P<0.05),G0/G1期细胞增多,S期细胞减少(P<0.05);Ifi204 siRNA组MTT吸光度A值增高(P<0.05),G0/G1期细胞减少,S期细胞增多(P<0.05);Control组MTT吸光度A值、G0/G1期细胞及S期细胞与 N组之间的差异无统计学意义,见表2。
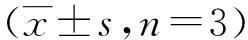
表2 各组大鼠VAFs增殖情况
(1)与N组比较,P<0.05
2.3Ras蛋白表达和Raf及Erk磷酸化水平
与N组比较,IFN-α组Ras蛋白表达减少,Raf及Erk磷酸化水平降低(P<0.05);Ifi204 siRNA组Ras蛋白表达增多,Raf及Erk磷酸化水平升高;而Control组上述指标与N组之间的差异无统计学意义,见图1。
3讨论
各种理化因素及炎症因子导致血管损伤后,血管外膜作为血管壁的第一“感知者”对损伤信号最先发生反应[9]。相对于分泌因子较少的VSMCs,VAFs通过分泌大量的因子或蛋白如转化生长因子β1(transforming growth factor β1,TGF-β1)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)及细胞粘附分子(cell adhesion molecule,CAM)等来调节血管炎症反应。因此, 现在越来越多的研究集中在外膜对于VRD如动脉粥样硬化、冠状动脉成形术后再狭窄及高血压等的作用, 而VAFs作为外膜最主要的细胞成分在其中起着非常重要的作用。
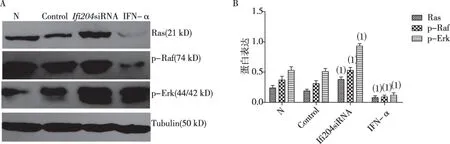
(1)与N组比较,P<0.05图1 Ras蛋白表达及Raf和Erk磷酸化水平(Western blot)Fig.1 Ras proteins and the phosphorylation levels of Raf and Erk
p204是p200家族的鼠类蛋白成员。所有p200家族蛋白在羧基端均含有一个或两个部分重复及保守的与蛋白和(或)DNA的结合相关的HIN-200结构域,据此结构域部分氨基酸的差异分为A、B及C三型[10]。p204 HIN-200结构域含A和B两种类型,其A结构域中含有与视网膜母细胞瘤蛋白(retinoblastoma protein, pRb)结合的IXCXE和LXCXE两个序列,而B结构域中仅包含LXCXE一个序列[10]。p204蛋白氨基酸序列含有多种蛋白激酶潜在的磷酸化位点如cAMP依赖性激酶、蛋白激酶C、钙调蛋白依赖性激酶及丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)等[10-11]。基于其结构特点p204具有调节细胞增殖及分化等功能[12]。前期研究表明,p204在VAFs存在基础表达,且p204过表达可抑制VAF增殖、迁移并促进其凋亡,在p204表达上调的同时伴随p53/p21表达增多,提示p204对VAFs的上述效应可能与p204促进p53/p21表达相关[5-6]。本研究显示,IFN作用于VAFs可致p204 mRNA和蛋白表达增多,VAFs增殖活性下降;针对p204基因保守序列设计的siRNA转染VAFs后,p204 mRNA和蛋白表达减少,VAFs增殖活性升高,提示VAFs p204表达可能存在IFN诱导性,p204 siRNA可分别在转录和翻译水平有效沉默p204表达,p204具有抑制VAFs增殖的作用。然而,p204除通过影响p53/p21表达调控VAFs增殖外,是否还有其它机制参与尚属未知。
Ras蛋白是分子量约为21 kD的单体GTP酶,参与典型的G蛋白激活与失活循环。Ras蛋白能被不同上游信号激活而调控多种信号通路,其中Ras/Raf/MEK/Erk是众多信号通路中具有调节细胞增殖、分化及细胞间功能同步等作用的通路之一。激活型Ras使下游信号蛋白逐级磷酸化而激活,最终活化Erk,活化的Erk转至细胞核激活不同转录因子而产生相应的生物学效应。血管损伤后,包括Ras在内的一些原癌基因表达增多,促进血管壁主要实质细胞VAFs、VSMCs及VECs增殖而导致血管重构。因此,研究如何中断Ras等介导的信号传递过程对VRD的防治具有重要意义。本研究结果显示,IFN可诱导p204表达增多,伴随Ras蛋白表达减少,其下游信号蛋白Raf、Erk磷酸化水平下降;反之,p204 基因siRNA沉默p204表达后,Ras蛋白表达增多,其下游信号蛋白Raf和Erk磷酸化水平随之升高,提示Ras信号通路参与了p204 对VAFs增殖的调控,p204可能具有抑制Ras信号通路激活的作用。
综上所述,p204表达可抑制大鼠VAFs增殖,Ras/Raf/MEK/Erk信号通路可能参与了p204对VAFs增殖的调控。
4参考文献
[1] Chiang HY, Korshunov VA, Serour A, et al. Fibronectin is an important regulator of flow-induced vascular remodeling[J]. Arterioscler Thromb Vasc Biol, 2009(7) :1074-1079.
[2] Yuan WD, Yang DX, Sun XH, et al. Effects of hydroxysafflor yellow A on proliferation and collagen synthesis of rat vascular adventitial fibroblasts induced by angiotensin II[J]. Int J Clin Exp Pathol, 2014(9):5772-5781.
[3] Wang F, Zhao XQ, Liu JN, et al. Antagonist of microRNA-21 improves balloon injury-induced rat iliac artery remodeling by regulating proliferation and apoptosis of adventitial fi broblasts and myofi broblasts[J]. J Cell Biochem, 2012(9):2989-3001.
[4] Coen M, Gabbiani G, Bochaton-Piallat ML. Myofibroblast-mediated adventitial remodeling: an underestimated player in arterial pathology[J]. Arterioscler Thromb Vasc Biol, 2011(11):2391-2396.
[5] 田茂波, 吴强,宋方, 等. Ifi204基因表达对大鼠血管外膜成纤维细胞凋亡和迁移的影响[J].基础医学与临床, 2015(5): 603-609.
[6] 宋方,田茂波, 肖燕, 等. 干扰素诱导蛋白p204 过表达抑制大鼠主动脉血管外膜成纤维细胞凋亡、增殖与迁移[J]. 中国循环杂志, 2015(11):1110-1114.
[7] 黄晶, 宋方, 龙向淑, 等. 干扰素诱导蛋白16对人脑血管外膜成纤维细胞增殖与迁移的影响及其机制 [J]. 中国病理生理杂志, 2013(4):584-589.
[8] 龙向淑, 吴强, 宋方. 干扰素诱导蛋白P204对大鼠血管平滑肌细胞增殖的影响及其机制[J]. 中国病理生理杂志, 2012(6): 1018-1022.
[9] Stenmark KR, Yeager ME, El Kasmi KC, et al. The adventitia: essential regulator of vascular wall structure and function[J]. Annu Rev Physiol, 2013(9):23-47.
[10]Zhao H, Elena Gonzalezgugel E, Cheng L, et al. The roles of interferon-inducible p200 family members IFI16 and p204 in innate immune responses, cell differentiation and proliferation[J]. Genes Dis, 2015(1): 46-56.
[11]Pinna LA, Ruzzene M. How do protein kinases recognize their substrate[J]. Biochim Biophys Acta, 1996(3):191-225.
[12]Peter L and Liu CJ. The P200 family protein P204 as a modulator of cell proliferation and differentiation: a brief survey[J]. Cell Mol Life Sci, 2010(3): 335-340.
(2016-02-15收稿,2016-04-27修回)
中文编辑: 周凌; 英文编辑: 刘华
Interferon-α Inducible Protein 204 Inhibition of Proliferation of Vascular Adventitial Fibroblasts in Rats
LONG Xiangshu1, HUANG Jing1,WU Qiang1, TIAN Maobo1, SONG Fang1, XIAO Yan2
(1.DepartmentofCardiology,GuizhouProvincePeople'sHospitalAffiliatedtoGuizhouMedcialUniversity,Guiyang550002,Guizhou,China; 2.DepartmentofInternalMedicine,GuizhouMedcialUniversity,Guiyang550004,Guizhou,China)
[Abstract]Objective: To explore the effect of interferon inducible protein204(p204) expression on rats' vascular adventitial fibroblasts(VAF) proliferation and possible mechanism. Methods: The cultured VAFs were divided into four groups: blank comparison group(N group), nonspecific siRNA transfection group(Control group), IFN-α intervention group(IFN-α group, treated with transfection of IFN-α) and Ifi204 siRNA transfection group(Ifi204 siRNA group, treated with transfection of p204 gene(Ifi204) siRNA ). Expression of p204 mRNA was monitored by real time fluorescence quantitative reverse transcription polymerase chain reaction(Real Time qRT-PCR). Cell vitality was detected by 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide(MTT) method. Cell cycle was analyzed by flow cytometry. Proteins of 204 and Ras and the phosphorylation levels of Raf and Erk were examined by Western blot. Results: Compared with N group, in IFN-α intervention group, the expression of p204 mRNA and protein up-regulated(P<0.05), the cell vitality and the cell cycle of G1/S transition down-regulated(P<0.05), the expression of Ras protein and the phosphorylation levels of Raf and Erk decreased(P<0.05); Compared with N group, in Ifi204 siRNA transfection group, the expression of p204 mRNA and protein down-regulated(P<0.05), the cell vitality increased, cells of G0/G1 stage decreased and S stage increased(P<0.05), the expression of Ras protein and the phosphorylation levels of Raf and Erk increased(P<0.05); There were no statistically significant differences in above-mentioned indicators between Control group and N group(P>0.05). Conclusion: The expression of p204 can inhibit the proliferation of VAFs in rat, and Ras signaling pathway may participate in regulation of p204 on proliferation of VAFs.
[Key words]interferon inducible protein 204; fibroblasts; proliferation; Ras signaling pathway; rats,Sprague-Dawley
*[基金项目]国家自然科学基金资助项目(81260030); 贵州省科技攻关项目[黔科合LH 字(2014)7023号]
[中图分类号]R363
[文献标识码]A
[文章编号]1000-2707(2016)05-0502-05
DOI:10.19367/j.cnki.1000-2707.2016.05.002
**通信作者 E-mail:gzgywq@126.com
网络出版时间:2016-05-13网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160513.2102.030.html
