猪肌肉组织中碱性磷酸酶的纯化及特性研究
2016-06-17李红卫王开萍唐正江刘国庆
李红卫,王开萍,吴 娱,唐正江,汤 飞,刘国庆,2
(1.合肥工业大学 生物与食品工程学院,安徽 合肥 230009;2.安徽省皖江禽产业研究院,安徽 宣城 242000)
猪肌肉组织中碱性磷酸酶的纯化及特性研究
李红卫1,王开萍1,吴娱1,唐正江1,汤飞1,刘国庆1,2
(1.合肥工业大学 生物与食品工程学院,安徽 合肥230009;2.安徽省皖江禽产业研究院,安徽 宣城242000)
摘要:猪肌肉组织中碱性磷酸酶经预冷的正丁醇提取、硫酸铵分级沉淀、DEAE-52纤维素离子交换柱层析、Sephacryl S-200凝胶过滤层析得到碱性磷酸酶。纯化倍数为57.34,比活力为28.77 U/mg。通过SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)分析可得该酶的分子质量为66 kDa。该酶催化底物对硝基苯磷酸二钠(p-NPP)的最适pH值为9.7,最适温度为30℃,Mg2+和Ca2+对其有激活作用,Zn2+和EDTA对其有抑制作用。
关键词:猪肌肉组织;碱性磷酸酶;分离纯化
碱性磷酸酶(AKP)是一种同源二聚体的糖蛋白,该酶属于磷酸酶,在碱性条件下(最适pH值为10左右)能够通过水解磷酸单酯将底物分子上的磷酸基团除去,产生无机磷酸和对应的醇、酚或糖。AKP不仅参与钙磷代谢,维持体内适宜的钙磷比例,而且还与蛋白的分泌与合成相关,在生物体的物质代谢中具有重要作用[1-2]。近年来,很多研究者从不同动物组织中分离纯化出了碱性磷酸酶[3-5],并对其性质做了大量的研究。文献[6]从鸡肝中分离纯化了鸡肝碱性磷酸酶,以对硝基苯磷酸二钠(p-NPP)为底物,测得该酶的最适pH值为10.5,最适温度为40℃。甲醇、乙二醇与丙三醇均对其活性有不同程度的抑制作用。文献[7]从鸭肝中分离纯化出电泳纯的碱性磷酸酶,该酶纯化倍数达58.3倍,比活力为337.4 U/mg。经SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)和凝胶过滤测得该酶的亚基分子量为60.5 kDa;以磷酸苯二钠为底物,测得该酶的最适pH值为9.0,最适温度为40℃;Na+、K+、Li+等一价离子对该酶活性基本无影响,Mg2+、Mn2+对该酶活性有激活作用,Cd2+对该酶活性有抑制作用。文献[8]从牛小肠中分离纯化出牛小肠碱性磷酸酶,提纯倍数为50.69,比活力为48.87 U/mg;经SDS-PAGE呈现单一条带;该酶催化对硝基苯磷酸二钠(p-NPP)水解反应的最适pH值为9.7,pH值小于6.5大于11.5均不稳定;最适温度为45℃,高于50℃不稳定;利用SDS-PAGE测定酶亚基的分子量为66 kDa;Mg2+、Mn2+和Ca2+对酶有不同程度的激活作用,Zn2+和EDTA对酶有抑制作用。文献[9]分离纯化番鸭小肠中碱性磷酸酶,并对其酶促动力学性质进行研究,结果表明,该酶催化磷酸苯二钠水解反应时最适温度为45℃,最适pH值为9.7;Mg2+对碱性磷酸酶活性有明显激活作用;Cd2+质量浓度小于0.4 mg/L时对碱性磷酸酶有激活作用,而质量浓度高于0.4 mg/L时则有抑制作用;Cu2+对碱性磷酸酶活性有明显抑制作用。
不同来源的碱性磷酸酶提取方法和特性存在差异性,目前关于猪肉中碱性磷酸酶分离纯化的相关报道不多,本文旨在建立猪肌肉组织中碱性磷酸酶分离纯化方法,并进一步探讨该酶的相关特性。
1材料与方法
1.1材料与试剂
1.1.1材料
猪(Sus domesticus)肌肉组织采自安徽省春然食品有限公司屠宰基地(合肥)健康活猪猪背最长肌,采用无菌薄膜包装后置于0~4℃冷却贮藏。
1.1.2试剂
DEAE-纤维素(DEAE-52)和丙烯葡聚糖凝胶S-200(Sephacryl S-200)购于GE Healthcare公司;丙烯酰胺(电泳级)、甲叉双丙烯酰胺、三羟甲基氨基甲烷(Tris)、十二烷基硫酸钠(SDS)、四甲基乙二胺(TEMED)、过硫酸铵,购于sigma公司;牛血清白蛋白(BSA),购于上海江莱生物科技有限公司;对硝基苯磷酸二钠(p-NPP),购于天津亿鑫化工有限公司;正丁醇、氯仿、碳酸氢钠、碳酸钠、甘氨酸、HCl、EDTA、NaCl、NaOH、硫酸铵固体、BaCl2、考马斯亮蓝,均购自国药集团化学试剂有限公司;2×蛋白质电泳loading buffer,购于北京天根生物公司;蛋白质marker,购于TaKaRa(大连)公司。
1.2仪器与设备
AR1140型电子分析天平(德国Sartorius公司)、台式高速离心机(上海安亭科学仪器厂)、CR22G型高速冷冻离心机(日本日立公司)、721E型紫外可见分光光度计(上海光谱仪器有限公司)、HH-2孔数显水浴锅(江苏金坛市环宇科学仪器厂)、凝胶电泳仪(北京君意东方电泳设备有限公司)、层析柱(16 mm×600 mm)(上海精科实业有限公司)、PHSCAN10型pH计(METER公司)、ULT-487型超低温冰箱(美国Revco公司)、超声波清洗仪(江苏昆山市超声仪器有限公司)、BSZ-100电脑自动部分收集器(上海精科实业有限公司)、GmbH紫外凝胶成像系统(美国Biostep公司)。
1.3方法
1.3.1碱性磷酸酶的分离纯化
参考文献[10]的方法并加以修改。称取100 g猪肉用蒸馏水漂洗干净,清除结缔组织和脂肪后剪碎,与预冷的0.05 mol/L Tris-HCl 缓冲液(含0.02 mol/L NaCl,pH值为7.5)按每克猪肉加入3 mL缓冲液的比例混合,研磨均匀,置4℃冰箱中抽取1 h。将匀浆液离心(4℃,10 000 r/min,15 min),取上清,加入1/5体积预冷的正丁醇,4℃抽提过夜进行除脂。次日,离心(4℃,10 000 r/min,15 min),取其中清液加入硫酸铵固体至饱和度为0.35,4℃冰箱静置4 h后离心(4℃,10 000 r/min,20 min),取其中清液并加入固体硫酸铵至饱和度为0.65,4℃冰箱中静置4 h,然后离心,取固相。
将固相溶于0.05 mol/L Tris-HCl(pH值为 7.5,下同)缓冲液中,用蒸馏水透析脱盐至透析水,加入BaCl2无白色沉淀为止。将蛋白于4℃ 10 000 r/min离心20 min,取上清液测定蛋白浓度及酶活力。
透析后取样液5 mL过DEAE-52纤维素柱,用含0~1.0 mo1/L NaCl的Tris-HCl作梯度洗脱,流速为0.5 mL/min,每管收集5 mL,在280 nm分别测定各管的蛋白质浓度和AKP 酶活力。合并活力峰附近的几管后,透析,冷冻干燥浓缩。
取蛋白酶250 mg溶于5 mL的0.05 mol/L Tris-HCl 缓冲液中,过Sephacryl S-200凝胶过滤柱,以0.1 mol/L的NaCl溶液(含0.05 mol/mL Tris-HCl)为洗脱液,洗脱流速为0.3 mL/min,每管3 mL,分别测定各管蛋白质浓度和AKP酶活力,收集活力峰,透析,浓缩,得纯化样品。
1.3.2酶活力的测定
采用以p-NPP为底物的金氏法[11]测定其酶活力,并在该方法规定的条件下,定义每15 min生成1 μmol酚所需的酶量为1个酶活力单位(U)。
1.3.3蛋白质浓度的测定
采用Bradford法[12]测定蛋白质浓度,牛血清蛋白为标准样品。
1.3.4SDS-PAGE
采用聚丙烯酰胺凝胶电泳进行鉴定,分离胶体积分数为10%,浓缩胶体积分数为10%;考马斯亮蓝R-250染色。
1.3.5碱性磷酸酶特性研究
(1)最适pH值及其酸碱稳定性的测定。将3 mL不同pH值的0.05 mol/L Tris-HCl 缓冲液、0.1 mL的蛋白质酶液,在37℃预热5 min,加入缓冲液的复合基质液1.9 mL(1.8 mL 0.1 mol/L Na2CO3-NaHCO3(pH值为9.5)缓冲液中加入0.1 mL 20 mmol/L p-NPP,37℃预热10 min),置于37℃恒温10 min,接着加入1.0 mL碱性溶液终止反应,测定每管的酶活力。以pH值为横坐标,相对酶活为纵坐标绘制pH值-活性曲线,求出碱性磷酸酶的最适pH值。
将1.8 mL不同pH值的0.05 mol/L Tris-HCl 缓冲液、0.1 mL的蛋白质酶液,在37℃预热1 h,再加入0.1 mL 20 mmol/L p-NPP,混匀,置于37℃恒温10 min,接着加入1.0 mL碱性溶液终止反应,测定每管的酶活力。对照样则在加入p-NPP之前先加入1.0 mL碱性溶液。以pH值为横坐标,相对酶活为纵坐标绘制酸碱稳定曲线,并分析碱性磷酸酶的酸碱稳定范围。
(2)最适温度及其热稳定性的测定。参考上述方法。采用pH值为9.7的缓冲液,温度分别设定为10、20、25、30、35、40、45、50、55、60℃,保温10 min,测定酶活力。以反应温度为横坐标,相对酶活为纵坐标,绘制温度-活性曲线,并求出碱性磷酸酶的最适温度。
采用pH值为9.7的缓冲液,将3 mL缓冲液、0.1 mL的蛋白质酶液,0.1 mL 20 mmol/L p-NPP,热处理温度分别为0、10、20、25、30、35、40、45、50、55、60℃,热处理时间为30 min后,立即以流动水冷却并置于37℃恒温水浴锅中预热2 min,37℃预热的复合基质液各加1.9 mL,37℃精确反应10 min,各加1.0 mL碱性溶液终止反应,测定酶活。以处理温度为横坐标,相对酶活为纵坐标,绘制热稳定曲线,并分析碱性磷酸酶的热稳定范围。
1.3.6金属离子及EDTA对AKP酶活的影响
在酶最适温度与pH值下,在1.8 mL 0.1 mol/L碳酸盐缓冲液、0.1 mL蛋白质酶液中,分别加入0.2 mL 20 mmol/L MgCl2、ZnCl2、EDTA、CaCl2及0.2 mL蒸馏水,37℃预热5 min,再加入0.1 mL 37℃预热p-NPP,37℃精确反应10 min,各加1.0 mL碱性溶液终止反应,测酶活力,分析其对AKP酶活的影响。
2结果与分析
2.1AKP酶的纯化
将猪肉经过预冷正丁醇的处理、硫酸铵分级分离、离心、透析等步骤处理后的粗酶液,经DEAE-52纤维素离子交换柱层析得到多组分蛋白,过Sephacryl S-200凝胶柱层析得到多组分蛋白,分别留样测定蛋白浓度和活性。计算出总蛋白质量、总活力、比活力和纯化倍数,见表1所列。

表1 猪肌肉组织中AKP的分离纯化
2.2DEAE-52离子交换层析
将粗酶液溶解于0.05 mol/L的Tris-HCl的平衡缓冲液,经以0.05 mol/L的Tris-HCl的平衡缓冲液平衡过的DEAE-52离子交换层析柱(16 mm×600 mm),通过0~1 mol/L NaCl的Tris-HCl缓冲液梯度洗脱,结果如图1所示。
图1中管数以每管吸取0.5 mL计算,由图1可知,主要有2个活力峰,其中第1个峰主要在第15~17管区域,第2个峰在第29~31管区域。由于第2个峰在0.6 mol/L的NaCl缓冲液洗脱的梯度下于280 nm处,测得较高的光密度值,同时酶活力也明显高于第1个峰,故将第29~31管酶液收集于一管,经低温冷冻干燥浓缩后待用。

图1 AKP的DEAE-52离子交换层析图
2.3Sephacryl S-200凝胶过滤层析
经上述纯化的酶溶解于0.05 mol/L的Tris-HCl的平衡缓冲液,经该平衡缓冲液平衡过的Sephacryl S-200层析柱(16 mm×600 mm),通过0.1 mol/L NaCl的Tris-HCl缓冲液洗脱,结果如图2所示。图2中,管数以每管吸取0.4 mL计算。图2中出现了2个主要的活力峰,第1个在第14~16管区域,第2个在第34~36管区域,再比较2个活力峰区域的光密度值,第2个峰明显高于第1个峰,故收集第34~36管的酶液于一管中,低温冷冻干燥浓缩得到酶纯品。

图2 AKP的Sephadex S-200 凝胶过滤层析
2.4SDS-PAGE电泳图
取经Sephacryl S-200凝胶过滤纯化的酶,通过SDS-PAGE电泳得到的电泳如图3所示。
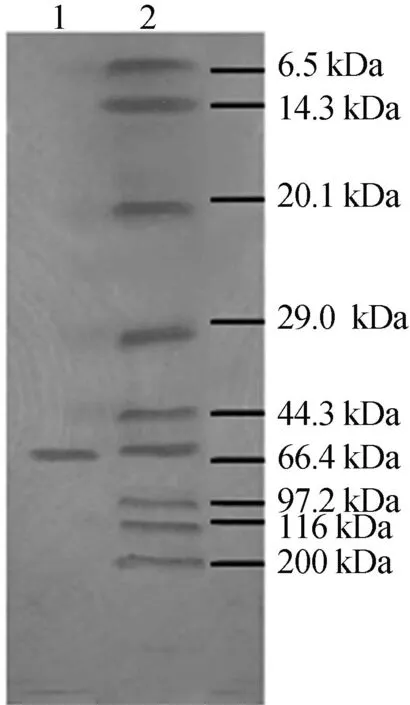
1.碱性扩增 2.蛋白质marker
图3中,第1列为纯化后的样品;第2列为蛋白质分子量标准,分别为:肌球蛋白(200 kDa)、β-半乳糖苷酶(116 kDa)、磷酸酶b(97.2 kDa)、牛血清蛋白(66.4 kDa)、卵清蛋白(44.3 kDa)、碳酸苷酶(29.0 kDa)、胰蛋白酶抑制剂(20.1 kDa)、溶菌酶(14.3 kDa)、抑肽酶(6.5 kDa)。从图3可以看出,纯化后的结果显现出单一区带,说明该酶已达到电泳纯,AKP的分子量大约为66 kDa。
2.5最适pH值测定及其酸碱稳定性
pH值对AKP活力的影响如图4所示,从图4可知,在pH值小于9.5的情况下,酶活力随pH值的增加而上升;在其大于10时,酶活力随pH值的增大而下降。酶在pH值为9.0~11.0时活力较高,在pH值为9.7时活力最高,所以最适pH值为 9.7。
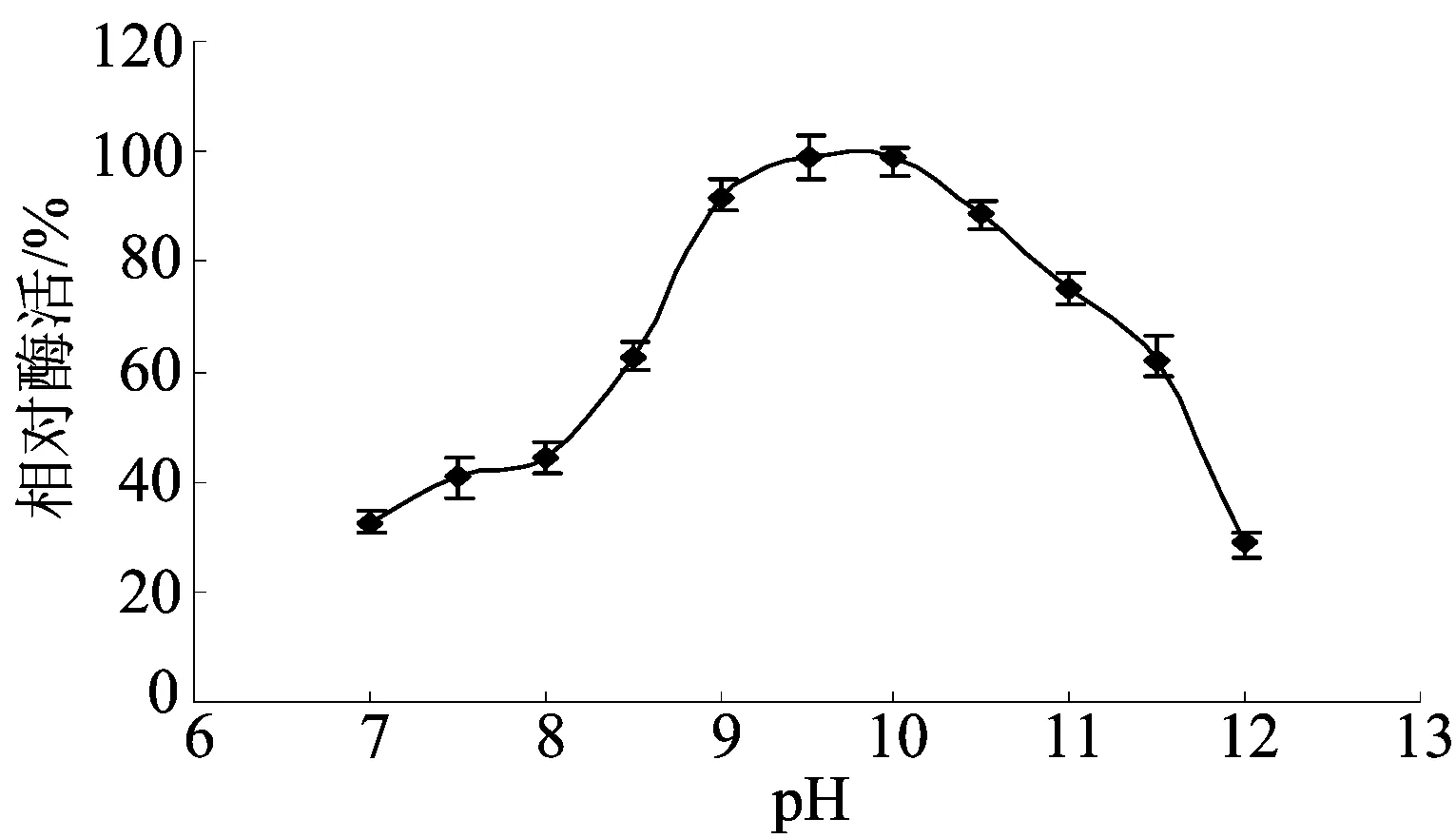
图4 pH值对AKP活力的影响
pH值对AKP稳定性的影响如图5所示。由图5可得,酶在pH值为7.0~10.5时酶活力变化不大,在该范围之外酶活力变化剧烈,说明在pH值为7.0~10.5时较稳定。

图5 pH值对AKP稳定性的影响
2.6最适温度及其热稳定性
温度对AKP活力的影响如图6所示。从图6可知,在温度高于30℃时,酶活力随温度的增大而下降;在低于30℃时,酶活力随温度的增大而上升。AKP在30℃时酶的活力最高,说明其最适温度为30℃。
温度对AKP稳定性的影响如图7所示,由图7可知,当温度高于40℃时,酶活力明显下降,说明酶高于40℃不稳定,易变性失活。

图6 温度对AKP活力的影响

图7 温度对AKP稳定性的影响
2.7金属离子及EDTA对AKP 酶活力的影响
Mg2+、Zn2+、Ca2+、EDTA 、H2O的相对酶活分别为120%、74%、135%、49%、100%,说明EDTA对AKP有较强的抑制作用,Mg2+和Ca2+对AKP有明显的激活作用,而Zn2+对AKP有抑制作用。
3讨论
本文通过正丁醇对样品的粗提、硫酸铵的分级分离得到粗蛋白酶,再经过离子交换层析、凝胶过滤等技术手段,从猪肌肉组织中纯化出碱性磷酸酶。
经SDS-PAGE电泳得到猪肌肉组织AKP分子量为66 kDa左右,与牛小肠的66 kDa、南方鲇[13]的66.2 kDa大致相同,而鸭肝AKP分子量为60.5 kDa,大凉疣螈[14]为48.41 kDa,大肠杆菌[15]为40 kDa,家蚕[16]约为55 kDa,从而证明了不同种属的AKP的大小不同。纯化倍数达57.34倍,与鸭肝的58.3倍、牛小肠的50.69倍大致相似,而比背角无齿蚌19倍[17]、白蜡虫16.8倍[18]、瘦肉型(PIC344)精液11.5倍[19]、大肠杆菌18.8倍[20]均有较大提高,说明该方法可有效纯化猪肌肉组织。
AKP的性质因动物物种的种属不同而不同,实验结果表明,猪肌肉组织中AKP的最适温度为30℃,而牛小肠中AKP和合浦珠母贝[20]的为45℃,鸡肝AKP的为40℃,差异较明显。猪肌肉组织AKP最适pH值为9.7,与合浦珠母贝和牛小肠相同、与背角无齿蚌pH值相近,与其他动物则有明显的差异,说明不同种类动物AKP的性质不同。
EDTA对碱性磷酸酶有较强的抑制作用,证明猪肉中碱性磷酸酶是一种金属酶[21],金属离子对维持其分子结构和催化活性均有重要作用,研究不同金属离子的影响,对于探讨AKP的作用机理,调节体内钙磷代谢等具有一定意义。Mg2+和Ca2+对AKP有明显的激活作用,此类离子应该为猪肌肉AKP的有益离子,而Zn2+对AKP有抑制作用,当浓度达到20 mmol/L时,酶活力就开始有所下降。因此,AKP作为一种重要的调节酶参与动物的生长发育,研究金属离子与该酶活力的关系,有利于选择合适的金属离子作为饲料添加剂,这样在保证动物产品食用安全的情况下,有利于提高经济效益,因而对于肉猪饲料的改进值得进一步研究。
[参考文献]
[1]Beedham G E.Observations on the mantle of the lamellibranchia[J].Quarterly Journal of Microscopical Science,1958,99(1):188-197.
[2]Kado Y.The distribution of alkaline phophatase in mantle tissue of bivalves[J].Journal of Science of Hiroshima University Series B,1954,15(1):183-188.
[3]Xiao Rui,Xie Liping,Lin Jingyu,et a1.Purification and enzymatic characterization of alkaline phosphatase from Pinctada fucata[J].Journal of Molecular Catalysis B:Enzymatic,2002,17(2):65-74.
[4]Wachsmuth E D,Hiwada K.Alkaline phosphatase from pig kidney:method of purification and molecular properties[J].Biochemical Journal,1974,141(1):273-282.
[5]Ahmed Z,King E J.Purification of placental alkaline phosphatase[J].Biochimica et Biophysica Acta,1960,40(1):320-328.
[6]赵赣,钱芳,孙永学,等.鸡肝碱性磷酸酶的分离纯化及其部分性质的研究[J].上海交通大学学报:农业科学版,2003,21(3):194-198.
[7]张丽丽,阙瑞琪,徐榕敏,等.鸭肝碱性磷酸酶的分离纯化及其部分性质研究[J].西南大学学报:自然科学版,2007,29(10):109-113.
[8]余同,张营,赵欣平,等.牛小肠碱性磷酸酶部分性质研究[J].四川大学学报:自然科学版,2009,46(6):1838-1844.
[9]刘建昌,余万凯,池雪林,等.番鸭小肠碱性磷酸酶的分离纯化及部分性质研究[J].福建农林大学学报:自然科学版,2010,39(2):164-167.
[10]McKenna M J,Hamilton T A,Sussman H H.Comparison of human alkaline phosphatases isoenzymes:structural evidence for three protein classes[J].Biochemical Journal,1979,181(1):67-73.
[11]上海市医学化验所.临床生化检验:上册[M].上海:上海科技出版社,1979:354-356.
[12]Bradford M M.A rapid sensitive method for the quantization of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1/2):248-254.
[13]陈定福.南方鲇碱性磷酸酶的分离纯化及部分性质的研究[J].生物化学杂志,1994,10(4):420-426.
[14]刘晓雯,刘克武,杨守忠,等.大凉疣螈碱性磷酸酶的分离纯化及部分性质[J].中国生物化学与分子生物学报,2001,17(1):135-138.
[15]徐卉芳,张先恩,张治平,等.大肠杆菌碱性磷酸酶的体外定向进化研究[J].生物化学与生物物理进展,2003,30(1):89-94.
[16]李长春,罗英,鲁成,等.家蚕碱性磷酸酶的分离纯化与部分性质[J].西南师范大学学报:自然科学版,2005,30(5):930-934.
[17]张洪渊,刘克武,石安静,等.背角无齿蚌碱性磷酸酶的分离纯化及其动力学研究[J].水生生物学报,1996,20(1):57-62.
[18]赵欣平,李擎,刘克武,等.白蜡虫碱性磷酸酶的分离纯化及部分性质研究[J].四川大学学报:自然科学版,2001,38(4):609-612.
[19]国锦琳,刘克武,岳碧松,等.瘦肉型猪(PIC344)精液碱性磷酸酶的分离纯化及部分性质研究[J].畜牧兽医学报,2004,35(1):37-41.
[20]林静瑜.合浦珠母贝碱性磷酸酶的分离纯化和性质研究[D].厦门:厦门大学,2001.
[21]廖金花,陈清西.金属离子对鲍鱼碱性磷酸酶活力的影响[J].厦门大学学报:自然科学学报,2004,43(Z1):12-15.
(责任编辑闫杏丽)
Purification and properties of alkaline phosphatase from pig muscle tissue
LI Hong-wei1,WANG Kai-ping1,WU Yu1, TANG Zheng-jiang1,TANG Fei1,LIU Guo-qing1,2
(1.School of Biotechnology and Food Engineering,Hefei University of Technology,Hefei 230009,China;2.Anhui Wan Jiang Poultry Industry Research Institute,Xuancheng 242000,China)
Abstract:Alkaline phosphatase(AKP)from pig muscle tissue was extracted by the cold n-butanol and precipitated with ammonium sulfate,ion-exchange chromatography was made with DEAE-52 cellulose column and gel filtration chromatography through Sephacryl S-200.The purification multiple was 57.34,and the specific activity was 28.77 U/mg.SDS-polyacrylamide gel electrophoresis(PAGE)result showed a single band with the relative molecular mass of 66 kDa.The optimum pH value for the enzyme to catalyze the hydrolysis of phenylphosphonic acid disodium salt(p-NPP)was 9.7 and the optimum temperature was 30℃.Mg2+and Ca2+could activate the enzyme while Zn2+and EDTA inhibit it.
Key words:pig muscle tissue;alkaline phosphatase(AKP);seperation and purification
收稿日期:2015-01-09;修回日期:2015-03-10
基金项目:安徽省科技攻关计划资助项目(1401032006)
作者简介:李红卫(1988-),男,安徽宿州人,合肥工业大学硕士生;刘国庆(1963-),男,安徽芜湖人,博士,合肥工业大学教授,硕士生导师.
Doi:10.3969/j.issn.1003-5060.2016.04.025
中图分类号:Q814.1
文献标识码:A
文章编号:1003-5060(2016)04-0560-06
