乳腺癌不同转移类型患者基质金属蛋白酶1表达情况研究
2016-06-16王增辉杨艳玲马振玲李宗富李润华
丁 梅,胡 芬,王增辉,杨艳玲,马振玲,李宗富,李润华
063000河北省唐山市协和医院普外一科(丁梅,王增辉,杨艳玲,马振玲,李宗富,李润华);华北理工大学生命科学学院(胡芬)
·论著·
乳腺癌不同转移类型患者基质金属蛋白酶1表达情况研究
丁 梅,胡 芬,王增辉,杨艳玲,马振玲,李宗富,李润华
063000河北省唐山市协和医院普外一科(丁梅,王增辉,杨艳玲,马振玲,李宗富,李润华);华北理工大学生命科学学院(胡芬)
【摘要】目的探讨乳腺癌不同转移类型患者基质金属蛋白酶1(MMP-1)表达情况。方法选取2012年3月—2015年3月唐山市协和医院普外一科收治的乳腺癌转移患者186例,根据首次诊断发生转移部位分为骨转移组(A组,90例)、肝转移组(B组,30例)、肺转移组(C组,40例)、软组织转移组(D组,26例)4组。采用免疫组织化学染色法,对各组手术时获得的癌组织标本进行MMP-1表达水平观察。结果A、B组患者MMP-1表达水平均高于C、D组,差异有统计学意义(P<0.05)。同一临床分期、病理类型、腋窝淋巴结转移数,4组患者间差异有统计学意义(P<0.05);同一组内,不同临床分期、腋窝淋巴结转移数患者MMP-1表达水平间差异有统计学意义(P<0.05),而不同病理类型患者MMP-1表达水平间差异无统计学意义(P>0.05)。结论乳腺癌骨转移、肝转移患者的MMP-1呈高表达,MMP-1在临床分期、腋窝淋巴结转移数的判断上具有一定参考价值。
【关键词】乳腺肿瘤;肿瘤转移;基质金属蛋白酶1
丁梅,胡芬,王增辉,等.乳腺癌不同转移类型患者基质金属蛋白酶1表达情况研究[J].中国全科医学,2016,19(13):1533-1536,1547.[www.chinagp.net]
Ding M,Hu F,Wang ZH,et al.Expression of MMP-1 of patients with breast cancer of different metastasis types[J].Chinese General Practice,2016,19(13):1533-1536,1547.
人类对乳腺癌治疗的探索已有100多年的历史,但全球每年因该病死亡的患者仍有40万之多[1]。乳腺癌转移是恶性肿瘤的固有特征,也是患者死亡的主要原因之一,但其恶化、转移的机制较为复杂,目前仍未完全明释,因此探寻其病因、浸润转移机制一直是该领域研究的难点、热点。研究表明,癌细胞诱导产生的蛋白酶降解细胞外基质和基底膜能力与其浸润转移能力呈正相关[2]。基质金属蛋白酶(matrix metalloproteinases,MMPs)对细胞外基质(extracellular matrix,ECM)具有重要的调节作用,其在正常组织中的激活、释放、抑制是受到严格控制的,而癌症发生时调节失控,则促使癌细胞侵袭、转移[3]。基质金属蛋白酶1(MMP-1)是第1个被定性的MMPs,也是MMPs家族中为数不多的能天然降解Ⅰ、Ⅱ、Ⅲ型胶原的水解酶之一,由169个氨基酸组成[4]。MMP-1通过降解细胞外基质而清除细胞转移过程中的物理屏障,因此在癌细胞转移过程中发挥着重要作用。目前,国内关于MMP-1在乳腺癌发生、发展中的临床特征观察并不多见,本研究拟通过免疫组织化学染色法观察MMP-1在乳腺癌不同转移类型患者中的表达情况,为MMP抑制剂的合理开发利用提供参考。
1对象与方法
1.1研究对象选取2012年3月—2015年3月唐山市协和医院普外一科收治的乳腺癌转移患者186例。纳入标准:(1)根据我国2011年发布的行业标准[5]进行诊断,具体为:乳房肿物,质硬、固定、伴有皮肤凹陷或腋窝淋巴结肿大、短期内肿物明显增大等为首发症状,或可出现乳头近期回缩、血性溢液,单侧乳头乳晕区皮肤湿疹样改变且常规治疗无改善;(2)经CT、X线、MRI等影像学检查符合转移癌诊断标准[6];(3)女性,均在本院进行初始治疗、手术、化疗、放疗等正规治疗;(4)转移发生均为术后首次发现,术前未经过化疗、放疗。排除标准:(1)合并有其他恶性肿瘤者;(2)未进行手术治疗,临床资料欠缺者;(3)非单纯转移者。根据首次诊断发生转移部位分为骨转移组(A组,90例)、肝转移组(B组,30例)、肺转移组(C组,40例)、软组织转移组(D组,26例)4组,其中各部位转移发生率分别为48.4%、16.1%、21.5%、14.0%。研究经本院医学伦理委员会审核、批准,患者均了解研究内容,并签署知情同意书。
1.2研究方法
1.2.1治疗方法患者根据病情需要选择根治术(A组57例、B组22例、C组35例、D组16例)、改良根治术(A组27例、B组5例、C组4例、D组2例)、保留乳房切除术(A组6例、B组3例、C组1例、D组8例);所有入选者均进行术后辅助化疗,化疗方案包括TA(多西他赛联合表阿霉素方案,A组19例、B组7例、C组9例、D组3例)、CEF(表柔比星、环磷酰胺联合氟尿嘧啶方案,A组41例、B组20例、C组21例、D组14例)、CMF(甲胺喋呤、环磷酰胺联合5-氟尿嘧啶方案,A组13例、C组5例、D组6例)、NE(表阿霉素联合诺维本方案,A组17例、B组3例、C组5例、D组3例)。
1.2.2病理组织准备标本均于手术时获得,使用4%甲醛溶液固定,进行石蜡包埋,连续切片4 μm,共3张,以便免疫组织化学染色使用。
1.2.3免疫组织化学染色将标本放在60 ℃温箱内烤片1 h,使用梯度酒精(100%、95%、90%、80%、70%)及二甲苯进行脱蜡,水化至蒸馏水,洗涤〔0.01 mol/L磷酸缓冲盐溶液(PBS缓冲液)〕5 min、3次;将切片浸泡于3%的过氧化氢(H2O2)溶液中0.5 h,使内源性过氧化酶失活,再洗涤(0.01 mol/L PBS缓冲液)5 min、3次;准备盛有枸橼酸盐抗原修复液的器皿,将切片浸入其中,再放入压力蒸气灭菌器中,高压修复20 min,待冷却后洗涤(0.01 mol/L PBS缓冲液)5 min、3次;将切片上的PBS缓冲液吸去,滴加10%山羊血清,湿盒内放置0.5 h使特异性反应得到中和;去除多余血清,在切片上滴加PBS缓冲液稀释的一抗,然后放置于湿盒,4 ℃,10 h;将湿盒置于室温下0.5 h,复温后洗涤(0.01 mol/L PBS缓冲液)5 min、3次;除水后加生物素化二抗,在37 ℃下湿盒内孵育20 min,洗涤(0.01 mol/L PBS缓冲液)5 min、3次;加辣根过氧化物酶标记链霉卵白素,在37 ℃下湿盒内孵育20 min,洗涤(0.01 mol/L PBS缓冲液)5 min、3次;取1 ml蒸馏水加入DAB显色试剂盒A、B、C试剂各1滴,混匀后滴于切片,在暗室中显色,使用自来水终止显色,利用显微镜控制显色时间。
1.2.4结果判定由资深医师在完全不了解任何临床及病理资料的情况下,对切片进行评估。每张切片随机选择10个400倍高倍视野,选取染色较为集中的区域计数细胞,连续计数100个肿瘤细胞及其阳性细胞数,以细胞内存在棕黄色或棕褐色颗粒为阳性细胞,每高倍镜视野的阳性染色细胞数按百分比进行计数。
2结果
2.14组患者一般资料比较4组患者年龄、临床分期、病理类型、腋窝淋巴结转移数间差异均无统计学意义(P>0.05,见表1),具有可比性。
2.24组患者MMP-1表达水平比较4组患者MMP-1表达水平间差异有统计学意义(P<0.05),其中C、D组与A、B组比较,差异均有统计学意义(P<0.05,见表2)。
2.34组不同临床分期、病理类型、腋窝淋巴结转移数患者MMP-1表达水平比较同一临床分期、病理类型、腋窝淋巴结转移数,4组患者间差异均有统计学意义(P<0.05);同一组内,不同临床分期、腋窝淋巴结转移数患者MMP-1表达水平间差异有统计学意义(P<0.05),而不同病理类型患者MMP-1表达水平间差异无统计学意义(P>0.05,见表3)。
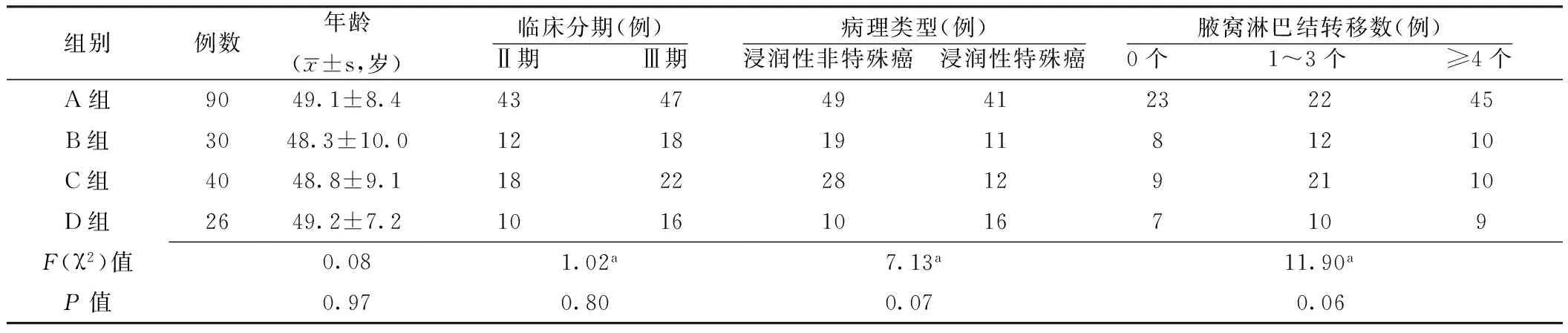
表1 4组患者一般资料比较
注:a为χ2值

Table3ComparisonoftheexpressionofMMP-1ofpatientswithdifferentclinicalstages,pathologicaltypesandnumbersofaxillarylymphnodemetastasisamongthefourgroups
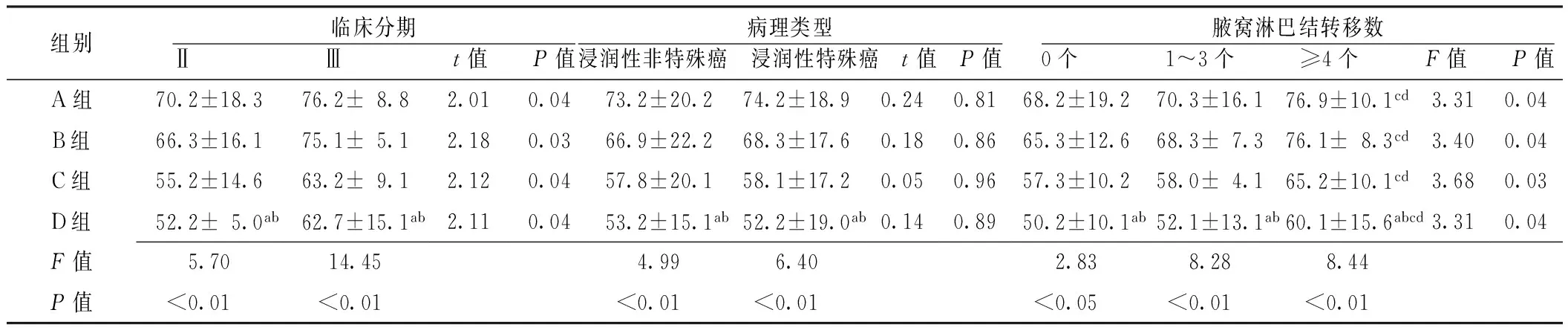
组别 临床分期Ⅱ Ⅲ t值 P值病理类型浸润性非特殊癌 浸润性特殊癌 t值 P值 腋窝淋巴结转移数0个 1~3个 ≥4个 F值 P值A组70.2±18.376.2±8.82.010.0473.2±20.274.2±18.90.240.8168.2±19.270.3±16.176.9±10.1cd3.310.04B组66.3±16.175.1±5.12.180.0366.9±22.268.3±17.60.180.8665.3±12.668.3±7.376.1±8.3cd3.400.04C组55.2±14.663.2±9.12.120.0457.8±20.158.1±17.20.050.9657.3±10.258.0±4.165.2±10.1cd3.680.03D组52.2±5.0ab62.7±15.1ab2.110.0453.2±15.1ab52.2±19.0ab0.140.8950.2±10.1ab52.1±13.1ab60.1±15.6abcd3.310.04F值5.7014.454.996.402.838.288.44P值<0.01<0.01<0.01<0.01<0.05<0.01<0.01
注:与A组比较,aP<0.05;与B组比较,bP<0.05;与0个比较,cP<0.05;与1~3个比较,dP<0.05

表2 4组患者MMP-1表达水平比较
注:MMP-1=基质金属蛋白酶1;与A组比较,aP<0.05;与B组比较,bP<0.05
3讨论
乳腺癌是严重威胁女性健康的疾病之一,是最常见的恶性肿瘤,15%~20%的患者术后发生远处转移,且该病治疗失败的最终原因就是复发及远处转移。乳腺癌最常见的远处转移部位是骨(发生率达70%以上),其次是肺、肝(8%~14%),脑转移较为少见[7]。本研究中骨转移发生率为48.4%,肺转移为21.5%,肝转移为16.1%,软组织转移为14.0%,骨转移仍然是最主要类型,但本研究中各转移类型均为单一发生部位,合并转移者均予剔除,且观察范围较为有限,这会造成与相关报道数据上的差异。
恶性肿瘤在生长过程中,原发灶会分泌MMPs,在人类已发现的23种MMPs中,包括6种膜相关酶和17种分泌型酶,分为胶原酶、明胶酶、膜型、基质溶素4种亚型,MMP-1属于胶原酶,其基因位于人类染色体11q22,由巨噬细胞、成纤维细胞、内皮细胞等分泌,其在乳腺癌、结肠癌、食管癌等患者中均呈高表达[8]。有研究显示,位于MMP-1基因启动子区的1G/2G单核苷酸多态性是功能性多态,其-1606位点的2G等位基因能够上调基因转录活性,使蛋白表达水平上调[9]。MMP-1在乳腺癌转移中的机制主要为以下两个方面:(1)发生转移时,MMP-1促使细胞外基质胶原纤维等成分的溶解,破坏血管基底膜,进而侵犯循环系统,乳腺癌细胞开始穿越基膜,通过基膜和间质结缔组织,在目标脏器上形成转移灶[10]。(2)转移灶出现后如果没有新生血管的长入,其大小不会超过2 mm2,研究表明MMP-1在新生血管启动上发挥重要作用,其机制可能是MMP-1对细胞外基质中纤维蛋白、胶原、层黏素等进行降解,使血管内皮细胞向肿瘤方向进行增殖,使原有血管发出新支,且对血管形成后的管腔、基底膜进行重塑[11]。赵贤宝[12]在观察80例大肠癌患者术后切除标本的MMP-1表达时发现,微血管密度与MMP-1表达呈正相关(r=0.642,P<0.01)。肿瘤新生血管的分化较低,癌细胞易于透过,进入血液循环,远端转移更易发生。
本研究结果显示,骨转移与肝转移患者均有较高的MMP-1表达水平,但二者间无差异。乳腺癌细胞易侵犯骨质,造成骨形成与骨质吸收的平衡紊乱,骨质流失,有报道指出破骨细胞对骨的降解作用可能是乳腺癌骨转移的重要影响因素,而这种降解则是在MMPs的催化下发生的[13]。那么,MMP-1的表达水平越高,骨降解作用越明显,发生骨转移的概率越高。在各型转移中,骨转移患者的生存期明显优于其他器官转移者,因此有较为充分的时间进行全身治疗,该型患者应以减少骨折、瘫痪、疼痛,提高患者生活质量、延长生存时间为目的,临床常在化疗的基础上进行放射性核素、二磷酸盐、内分泌等治疗[14]。本研究骨转移患者MMP-1的表达较为突出,表现出一定的特异性,推测此型患者或对MMP-1抑制剂有较好的敏感性,这有待进一步的临床实践观察。肝转移存在于55%~75%的乳腺癌死亡患者中,此类患者预后较差,中位生存期约14个月[15]。乳腺癌细胞具有嗜靶器官性,肝脏微环境对乳腺癌细胞的生物学行为具有一定影响,但具体机制尚不清楚,或与肝内趋化因子及其受体相关,或与miRNA表达相关,或与闭合蛋白相关[16]。本研究肝转移患者表现出较高的MMP-1水平,提示肝转移的发生与MMP-1水平或具有相关性,但其中机制尚有待进一步研究阐释。
有研究显示,乳腺癌中浸润性非特殊癌约占80%,是病理中的主要类型[17]。本研究中浸润性非特殊癌患者占57.0%(106/186),亦为主体类型。从各组内MMP-1表达来看,浸润性非特殊癌和浸润性特殊癌未表现出明显差异,说明同一转移类型MMP-1的病理学表达特异性不明显。淋巴结阳性数与乳腺癌转移、复发呈正相关,腋窝淋巴结转移状态是反映肿瘤播散能力的重要指标[18]。本研究结果显示,淋巴结转移数越多,MMP-1的表达水平越高,各组内MMP-1表达水平在淋巴结转移数≥4个中均值最高,说明MMP-1表达在一定程度上能够反映肿瘤浸润、播散能力。此外,从临床分期情况来看,各组内Ⅲ期MMP-1表达水平均高于Ⅱ期,提示MMP-1水平或可对临床分期的判断提供参考。病理类型、淋巴结转移数、临床分期的不同层次下均表现出了明显的组间差异,这可能是不同转移类型对MMP-1刺激程度、表达水平的差异造成,也有待大样本、多中心的临床观察进行证实,其确切的机制尚有待进一步研究证实。
体外研究显示,MMPs抑制剂主要通过对细胞外基质游走、聚集的抑制而发挥作用,通过切断转移途径而非直接作用于肿瘤细胞本身,因此此类药物较难产生抗药性[19]。但目前MMPs的应用情况并不理想,考虑是缺乏特异性的合理应用造成,本研究显示不同转移类型的乳腺癌患者MMP-1水平间存在差异,提示在应用MMP-1抑制剂时应参考转移高危人群特点实施。本研究缺乏对MMP-1基因多态性的分析,在未来研究中,可对MMP-1基因多态性在乳腺癌转移人群中的分布进行探讨,为MMPs抑制剂的使用提供更多参考。
作者贡献:丁梅进行试验设计与实施、撰写论文、成文并对文章负责;胡芬进行质量控制与审校;王增辉、杨艳玲、马振玲、李宗富、李润华进行试验实施、评估、资料收集。
本文无利益冲突。
参考文献
[1]Wang LJ,Wang T,Wu XH,et al.The clinical values of breast cancer resistance protein mRNA levels in plasma microvesicles predicting breast cancer chemotherapy[J].Chinese Journal of Experimental Surgery,2015,32(5):587-590.(in Chinese)
汪林军,王腾,吴小红,等.血浆微泡乳腺癌耐药蛋白mRNA水平对乳腺癌化疗疗效的预测价值[J].中华实验外科杂志,2015,32(5):587-590.
[2]Zhou Q,Yan TT,Lu JS.Research progress on the relationship of metastatic tumor antigen 1 and breast cancer and its mechanism[J].Fudan University Journal of Medical Sciences,2011,38(5):987-990.(in Chinese)
周琼,严婷婷,陆劲松.转移性肿瘤抗原1与乳腺癌发生和转移的关系及其机制的研究进展[J].复旦学报:医学版,2011,38(5):987-990.
[3]Fang M,Kang L,Chen YJ,et al.Expressions and clinical significances of SMO,STAT3 and MMP-9 in triple negative breast cancer[J].Chinese Journal of Immunology,2014,33(6):1045-1049.(in Chinese)
方明,康乐,陈英杰,等.Smoothened、STAT3和MMP-9在三阴性乳腺癌中的表达及临床意义[J].中国免疫学杂志,2014,33(6):1045-1049.
[4]Lyu N,Huang Y,Ma LJ,et al.Expression of MMP-1 and PTEN protein in the lesions of basal cell papilloma and its correlation with skin photoaging[J].Chinese Journal of Clinical Oncology,2014,23(16):88-91.(in Chinese)
吕宁,黄永,马立娟,等.基底细胞乳头状瘤MMP-1 PTEN蛋白的表达及与皮肤光老化关系[J].中国肿瘤临床,2014,23(16):88-91.
[5]中华人民共和国卫生部.中华人民共和国卫生行业标准·乳腺癌诊断[S].2011.
[6]魏于全,赫捷.肿瘤学[M].2版.北京:人民卫生出版社,2015.
[7]于法常,韩淑梅,张国栋,等.乳腺癌卵巢转移的相关研究进展[J].山东医药,2013,53(46):902-906.
[8]Liao MM,Zhao JF,Wang N,et al.Expression and clinical value of MMP-1 protein in hepatocellular carcinoma[J].China Journal of Modern Medicine,2012,22(1):34-36.(in Chinese)
廖明媚,赵劲风,王宁,等.MMP-1在肝细胞癌中的表达及临床意义[J].中国现代医学杂志,2012,22(1):34-36.
[9]Qi YQ,Li TH,Fan LY,et al.Regulation of activated genes of fibroblasts and their improvement of skin aging[J].Chinese Journal of Medical Aesthetics and Cosmetology,2013,19(1):587-590.(in Chinese)
亓玉青,李天航,范丽云,等.成纤维细胞激活基因的调控及改善皮肤老化的研究[J].中华医学美学美容杂志,2013,19(1):587-590.
[10]Guo L,Li GX,Lu Z,et al.Expression of PEA3/E1AF/ETV4,MMP-1 and MMP-9 and correlation among them in human breast cancer cells[J].Acta Academiae Medicinae Weifang,2010,32(2):657-660.(in Chinese)
郭璐,李贵新,路中,等.乳腺癌细胞中E1AF,MMP-1和MMP-9的表达及其相关性[J].潍坊医学院学报,2010,32(2):657-660.
[11]刘斌.Syndecan-1、MMP-1与乳腺癌浸润、转移关系的研究[D].郑州:郑州大学,2006.
[12]赵贤宝.MMP-1在大肠癌中的表达及与肿瘤血管生成关系的研究[D].昆明:昆明医学院,2003.
[13]袁火忠,黄兴伟,谢敏明,等.乳腺癌骨转移风险因素分析[J].广东医学,2010,31(21):1207-1210.
[14]闫敏,宋三泰,江泽飞,等.乳腺癌骨转移内分泌治疗与化疗的对比研究[J].中华肿瘤杂志,2004,26(3):874-876.
[15]Zhang L,Guo XM.The role of local therapy in liver oligometastases of breast cancer[J].China Oncology,2013,16(12):26-30.(in Chinese)
张丽,郭小毛.局部治疗在乳腺癌局限性肝转移中的作用[J].中国癌症杂志,2013,16(12):26-30.
[16]周四海,朱荣涛,余正,等.乳腺癌肝脏转移分子生物学机制的研究进展[J].检验医学与临床,2012,9(15):1917-1919.
[17]陈绍光.浸润性乳腺癌超声弹性成像与病理的相关性研究[J].中国妇幼保健,2014,29(35):621-624.
[18]Sun H,Wei CZ.Related risk factors of axillary metastasis of breast cancer patients with positive sentinel lymph nodes[J].Maternal & Child Health Care of China,2015,30(6):668-670.(in Chinese)
孙恒,尉承泽.前哨淋巴结阳性乳腺癌患者腋窝转移的相关危险因素探究[J].中国妇幼保健,2015,30(6):668-670.
[19]Zhu B,Zhao HL,Wang Y,et al.Research on the expressions of KAI1 gene,TIMP-1 and MMP-9 and their correlations with clinicopathologic features of non-small cell lung cance[J].Laboratory Medicine,2014,26(3):746-750.(in Chinese)
朱波,赵惠柳,王英,等.非小细胞肺癌KAI1基因和TIMP-1、MMP-9表达与临床生物学行为的关系研究[J].检验医学,2014,26(3):746-750.
(本文编辑:崔沙沙)
Expression of MMP-1 of Patients With Breast Cancer of Different Metastasis Types
DINGMei,HUFen,WANGZeng-hui,etal.
TheFirstDepartmentofGeneralSurgery,TangshanUnionMedicalCollegeHospital,Tangshan063000,China
【Abstract】ObjectiveTo investigate the expression of MMP-1 of patients with breast cancer of different metastasis types.MethodsFrom March 2012 to March 2015,we enrolled 186 patients with breast cancer metastasis who received treatment in the First Department of General Surgery of Tangshan Union Medical College Hospital.According to the site of metastasis,these patients were divided into four groups:bone metastasis group(group A,n=90),liver metastasis group(group B,n=30),lung metastasis group(group C,n=40),and soft tissue group(group D,n=26).Immunohistochemistry staining was used to observe the expression of MMP-1 in the cancer tissue samples of each group.ResultsGroup A and group B were higher than group C and group D in the expression of MMP-1 (P<0.05).The four groups were significantly different in the expression of MMP-1 in patients of same clinical stage,pathological type or with same number of axillary lymph node metastasis (P<0.05).In the same group,patients with different clinical stages and numbers of axillary lymph node metastasis were significantly different in the expression of MMP-1 (P<0.05),and patients with different pathological types were not significantly different in the expression of MMP-1(P>0.05).ConclusionPatients with breast cancer bone metastasis and liver metastasis have high expression of MMP-1,and MMP-1 has reference value for the determination of clinical staging and the number of axillary lymph node metastasis.
【Key words】Breast neoplasms;Neoplasm metastasis;Matrix metalloproteinase 1
基金项目:国家自然科学基金资助项目(81302323)——BMP-6调控MMP表达抑制乳腺癌细胞转移的功能和机理研究;河北省自然科学基金资助项目(c2014209140)——BMP-6调控MMP-1表达抑制乳腺癌细胞转移的功能和机制研究
通信作者:胡芬,063000河北省唐山市,华北理工大学生命科学学院;E-mail:ihufen@126.com
【中图分类号】R 737.9
【文献标识码】A
doi:10.3969/j.issn.1007-9572.2016.13.013
(收稿日期:2016-01-08;修回日期:2016-03-14)
