188例重症肌无力患者生活质量研究
2016-06-16马姗范玲玲杨永祥张慜王钧刚王圣元闫忠军李川郭鹏李柱一
马姗 范玲玲 杨永祥 张慜 王钧刚 王圣元 闫忠军 李川 郭鹏 李柱一
710077 陕西省西安市西安医学院第一附属医院神经内科(马姗*、范玲玲*);710038 陕西省西安市第四军医大学唐都医院神经内科(杨永祥、张慜、王钧刚、王圣元、李川、郭鹏、李柱一),神经外科(闫忠军)
188例重症肌无力患者生活质量研究
马姗*范玲玲*杨永祥张慜王钧刚王圣元闫忠军李川郭鹏李柱一
710077 陕西省西安市西安医学院第一附属医院神经内科(马姗*、范玲玲*);710038 陕西省西安市第四军医大学唐都医院神经内科(杨永祥、张慜、王钧刚、王圣元、李川、郭鹏、李柱一),神经外科(闫忠军)
摘要:目的分析重症肌无力(MG)患者的生活质量。方法纳入2013-03-2014-06在唐都医院神经内科就诊的MG患者188例,应用重症肌无力量化评分(QMGs) 评估患者病情严重程度,采用36项简明健康状况调查表(SF-36)评估患者生活质量,采用汉密尔顿抑郁量表(HDRS)和汉密尔顿焦虑量表(HARS)评估抑郁和焦虑症状。比较不同教育水平、职业、眼肌型重症肌无力(ocular MG,OMG)症状、胸腺情况等患者间SF-36评分的差异,并对QMG评分、年龄、HARS和HDRS得分与SF-36两项复合得分进行多元线性回归分析。结果高级教育组在躯体疼痛项得分高于初级教育组(P<0.05),学生组在生理机能项(P<0.05)和生理角色功能项(P<0.05)得分均高于脑力劳动组,学生组在生理角色功能项得分亦高于体力劳动组(P<0.05);学生组在生理复合得分(PCS)项得分高于按照职业分组的其他3组(均P<0.05);OMG组在精神复合得分(MCS)项得分高于全身型重症肌无力(generalized MG,GMG)组(P<0.05)。较高的QMGs、HARS得分和高龄可以预测较低的PCS得分,较高的QMGs和HARS得分可预测较低的MCS得分。结论影响MG患者生活质量的因素包括年龄、教育水平、职业、胸腺情况、MG的类型和GMG的类型、疾病的严重程度和心理障碍。较高的QMGs和HARS得分可以预测较低的PCS和MCS得分,年龄大可预测较低的PCS得分。
关键词:重症肌无力;定量重症肌无力评分;生活质量;36项简明健康状况调查表;汉密尔顿抑郁量表;汉密尔顿焦虑量表
重症肌无力(myasthenia gravis,MG)是一种自身免疫性疾病,主要特征是骨骼肌的波动性和易疲劳性[1]。约85%的眼肌型重症肌无力(ocular myasthenia gravis,OMG)起始症状以眼外肌无力和复视为特征,大约有90%的OMG患者在3年内进展为全身型MG(generalized MG,GMG)[2]。MG患者慢性临床症状和长期持久的治疗过程可导致其生活质量下降[3-5]。本研究通过评估MG患者生活质量及其影响因素,以期对提高MG患者生活质量、改善临床症状提供帮助。
1对象和方法
1.1对象纳入2013-03-2014-06在唐都医院神经内科就诊的MG患者280例,符合排除标准的患者50例,排除问卷无效患者42例,最终纳入188例MG患者。其中男95例、女93例;年龄17~78岁,平均(42.8±15.8)岁;病程中位数为4.3年,四分位数间距为2.6年。采用美国重症肌无力协会(Myasthenia Gravis Foundation of America,MGFA)分型标准确定患者临床分型,其中Ⅰ型104例(55.3%),Ⅱa型26例(13.8%),Ⅱb型13例(6.9%),Ⅲa型8例(4.3%),Ⅲb型33例(17.6%),Ⅳa型1例(0.5%),Ⅳb型3例(1.6%)。MG的诊断需要满足以下标准中的前2项和第3项或第4项:(1)具有特征性的骨骼肌易疲劳现象;(2)新斯的明试验阳性;(3)低频重复神经电刺激(repetitive nerve stimulation, RNS)波幅衰减至少达15%;(4)抗乙酰胆碱受体抗体(AChR-Ab)阳性。排除标准包括:(1)妊娠;(2)其他自身免疫性疾病或炎性反应性疾病;(3)心肺疾病;(4)MGFA分型中的V型且需要辅助呼吸的MG患者。所有患者签署知情同意书,且该研究经唐都医院伦理委员会批准通过。
1.2方法采用重症肌无力量化评分量表(quantitative myasthenia gravis score,QMGs)评估患者疾病的严重程度[6],平均QMGs得分为(6.7±4.9)分。使用汉密尔顿抑郁量表(Hamilton depression rating scale,HDRS)和汉密尔顿焦虑量表(Hamilton anxiety rating scale,HARS)用来评估抑郁和焦虑症状[7-8],平均HARS得分为(7.4±5.9)分,平均HDRS得分为(8.1±6.7)分。使用36项简明健康状况调查表(medical outcome survey 36-item short-form health survey,SF-36)评估患者生活质量,该量表可测量8个健康方面的得分,包括:生理功能、生理角色功能、躯体疼痛、整体健康、精力、社会功能、感情角色功能和精神健康。生理复合得分(PCS)和精神复合得分(MCS)是生活质量的两个复合亚类得分。每个分项的得分范围是0~100,得分越高表示生活质量越好。SF-36量表(中文版)的信度和效度已经在中国人群中得到证实[9]。依照教育水平划分为初级教育组(29例,占15.4%)、中级教育组(104例,占55.3%)、高级教育组(55例,占29.3%);依照职业划分为脑力劳动组(65例,占34.6%)、体力劳动组(75例,占39.9%)、退休组(28例,占14.9%)和学生组(20例,占10.6%);将104例OMG患者依照眼肌症状划分为眼睑下垂组(27例,占26.0%)、复视组(4例,占3.8%)、眼睑下垂和复视组(73例,占70.2%);将84例GMG患者分为由OMG转化为GMG组(59例)和以GMG起病组(25例);依照胸腺情况划分为无胸腺瘤组(157例,占83.5%)、胸腺瘤但未手术组(20例,占10.6%)、胸腺瘤且胸腺切除术组(合并胸腺瘤手术组,11例,占5.9%)。
1.3统计学处理将结果输入Microsoft Excel 2007建立数据库,采用SPSS17.0软件进行统计学分析。计量资料以均数±标准差表示。两均数比较采用t检验;多组均数比较采用单因素方差分析,两两比较采用Bonferroni法。多元回归分析用来评估QMG评分、年龄、HARS和HDRS得分对于SF-36两项复合得分的预测价值。以P<0.05为差异有统计学意义。
2结果
2.1各组SF-36各项平均得分比较 结果见表1~7。男性和女性得分的差异无统计学意义;高级教育组躯体疼痛得分高于初级教育组(P<0.05);学生组生理功能(P<0.05) 和生理角色功能 (P<0.05)得分高于脑力劳动组,学生组生理角色功能得分高于体力劳动组(P<0.05)。OMG组生理功能(P<0.01)、生理角色功能(P<0.01)、躯体疼痛项(P<0.05)、精力(P<0.05)和社会功能(P<0.01)得分均高于GMG组;以GMG起病组在躯体疼痛(P<0.05)、整体健康(P<0.01)和精力(P<0.05)得分均高于由OMG转化组;无胸腺瘤组生理功能得分高于合并胸腺瘤未行手术组(P<0.01)。
2.2MG患者SF-36两项复合得分比较 学生组PCS得分高于脑力劳动组、体力劳动组、退休组(均P<0.05)。OMG组PCS得分(P<0.01)和MCS得分(P<0.05)均高于GMG组;以GMG起病组PCS得分高于由OMG转化组(P<0.01)。结果见表1~7。
2.3MG患者生活质量预测 多元线性回归分析提示QMG评分较高(r=-0.935,95%CI:-1.476~0.394,P<0.01)、HARS得分(r=-1.034,95%CI:-1.493~0.575,P<0.01)和较大年龄(r=-0.222,95%CI:-0.391~0.053,P<0.05)可以预测较低的PCS得分,QMG评分较高(r=-0.714,95%CI:-1.306~0.122,P<0.05)和HARS得分(r=-1.523,95%CI:-2.026~1.021,P<0.01)可以预测较低的MCS得分。

表 1 不同性别MG患者SF-36各项得分及两项复合得分比较±s)
注:MG:重症肌无力,表2~4、7同;PCS:生理复合得分,MCS:精神复合得分,表2~7同

表 2 不同教育水平MG患者SF-36各项得分及两项复合得分比较±s)
注:与初级组比较,aP<0.05

表 3 不同职业MG患者SF-36各项得分及两项复合得分比较±s)
注:与脑力劳动组比较,aP<0.05;与体力劳动组比较,bP<0.05;与退休组比较,cP<0.05

表 4 不同类型MG患者SF-36各项得分及两项复合得分比较±s)
注:OMG:眼肌型重症肌无力,GMG:全身型重症肌无力,表5~6同
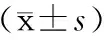
表 5 104例OMG患者SF-36各项得分及两项复合得分比较
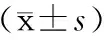
表 6 GMG患者SF-36各项得分及两项复合得分比较
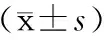
表 7 不同组别MG患者SF-36各项得分及两项复合得分比较
注:与合并胸腺瘤未手术组比较,aP<0.01
3讨论
MG的主要临床表现为眼睑下垂、吞咽困难和肢体无力等[10]。由于病程持续时间长以及临床症状的波动性,一定程度上影响了MG患者的生活质量,使其担负工作和家庭角色的能力下降[3, 5]。尽管目前MG治疗方法不断推陈出新,患者的寿命得到一定程度延长,但他们的社会和生活角色的担当,已不能恢复到病前的状态[11]。本研究通过分析可能影响MG患者生活质量的相关因素,可能对改善其生活质量有潜在的指导意义。
关于教育水平,本研究结果显示高级教育组MG患者躯体疼痛平均得分高于初级教育组,进一步分析发现教育水平对于PCS和MCS得分没有影响。然而,有文献报道较高的教育水平与更好的生理生活质量之间存在正相关[12]。这种差异可能与不同的国家拥有不同的社会环境和文化教育背景有关。至今,尚未找到令人信服的理由来解释关于MG患者生活质量中的躯体疼痛得分结果[13]。
本研究对MG患者不同职业的SF-36得分比较结果显示,学生组在生理功能和生理角色功能得分高于脑力劳动组;另外,学生组在生理角色功能得分亦高于体力劳动组;学生组在PCS的得分高于其他3组。其原因可能与学生的体力活动和精神压力较低有关。有研究结果同样显示,需要消耗体力的工作会对生活质量产生消极影响,这与MG可以导致肌肉的疲劳和无力相一致[14-15]。
本研究分析不同临床特征MG患者生活质量的差异发现,GMG患者的5项得分(生理功能、生理角色功能、躯体疼痛、精力、社会功能)和两项复合得分(PCS和MCS)要低于OMG患者,提示GMG患者的生活质量较OMG患者差。其原因为,GMG患者骨骼肌和延髓肌无力症状较OMG患者严重。OMG患者不同临床表现(即眼睑下垂、复视、眼睑下垂+复视)组间SF-36各项得分间比较差异无统计学意义。进一步分析GMG患者发现,由OMG进展为GMG的患者在躯体疼痛、整体健康、精力和PCS得分低于直接以GMG起病的患者,推测OMG进展为GMG是影响MG患者生活质量的一个重要因素。
有研究指出MG患者的胸腺处于慢性炎性反应状态,并认为胸腺是MG发生并引起异常免疫反应的部位[16]。胸腺切除术可改善MG患者临床症状[17]。本研究发现合并胸腺瘤的MG患者的生理功能得分低于未合并胸腺瘤者,然而,已行胸腺切除的MG患者生活质量和未行胸腺切除的患者间比较差异无统计学意义。有关胸腺切除对MG患者生活质量的影响尚不清楚[4, 12]。
本研究结果显示,较高的QMG和HARS得分可预测较低的PCS和MCS得分;高龄可预测较低的MCS得分。这与某些研究结论相一致[4, 11-12]。本研究结果证实了病情较重的MG患者在躯体和心理方面的生活质量均更差。这与既往研究结果相一致[11-12]。本研究同时发现,HARS得分较高的MG患者在躯体方面和精神方面的生活质量均更差,提示如将MG的常规治疗和心理支持结合起来,MG患者的疾病状况和生活质量可能会得到更好改善。
总之,影响MG患者生活质量的因素包括年龄、教育水平、职业、胸腺情况、MG的类型和全身型GMG的类型、疾病的严重性和心理障碍。较高的QMG和HARS得分是两个可以预测较低PCS和MCS的因素,高龄是预测较低PCS的因素。该结果对MG患者的临床治疗策略改进,进而提高患者生活质量可能有潜在的指导意义。另外,治疗MG患者的躯体症状同时,心理症状比如焦虑和抑郁同样值得关注。
参考文献:
[1]Conti-Fine BM, Milani M, Kaminski HJ. Myasthenia gravis: past, present, and future[J]. J Clin Invest, 2006,116(11):2843-2854.
[2]Grob D, Brunner N, Namba T, et al. Life time course of myasthenia gravis[J]. Muscle Nerve, 2008,37(2):141-149.
[3]Paul RH, Nash JM, Cohen RA, et al. Quality of life and well-being of patients with myasthenia gravis[J]. Muscle Nerve, 2001,24(4):512-516.
[4]Padua L, Evoli A, Aprile I, et al. Health-related quality of life in patients with myasthenia gravis and the relationship between patient-oriented assessment and conventional measurements[J]. Neurol Sci, 2001,22(5):363-369.
[5]Mullins LL, Carpentier MY, Paul RH, et al. Disease-specific measure of quality of life for myasthenia gravis[J]. Muscle Nerve, 2008,38(2):947-956.
[6]Jaretzki AR, Barohn RJ, Ernstoff RM, et al. Myasthenia gravis: recommendations for clinical research standards. Task Force of the Medical Scientific Advisory Board of the Myasthenia Gravis Foundation of America[J]. Neurology, 2000,55(1):16-23.
[7]Hamilton M. A rating scale for depression[J]. J Neurol Neurosurg Psychiatry, 1960,23(3):56-62.
[8]Hamilton MM. The assessment of anxiety states by rating[J]. Br J Med Psychol, 1959,32(1):50-55.
[9]Wang W, Lopez V, Ying CS, et al. The psychometric properties of the Chinese version of the SF-36 health survey in patients with myocardial infarction in mainland China[J]. Qual Life Res, 2006,15(9):1525-1531.
[10]Vincent A, Palace J, Hilton-Jones D. Myasthenia gravis[J]. Lancet, 2001,357(9274):2122-2128.
[11]Twork S, Wiesmeth S, Klewer J, et al. Quality of life and life circumstances in German myasthenia gravis patients[J]. Health Qual Life Outcomes, 2010,8:129.
[12]Basta IZ, Pekmezovic TD, Peric SZ, et al. Assessment of health-related quality of life in patients with myasthenia gravis in Belgrade (Serbia)[J]. Neurol Sci, 2012,33(6):1375-1381.
[13]Wager TD, Rilling JK, Smith EE, et al. Placebo-induced changes in FMRI in the anticipation and experience of pain[J]. Science, 2004,303(5661):1162-1167.
[14]Raggi A, Leonardi M, Mantegazza R, et al. Social support and self-efficacy in patients with myasthenia gravis: a common pathway towards positive health outcomes[J]. Neurol Sci, 2010,31(2):231-235.
[15]Raggi A, Leonardi M, Antozzi C, et al. Concordance between severity of disease, disability and health-related quality of life in myasthenia gravis[J]. Neurol Sci, 2010,31(1):41-45.
[16]Cavalcante P, Le Panse R, Berrih-Aknin S, et al. The thymus in myasthenia gravis: Site of “innate autoimmunity”?[J]. Muscle Nerve, 2011,44(4):467-484.
[17]Marx A, Wilisch A, Schultz A, et al. Pathogenesis of myasthenia gravis[J]. Virchows Archiv, 1997,430(5):355-364.
(本文编辑:时秋宽)
Analysis of health-related quality of life in 188 myasthenia gravis patients
MAShan*,FANLingling*,YANGYongxiang,ZHANGMin,WANGJungang,WANGShengyuan,YANZhongjun,LIChuan,GUOPeng,LiZhuyi#.
#DepartmentofNeurology,TangduHospital,TheFourthMilitaryMedicalUniversity,Xi’anShaanxi710038,China
*Theseauthorscontributedequallytothiswork
ABSTRACT:ObjectiveTo analyze the quality of life in patients with myasthenia gravis(MG). MethodsOne hundred and eighty-eight MG patients in Department of Neurology of Tangdu hospital from March 2013 to June 2014 were recruited. The quantitative myasthenia gravis score (QMGs) was applied to assess the severity of the disease. The medical outcome study 36-item short-form health survey (SF-36) was used to estimate the health-related quality of life (HRQoL). Hamilton Depression Rating Scale (HDRS) and Hamilton Anxiety Rating Scale (HARS) were utilized to measure the depression and anxiety symptoms. Education level was stratified into three layers as elementary, secondary and university. Occupation was stratified into four layers as intellectual work, physical work, retired and student. Ocular myasthenia gravis(OMG) symptoms were stratified into three layers as eyelid ptosis, diplopia, and both eyelid ptosis and diplopia. The clinical type of generalized myasthenia gravis(GMG) was stratified into two layers as progressed from OMG and initial symptom as GMG. The situation of the thymus was stratified into three layers as without thymoma, with thymoma, and both with thymoma and thymectomy. Student’s t test, One-way ANOVA and Bonferroni post-hoc tests were used to compare the scores of eight domains and two composite scales from SF-36. Multiple linear regression analysis was used to identify prognostic value of the investigated factors in the estimation of physical composite score(PCS) and mental composite score(MCS). ResultsThe university group had higher score in domain bodily pain (BP) than the elementary group (P=0.037), the student group had higher score in domain physical functioning (PF)(P<0.05) and role-physical(RP)(P<0.05) than the intellectual work group, the student group had higher score in domain RP than the physical work group (P<0.05). The student group had higher PCS than any of the other three groups (P<0.05). The OMG group had higher score in MCS than the GMG group (P<0.05). Higher QMG and HARS scores and elderly age were predictors of lower PCS and lower MCS was predicted by higher QMG and HARS scores. ConclusionsFactors that may influence the HRQoL of MG patients include age, educational level, occupation, the situation of the thymus, the type of MG and GMG, the severity of the disease, and accompanying psychological disorders. Higher QMG and HARS scores can prognosticate lower PCS and MCS, while older age can just prognosticate lower PCS.
Key words:myasthenia gravis; quantitive myasthenia gravis score; health-related quality of life; 36-item short-form health survey; Hamilton depression rating scale; Hamilton anxiety rating scale
doi:10.3969/j.issn.1006-2963.2016.02.001
通讯作者:李柱一,Email: lizhuyi@fmmu.edu.cn
中图分类号:R746.1
文献标识码:A
文章编号:1006-2963 (2016)02-0077-06
Corresponding author:LI Zhuyi, Email: lizhuyi@fmmu.edu.cn
(收稿日期:2015-04-10)
*这些作者对本文具有同等贡献
