双歧杆菌脂磷壁酸对深部白色念珠菌感染小鼠细胞免疫的影响*
2016-06-15王频佳谢成彬
王频佳,王 娴,谢成彬,王 跃
(1.成都医学院临床微生物学教研室,成都 610500;2.四川省成都市第三人民医院检验科 610031;3.四川省妇幼保健院检验科,成都 610045)
双歧杆菌脂磷壁酸对深部白色念珠菌感染小鼠细胞免疫的影响*
王频佳1,王娴2#,谢成彬3△,王跃1
(1.成都医学院临床微生物学教研室,成都 610500;2.四川省成都市第三人民医院检验科610031;3.四川省妇幼保健院检验科,成都 610045)
[摘要]目的观察双歧杆菌脂磷壁酸(BLTA)对深部白色念珠菌感染小鼠细胞免疫功能的影响。方法通过尾静脉注射白色念珠菌建立免疫低下小鼠深部白色念珠菌感染模型,观察BLTA处理对小鼠胸腺指数、脾脏指数、脾淋巴细胞增殖活性、NK细胞杀伤活性及血清细胞因子水平的影响。结果免疫低下小鼠深部感染白色念珠菌后,小鼠胸腺指数、脾脏指数和脾脏淋巴细胞增殖活性轻度下降(P>0.05),NK细胞杀伤活性明显下降(P<0.05),IL-2、IL-4和INF-γ水平轻微升高(P>0.05),IL-10水平明显升高(P<0.05);BLTA处理后,小鼠胸腺指数、脾脏指数、脾淋巴细胞增殖活性和NK细胞杀伤活性明显升高(P<0.01),血清IL-2和INF-γ水平明显升高(P<0.05),IL-4变化不大,IL-10明显降低(P<0.01)。结论BLTA可改善免疫低下小鼠的免疫功能状态,恢复甚至增强深部感染念珠菌后受到抑制的细胞免疫应答。
[关键词]小鼠;双歧杆菌脂磷壁酸;白色念珠菌;细胞免疫
白色念珠菌寄生于人体的体表、口腔、上呼吸道、胃肠道和阴道黏膜等部位,是临床常见的条件致病菌。当前,随着抗菌药物、激素和免疫抑制剂的大量使用,白色念珠菌引起的深部感染变得日益常见。由于抗真菌药物在成本、毒性、药代动力学的变化及药物相互作用复杂性等方面的局限性,导致侵袭性真菌感染的发病率和死亡率都较高[1]。研究还发现,念珠菌感染后会使机体的免疫功能受到进一步的抑制[2-4],从而使侵袭性真菌感染愈加难于控制。因此,开发既具有一定抗真菌感染活性又能提高机体免疫力的新型抗真菌药物或生物制剂成为了众多研究者热衷的事情[5-6]。双歧杆菌是人体肠道最重要的益生菌,研究证实双歧杆菌无论是全菌、培养上清液或其表面分子都具有抗微生物的活性,包括抗细菌活性、抗真菌活性和抗病毒活性。脂磷壁酸(bifidobacterial lipoteichoic acid,BLTA)是双歧杆菌的细胞壁成分,也是双歧杆菌发挥生物学功能的重要活性分子。作者的前期研究发现,BLTA能够改善深部白色念珠菌感染小鼠的生存状态,提高生存率,且这种作用与BLTA的剂量呈依赖关系。本研究旨在观察BLTA对深部白色念珠菌感染小鼠细胞免疫功能的影响,探讨BLTA对念珠菌感染小鼠的免疫调节作用,以期为白色念珠菌病的治疗提供新的途径。
1材料与方法
1.1材料
1.1.1实验动物和细胞株健康BALB/c雄性小鼠(SPF级)30只,8~10周龄,体质量18~20 g,由四川省简阳市简城比尔动物养殖场提供,动物合格证号:0011159;小鼠淋巴瘤细胞株YAC-1由本室保存。
1.1.2实验菌株白色念珠菌标准株ATCC90029,购自温州康泰生物科技有限公司。接种沙保培养基35 ℃培养48 h后,取单个菌落用无菌生理盐水制成菌悬液,经细胞计数板计数后调整到所需浓度。
1.1.3主要试剂BLTA由本室从两歧双歧杆菌提取纯化;注射用环磷酰胺,规格0.2 g/瓶,江苏恒瑞医药股份有限公司,批号H32020857;沙保培养基,温州康泰生物科技有限公司;RPMI 1640培养液,美国Gibco公司;胎牛血清,杭州四季青生物工程材料公司;刀豆蛋白(ConA)、四甲基偶氮唑盐(MTT),美国Sigma公司;细胞因子IL-2、IL-4、IL-10 和INF-γ检测试剂盒,欣博盛生物科技发展有限公司。
1.1.4主要仪器MJX-100型霉菌培养箱(常州中诚仪器制造有限公司),HERA cell i CO2培养箱[赛默飞世尔科技(中国)有限公司],DNM-9602酶标仪(北京普朗新技术有限公司),AU2700型全自动生化分析仪[贝克曼库尔特商贸(中国)有限公司]。
1.2方法
1.2.1动物分组健康雄性BALB/c小鼠30只,适应性喂养5 d后,给予小鼠腹腔注射环磷酰胺80 mg·kg-1·d-1,连续注射3 d,制备免疫低下小鼠模型。随后将小鼠分成对照组、感染组、BLTA组,每组10只。各组间小鼠体质量差异无统计学意义(P>0.05)。
1.2.2深部白色念珠菌感染小鼠模型的建立及处理至第3次注射环磷酰胺24 h后,BLTA组小鼠每日1次颈背部皮下注射BLTA 150 μg/鼠,连续7 d,其余小鼠同部位注射等量生理盐水。第11天,感染组和BLTA组小鼠经尾静脉注射浓度为1.0×105CFU/mL的白色念珠菌菌液0.2 mL(2×104CFU/mice),注射1次,对照组小鼠经尾静脉注射等量生理盐水。自注射白色念珠菌当日起,每日1次对BLTA组每只小鼠颈背部皮下注射BLTA 150 μg,连续7 d,其余小鼠同部位注射等量生理盐水。于最后1次注射BLTA 24 h后,摘除各组小鼠眼球取血并断颈处死,称量体质量,摘出胸腺及脾称质量,计算胸腺指数和脾脏指数,即相应脏器质量(mg)除以体质量(g),并无菌制备脾脏单个细胞悬液。
1.2.3脾淋巴细胞增殖的检测用含100 mL/L胎牛血清的RPMI 1640培养液调整脾细胞浓度至1.5×106/mL,加入96孔细胞培养板中,200 μL/孔,重复3孔,加入ConA 20 μL (终浓度5 μg/mL)。于37 ℃、5%CO2培养68 h后,加入5 g/L MTT 10 μL,继续培养4 h,离心弃上清液,加DMSO 100 μL/孔,温育10 min,检测波长570 nm处各孔的吸光度值(A)。
1.2.4NK细胞杀伤活性的检测用含50 mL/L胎牛血清的RPMI 1640培养液调整脾细胞和YAC-1细胞的浓度至2×109/L。将两者等比例混合后,加入96孔细胞培养板中,每孔200 μL,重复3孔,记为实验孔(E)。另设空白对照(B)3孔(每孔加入RPMI 1640培养液200 μL)、靶细胞自然释放孔(Tn) 3孔(每孔加入YAC-1细胞悬液和培养液各100 μL)及靶细胞最大释放孔(Tm)3孔(每孔加入YAC-1细胞悬液100 μL)。于37 ℃、50 mL/L CO2条件下培养24 h,向Tm孔中加入含20 mL/L Triton X-100的RPMI 1640溶液,100 μL/孔。混匀后,静置10 min,离心收集上清液,在全自动生化分析仪上用速率法检测乳酸脱氢酶(LDH)的活性,并按下列公式计算NK细胞的杀伤率(%)。NK细胞的杀伤率=[(E-B)-(Tn-B)]/[(Tm-B)-(Tn-B)]×100%。
1.2.5血清细胞因子的检测收集小鼠血清,按照试剂盒说明书进行操作,分别检测血清中IL-2、IL-4、IL-10和INF-γ的水平。

2结果
2.1BLAT对深部白色念珠菌感染小鼠一般状况和脏器指数的影响小鼠自注射环磷酰胺后出现少动、消瘦、饮食减少、多尿、皮毛欠光滑等现象,与临床上免疫力低下患者纳差、消瘦、懒动乏力等症状相似。小鼠深部感染白色念珠菌后,出现少食、畏寒、少动的状态,而BLTA组小鼠精神和食欲相对较好,体质量下降缓慢。从免疫器官指数结果来看,感染组小鼠与对照组相比胸腺指数和脾脏指数均有轻度下降(P>0.05);但是在用BLTA处理后小鼠的脏器指数明显增加,与对照组和感染组相比,差异均具有统计学意义(P<0.01)。BLTA组小鼠脾脏指数和胸腺指数的增加,表明BLTA能够促进免疫器官的增殖发育。见表1。

表1 BLAT对小鼠胸腺指数和脾脏指数的影响
2.2BLTA对深部白色念珠菌感染小鼠脾淋巴细胞增殖活性和NK细胞杀伤活性的影响实验发现,免疫低下小鼠感染白色念珠菌后,小鼠脾脏淋巴细胞增殖能力略有下降(P>0.05),NK细胞杀伤活性则下降明显(P<0.05)。在经BLTA处理后,小鼠脾脏淋巴细胞增殖能力和NK细胞杀伤活性明显升高,与对照组和感染组相比,差异均具有统计学意义(P<0.01)。见表2。
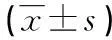
表2 BLTA对小鼠脾淋巴细胞增殖和NK细胞杀伤活性的影响
2.3BLTA对深部白色念珠菌感染小鼠细胞因子分泌的影响实验发现,免疫低下小鼠感染白色念珠菌后,血清中细胞因子IL-2、IL-4和INF-γ水平较感染前有轻微升高,但差异无统计学意义(P>0.05),感染组小鼠IL-10较对照组有明显升高(P<0.05)。经BLTA处理后,血清IL-2和INF-γ水平明显升高,与对照组和感染组相比,差异均具有统计学意义(P<0.05);血清IL-4与感染组相比变化不大,只是比对照组有所升高(P<0.01);血清IL-10水平较感染组有所降低(P<0.01),而与对照组水平持平。见表3。
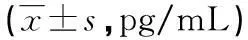
表3 BLTA对小鼠血清IL-2、IL-4、IL-10、INF-γ浓度的影响
3讨论
免疫力低下人群常出现深部白色念珠菌感染[7-9],而白色念珠菌感染后又通过直接或间接作用导致机体免疫功能进一步受到抑制,再加上念珠菌对氟康唑等抗真菌类药物耐药性的不断增强[10-12],给临床念珠菌病的治疗带来很大困难。因此,在念珠菌病临床治疗过程中,除了及时的抗真菌治疗外,尽可能恢复甚至增强受抑制的免疫功能就显得格外重要。本研究应用环磷酰胺降低小鼠免疫功能,并通过尾静脉注射白色念珠菌制备深部感染小鼠模型,以达到模拟免疫低下患者罹患深部念珠菌病的目的。本研究发现,免疫低下小鼠深部感染念珠菌后,机体的免疫功能受到进一步的抑制,表现为胸腺和脾脏指数、脾淋巴细胞增殖活性及NK细胞杀伤活性均较对照组小鼠有所下降,其中NK细胞杀伤活性的下降程度尤为显著(P<0.05);而在经BLTA处理后,胸腺和脾脏指数、脾淋巴细胞增殖活性及NK细胞杀伤活性均明显升高(P<0.01)。研究表明,BLTA可改善免疫低下小鼠的免疫功能状态,恢复甚至增强深部感染念珠菌后受到抑制的免疫应答。
深部念珠菌感染后,机体的免疫应答是一个极其复杂的过程,其中细胞免疫应答在对抗念珠菌感染中发挥着主导作用,而且念珠菌感染的结局很大程度上取决于机体内Th1/Th2型免疫应答何者占据主要地位[13-15]。Stuehler等[16]研究发现,Th1细胞能增加机体对白色念珠菌的抵抗力,而Th2细胞则增加机体的易感性。Th1细胞以分泌IL-2和INF-γ为主,主要参与细胞免疫应答的激活;Th2细胞则主要激活体液免疫应答,并通过其分泌的IL-4和IL-10抑制Th1细胞活性。本研究发现,免疫低下小鼠深部感染念珠菌后,其血清中IL-2、INF-γ和IL-4的水平虽然与对照组相比差别不大(P>0.05),但IL-10的水平明显升高(P<0.05),说明念珠菌感染后免疫应答的确是以Th2型应答为主,而Th1型应答则可能受到抑制。由于IL-2是机体最主要、最强有力的T细胞生长因子,是促使Th0向Th1分化的关键细胞因子;INF-γ则具有巨噬细胞激活因子的作用,能增加巨噬细胞、NK细胞和CTL细胞等的杀伤活性,促进Th0细胞分化为Th1细胞并抑制Th2细胞增生;而IL-4是特征性的Th2型细胞因子,具有抑制Th1型反应的作用;IL-10能抑制Th1细胞功能和细胞因子合成。故念珠菌感染免疫低下小鼠后,很可能通过抑制IL-2、INF-γ的分泌释放,增强IL-10的分泌释放使机体的免疫应答未能及时由Th0向Th1应答转化,导致胸腺和脾脏增殖受到抑制,脾淋巴细胞增殖活性及NK细胞杀伤活性下降,从而造成机体对白色念珠菌抵抗力差,极易出现系统性念珠菌病。在经BLTA处理后,深部念珠菌感染小鼠血清IL-2和INF-γ水平均较感染组明显升高(P<0.01),IL-4水平虽然变化不大(P>0.05),但IL-10水平较感染组明显下降(P<0.01),更接近对照组水平(P>0.05)。说明BLTA能够通过增强IL-2和INF-γ的分泌释放使机体免疫应答由Th0向Th1应答转化,Th1型细胞因子的分泌大大增加,促进胸腺和脾脏增生,增强脾淋巴细胞的增殖活性,提高NK细胞的杀伤活性,使Th1/Th2的紊乱得以纠正,从而提高了机体对白色念珠菌感染的抵抗力。本研究结果说明,BLTA主要激发深部白色念珠菌感染小鼠Th1型细胞的应答,具有良好的调节细胞免疫功能的作用。
参考文献
[1]Miyazaki M,Horii T,Hata K,et al.In vitro activity of E1210,a novel antifungal,against clinically important yeasts and molds[J].Antimicrob Agents Chemother,2011,55(10):4652-4658.
[2]Collette JR,Zhou H,Lorenz MC.Candida albicans suppresses nitric oxide generation from macrophages via a secreted molecule[J].PLoS One,2014,9(4):e96203.
[3]Zheng XF,Hong YX,Feng GJ,et al.Lipopolysaccharide-induced M2 to M1 macrophage transformation for IL-12p70 production is blocked by Candida albicans mediated up-regulation of EBI3 expression[J].PLoS One,2013,8(5):e63967.
[4]Wellington M,Dolan K,Krysan DJ.Live Candida albicans suppresses production of reactive oxygen species in phagocytes[J].Infect Immun,2009,77(1):405-413.
[5]Sevilla MJ,Robledo B,Rementeria A,et al.A fungicidal monoclonal antibody protects against murine invasive candidiasis[J].Infect Immun,2006,74(5):3042-3045.
[6]Kidane YH,Lawrence C,Murali TM.Computational approaches for discovery of common immunomodulators in fungal infections:towards broad-spectrum immunotherapeutic interventions[J].BMC Microbiol,2013,13:224.
[7]Klingspor L,Tortorano AM,Peman J,et al.Invasive Candida infections in surgical patients in intensive care units:a prospective,multicentre survey initiated by the European Confederation of Medical Mycology (ECMM) (2006-2008)[J].Clin Microbiol Infect,2015,21(1):87.
[8]Kumar D,Kumar A,Singh S,et al.Candidemia-induced pediatric sepsis and its association with free radicals,nitric oxide,and cytokine level in host[J].J Crit Care,2015,30(2):296-303.
[9]Eggimann P,Que YA,Revelly JP,et al.Preventing invasive candida infections.Where could we do better?[J].J Hosp Infect,2015,89(4):302-308.
[10]Wang H,Xiao M,Chen SC,et al.In Vitro Susceptibilities of Yeast Species to Fluconazole and Voriconazole as Determined by the 2010 National China Hospital Invasive Fungal Surveillance Net (CHIF-NET) Study[J].J Clin Microbiol,2012,50(12):3952-3959.
[12]Jang MJ,Shin JH,Lee WG,et al.In vitro fluconazole and voriconazole susceptibilities of Candida bloodstream isolates in Korea:use of the CLSI and EUCAST epidemiological cutoff values[J].Ann Lab Med,2013,33(3):167-173.
[13]Richardson JP,Moyes DL.Adaptive immune responses to Candida albicans infection[J].Virulence,2015,6(4):327-337.
[14]Romagnoli G,Nisini R,Chiani P,et al.The interaction of human dendritic cells with yeast and germ-tube forms of Candida albicans leads to efficient fungal processing,dendritic cell maturation,and acquisition of a Th1 response-promoting function[J].J Leukoc Biol,2004,75(1):117-126.
[15]Angulo I,Jiménez-Díaz MB,García-Bustos JF,et al.Candida albicans infection enhances immunosuppression induced by cyclophosphamide by selective priming of suppressive myeloid progenitors for NO production[J].Cell Immunol,2002,218(1/2):46-58.
[16]Stuehler C,Khanna N,Bozza S,et al.Cross-protective TH1 Cells to Aspergillus Fumigatus and Candida albicans[J].Blood,2011,117(22):5881-5891.
Effect of bifidobacterial lipoteichoic acid on cellular immunity of mice with systemic Candida albicans infection*
Wang Pinjia1,Wang Xian2#,Xie Chengbin3△,Wang Yue1
(1.Department of Clinical Microbiology,Chengdu Medical College,Chengdu,Sichuan 610500,China;2.Department of Clinical Laboratory,the Third People′s Hospital of Chengdu,Chengdu,Sichuan 610031,China;3.Department of Clinical Laboratory,Sichuan Provincial Hospital of Children and Women,Chengdu,Sichuan 610045,China)
[Abstract]ObjectiveTo observe the effect of bifidobacterial lipoteichoic acid (BLTA) on cellular immunity of mice with systemic Candida albicans infection.MethodsSystemic C.albicans infection model in immunocompromised mice were established by injecting standard strain of C.albicans via caudal vein.The effects of BLTA on thymus index,spleen index,splenic lymphocytes proliferation and NK cells cytotoxicity were observed as well as serum levels of cytokines.ResultsAfter systemic C.albicans infection in immunocompromised mice,thymus index,spleen index and splenic lymphocytes proliferation activity were decreased (P>0.05),NK cells cytotoxicity was decreased significantly (P<0.05),IL-2,IL-4 and INF-γ levels were increased slightly (P>0.05),IL-10 levels were increased significantly(P<0.05).After treated by BLTA,thymus index,spleen index,splenic lymphocytes proliferation and NK cells cytotoxicity were increased significantly (P<0.01),IL-2 and INF-γ levels were increased significantly (P<0.05),IL-4 levels showed little change,IL-10 levels were decreased significantly (P<0.01).ConclusionBLTA can improve immune status of immunocompromised mice,which can restore and enhance the compromised cellular immunity of mice with systemic C.albicans infection.
[Key words]mice;bifidobacterial lipoteichoic acid;candida albicans;cellular immunity
doi:论著·基础研究10.3969/j.issn.1671-8348.2016.11.008
[中图分类号]R378.99
[文献标识码]A
[文章编号]1671-8348(2016)11-1467-03
(收稿日期:2015-10-28修回日期:2016-01-10)
