镇痛镇静对重型脑损伤患者心率变异性及血清儿茶酚胺变化的影响
2016-06-15丘培利肖建敏王开宇1龚书榕1勇1许镜清1于荣国1
丘培利, 肖建敏, 王开宇1,, 龚书榕1,, 叶 勇1,, 许镜清1,, 于荣国1,
1.福建省立医院 重症医学三科,福州 350001;
镇痛镇静对重型脑损伤患者心率变异性及血清儿茶酚胺变化的影响
丘培利1,2,3, 肖建敏2, 王开宇1,2, 龚书榕1,2, 叶勇1,2, 许镜清1,2, 于荣国1,2
1.福建省立医院 重症医学三科,福州350001;
摘要:目的研究镇痛镇静对重型脑损伤患者早期心率变异性(HRV)及血清儿茶酚胺的影响,明确重型脑损伤患者早期使用镇痛镇静剂的安全性及有效性。方法单中心、前瞻性、非随机对照、开放研究。收集起病48 h内入住外科重症病房(SICU)的重型脑损伤患者34例为研究对象,其中镇静组15例在入住SICU后即予咪达唑仑及舒芬太尼持续镇痛镇静,非镇静组19例按SICU常规治疗。连续3 d监测所有患者同一时间段24 h动态心电图;连续4 d检测所有患者每天8:00血儿茶酚胺(肾上腺素、去甲肾上腺素)水平。收集同期24例体检者作为对照组。结果镇静组及非镇静组的血清儿茶酚胺的水平与正常参考值比较均升高(P<0.05),非镇静组儿茶酚胺水平较镇静组高,但差别无统计学意义(P>0.05)。镇静组和非镇静组的HRV各指标水平均明显小于对照组(P<0.05)。短期预后评估中镇静组的昏迷天数、总住院时间均明显小于非镇静组(P<0.05)。结论重型脑损伤可引起血清儿茶酚胺升高及自主神经功能紊乱。镇痛镇静可以改善自主神经功能紊乱,减少儿茶酚胺分泌,改善短期预后,但仍需大样本的研究以证实。
关键词:脑损伤; 镇痛; 催眠药和镇静药; 心率; 儿茶酚胺类; 交感神经系统; 副交感神经系统
重型颅脑损伤后常常出现自主神经功能紊乱,并发脑心综合征,目前仍无有效的治疗方法。镇痛镇静是其治疗方法之一。但早期使用镇痛镇静剂仍存在争议。本研究通过比较重型脑损伤患者在使用或不使用镇痛镇静剂下早期心率变异性(heart rate variability,HRV)、血清儿茶酚胺水平变化及昏迷天数、住院时间等预后指标变化,对早期使用镇痛镇静药物的安全性及有效性进行评价。
1对象与方法
1.1对象收集2013年3月-2014年3月笔者医院重症医学三科(surgical intensive care unit, SICU)重型脑损伤患者34例为研究对象。参照Colton的研究及《中国脑血管病防治指南》中颅脑外伤、脑血管疾病诊断标准[1-2],纳入标准:(1)颅脑损伤后48 h内入住SICU(包括颅脑外伤、脑血管疾病、颅脑手术后);(2)颅脑CT/CTA明确颅脑损伤诊断;(3)GCS评分在3~8分。排除标准:(1)年龄<16周岁或>75周岁;(2)有心脏疾病(心肌损害、心律失常、心功能衰竭、冠心病等)、脑功能障碍、糖尿病、严重肝功能障碍基础疾病者;(3)循环不稳定,经合理补液后,平均动脉压<55 mmHg或左心室射血分数<30%;(4)穿透性脑损伤、脊髓损伤。选择在同一时期无心脏病史、糖尿病史和服用特殊药物的正常HRV的门诊体检者24例为对照组。本研究方案得到福建医科大学、福建省立医院伦理委员会批准,并在遵循患者或患者家属知情同意原则下进行。
1.2方法
1.2.1分组采用非随机对照分组方法。根据ICU患者镇痛镇静治疗指南及专家共识[3-4],结合临床实际治疗需要,由同一医师将研究对象分为使用镇痛镇静药的镇静组(15例)和未使用镇痛镇静药的非镇静组(19例),如有躁动、机械通气人机对抗、颅内高压的患者进入镇静组。镇静组、非镇静组和对照组3组之间的性别和年龄比较,差别无统计学意义(P>0.05),3组各指标采集在均在同一时间点完成。
1.2.2用药镇静组在纳入后24 h内使用咪达唑仑0.02~0.04 mg·kg-1·h-1持续泵入、舒芬太尼1~3 μg/h持续泵入(舒芬太尼50 μg,咪达唑仑50 mg用生理盐水、葡萄粮液稀释配至50 mL,使舒芬太尼浓度达1 μg/mL、咪达唑仑浓度1 mg/mL),均由同一主任医师根据成人非语言疼痛量表(the adult nonverbal pain scale, NVPS)调整药物剂量[5],维持NVPS≤4分时每4 h评估1次NVPS,NVPS>4分时追加咪达唑仑0.01 mg·kg-1·h-1。
1.2.3基础治疗根据《重型颅脑外伤管理指南》,均予脱水利尿、防治癫痫,营养神经、维持内环境稳定(酸碱、电解质平衡)等治疗,各组除了干预药物的因素不同,其余因素如药物干预、呼吸循环等器官功能支持无明显差别。
1.3监测指标
1.3.1一般资料性别、年龄、体质量、既往史、颅脑损伤情况(鹿特丹CT评分、马歇尔CT分级[6])、纳入时GCS评分、治疗情况、损伤类型。
1.3.2血儿茶酚胺水平入住SICU的前4天(第1~4天)每天早晨8:00在患者安静状态下抽取静脉血4 mL,置于抗凝试管中,立即离心(2 000 r/min,5 min)取上清液(血浆2 mL),存放于-80 ℃冰箱直至统一检测,高效液相色谱分析法测定血清肾上腺素及去甲肾上腺素水平。对比颅脑损伤后血清儿茶酚胺的浓度变化。1.3.3心率变异率纳入研究后连续在第1~3天使用动态心电血压记录仪(CB-1306-C,中健科仪有限公司)行24 h(均为8:00至次日8:00)动态心电图监测。使用心电血压回顾分析系统(版本6.1.8[A.5],中健科仪有限公司)统一分析HRV的时域指标及频域指标,了解颅脑损伤后HRV的变化情况。HRV指标的定义、意义列于表1[7]。

表1 心率变异性各指标的定义及意义
msec、ms:毫秒;AU:抽象值.
1.3.4预后指标死亡率、纳入研究后28 d的GOSE/GOS/GCS评分、ICU住院天数、总住院天数、昏迷天数、机械通气天数。
2结果
2.1研究对象基线资料镇静组、非镇静组和对照组间的性别和年龄比较,差别无统计学意义(P>0.05);镇静组和非镇静组的纳入时GCS评分、鹿特丹CT评分、马歇尔CT分级、既往高血压病史、治疗方法比较,差别也均无统计学意义(P>0.05)。各组研究对象间具有可比性(表2)。
2.2血清儿茶酚胺水平
2.2.1非镇静组和镇静组与正常参考值比较重型脑损伤后,与正常参考值比较,镇静组第2天的肾上腺素水平及非镇静组中第1~4天的肾上腺素水平均明显升高,差别有统计学意义(P<0.05);非镇静组中第2~4天去甲肾上腺素水平较正常参考值明显升高,差别有统计学意义(P<0.05)。表中儿茶酚胺的正常参考值参考《现代医学辞典》[8],即肾上腺素的参考值为0~87.9 pg/mL,去甲肾上腺素为64.1~548.2 pg/mL(表3)。
2.2.2镇静组与非镇静组间比较非镇静组除第3天肾上腺素水平<镇静组,第1天去甲肾上腺素水平<镇静组外,其余非镇静组儿茶酚胺水平均>镇静组,但差别无统计学意义(P>0.05)。2组的肾上腺素水平在第2天短暂下降后又逐渐升高,且以非镇静组更为明显。但各组每天的儿茶酚胺之间变化均无统计学意义(P>0.05,图1)。
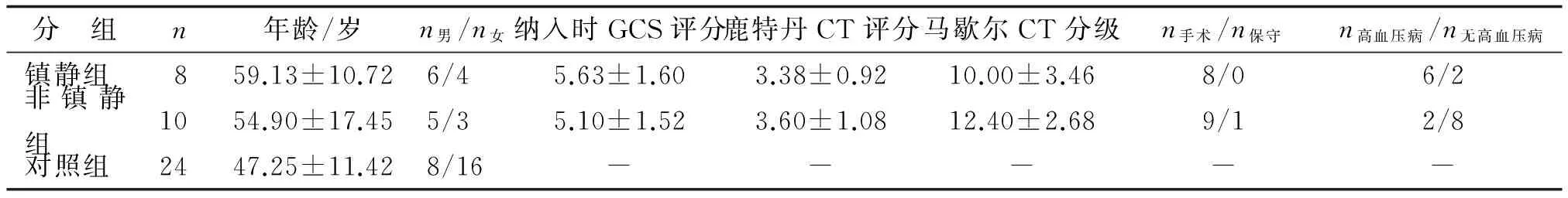
表2 基本资料
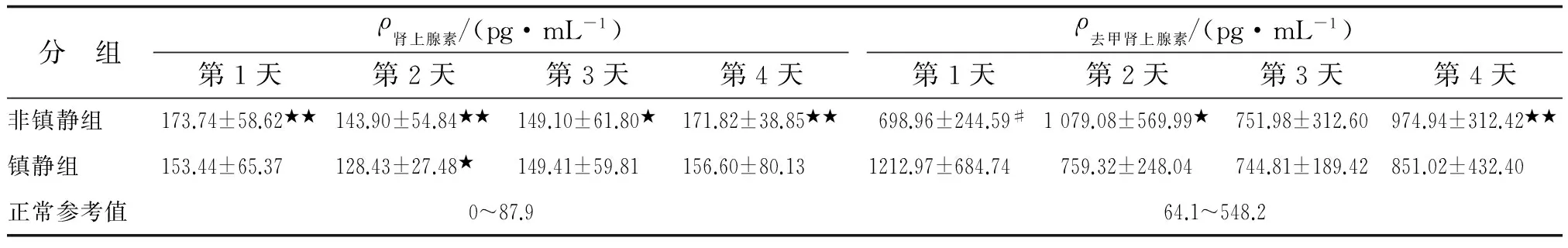
表3 儿茶酚胺检测结果
2.3HRV各指标的变化
2.3.1反映植物神经总活性的指标镇静组及非镇静组第1~3天的SDNN、LF、TP指标均<对照组,除第1天的LF指标差别无统计学意义(P>0.05)外,其余均有统计学意义(P<0.05)。非镇静组SDNN指标均<镇静组;LF指标中,第1,3天非镇静组<镇静组;TP指标中,第3天非镇静组<镇静组,但差别均无统计学意义(P>0.05)。虽然镇静组与非镇静组之间比较,差别无统计学意义(P>0.05),但从第1~3天的变化趋势看,非镇静组的SDNN、LP、TP指标均持续下降,而镇静组在下降后回升(图2)。
2.3.2反映迷走神经活性的指标对照组的RMSDD、PNN50及HF指标均高于重型脑损伤的非镇静组和镇静组患者,其中对照组与实验组之间第1~3天的RMSDD指标比较,差别有统计学意义(P<0.05);PNN50中,第3天非镇静组与对照组比较,差别有统计学意义(P<0.05),余无统计学意义(P>0.05)。重型脑损伤的镇静组和非镇静组之间比较,除了镇静组第1天的HF指标及第2天的RMSDD指标<非镇静组,其余时间反映迷走神经活性的HF、PNN50、RMSDD指标均是非镇静组<镇静组,但差别无统计学意义(P>0.05)。从趋势上看,非镇静组在第3天均有明显下降过程,而镇静组下降得缓慢甚至有所回升(图3)。
2.3.3反映交感神经活性的指标非镇静组和镇静组的SDANN指标均<对照组,但差别无统计学意义(P>0.05,图4)。
2.3.4反映交感和迷走神经平衡的HRV指标非镇静组和镇静组的LF/HF变化明显<对照组。而镇静组与非镇静组之间比较,非镇静组LF/HF值更高,但差别无统计学意义(P>0.05,图5)。
2.4预后指标
2.4.1死亡率34例中,镇静组死亡2例(2/15),非镇静组死亡4例(4/19),2组死亡率比较,差别无统计学意义(χ2检验中Fisher确切概率法P=0.437)。
2.4.2短期预后指标镇静组的昏迷天数和总住院时间圴<非镇静组,差别有统计学意义(P<0.05)。镇静组的ICU住院时间及机械通气天数<非镇静组,但差别无统计学意义(P>0.05)。镇静组的28天GOSE评分、GOS评分、GCS评分均高于非镇静组,但差别无统计学上意义(P<0.05,表4)。
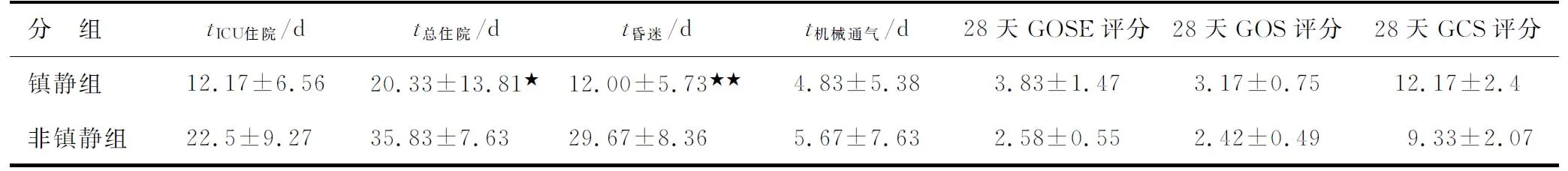
表4 存活患者的短期预后指标
与非镇静组比较,★:P<0.05,★★:P<0.01.
3讨论
重型脑损伤后有8%~33%出现自主神经功能紊乱[9-11],并发的脑心综合征更是常见。咪达唑仑属于新型短效、目前临床上常用的唯一的水溶性苯二氮卓(benzodiazepines,BZ)类药物,可以迅速透过血-脑脊液屏障,随剂量增加起到抗焦虑、镇静、催眠、抗惊厥、抗癫痫及中枢性肌松等作用。其作用机制是与BZ受体结合,通过变构调节作用增强γ氨基丁酸(gamma-aminobutyric acid,GABA)与GABA受体结合,使Cl-通道开放,促使Cl-内流,引起细胞膜的超极化,从而产生中枢神经的抑制效应,减少中枢性儿茶酚胺的释放[12-13]。舒芬太尼是一种强效的阿片类镇痛药,它可以抑制应激反应,减少脑水肿,有一定脑保护作用[14]。“Lund Concept”(隆德概念)中治疗重型颅脑损伤患者的策略之一是以咪达唑仑或异丙酚来持续镇静以降低机体的应激水平及脑的能量代谢从而改善预后[15-16],据此并结合笔者科室临床实际情况,选用咪达唑仑及舒芬太尼。
本研究中,重型颅脑外伤后无论是镇静组还是非镇静组,其血清儿茶酚胺的水平均较正常水平升高,且以非镇静组升高更为明显,这与国内外大量文献报道颅脑外伤后血清儿茶酚胺升高相一致[17-20]。非镇静组儿茶酚胺比镇静组升高更为明显,说明使用镇痛镇静药物可能可减少血清儿茶酚胺的分泌。但其差别在统计学上无意义(P>0.05),考虑可能与样本数小有关,因此需要大样本量的研究来进一步验证重型颅脑外伤后早期使用镇痛镇静药物是否可以减轻交感兴奋、减少儿茶酚胺的分泌。
研究指出,严重颅脑外伤后HRV下降,且HRV分析可以作为重型颅脑外伤患者死亡和不良预后的一个无创性预测指标[21-24]。本研究中,反映植物神经总活性的HRV指标(SDNN、TP、LF)、反映迷走神经活性的指标(RMSDD、PNN50、HF)及反映交感神经与迷走神经之间平衡的指标(LF/HF)在镇静组和非镇静组中均小于对照组,差别有统计学意义,说明颅脑损伤后出现自主神经功能障碍,表现为HRV指标的下降。通常认为HRV指标的下降提示交感神经活性相对占优势[7]。虽然镇静组与非镇静组之间比较,差别无统计学意义(P>0.05),但从图2,3的变化趋势中可以看出,相对于非镇静组各指标的持续下降,镇静组下降得更为缓慢并有回升的趋势,这说明使用镇痛镇静剂的镇静组颅脑损伤后自主神经功能障碍可能更轻,恢复更快。这还需要大样本的研究来进一步验证。而LF/HF指标中,非镇静组比镇静组大,这与非镇静组迷走神经活性下降更明显,交感神经相对更占优势相符合,与已有的研究结果相符[21,25]。
镇静组比非镇静组更少的昏迷天数和总住院时间说明镇痛镇静可改善短期预后。其他短期预后指标中,虽然镇静组均优于非镇静组,但无统计学意义(P>0.05),这可能与病例数较少有关,有待后续加大样本量来进一步证实。
由于危重病患者病情复杂多变、经济有限、中途退出等原因,故纳入实验的病例数少,相关数据部分缺失,导致部分实验数据在统计学上无明显差别;同时因临床实际治疗需要未能做到随机分组,导致研究有潜在偏畸可能。本课题组其他成员将继续延续本研究,从病例的积累、指标的完善和加强长期预后的随访等方面进行研究,以期进一步明确重型脑损伤患者早期使用镇痛镇静剂的安全性及有效性。
参考文献:
[1]Colton K,Yang S,Hu P F,etal.Responsiveness to therapy for increased intracranial pressure in traumatic brain injury is associated with neurological outcome[J].Injury,2014,45(12):2084-2088.
[2]饶明俐.中国脑血管病防治指南[M].北京:人民卫生出版社,2007:26-49.
[3]中国医师协会神经外科医师分会神经重症专家委员会. 重症脑损伤患者镇痛镇静专家共识[J].中华危重病急救医学,2013,25(7):387-393.
[4]Barr J,Fraser G L,Puntillo K,etal. Clinical practice guidelines for the management of pain, agitation, and delirium in adult patients in the intensive care unit[J].CritCareMed,2013,41(1):263-306.
[5]Topolovec-Vranic J,Gelinas C,Li Y,etal.Validation and evaluation of two observational pain assessment tools in a trauma and neurosurgical intensive care unit[J].PainResManag,2013,18(6):107-114.
[6]Maas A I,Hukkelhoven C W,Marshall L F,etal. Prediction of outcome in traumatic brain injury with computed tomographic characteristics: a comparison between the computed tomographic classification and combinations of computed tomographic predictors[J].Neurosurgery,2005,57(6):1173-1182.
[7]Xhyheri B,Manfrini O,Mazzolini M,etal. Heart rate variability today[J].ProgCardiovascDis,2012,55(3):321-331.
[8]刘福岭,栾铭箴,戚仁铎,等. 现代医学辞典[M].济南:山东科学技术出版社,1990:595.
[9]Kirk K A,Shoykhet M,Jeong J H,etal. Dysautonomia after pediatric brain injury[J].DevMedChildNeurol,2012,54(8):759-764.
[10]Lv L Q,Hou L J,Yu M K,etal. Prognostic influence and magnetic resonance imaging findings in paroxysmal sympathetic hyperactivity after severe traumatic brain injury[J].JNeurotrauma,2010,27(11):1945-1950.
[11]Liu Y,Jolly S,Pokala K.Prolonged paroxysmal sympathetic storming associated with spontaneous subarachnoid hemorrhage[J].CaseRepMed,2013,2013:358182.
[12]Champion S,Belcour D,Vandroux D,etal. Stress (Tako-tsubo) cardiomyopathy in critically-ill patients[J].EurHeartJAcuteCardiovascCare,2015,4(2):189-196.
[13]Asiedu M N,Mejia G,Ossipov M K,etal. Modulation of spinal GABAergic analgesia by inhibition of chloride extrusion capacity in mice[J].JPain,2012,13(6):546-554.
[14]Zhang K,Li M,Peng X C,etal. The protective effects of sufentanil pretreatment on rat brains under the state of cardiopulmonary bypass[J].IranJPharmRes,2015,14(2):559-566.
[15]Grände P O. The “Lund Concept” for the treatment of severe head trauma-physiological principles and clinical application[J].IntensiveCareMed,2006,32(10):1475-1484.
[16]Grände P O.PRO:The “Lund Concept” for treatment of patients with severe traumatic brain injury[J].JNeurosurgAnesthesiol,2011,23(3):251-255.
[17]Heffernan D S,Inaba K,Arbabi S,etal. Sympathetic hyperactivity after traumatic brain injury and the role of beta-blocker therapy[J].JTrauma,2010,69(6):1602-1609.
[18]孙克华,刘承基,谭启富,等. 急性脑外伤后儿茶酚胺的改变[J].中华神经外科杂志,1993,9(1):20-23.
[19]Clifton G L,Ziegler M G,Grossman R G. Circulating catecholamines and sympathetic activity after head injury[J].Neurosurgery,1981,8(1):10-14.
[20]Koiv L,Merisalu E,Zilmer K,etal. Changes of sympatho-adrenal and hypothalamo pituitary adrenocortical system in patients with head injury[J].ActaNeurolScand,1997,96(1):52-58.
[21]Kox M,Vrouwenvelder M Q,Pompe J C,etal. The effects of brain injury on heart rate variability and the innate immune response in critically ill patients[J].JNeurotrauma,2012,29(5):747-755.
[22]Wang Y M,Wu H T,Huang E Y,etal. Heart rate variability is associated with survival in patients with brain metastasis: a preliminary report[J].BiomedResInt,2013,2013(6):503421.
[23]Baguley I J,Heriseanu R E,Felmingham K L,etal. Dysautonomia and heart rate variability following severe traumatic brain injury[J].BrainInj,2006,20(4):437-444.
[24]Mark M D,Ryan L. Heart rate variability is an independent predictor of morbidity and mortality in hemodynamically stable trauma patients[J].JTrauma,2011,70(6):1371-1380.
[25]Biswas A K,Scott W A,Sommerauer J F,etal. Heart rate variability after acute traumatic brain injury in children[J].CritCareMed,2000,28(12):3907-3912.
(编辑:张慧茹)
The Effects of Analgesic and Sedative on the Heart Rate Variability and Plasma Catecholamine in Patients after Severe Brain Injury
QIU Peili1,2,3, XIAO Jianmin2, WANG Kaiyu1,2, GONG Shurong1,2,YE Yong1,2, XU Jingqing1,2, YU Rongguo1,2
1.Department of Surgical Intensive Care Unit, Fujian Provincial Hospital, Fuzhou 350001, China;2.College of Provincial Clinical Medicine,Fujian Medical University, Fuzhou 350004, China;3.Department of Anesthesiology, The First Hospital of Longyan Affiliated to Fujian Medical University, Longyan 364000,China
ABSTRACT:ObjectiveTo study the impact of analgesic and sedative on the heart rate variability (HRV) and plasma catecholamine in severe brain injury patients, to evaluate the safety and efficacy of analgesic and sedative early in severe brain injury patients.MethodA prospective, single-center, non-randomized controlled clinical trial was conducted in 34 severe brain injury patients admitted to our Surgical Intensive Care Unit (SICU) within 48 hours of injury.Midazolam and sufentanil were used in the sedated group(n=15) as soon as they were admitted to the SICU.The routine treatments were performed in both sedated group and non-sedated group(n=19).All patients underwent continuous 24 hours Holter monitoring for the same period for 3 consecutive days, and blood samples were drawn at 08:00 every day to check blood catecholamine levels (epinephrine and norepinephrine) for 4 consecutive days.We also collected 24 healthy subjects’ HRV indices from the same period, as normal control group.ResultsAfter severe brain injury, compared with normal reference values, the serum catecholamine levels in both the sedated group and non-sedated group were significantly increased(P<0.05); the epinephrine and norepinephrine levels in non-sedated group were higher than the sedated group, but the difference between them was not statistically significant (P>0.05).The levels of HRV indices in both the sedated group and non-sedated group were significantly less than the normal control group(P<0.05).The sedated group had shorter coma days and total hospital stay than the non-sedated group(P<0.05).ConclusionSevere brain injury can lead to plasma catecholamine levels increased and autonomic nervous system dysfunction.Using of the sedative and analgesic drugs can improve short-term prognosis and may improve autonomic nervous system dysfunction, though the study needs to be confirmed with large sample studies.
KEY WORDS:brain injuries; analgesia; hypnotics and sedatives; heart rate; catecholamines; sympathetic nervous system; parasympathetic nervous system
收稿日期:2015-09-23
基金项目:国家重点专科建设项目[财社2011(170)];福建省卫生厅创新基金(2009-CXB-1)
作者简介:丘培利(1988-),男,住院医师,医学硕士通讯作者: 于荣国. Email: garyyrg@yahoo.com
中图分类号:R331.31; R614; R614.4; R742; R747
文献标志码:A
文章编号:1672-4194(2016)01-0031-07
2.福建医科大学 省立临床医学院,福州350004;
3.福建医科大学 附属龙岩市第一医院麻醉科,龙岩364000
