白黄链霉菌TD-1菌株挥发性有机物对灰霉孢菌的抑制作用
2016-06-14李贞景张春慧路来风武淑芬陈勉华韩昕男王昌禄
李贞景,张春慧,路来风,武淑芬,陈勉华,韩昕男,王昌禄
(天津科技大学食品工程与生物技术学院/食品营养与安全教育部重点实验室,天津300457)
白黄链霉菌TD-1菌株挥发性有机物对灰霉孢菌的抑制作用
李贞景,张春慧,路来风,武淑芬,陈勉华,韩昕男,王昌禄*
(天津科技大学食品工程与生物技术学院/食品营养与安全教育部重点实验室,天津300457)
为探讨白黄链霉菌TD-1菌株挥发性有机物(VOCs)对灰霉孢菌的抑制作用,采用双皿对扣法测定VOCs对灰霉孢菌的抑菌率,通过扫描电镜观察VOCs对灰霉孢菌菌丝体的影响,利用GC/ MS技术对VOCs组分进行分析。结果表明,作用5 d后,6.0 g TD-1菌株麦麸培养物产生的VOCs对灰霉孢菌的抑菌率为66.67%,灰霉孢菌的产孢量(3.9×106个/ cm2)较空白组(5.9×107个/ cm2)显著降低(p<0.01),且菌丝形态异常、表面粗糙,菌体细胞膜通透性增强。TD-1菌株VOCs由63种组分组成,其中2-甲基异冰片(13.52%)和1,4-二甲基金刚烷(14.08%)的相对含量较高。白黄链霉菌TD-1菌株产生的VOCs对灰霉孢菌良好的抑制作用为将其开发成生物熏蒸剂提供了理论依据。
白黄链霉菌;灰霉孢菌;挥发性有机物;抑菌活性
灰霉孢菌(Botrytis cinerea)是引起瓜果蔬菜及大部分果树真菌性病害的主要病原菌之一。其中,由灰霉孢菌引起的灰霉病是导致番茄和葡萄产量和质量下降的最主要病害。统计显示,每年约有20%的番茄产量损失是由灰霉病引起的[1]。因此,加强灰霉病的防治对农业生产和果蔬保鲜具有重要意义。目前,已有植物源和微生物源天然抑菌剂应用于果蔬灰霉病的防治[2],但利用生防菌产生的挥发性有机物(volatile organic compounds,VOCs)抑制灰霉孢菌的报道较少。
链霉菌是植物病害主要的生防菌之一,广泛存在于自然界,其代谢产物可分为挥发性和非挥发性物质,其中挥发性物质因安全性高、抑菌作用强和残留低等优势越来越受到国内外学者的关注[3]。据报道,Streptomyces globisporus JK-1菌株挥发性物质对四季桔青霉病等具有良好的防治作用[4],常温下中等浓度VOCs熏蒸处理(120 g/ L)可以有效降低70.3%的采后砂糖橘果实自然发病率。
目前,对白黄链霉菌(Steptomyces alboflavus)抑菌活性及抑菌物质的研究较少。JI Zhiqin等[5]从白黄链霉菌313中分离纯化出两种新型的环己肽类化合物NW-G08和NW-G09,这两种物质对抗药性金黄色葡萄球菌的抑制效果高于氨苄青霉素。单莉萍等[6]的研究结果表明,白黄链霉菌能产生抑制灰霉病的活性物质,且能通过提高番茄片中抗病相关酶的活性来抵御灰霉病菌的感染。本课题组从饲料厂附近土样中筛选得到一株对串珠镰刀菌具有良好拮抗作用的白黄链霉菌TD-1菌株[7],研究发现,该菌株在麦粒培养物上产生的VOCs对串珠镰刀菌菌落生长直径的抑制作用与该菌株麦粒培养物的质量呈正效应关系,随着培养皿内麦粒培养物质量的增加,其菌落直径逐渐减小,在16 g/皿时,串珠镰刀菌的菌饼5 d未见生长[8 -9]。基于前期研究基础,本研究继续对白黄链霉菌TD-1菌株产生的VOCs对灰霉孢菌的抑菌活性及抗菌物质进行研究,为将其研发成高效、安全、环保的微生物熏蒸剂奠定基础。
1 材料与方法
1.1 供试菌株
白黄链霉菌TD-1(S.alboflavus TD-1),本实验室自天津市宝坻区饲料厂储粮仓附近土样中筛选并保藏于中国微生物菌种保藏管理委员会普通微生物中心(编号:CGMCC No.4666)。Botrytis cinerea,由天津市畜牧兽医研究所提供。
1.2 培养基
链霉菌TD -1活化培养基:高氏一号固体培养基。
链霉菌TD-1种子培养基:葡萄糖65.0 g,黄豆粉10.0 g,KNO30.5 g,MgSO4·7H2O 1.0 g,K2HPO41.0 g,NaCl 0.5 g,KCl 0.2 g,FeSO4·7H2O 0.01 g,自来水1 000.0 mL,pH值7.2。
灰霉孢菌培养基:PDA培养基。
1.3 链霉菌TD-1种子液及麦麸培养物的制备
将TD-1菌株划线接种于高氏一号固体培养基上进行活化,30℃培养5~6 d后制备成106~108CFU/ mL孢子悬液,按1%体积比接种于链霉菌种子培养基中,30℃、180 r/ min摇床培养2 d,得链霉菌TD-1种子液。
取20 g麦麸置于250 mL锥形瓶内,按质量比1∶1加入自来水,121℃、20 min灭菌。接种4.0 mL链霉菌种子液于麦麸上,30℃下培养8 d。
1.4 灰霉孢菌菌饼的制备
取在PDA培养基上培养7 d的灰霉孢菌,无菌水洗下孢子,8层纱布过滤,制成孢子浓度为106~108CFU/ mL的孢子悬液。取1 mL加入到10 mL约40℃的PDA培养基中,摇匀后倒入培养皿中,培养基冷却后,用打孔器打孔,得到直径6 mm的灰霉孢菌菌饼。
1.5 链霉菌TD-1 VOCs抑菌活性的测定
采用双皿对扣法测定TD-1菌株VOCs的抑菌活性[10]。取2个直径为90 mm的培养皿的皿底,一个倒入15 mL PDA培养基,冷却后将灰霉孢菌菌饼置于培养基中央,另一个放置6.0 g TD-1菌株麦麸培养物。将有灰霉孢菌菌饼的皿底对扣于含麦麸培养物的皿底上,封口膜封口,以含有相同质量的无菌麦麸培养皿为空白对照,30℃培养5 d后,采用十字交叉法测定处理组及空白组灰霉孢菌菌落直径,并用式(1)计算TD-1菌株VOCs的抑菌率。

1.6 VOCs对灰霉孢菌产孢能力及菌丝形态的影响实验
1.5中双皿对扣法培养结束后,采用血球板计数各组中灰霉孢菌的孢子数,并在扫描电镜下观察灰霉孢菌的菌丝形态。
1.7 VOCs对灰霉孢菌细胞膜通透性的影响实验
按1.5中的双皿对扣法,下层皿底为TD-1麦麸培养物,上层皿底倒入PDA培养基,冷却后平铺无菌玻璃纸(1.5 cm×1.5 cm)。将0.5 mL孢子悬液均匀涂布于玻璃纸上,以等质量的无菌麦麸为空白对照,封口膜密封,30℃培养一定时间后,5 mL无菌水洗下菌体,离心,分光光度计测定上清液OD260值[11]。
1.8 VOCs的GC/ MS分析鉴定
链霉菌TD-1麦麸培养物培养8 d后,其VOCs用顶空固相萃取法收集后利用GC/ MS分析检测[8],检测条件如下。
气相色谱条件:VF-5MS型色谱柱(30 m×0.25 mm×0.25 μm),进样口温度250℃。载气He纯度99.999%,分流比10∶1,流速1 mL/ min,程序升温,初始温度40℃(保持3 min),以4℃/ min升至150℃(保持1 min),以8℃/ min升至250℃(保持6 min),根据气相色谱峰面积归一法确定各组分含量。
质谱条件:EI离子源,电离能量70 eV,离子阱温度220℃,传输线温度280℃,溶剂延迟时间1.5 min。全扫描方式,扫描范围43~500 m/ z,检索谱库NIST05。
1.9 数据统计与分析
利用SPSS统计分析软件(Version 13.0,SPSS Inc.,Chicago,USA)对各项数据进行分析。用最小显著差数法比较不同处理的差异显著性。
2 结果与分析
2.1 VOCs的GC/ MS分析鉴定
发酵8 d的链霉菌TD -1麦麸培养物产生的VOCs总离子流色谱如图1。通过NIST05数据库比对质谱图和相对保留时间共鉴定出63种挥发性组分,结果如表1。由表1可以看出,在不同培养时间内链霉菌TD-1产生的挥发性物质种类几乎相同,但相对含量变化较大,经GC/ MS分析共鉴定出63种化合物,其中烯烃类、烷烃类和芳香烃类化合物较多。结合图1和表1的结果,链霉菌TD-1麦麸培养物产生的VOCs中二甲基异冰片和1,4-二甲基金刚烷相对含量较高,其相对含量分别为13.52%和14.08%。
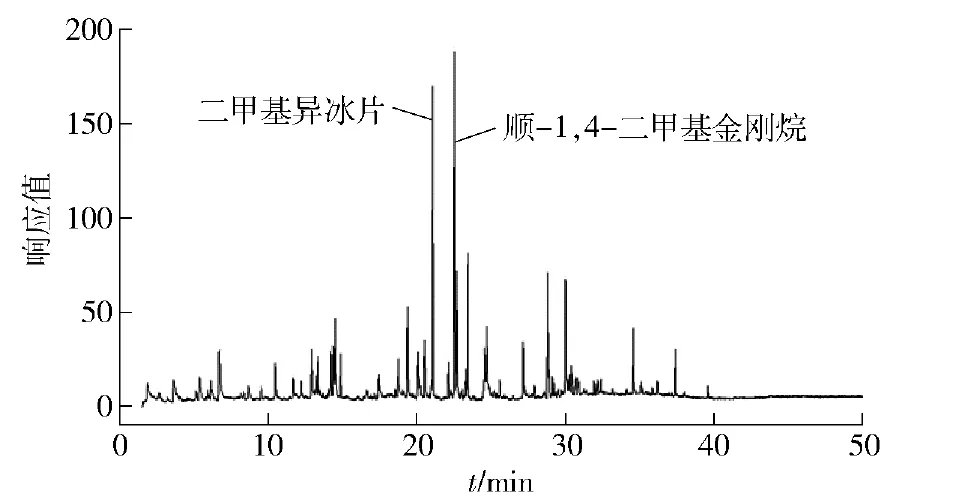
图1 S.alboflavus TD-1麦麸培养物产生VOCs总离子流图Fig.1 Total ion chromatogram of VOCs from S.alboflavus TD-1 grown on autoclaved wheat bran
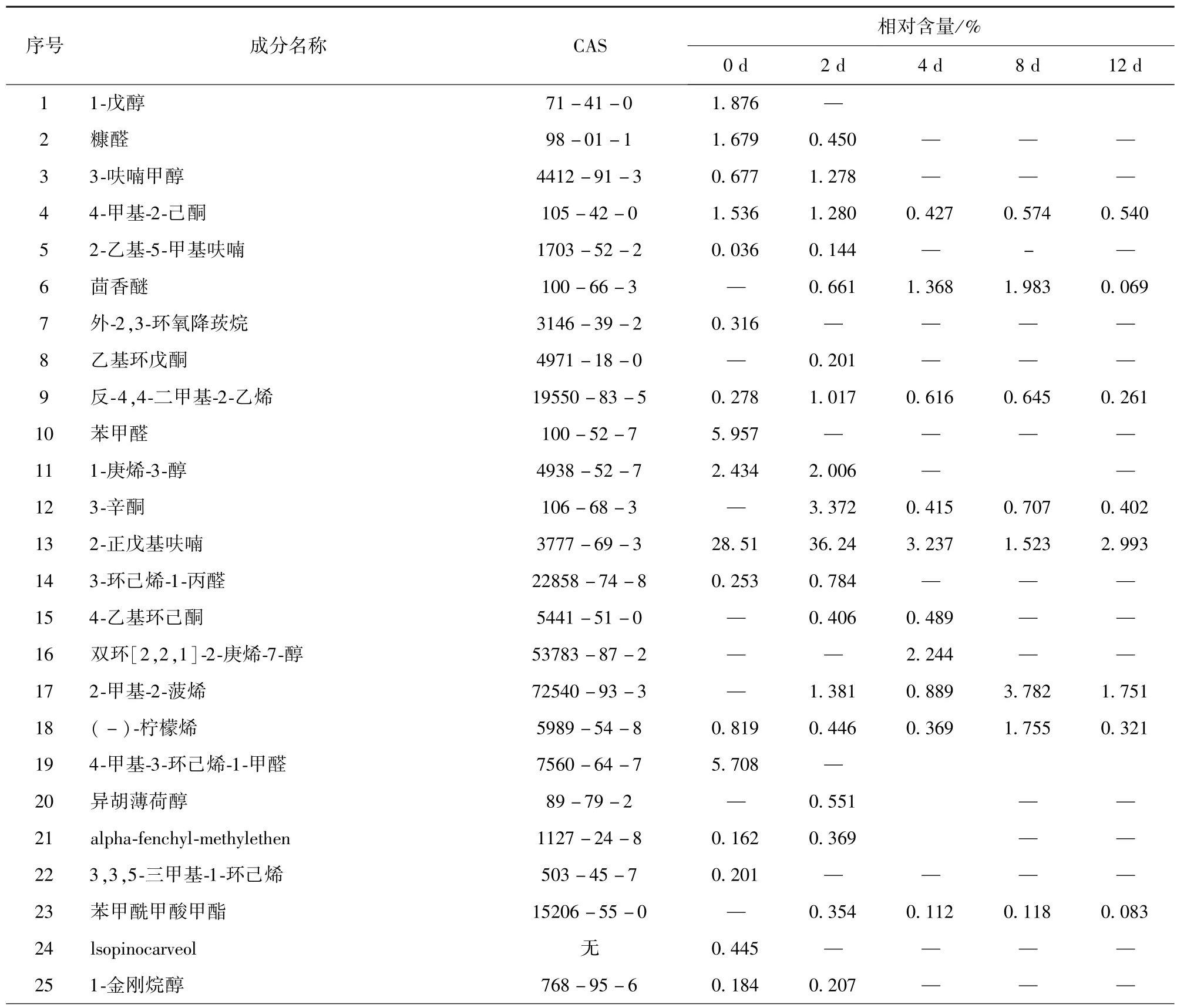
表1 链霉菌TD-1麦麸培养物挥发性成分及相对含量Tab.1 Volatile components and relative contents of S.alboflavus TD-1 bran culture

续表1
2.2 VOCs对灰霉孢菌的抑制作用分析
6.0 g链霉菌TD-1麦麸培养物产生的VOCs对灰霉孢菌的抑制作用结果如图2。空白对照组中灰霉孢菌菌落直径为7.20 cm,而受6.0 g链霉菌TD-1麦麸培养物产生的VOCs作用5 d的灰霉孢菌菌落直径为2.40 cm,对灰霉孢菌的抑菌率达到66.67%。由此可见,链霉菌TD-1麦麸培养物产生的VOCs对灰霉孢菌的生长具有良好的抑制作用。

图2 链霉菌TD-1麦麸培养物产生的VOCs对灰霉孢菌抑制作用Fig.2 Effects of VOCs from S.alboflavus TD-1 grown on autoclaved wheat bran on mycelial growth of B.cinerea
2.3 VOCs对灰霉孢菌产孢能力的影响
6.0 g链霉菌TD-1麦麸培养物产生的VOCs对灰霉孢菌孢子数量的影响如图3。VOCs作用5 d后,实验组中灰霉孢菌孢子数量(3.90×106个/ cm2)明显低于空白对照组(5.90×107个/ cm2)(p<0.01),抑制率为93.39%,表明链霉菌TD-1麦麸培养物产生的VOCs能明显抑制灰霉孢菌孢子的产生。

图3 链霉菌TD-1麦麸培养物产生的VOCs对灰霉孢菌产孢能力的影响Fig.3 Effects of VOCs from S.alboflavus TD-1 grown on autoclaved wheat bran on sporulation of B.cinerea
2.4 VOCs对灰霉孢菌细胞膜通透性的影响
细胞膜是维持细胞完整性及保持正常物质和能量代谢的基础,当细胞膜遭到破坏时,细胞膜通透性增大,胞内的一些蛋白质、磷酸盐、碳酸盐、DNA和RNA等能通过细胞膜释放出来,而这些核内物质在260 nm处有很强的紫外吸收,因此,细胞悬液的OD260值能反应细胞膜的通透性[12 -13]。6.0 g链霉菌TD-1麦麸培养物产生的VOCs对灰霉孢菌核酸泄露的影响如图4。由图4可知,链霉菌TD -1 VOCs作用于灰霉孢菌后,其细胞悬液的OD260值高于空白对照组,表明链霉菌TD-1麦麸培养物产生的VOCs对灰霉孢菌的细胞膜具有一定的破坏作用。
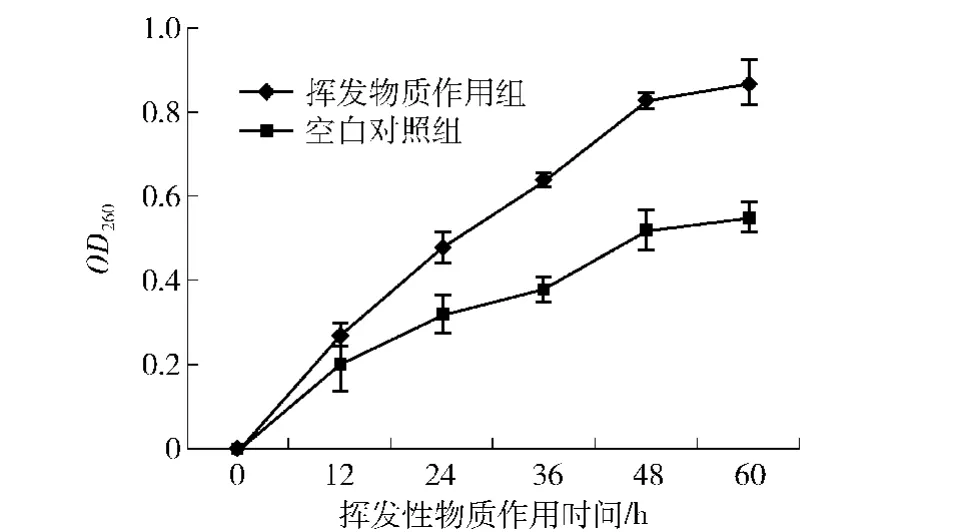
图4 链霉菌TD-1麦麸培养物产生的VOCs对灰霉孢菌细胞膜通透性的影响Fig.4 Effects of VOCs from S.alboflavus TD-1 grown on autoclaved wheat bran on mycelial membrane permeability of B.cinerea
2.5 VOCs对灰霉孢菌菌丝形态的影响
6.0 g链霉菌TD-1麦麸培养物产生的VOCs对灰霉孢菌菌丝形态影响的扫描电镜图如图5。图5结果表明,空白组菌丝形态结构完整,表面光滑,菌丝体圆润饱满,表现出良好的生长状态,能够产生大量孢子。而受VOCs抑制的菌丝生长畸形,表面凹凸不平,粗细不均,菌丝甚至会出现破损现象,只能产生少量的孢子。

图5 链霉菌TD-1麦麸培养物产生的VOCs对灰霉孢菌菌丝形态影响的扫描电镜图Fig.5 Scanning electronic micrographs of hypha of B.cinerea germinated in absence or presence of VOCs from S.alboflavus TD-1 grown on autoclaved wheat bran
3 讨 论
利用微生物代谢的VOCs在密闭条件下防治植物病害是一种新的防治措施,与动、植物源熏蒸剂相比,其具有繁殖快,生长周期短,易改良,适应性强,不受季节限制,易培养等优点。
本实验以灰霉孢菌为指示菌,在离体条件下对S.alboflavus TD-1麦麸培养物产生VOCs进行抑菌活性实验。研究结果表明,6.0 g的S.alboflavus TD-1麦麸培养物产生的VOCs能明显抑制灰霉孢菌的生长,抑制率为66.67%。此外,VOCs还能抑制灰霉孢菌的产孢能力,并使细胞膜通透性增大、细胞形态异常、菌丝表面粗糙、分节增多,这与陈华等[14]、LI等[4]的研究结果相似。本课题组另外的研究结果还表明,S.alboflavus TD-1的发酵液对灰霉孢菌同样具有抑制作用,其中发酵原液体外对灰霉病菌菌生长的抑制率为98.10%,对番茄植株上灰霉病的抑制率为76.98%,且能通过提高番茄叶片中抗病相关酶的活性来抵御灰霉病的感染[6]。S.alboflavus TD-1产生的VOCs对实体植株灰霉病的防治效果及活性酶的影响有待进一步研究。
微生物代谢产生的VOCs的抑菌活性与其组分密切相关。实验结果表明,S.alboflavus TD-1麦麸培养物产生的VOCs由63种组分组成,其中2-甲基异冰片和1,4二甲基金刚烷的含量相对较高。2-甲基异冰片是一种挥发性霉味环叔醇类物质,结构稳定,具有一定的水溶性和脂溶性,在链霉菌中普遍存在[15],且对十字花科植物的种子萌发有一定抑制作用[16]。有关1,4-二甲基金刚烷的抑菌作用还未见报道。因此,S.alboflavus TD-1产生的VOCs对灰霉孢菌抑制活性与2-甲基异冰片和1,4-二甲基金刚烷的相关性还有待深入研究。
[1] 纪军建,张小凤,王文桥,等.番茄灰霉病防治研究进展[J].中国农学学报,2012,28(31):109 -113.JI J J,ZHANG X F,WANG W Q,et al.Research progress on control of tomato gray mold[J].Chinese Agricultural Science Bulletin,2012,28(31):109 -113.
[2] 窦瑞术.3株植物内生细菌对番茄灰霉病的防治效果[J].河南农业科学,2010(4):77 -78.
[3] ARREBOLA E,SIVAKUMAR D,KORSTEN L.Effect of volatile compounds produced by Bacillus strains on postharvest decay in Citrus[J].Biological Control,2010,53(1): 122 -128.
[4] LI Qili,NING Ping,LU Zheng,et al.Fumigant activity of volatiles of Streptomyces globisporus JK-1 against Penicillium italicum on Citrus microcarpa[J].Postharvest Biology and Technology,2010,58(2): 157 -165.
[5] JI Zhiqin,QIAO Gang,WEI Shaopeng,et al.Isolation and characterization of two novel antibacterial cyclic hexapeptides from Streptomyces alboflavus 313[J].Chemistry and Biodiversity,2012,9(8):1567 -1578.
[6] 单莉萍,王昌禄,李贞景,等.链霉菌TD- 1对番茄灰霉病菌的抑制及防御酶活性的影响[J].华北农学报,2015,30(2):100 -103.SHAN L P,WANG C L,LI Z J,et al.Inhibitory effect of Streptomyces alboflavus TD -1 against Botrytis cinerea and its effect on defensive enzymes activity[J].Acta Agriculturae Boreali-sinica,2015,30(2):100 -103.
[7] 刘春静,王昌禄,陈勉华,等.串珠镰刀菌拮抗菌的分离筛选及其抑菌作用[J].粮食与饲料工业,2011 (1):41 -42.
[8] WANG Changlu,WANG Zhifang,QIAO Xi,et al.Antifungal activity of volatile organic compounds from Streptomyces alboflavus TD-1[J].FEMS Microbiology Letters,2013,341(1): 45 -51.
[9] WANG Zhifang,WANG Changlu,LI Fengjuan,et al.Fumigant activity of volatiles from Streptomyces alboflavus TD-1 against Fusarium moniliforme Sheldon[J].Journal of Microbiology,2013,51(4):477 -483.
[10] GU Y Q,MO M H,ZHOU J P,et al.Evaluation and identification of potential organic nematicidal volatiles from soil bacteria[J].Soil Biology and Biochemistry,2007,39(10):2567 -2575.
[11] VIRTO R,MANAS P,ALVAREZ I,et al.Membrane damage and microbial inactivation by chlorine in the absence and presence of a chlorine-demanding substrate [J].Applied and Environmental Microbiology,2005,71(9): 5022 -5028.
[12] 赵世杰,许长成,邹琦,等.植物组织中丙二醛测定方法的改进[J].植物生理学通讯,1991:30(3): 207 -210.
[13] 李文娟.瑞香狼毒抑菌活性及其作用机制的初步研究[D].成都:四川大学,2006.
[14] 陈华,郑之明,余增亮.枯草芽孢杆菌JA脂肽类及挥发性物质抑菌效应的研究[J].微生物学通报,2008,35(1):1 -4.CHEN H,ZHENG Z M,YU Z L.Antagonistic properties of lipopeptides and volatiles produced by Bacillus subtilis JA[J].Microbiology,2008,35(1):1 -4.
[15] WANG C M,CANE D E.Biochemistry and molecular genetics of the biosynthesis of the earthy odorant methylisoborneol in Streptomyces coelicolor[J].Journal of the American Chemical Society,2008,130(2):8908 -8909.
[16] OGURA T,SUNAIRI M,NAKAJIMA M.2-methylisoborneol and geosmin,the main sources of soil odor,inhibit the germination of brassicaceae seeds[J].Soil Science and Plant Nutrition,2000,46(1): 217 -227.
Inhibitory Effect of Volatile Organic Components from Streptomyces Alboflavus TD-1 Against Botrytis Cinerea
LI Zhenjing,ZHANG Chunhui,LU Laifeng,WU Shufen,CHEN Mianhua,HAN Xinnan,WANG Changlu*
(College of Food Engineering and Biological Technology/ Key Laboratory of Food Nutrition and Safety,Ministry of Education,Tianjin University of Science and Technology,Tianjin 300457,China)
The antimicrobial effects of the volatile organic components(VOCs)from Streptomyces alboflavus TD-1 on Botrytis cinerea were tested by two-sealed-base-plates method and illustrated by scanning electron micrographs(SEM).Furthermore,the chemical component of VOCs was analyzed by GC-MS in this study.The results showed that VOCs from S.alboflavus TD-1 grown on autoclaved wheat bran had a certain degree of antifungi activity on the growth of Botrytis cinerea,while the inhibitory ratio reached the strongest with 66.67%after 5 days.The sporulation was significantly inhibited(p<0.01),and morphological abnormalities,rough surface as well as increased cell membrane permeability were observed after 5 days.Additionally,the main chemical components of VOCs were 2-MIB(13.52%)and 1,4-dimethyl adamantine(14.08%).All these results suggest that the VOCs from S.alboflavus TD-1 could be developed into a bio-fumigant.
Streptomyces alboflavus;Botrytis cinerea;volatile organic compounds;antibacterial activity
叶红波)
TS255.3;Q939.95
A
10.3969/ j.issn.2095-6002.2016.03.007
2095-6002(2016)03-0046-07
李贞景,张春慧,路来风,等.白黄链霉菌TD-1菌株挥发性有机物对灰霉孢菌的抑制作用[J].食品科学技术学报,2016,34(3):46 -52.
LI Zhenjing,ZHANG Chunhui,LU Laifeng,et al.Inhibitory effect of volatile organic components from Streptomyces alboflavus TD-1 against Botrytis cinerea[J].Journal of Food Science and Technology,2016,34(3):46 -52.
2015-04 -29
李贞景,男,助理研究员,博士,主要从事发酵食品与微生物资源方面的研究;*王昌禄,男,教授,博士生导师,主要从事食品生物技术方面的研究。通信作者。
