微波真空干制加工对荷叶茶酚类物质含量及其抗氧化活性的影响
2016-06-14刘慧娟郑云展陈燕霞石从桢苏东晓
刘慧娟,郑云展,陈燕霞,石从桢,苏东晓,2,*
(1.长江大学生命科学学院,湖北荆州 434025;2.长江大学荆楚特色食品研发中心,湖北荆州 434025)
微波真空干制加工对荷叶茶酚类物质含量及其抗氧化活性的影响
刘慧娟1,郑云展1,陈燕霞1,石从桢1,苏东晓1,2,*
(1.长江大学生命科学学院,湖北荆州 434025;2.长江大学荆楚特色食品研发中心,湖北荆州 434025)
干制脱水加工被广泛应用于农副产品的保藏和精深加工,但是干制加工会影响产品活性物质的含量,导致其生物活性发生改变。为了研究微波真空干制功率对荷叶酚类物质的影响,比较了300,400,500 W等不同微波功率真空干制及热风干燥、日晒条件下,荷叶酚类物质含量变化;采用DPPH和FRAP方法比较不同微波功率产品的抗氧化活性差异。结果表明,荷叶经微波真空干制加工后,总酚和总黄酮含量较热风干燥法显著提高,分别是后者的1.79和1.76倍;荷叶提取物抗氧化活性显著提高,微波真空干制荷叶清除DPPH·活性优于热风干燥方式,300,400,500 W微波功率干制荷叶清除DPPH·IC50值分别是62.52,49.31,43.59 μg/ mL;微波功率500 W干制荷叶提取物FRAP抗氧化活性分别是日晒荷叶和热风干燥荷叶的3.18和1.82倍。抗氧化活性指标与酚类物质含量相关性分析发现,荷叶总黄酮含量与FRAP和DPPH为极显著相关,表明微波真空干制能够显著影响荷叶酚类物质含量,进而增强其抗氧化活性。
荷叶;真空微波;酚;抗氧化;自由基
中国莲(Nelumbo nucifera Gaertn.)为睡莲科莲属,主要分布在长江、黄河和珠江三大流域[1 -2]。荷叶(lotus leaf)是中国莲的叶,被国家卫生和计划生育委员会列入“既是食品又是药品”的名单之中[3]。现代医学研究表明,荷叶具有优良的调节血脂、抗氧化和抗病毒等功效[4 -8]。
据估计仅湖北省每年有40万吨荷叶待开发。然而由于荷叶采收季节性强,仅有少部分荷叶被用于医疗和食品等行业,其余自然凋零废弃在池塘中或被收集焚烧而未被利用,造成极大的资源浪费和较严重的环境污染。国内已有荷叶加工的初步研究,但是,由于目前开发的荷叶茶仍旧使用传统绿茶干燥生产工艺,而荷叶中的活性成分黄酮类物质热稳定性较差,长时间的高温干燥,会造成活性成分大量损失,降低产品生物功效,因此,有必要创新荷叶茶的加工工艺并开发新的荷叶茶产品。
脱水干制加工是水果、蔬菜和中草药原料保藏和精深加工的重要手段。自然晒干[9]、热风干燥[10]、红外干燥[11]、微波干燥[12]等干制方式已被用于食品脱水干制,并取得良好效果。由于传统的干燥方法干燥时间长、产品品质较差,科学家已开发出干燥能效和产品品质更高的脱水方法——微波真空干燥技术。微波可以快速传递热量,真空能够及时除去干燥产生的水蒸气,并维持干燥过程在一个较低的温度条件下进行[13],有利于热敏性生物活性物质的保留,提高产品生物功效。真空微波干燥技术已广泛用于蔬菜[14 -15]、水果[16]、香辛料[17]和肉制品[18]等食品加工中,并且取得良好效果。
本研究比较了300,400,500 W等不同功率微波真空干制以及热风干燥、日晒条件下荷叶酚类物质含量变化和抗氧化活性差异,旨在探讨微波加工对荷叶活性物质的影响,为其精深加工和功能食品开发提供科学依据。
1 材料与方法
1.1 材料与仪器
荷叶于2015年7月采自湖北省荆州市太湖。
DPPH(1,1-diphenyl-2-picryldydrazyl)、TPTZ (2,4,6-tripyridyl-s-triazine)、Trolox(6-hydroxy-2,5,7,8-tetramethy lchroman-2 -carboxylic acid),购自美国Sigma公司;优级纯硫酸亚铁和福林酚试剂,购自西亚试剂公司;其他试剂均为国产分析纯。
ORW08S-3Z型微波真空干燥机,南京奥润微波科技有限公司;1-2LD-Plus型真空冷冻干燥仪,德国Marin Christ公司;DHG-9076A型电热恒温鼓风干燥箱,上海精宏实验设备有限公司;UV -1800型紫外可见分光光度计,日本岛津公司;2300 En-Spire型多功能酶标仪,美国PerkinElmer公司。
1.2 实验方法
1.2.1 荷叶的微波真空干制工艺
挑选新鲜荷叶,剪成长条,微波真空干燥(真空度0.01 MPa,微波功率500,400,300 W,干至水分含量介于4.5%~5.0%),包装。按微波干燥功率分别标记为MV500,MV400和MV300贮存备用。
荷叶热风干燥[10,19](hot air drying)控制产品水分含量与微波真空干燥产品一致,标记为HAD。日晒荷叶产品(sun drying)标记为SD。新鲜荷叶(fresh lotus leaf)标记为FLL。
1.2.2 荷叶酚类物质的提取
荷叶酚类物质提取参考Hossain等[20]的方法并稍作修改。将荷叶干制产品通过万能粉碎机粉碎,过40目筛。称取2 g荷叶粉按照质量体积比1∶20的比例加入80%甲醇水溶剂,室温超声提取10 min,5 000 r/ min离心8 min,收集上清液,沉底部分按照上述条件重复提取一次。合并两次离心上清液,真空条件下45℃蒸发近干,用体积比为85∶15的甲醇与水溶液定容至25 mL,-80℃冷藏备用。
1.2.3 荷叶总酚含量测定
荷叶总酚含量测定方法[20]:准确吸取样品或标品(125 μL)加入0.5 mL去离子水和125 μL福林酚试剂,漩涡振荡器充分摇匀,静置6 min后加入1.25 mL质量体积比为70 g/ L的Na2CO3溶液和1 mL去离子水,振荡混匀,室温条件下置于暗室反应90 min,采用紫外分光光度计测定其760 nm吸光度。以没食子酸为标准,总酚含量按照每克荷叶干品中没食子酸质量(GAE)表示,单位为mg/ g。
1.2.4 荷叶总黄酮含量测定
荷叶总黄酮含量测定[20]:向1.5 mL去离子水中加入300 μL提取物或标品和90 μL质量浓度为50 g/ L的NaNO2溶液,漩涡振荡混匀,静置6 min后加入180 μL质量浓度为100 g/ L的AlCl3·6H2O溶液,振荡混匀,反应5 min后再加入0.6 mL NaOH (1 mol/ L)溶液,最后加去离子水至3 mL,510 nm测定其吸光度。以芦丁为标准品,总黄酮含量以每克荷叶干品中所含芦丁质量(RE)表示,单位为mg/ g。
1.2.5 荷叶抗氧化活性分析
1.2.5.1 DPPH·清除能力测定
参考Thaipong等[21]的方法并稍作修改。配置0.1 mmol/ L DPPH甲醇溶液,将各样品稀释至0.02,0.04,0.06,0.08,0.10 g/ L。将1 mL样品和2 mL DPPH·溶液充分混匀后,避光反应30 min,测定其在517 nm处的吸光值。每个样品做3次重复实验。荷叶甲醇提取物清除DPPH·的能力按照式(1)计算。
DPPH·清除率=[1 -(A样品- A对照)/ A空白]×100%。(1)
式(1)中,A空白为1 mL甲醇与2 mL 0.1 mmol/ L DPPH溶液的混合液在517 nm处的吸光度值,A样品为1 mL样品溶液与2 mL 0.1 mmol/ L DPPH溶液的混合液在517 nm处的吸光度值,A对照为1 mL样品溶液与2 mL甲醇的混合液在517 nm处的吸光度值。
1.2.5.2 FRAP抗氧化能力测定
参考Thaipong[21]的方法并稍作修改。FRAP工作液的制备:0.3 mol/ L醋酸钠缓冲液(pH = 3.6),20 mmol/ L FeCl3和10 mmol/ L TPTZ以体积比为10∶1∶1,漩涡振荡混匀后置于37℃水浴锅中恒温备用。
测定方法:取30 μL样品加90 μL蒸馏水,加900 μL FRAP工作液,摇匀后避光保存30 min后于593 nm测其吸光值。以Trolox溶液作为标准样品绘制标准曲线。根据标准曲线,得到各多糖的FRAP抗氧化能力值,以每克干品中所含Trolox质量(μmol / g)表示。
1.3 结果统计分析
每个指标同一样品重复测定3次,结果以平均值±标准差(M±SD)表示。采用SPSS 13.0统计软件进行单因素方差分析,并以S-N-K检验比较各组间显著性差异,显著性水平为p<0.05,不同处理间显著性差异用不同小写字母表示。
2 结果与分析
2.1 荷叶总酚含量分析
总酚和总黄酮含量能够初步反映果蔬生物活性物质含量。脱水干制方式对总酚和总黄酮含量影响显著。不同功率微波真空干制及其他干制方式对荷叶总酚含量的影响见图1。随着微波真空干制功率从300 W提高到500 W,干燥时间缩短,微波功率500 W荷叶甲醇提取物总酚含量较300,400 W显著提高(p<0.05),表明微波功率显著影响荷叶总酚含量,这可能与干燥时间有关。然而,后两者总酚含量接近,差异不显著。微波真空干制较热风干燥或日晒脱水方式荷叶总酚含量从(29.13±2.66)mg/ g提高到(52.08±3.77)mg/ g,分别显著(MV400和MV300)和极显著(MV500)提高。微波真空干燥500 W条件下荷叶总酚含量较新鲜荷叶小,但二者差异不显著(p>0.05),表明真空微波脱水干燥方式能够较好保留荷叶中酚类物质。
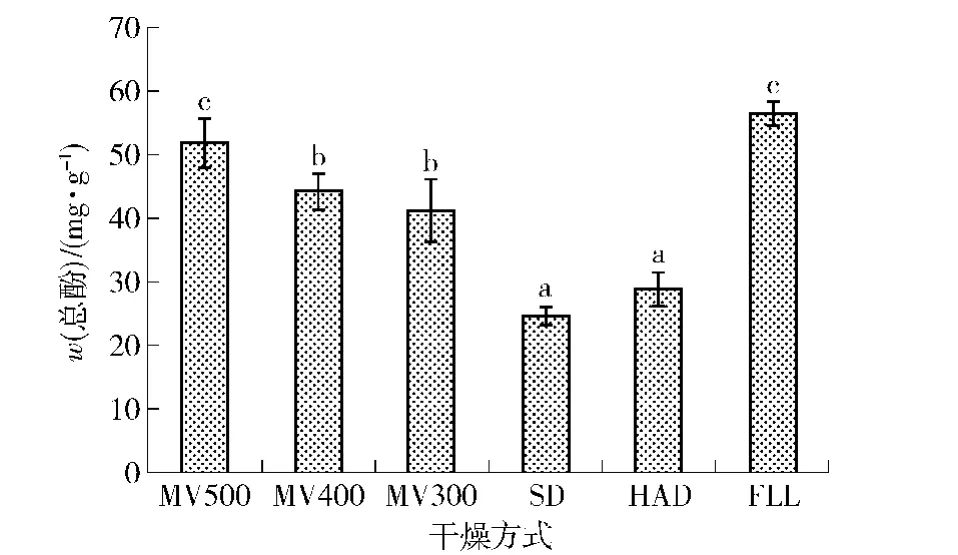
图1 不同干燥方式时荷叶提取物总酚变化情况Fig.1 Phenolics content of lotus leaf extacts treated by different drying ways
2.2 荷叶总黄酮含量分析
微波真空干制功率以及其他干燥方式对荷叶总黄酮含量的影响见图2。微波真空干制功率从300 W提高到500 W,干燥至特定水分含量所需时间大幅缩短,荷叶中总黄酮含量从(21.53±2.45)mg/ g提高到(31.02±0.61)mg/ g,微波功率400 W和500 W荷叶甲醇提取物总黄酮含量较300 W分别显著提高13.64%和44.04%(p<0.05),表明荷叶总黄酮含量与微波干制功率正相关。微波真空干制荷叶总黄酮含量较传统热风干燥或日晒脱水产品总黄酮含量保留率显著提高,从热风干制的(17.55± 0.28)mg/ g或日晒脱水的(13.38±0.43)mg/ g提高到(31.02±0.61)mg/ g,这可能与干燥时间和温度对黄酮含量的影响有关。新鲜荷叶中黄酮类化合物含量较高((35.86±1.03)mg/ g),较微波真空干燥500 W条件下荷叶总黄酮含量显著高出约15.62%(p<0.05)。研究结果表明,微波真空干燥较热风或日晒脱水方式好,短时间的真空微波脱水干燥方式能够较多地保留荷叶中酚类物质。

图2 不同干燥方式时荷叶提取物总黄酮变化情况Fig.2 Flavonoids content of lotus leaf extacts treated by different drying ways
2.3 荷叶黄酮的DPPH·清除率分析
二苯代苦味酞基自由基(DPPH·)是一种以氮为中心的稳定型自由基,天然黄酮类化合物对其清除作用的大小,表示该化合物降低羟自由基、烷自由基或过氧化自由基的有效浓度和终止脂质过氧化链反应的作用能力大小。DPPH·有个单电子,在波长517 nm处有强吸收,其甲醇水溶液呈深紫色,加入抗氧化物质后,可以动态监测其对DPPH·的清除效果。图3为不同干制方式对荷叶提取物清除DPPH·活性比较结果。由图3可知,不同微波功率干制以及其他干燥方式荷叶黄酮甲醇提取物与DPPH·清除率都存在剂量依赖关系,且相同浓度下400 W和500 W微波真空干制方式荷叶的清除活性明显高于300 W及热风和日晒产品。MV500、MV400和MV300 在0.02~0.10 g/ L的DPPH·清除率分别是23.22%~75.21%,20.29% ~70.73%和16.27% ~64.55%;HAD和SD在0.02~0.10 g/ L,清除率分别是15.25%~58.76%和12.44%~53.93%,表明微波真空干制方式对荷叶甲醇提取物清除DPPH·活性强于热风干燥和日晒产品提取物。
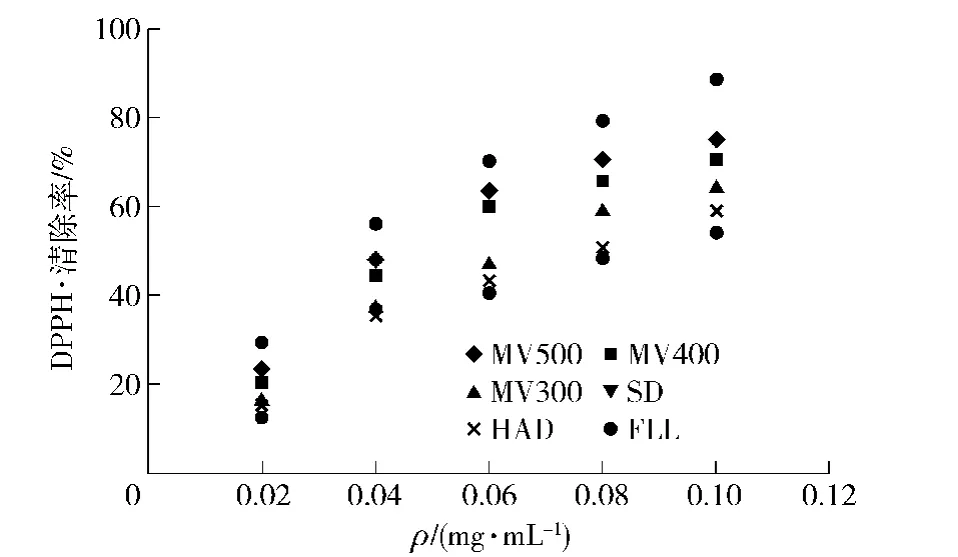
图3 不同干燥方式时荷叶提取物DPPH·清除率Fig.3 DPPH·scavenging ability of lotus leaf extacts treated by different drying ways
不同干制方式荷叶提取物清除DPPH·IC50值见图4。通过不同功率微波真空干制荷叶清除DPPH·,IC50值分别为43.59,49.31,62.52 μg/ mL。微波功率500 W和400 W荷叶提取物清除自由基能力相当(p>0.05),二者较功率300 W荷叶产品清除活性提高,且差异显著(p<0.05);不同功率微波真空干燥荷叶清除自由基活性均比热风干燥和日晒产品能力强,差异均为显著水平(p<0.05),表明微波真空干制荷叶清除DPPH·活性较热风干燥或日晒脱水产品好,且MV500和MV400产品清除自由基能力较MV300好。

图4 不同干燥方式时荷叶黄酮清除DPPH·活性Fig.4 DPPH·cleaning IC50value of lotus leaf extracts treated by different drying methods
2.4 荷叶黄酮的FRAP抗氧化能力分析
抗氧化物质可将Fe3 +-TPTZ复合物还原成深蓝色的Fe2 +-TPTZ复合物,该蓝色复合物在593 nm处有最大吸收值,因此可根据吸光值的大小计算样品抗氧化活性的强弱。不同微波功率对荷叶提取物FRAP抗氧化活性影响见图5。随着微波功率提高,相同料液比不同功率荷叶提取物还原三价铁离子能力逐渐提高,且3个功率间差异显著(p<0.05)。微波功率MV500荷叶提取物FRAP抗氧化活性分别是SD和HAD产品的3.18和1.82倍,微波干制抗氧化能力均显著高于CD和HAD方式,表明微波真空干制荷叶FRAP抗氧化活性较热风干燥或日晒脱水产品好,且MV500产品抗氧化活性较MV400 和MV300好。
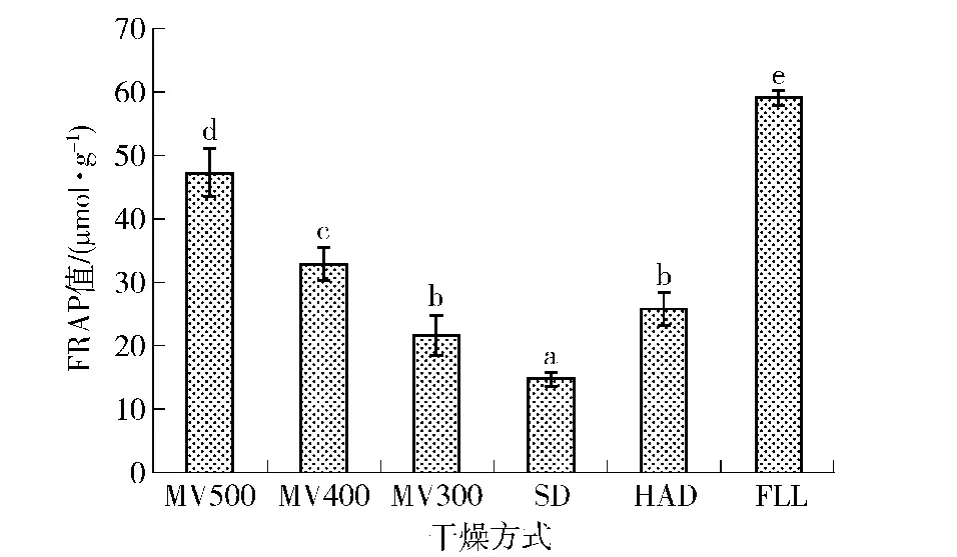
图5 不同干燥方式时荷叶FRAP抗氧化活性Fig.5 FRAP value of lotus leaf extracts treated by different drying methods
3 讨 论
农副产品可以通过日晒、热风干燥和真空微波干制等多种方式脱水,然而不同干制方式直接影响活性物质含量。本研究发现,与热风干燥和日晒相比,真空微波干燥生产荷叶茶可以显著提高其总酚和总黄酮含量,这可能与干燥温度和干燥时间有关。真空微波干燥也有利于酚类物质的溶出,从而提高其抗氧化活性。Therdthai等[19]比较了微波真空干燥与热风干燥对薄荷叶产品干燥效率和品质的影响,发现微波真空干燥可以大幅减少干燥时间,节约时间约85%~90%,而且脱水薄荷叶明度、绿度和黄度均明显提升;扫描电镜显微结构发现,真空微波干燥薄荷叶结构疏松均匀、孔径增大、孔隙增多,且复水时间短。真空微波干燥与传统焙炒或热风干燥等方法相比,干燥时间大幅缩短,这对于荷叶等含有热敏性活性成分材料而言,可以增加黄酮等具有生物活性物质的保留率。真空微波干燥能够增加和增大产品内部孔径,有助于活性物质在短时间内冲泡浸出,提高利用率,因此,采用真空微波干燥的方式生产荷叶茶具有明显优势。
植物提取物抗氧化活性与其总酚和总黄酮含量具有相关性[20]。本研究通过分光光度法测定荷叶提取物酚类物质含量;通过FRAP和DPPH法分析不同微波功率条件下以及热风干燥和日晒干燥荷叶干品提取物抗氧化活性,发现荷叶提取物含有丰富的酚类物质,具有较好抗氧化活性。抗氧化活性指标FRAP和DPPH与总酚、总黄酮相关性分析发现,总酚和总黄酮含量显著相关,提示荷叶酚类物质可能主要是黄酮类物质,干制过程中酚类物质损失可能与黄酮类化合物发生改变有关。抗氧化活性指标与酚类物质含量相关性分析发现,荷叶总黄酮含量与FRAP和DPPH均为极显著相关(p<0.01),而总酚与FRAP未达到极显著相关水平,因此推测荷叶中发挥FRAP抗氧化活性和清除DPPH·的活性物质可能是黄酮类化合物。
4 结 论
比较了300,400,500 W等不同微波真空干燥功率以及不同干制方式对荷叶酚类物质含量和抗氧化活性的影响,结果表明,采用微波干制方式提高微波功率,能够较好地提高荷叶中总酚和总黄酮含量及其抗氧化活性。与热风干燥和日晒脱水方式相比,微波真空干燥荷叶总酚和总黄酮含量较热风干燥法显著提高,分别是后者的1.79和1.76倍,是日晒脱水方式的2.11和2.32倍;300,400,500 W微波功率干制荷叶清除DPPH·IC50值分别是62.52,49.31,43.59 μg/ mL,较热风干燥和日晒脱水方式显著降低;微波功率500 W荷叶提取物FRAP抗氧化活性分别是热风干燥荷叶和日晒荷叶茶的1.82和3.18倍。荷叶抗氧化活性与其黄酮类化合物含量极显著相关,由此可见,干制方式及干燥工艺参数能够影响荷叶中总酚和总黄酮等活性物质的含量,进而改变其抗氧化活性。本研究结果可为荷叶茶开发提供理论依据。
[1] 田娜,刘仲华,黄建安,等.高效制备液相色谱法从荷叶中分离制备黄酮类化合物[J].色谱,2007,25 (1): 88 -92.TIAN N,LIU Z H,HUANG J A,et al.Isolation and preparation of flavonoids from the leaves of Nelumbo nucifera Gaertn by preparative reversed-phase high performance liquid chromatography[J].Chinese Journal of Chromatography,2007,25(1):88 -92.
[2] 郑虎占,董泽宏,余靖.中药现代研究与应用:四卷[M].北京:学苑出版社,1998: 3583 -3597.
[3] 蒋益虹.荷叶黄酮的乙醇提取工艺优化研究[J].农业工程学报,2004,20(4): 168 -171.JIANG Y H.Optimum extracting technology of flavonoids in lotus leaves with ethanol[J].Chinese Society of Agricultural Engineering,2004,20(4):168 -171.
[4] SRIDHAR K R,RAJEEV B.Lotus: a potential nutraceutical source[J].Journal of Agricultural Technology,2007,3(1): 143 -153.
[5] KUO Y C,LIN Y L,LIU C P,et al.Herpes simplex virus type 1 propagation in HeLa cells interrupted by Nelumbo nucifera[J].Journal of Biomedical Science,2005,12(6): 1021 -1034.
[6] ONO Y,HATTORI E,FUKAYA Y,et al.Anti-obesity effect of Nelumbo nucifera leaves extract in rats and mice [J].Journal of Ethnopharmacology,2006,106(2): 238 -244.
[7] ELEGAMI A A.BATES C,GRAY A I,et al.Two very unusual macrocyclic flavonoids from the water lily Nymphaea lotus[J].Phytochemistry,2003,63(6): 727 -737.
[8] ZHOU T Y,LUO D H,LI X Y,et al.Hypoglycemic and hypolipidemic effects of flavonoids from lotus(Nelumbo nuficera Gaertn.)leaf in diabetic mice[J].Journal of Medicinal Plants Research,2009,3(4): 290 -293.
[9] PEHIVAN D.Modelling of thin layer drying kinetics of some fruits under open-air sun drying process[J].Journal of Food Engineering,2004,65(3): 413 -425.
[10] VEGA A,Uribe E,Lemus R,et al.Hot-air drying characteristics of Aloe vera(Aloe barbadensis Miller)and influence of temperature on kinetic parameters[J].LWT-Food Science and Technology,2007,40(10): 1698 -1707.
[11] NOWAK D,LEWICKI P P.Infrared drying of apple slices[J].Food Engineering,2004,5: 353 -360.
[12] WANG J,XI Y S.Drying characteristics and drying quality of carrot using a two-stage microwave process[J].Journal of Food Engineering,2005,68(4): 505 -511.
[13] BONDRUK J,MARKOWSKI M,BłASZCZAK W.Effect of drying conditions on the quality of vacuummicrowave dried potato cubes[J].Journal of Food Engineering,2007,81(2): 306 -312.
[14] SONG X J,ZHANG M,MUJUMDAR A S,et al.Dr-ying characteristics and kinetics of vacuum microwavedried potato slices[J].Drying Technology,2009,27 (9): 969 -974.
[15] NAHIMANA H,ZHANG M.Shrinkage and color change during microwave vacuum drying of carrot[J].Drying Technology,2011,29(7): 836 -847.
[16] ERLE U,SCHUBERT H.Combined osmotic and microwave-vacuum dehydration of apples and strawberries [J].Journal of Food Engineering,2001,49(2/3): 193 -199.
[17] ADAMSKI M,CARBONELL-BARRACHINA Á A.Effects of vacuum level and microwave power on rosemary volatile composition during vacuum-microwave drying[J].Journal of Agricultural and Food Chemistry,2011,103(2): 219 -227.
[18] LAOPOOLKIT P,SUWANNAPORN P.Effect of pretreatments and vacuum drying on instant dried pork process optimization[J].Meat Science,2011,88(3): 553 -558.
[19] THERDTHAI N,ZHOU W.Characterization of microwave vacuum drying and hot air drying of mint leaves (Mentha cordifolia Opiz ex Fresen)[J].Journal of Food Engineering,2009,91(3): 482 -489.
[20] HOSSAIN M A,MIZANUR RAHMAN S M.Total phenolics,flavonoids and antioxidant activity of tropical fruit pineapple[J].Food Research International,2011,44(3): 672 -676.
[21] THAIPONG K,BOONPRAKOB U,CROSBY K,et al.Comparison of ABTS,DPPH,FRAP,and ORAC assays for estimating antioxidant activity from guava fruit extracts[J].Journal of Food Composition and Analysis,2006,19(6/7): 669 -675.
Effect of Microwave Vacuum Drying on Contents of Phenolic and Antioxidant Activity of Lotus Leaf Tea
LIU Huijuan1,ZHENG Yunzhan1,CHEN Yanxia1,SHI Congzhen1,SU Dongxiao1,2,*
(1.College of Life Science,Yangtze University,Jingzhou 434025,China;2.Research and Development Center of Special Food of Jingchu,Yangtze University,Jingzhou 434025,China)
Drying is commonly used for preservation and deep processing of agricultural byproducts.However,the contents of active substances may be altered during the drying process,resulting in decrease of biological activities.In order to study the effect of power of microwave vacuum drying on phenolic substances in lotus leaf tea,effects of microwave drying under different power(300,400,and 500 W),hot air drying,and sun drying on the contents of phenolic compounds and its antioxidant activity in lotus leaf tea were investigated.DPPH radical scavenging capacity and ferric reducing antioxidant power (FRAP)were used to analyze the antioxidant activities.The results showed that the contents of total phenolcis and total flavonoids in lotus leaf tea treated by microwave vacuum drying were 1.79 and 1.76 folds higher than those of traditional hot air drying products.Microwave vacuum drying lotus leaf exhibited higher antioxidant activity in DPPH·scavenging activity(IC50values 62.52,49.31,43.59 μg/ mL,respectively)comparing to hot air drying products.In addition,the FRAP value of microwave vacuum drying(500 W)samples was 3.18 and 1.82 folds higher than that of sun drying and hot air drying smaples.The Pearson correlation analysis between antioxidant activity and phenolic compounds showed that the content of total flavonoids in lotus leaf was significantly correlated with DPPH and FRAP,indicating that the microwave vacuum drying would significantly affect the content of phenolic compounds in lotus leaf,and then enhance its antioxidant activity.
lotus;microwave vacuum drying;phenolic;antioxidant activity;free radicals
叶红波)
TS255.1;TS272.5;TS201.2
A
10.3969/ j.issn.2095-6002.2016.03.006
2095-6002(2016)03-0040-06
刘慧娟,郑云展,陈燕霞,等.微波真空干制加工对荷叶茶酚类物质含量及其抗氧化活性的影响[J].食品科学技术学报,2016,34(3):40 -45.
LIU Huijuan,ZHENG Yunzhan,CHEN Yanxia,et al.Effect of microwave vacuum drying on contents of flavonoids and antioxidant activity of lotus leaf tea[J].Journal of Food Science and Technology,2016,34(3):40 -45.
2016- 05- 09
长江大学青年科研支持计划基金项目(2015CQN62);长江大学荆楚特色食品研发中心开放基金项目(2015JSF01)。
刘慧娟,女,硕士研究生,研究方向为功能食品;*苏东晓,男,讲师,博士,主要从事果蔬副产物综合利用研究。通信作者。
