高纯度苏丹红单体的高效逆流色谱纯化研究
2016-06-14李培根曹学丽
李培根,王 钊,曹学丽
(北京工商大学食品学院/北京市食品添加剂工程技术研究中心/食品质量与安全北京实验室,北京 100048)
高纯度苏丹红单体的高效逆流色谱纯化研究
李培根,王 钊,曹学丽*
(北京工商大学食品学院/北京市食品添加剂工程技术研究中心/食品质量与安全北京实验室,北京 100048)
建立了两种高纯度苏丹红单体的高效逆流色谱分离纯化方法。采用1 000 mL逆流色谱分离柱,V(正己烷)∶V(乙腈)=1∶1体系,上相为固定相,下相为流动相,流动相流速为45 mL/ min,上样量600 mg,经过一次分离纯化(40 min),即可将苏丹红Ⅱ样品的检测纯度(280 nm下)从97.01%提高到98.42%,得率为90.8%。在254 nm和500 nm下的纯化组分检测纯度也分别可以达到98.01%和99.79%。采用同样的色谱柱,V(正己烷)∶V(乙腈)∶V(乙酸乙酯)=5∶5∶1体系,上相为固定相,下相为流动相,流动相流速为20 mL/ min,上样量900 mg,经过两步分离纯化,可以将苏丹红Ⅳ的检测纯度(280 nm下)从84.67%提高到96.6%,得率为48.8%。在254 nm和500 nm下的检测纯度可以分别达到97.16%和98.32%。该方法具有快速、高效、制备量大等特点,可以为高质量苏丹红标准样品的研制提供技术支持。
逆流色谱;苏丹红Ⅱ;苏丹红Ⅳ;高纯度;分离纯化
苏丹红(Sudan)是人工合成的亲脂性偶氮染料,多用于油彩、机油、蜡和鞋油等产品的染色。主要有苏丹红Ⅰ、Ⅱ、Ⅲ、Ⅳ4种结构。早在1995年欧盟等国家和地区已禁止其作为色素添加在食品中,国际癌症研究机构将苏丹红Ⅰ、Ⅱ、Ⅲ和Ⅳ列为动物致癌物,我国卫生监管部门已禁止苏丹红作为食品添加剂使用。但是由于用苏丹红染色后的食品颜色非常鲜艳且不易褪色,能引起人们强烈的食欲,一些不法食品企业把苏丹红添加到食品中[1 -7]。常见的添加苏丹红的食品有辣椒粉、辣椒油、红豆腐,红心禽蛋等。我国已经制定了检测食品中苏丹红的高效液相色谱标准方法,方法检出限为0.010 μg / g[8]。目前国内外对于苏丹红的研究也多集中在食品中苏丹红的检测方法上[9 -13]。由于在检测中多采用其特征波长500 nm作为检测波长,且用较低浓度的对照品做标准曲线进行外标法定量,对照品中少量杂质在HPLC图中多数反映不出来,因而易被忽略。我们在调研中发现市场上的苏丹红对照品良莠不齐,价格悬殊,进口产品根据纯度也有很大的价格差异。用没有经过严格检定的对照品对食品样品中的低含量苏丹红进行定量分析,必对其准确性带来影响。
本研究尝试用逆流色谱方法对两个苏丹红样品进行纯化,以期得到高纯度的苏丹红单体,为高纯度苏丹红对照品的制备提供一条技术途径。逆流色谱是一种新型的液-液分配色谱分离技术,它具有制备量大、分离效率高、成本低、操作简单等特点[14 -15]。关于逆流色谱在苏丹红分离方面的应用鲜有报道[16]。
1 材料与方法
1.1 材料与试剂
苏丹红样品从市场获得,分别为苏丹红Ⅰ、Ⅱ、Ⅲ、Ⅳ粗样。苏丹红Ⅰ、Ⅱ、Ⅲ、Ⅳ的4种化学结构式,如图1。正己烷和乙腈,分析纯,国药集团化学试剂有限公司;乙酸乙酯,分析纯,北京化工厂;乙腈,色谱纯,Fisher Scientific;冰醋酸,色谱纯,光复精细化工;纯水由Millipore-Q纯水机自制。

图1 苏丹红Ⅰ,Ⅱ,Ⅲ和Ⅳ的化学结构Fig.1 Chemical structures of SudanⅠ,Ⅱ,ⅢandⅣ
1.2 仪器与设备
1100型高效液相色谱系统(配备在自动进样器,四元梯度泵,DAD检测器),美国Agilent公司;DE-spectrum型(柱体积22.5 mL/135 mL)、DE-MIDI型(柱体积1 000 mL)高效逆流色谱仪(high performance countercurrent chromatography,HPCCC),英国DE公司;Smart line 1 000型和Azura P2.1型制备液相系统(配逆流色谱仪),德国KNANER公司;AB135-S型分析天平,瑞士METTLER TOLEDO公司;KQ-400DB型超声波清洗仪,昆山市超声仪器有限公司;RE-2000型旋转蒸发仪,上海亚荣公司。
1.3实验方法
采用DE-spectrum小体积逆流色谱仪进行溶剂体系的筛选,再采用DE-MIDI大体积逆流色谱仪对苏丹红Ⅱ和Ⅳ两个样品进行分离纯化,并采用HPLC对纯化前后样品组分进行分析。
1.3.1 高效液相色谱分析
经过不同流动相及梯度的优化,以4种苏丹红的完全分离为目标,最终选定的色谱条件为Agilent ZOBAX SB-C18色谱柱(150 mm×4.6 mm,5 μm);柱温25℃;流动相V(φ(醋酸)= 0.75%水溶液)∶V(乙腈)=0.5∶0.95,等度洗脱(0~13 min);DAD检测波长254,500,280 nm;流速1.0 mL/ min;进样量10 μL。
采用上述条件对苏丹红Ⅰ,Ⅱ,Ⅲ和Ⅳ的混合样及苏丹红Ⅱ和Ⅳ粗样进行分析,比较了其在不同浓度和不同波长下检测时纯度的差异。并对纯化后的样品纯度进行了检测。
1.3.2 逆流色谱分离
1.3.2.1 分离条件的选择
采用小体积的DE-Spectrum HPCCC(柱体积为22.5 mL)进行溶剂体系和条件的选择。根据苏丹红的弱极性,首先实验了弱极性的V(正己烷)∶V(乙腈)=1∶1体系对苏丹红Ⅱ和Ⅳ的纯化效果,后对苏丹红Ⅳ的纯化采用了微调后的V(正己烷)∶V(乙腈)∶V(乙酸乙酯)= 5∶5∶1体系。分离条件为上样量10 mg溶解在1 mL流动相中;采用上述溶剂体系,上相为固定相,下相为流动相,流速1 mL/ min;转速1 400 r/ min;检测波长500 nm。
1.3.2.2 半制备分离
采用DE-Spectrum HPCCC(柱体积为135 mL)进行半制备分离实验。上样量60 mg溶解在2 mL流动相中;溶剂体系同1.3.2.1节,上相为固定相,下相为流动相,流速6 mL/ min;转速1 400 r/ min;检测波长500 nm。
1.3.2.3 大制备量分离纯化
采用大体积的DE-MIDI(柱体积1 000 mL)对苏丹红Ⅱ和Ⅳ进行大量分离纯化。上样量600~900 mg溶解在25~50 mL的1∶1的上下相混合液中;溶剂体系同上,上相为固定相,下相为流动相,流速45 mL/ min(苏丹红Ⅱ),20 mL/ min(苏丹红Ⅳ);转速1 100 r/ min;检测波长500 nm。对苏丹红Ⅳ还需进行二次纯化。
1.3.2.4 分离操作过程
每次分离前,将预先配制好的两相溶剂体系分离;将上相作为固定相以较大的流速泵入逆流色谱柱内;接着将仪器调至相应的转速,将下相作为流动相以相应的流速泵入柱中,待柱后只有流动相流出,表明体系达到平衡,记录推出的固定相体积,计算固定相保留率Sf,并将样品注入进样环;然后用流动相进行洗脱,根据检测器所检测到的色谱峰分段收集流份,并用HPLC进行分析。最后将纯度相近的流份合并,经旋转浓缩后真空干燥,得到最终纯化物。
2 结果与讨论
2.1 苏丹红的HPLC分析
2.1.1 4种苏丹红混合物的分析
采用优化后的HPLC条件可以使苏丹红Ⅰ~Ⅳ实现很好的分离,如图2,为后续分离物的分析检测奠定了良好基础。且从图2中的UV光谱图可以看出,4种苏丹红均在480~520 nm之间有一个特征吸收,故通常采用500 nm作为样品中苏丹红检测的特征波长。但是对于用于定量的苏丹红标样而言,在500 nm下进行检测,有可能由于在该波长下其中杂质的低响应值而被掩盖,标样纯度不准确或以次充好,从而影响定量的准确性。
2.1.2 不同浓度对苏丹红纯度的影响
样品在不同浓度下对杂质进行检测(检测波长500 nm),如图3。
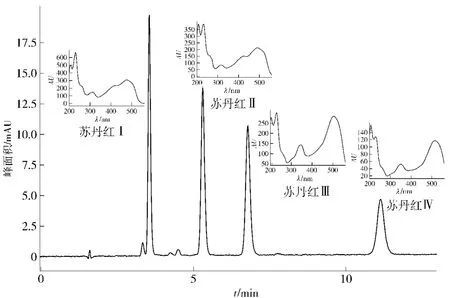
图2 4种苏丹红混合物的HPLC分析Fig.2 HPLC chromatogram of Sudan mixed samples

图3 苏丹红Ⅱ和Ⅳ在不同浓度下的HPLC图Fig.3 HPLC chromatogram of SudanⅡandⅣat different concentrations
由图3可知,同一样品随着样品浓度不断提高,低浓度无法检测的杂质峰越来越明显。苏丹红定量检测中常用的线性范围为1.0~20 μg/ mL,在此浓度范围内,有些苏丹红标样中存在的杂质很可能因响应值低而被忽略。本文在较高的100 μg/ mL浓度下分析苏丹红样品的纯度。
2.1.3 检测波长对苏丹红纯度的影响
使用254,500,280 nm等3个波长对浓度为100 μg/ mL的苏丹红Ⅳ进行分析检测,见图4。

图4 不同波长下苏丹红Ⅳ的HPLC图Fig.4 HPLC chromatogram of SudanⅣat different detection wavelengths
从图4可以看出苏丹红Ⅳ在不同波长下被检出的杂质含量有差异,其中280 nm下杂质吸收较高。在254,280,500 nm下苏丹红Ⅳ的检测纯度分别为88.2%,83.8%,93.4%,可见使用500 nm作为检测波长所得到的检测纯度最高,难以发现杂质,而使用280 nm时其检测纯度大幅下降,所以应使用多个波长,尤其是254 nm和280 nm等通用波长对苏丹红标样纯度进行考究。本文后续的工作即是采用逆流色谱对两个苏丹红样品进行了分离纯化,以提高其纯度。
2.2 苏丹红Ⅱ的纯化
根据苏丹红的结构特性,选取非极性的V(正己烷)∶V(乙腈)=1∶1作为分离体系,上相为固定相,下相为流动进行分离。苏丹红Ⅱ在不同柱体积下分离的逆流色谱,见图5。
先实验了少量样品在小体积柱上的分离效果,杂质与苏丹红Ⅱ能够完全分离,如图5a。然后逐级在半制备柱和制备柱上进行了放大分离,如图5b和5c,在较短时间内,都取得了很好的分离结果。
苏丹红Ⅱ粗样及分离后各级分的HPLC分析结果见图6。
由图6可知,通过一次逆流色谱分离,样品中主要的杂质基本完全去除。苏丹红Ⅱ的检测纯度(峰面积归一化法,280 nm)从97.01%提高到98.42%,得率(产品质量/上样量)为90.8%。在254 nm和500 nm下的纯化组分检测纯度也分别可以达到98.01%和99.79%。
2.3 苏丹红Ⅳ的纯化
根据HPLC分析可知,苏丹红Ⅳ样品中杂质较苏丹红Ⅱ中更多,纯度更低,纯化的难度要大。同样先选取非极性的V(正己烷):V(乙腈)= 1:1作为分离体系,上相为固定相,下相为流动进行分离,见图7。

图5 苏丹红Ⅱ在不同柱体积下分离的逆流色谱Fig.5 High performance countercurrent chromatogram ofSudanⅡin different column volumes

图6 280 nm条件下苏丹红Ⅱ粗样及分离后各成分的HPLC分析Fig.6 HPLC chromatogram of SudanⅡcrude sample and different fractions under 280 nm
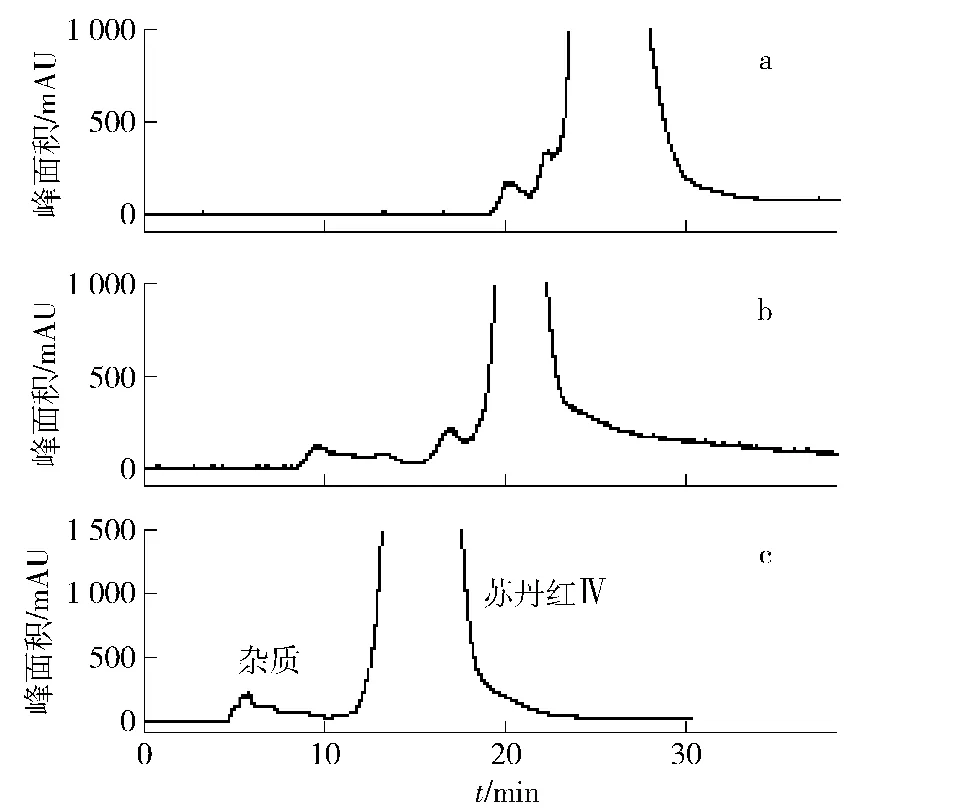
图7 苏丹红Ⅳ样品逆流色谱纯化条件的优化Fig.7 Optimization of high performance countercurrent chromatography conditions for SudanⅣ
先实验了少量样品在小体积柱上的分离效果,如图7a,杂质与苏丹红Ⅳ不能很好分离。然后将稍微提高体系极性,调整为V(正己烷)∶V(乙腈)∶V(乙酸乙酯)=5∶5∶1,再进行分离,如图7b,杂质与苏丹红Ⅳ的分离度有了明显改善。然后采用该体系在半制备柱进行了分离,如图7c。
在上述优化条件下,在制备柱上对苏丹红Ⅳ样品进行分离,见图8。
首先进行放大分离,如图8a,一次分离所收集的苏丹红Ⅳ级分经HPLC分析纯度并不理想。因此将各收集级分按纯度合并为两个级分Ⅳ-1和Ⅳ-2,浓缩后分别进行了二次分离,如图8b和图8c。经过二次分离,苏丹红Ⅳ样品中大部分的杂质得到了去除。
苏丹红Ⅳ样品分离前后的HPLC分析见图9。
由图9可知,通过二步逆流色谱分离,苏丹红Ⅳ的检测纯度(280 nm下)从84.67%提高到96.6%,得率为48.8%。在254 nm和500 nm下的检测纯度可以分别达到97.16%和98.32%。但是从图9中也可以看出,其中仍有一个难以分离的杂质存在,需要以后采取其他手段再进一步纯化。

图8 苏丹红Ⅳ样品的制备性逆流色谱纯化Fig.8 Preparative high performance countercurrent chromatography of SudanⅣ
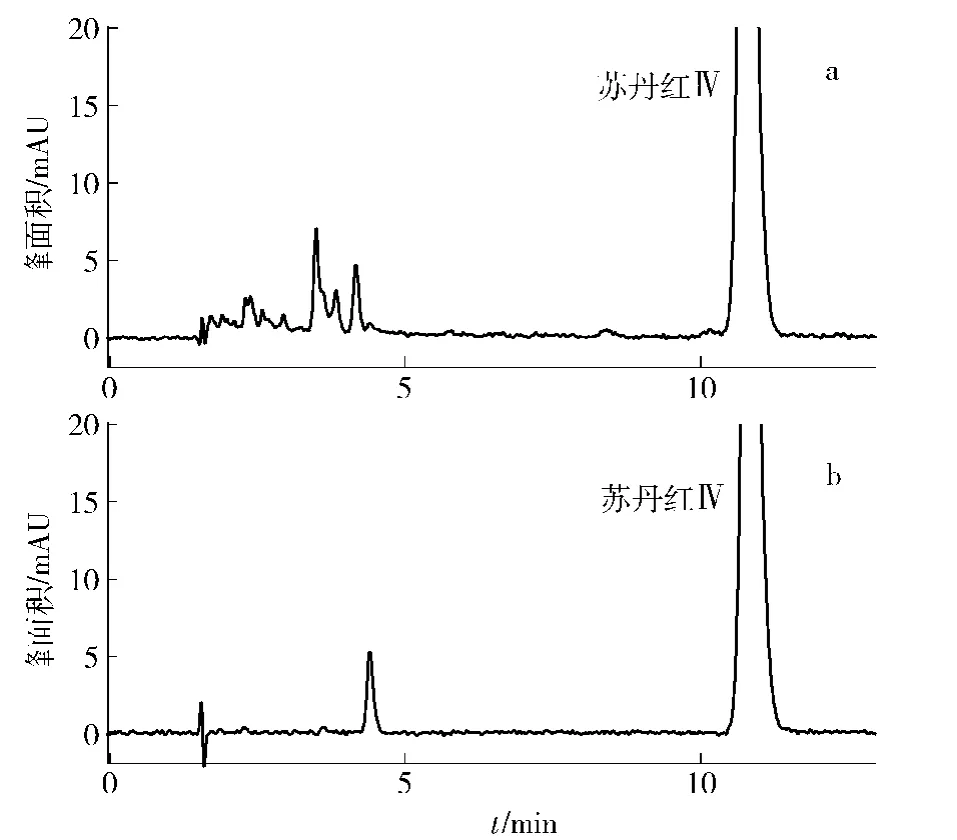
图9 苏丹红Ⅳ样品分离前后的HPLC分析图Fig.9 HPLC chromatogram of SudanⅣcrudesample and purified product
3 结 论
针对市场上苏丹红对照品良莠不齐的情况及其对食品样品中的低含量苏丹红定量检测的准确性可能存在的影响,建立了两种高纯度苏丹红单体的逆流色谱纯化方法,该方法可以有效去除苏丹红样品中的杂质,使苏丹红Ⅱ的检测纯度(280 nm下)从97.01%提高到98.42%,苏丹红Ⅳ的检测纯度(280 nm下)从84.67%提高到96.6%。且逆流色谱法具有快速、高效、制备量大等特点,本文所采用的逆流色谱纯化苏丹红的单次上样量和分离效率也是一般方法难以比拟的,为苏丹红样品的高效纯化及高纯度苏丹红对照品的制备提供了一条有效的途径。
[1] 中国疾病预防控制中心营养与食品安全所.食品添加剂卫生使用标准:GB 2760—2007[S].北京:中国标准出版社,2007.
[2] 秦品章.从苏丹红事件剖析食品安全与卫生问题[J].中国预防医学杂志,2006,7(3):233 -234.
[3] 聂雪梅,储晓刚,孙惠杰,等.欧盟食品中染料使用情况的研究[J].食品工业科技,2010,31(4):392 -394,398.NIE X M,CHU X G,SUN H J,et al.Study on the use of dyes in EU food[J].Science and Technology of Food Industry,2010,31(4):392 -394,398.
[4] XU Haiyan,HEINZE T M,CHEN Siwei,et al.Anaerobic metabolism of 1-amino-2-naphthol-based azo dyes (Sudan dyes)by human intestinal microflora[J].Applied and Environmental Microbiology,2007,73(23): 7759 -7762.
[5] 严玉霖,高洪,孙文汇,等.苏丹红Ⅰ对大鼠肝损伤及CYP 1A1表达的影响[J].动物医学进展,2010,31 (s1):31 -35.YAN Y L,GAO H,SUN W H,et al.The effect of SudanⅠon liver injury and expressions of CYP 1A1 in rats [J].Progress in Veterinary Medicine,2010,31(s1):31 -35.
[6] 常重杰,王君,肖静,等.苏丹红Ⅲ对泥鳅的急性毒性、遗传及生理毒性研究[J].水生态学杂志,2012,33 (4):113 -117.CHANG C J,WANG J,XIAO J,et al.The acute toxicity,genetics toxicity and physiology toxicity of Sudan red Ⅲon Misgurnus anguillicandatus[J].Journal of Hydroecology,2012,33(4):113 -117.
[7] 张翠英,蔡少青,王雪芹.LC/ MS/ MS法分析食品中微量苏丹红Ⅰ、Ⅱ、Ⅲ、Ⅳ[J].中国卫生检验杂志,2007,17(9):1547 -1548,1646.ZHANG C Y,CAI S Q,WANG X Q.Detection of SudanⅠ,SudanⅡ,SudanⅢand SudanⅣin foodstuffs by ultra performance liquid chromatography-tandem mass spectrometry[J].Chinses Journal of Health Laboratory Technology,2007,17(9):1547 -1548,1646.
[8] 国家质检总局.食品中苏丹红染料的检测方法高效液相色谱法:GB/ T 19681—2005[S].北京:中国标准出版社,2005.
[9] 陈静,刘召金,安宝超,等.全自动在线固相萃取-二维高效液相色谱与质谱联用测定辣椒油中苏丹红[J].分析化学,2013,41(9):1418 -1422.CHEN J,LIU Z J,AN B C,et al.Two-dimensional high performance liquid chromatography combined with on-line solid phase extraction and mass spectrometry for determination of Sudan dyes in chili oil[J].Chinese Journal of Analytical Chemistry,2013,41(9):1418 -1422.
[10] 裘雪梅,朱立鑫,徐玲,等.辣椒粉中苏丹红Ⅰ的免疫亲和柱-高效液相色谱法检测[J].时珍国医国药,2013,24(1):234 -235.QIU X M,ZHU L X,XU L,et al.Detecting Sudan I in chill powder by the method of immunoaffinity column-HPLC[J].Lishizhen Medicine and Materia Medica Research,2013,24(1):234 -235.
[11] WANG M,CHEN Z,CHEN Y,et al.New synthesis of self-assembly ionic liquid functionalized reduce dgraphene oxide-gold nanoparticle composites for electrochemical determination of Sudan I[J].Journal of Electroanalytical Chemistry,2015,756: 49 -55.
[12] YU Wei,LIU Zhongling,LI Qiang,et al.Determination of SudanⅠ-Ⅳin candy using ionic liquid/ anionic surfactant aqueous two-phase extraction coupled with high-performance liquid chromatography[J].Food Chemistry,2015,173: 815 -820.
[13] UNSAL Y E,TUZEN M,SOYLAK M.Separation and preconcentration of Sudan blueⅡusing membrane filtration and UV-visible spectrophotometric determination in river water and industrial wastewater samples[J].Journal of AOAC International,2015,98(1): 213 -217.
[14] ITO Y,CONWAY W D.Chemical analysis: high-speed countercurrent chromatography[M].New York: Wiley,1996.
[15] 曹学丽.高速逆流色谱的分离技术及应用[M].北京:化学工业出版社,2005.
[16] WEISZ A,ITO Y.Performance comparison of three types of high-speed counter-current chromatographs for the separation of components of hydrophilic and hydrophobic color additives[J].Journal of Chromatography A,2011,1218(36): 6156 -6164.
)
Purification of High Pure Sudans by High Performance Countercurrent Chromatography
LI Peigen,WANG Zhao,CAO Xueli*
(School of Food and Chemical Engineering/ Beijing Engineering and Technology Research Center of Food Additives/ Beijing Laboratory for Food Quality and Safety,Beijing Technology and Business University,Beijing 100048,China)
The separation methods of two high pure Sudans by high performance countercurrent chromatography(CCC)were developed.The solvent system composed of hexane: acetonitrile(1∶1,V/ V)with the lower phase was the mobile phase at the flow-rate of 45 mL/ min,and 600 mg sudanⅡsample was purified within 40 min using the 1 000 mL column.The results showed that its purity(280 nm)was improved from 97.01%to 98.42%with the yield of 90.8%,while its purity at 254 nm and 500 nm reached 98.01%and 99.79%,respectively.Using the solvent system composed of hexane∶acetonitrile∶ethyl acetate(5∶5∶1,V/ V/ V)with the lower phase as the mobile phase at the flow-rate of 20 mL/ min,900 mg SudanⅣsample was purified through two-steps.As a result,its purity(280 nm)could be improved from 84.67%%to 96.6%with the yield of 48.8%,while its purity at 254 nm and 500 nm could also reach 97.16%and 98.32%,respectively.This method with the characters of high-speed,high-efficiency,and high preparation quality could give supports for the study of high pure Sudans standards.
countercurrent chromatography;SudanⅡ;SudanⅣ;high pure;separation and purification
李 宁
TS207.3
A
10.3969/ j.issn.2095-6002.2016.03.010
2095-6002(2016)03-0067-07
李培根,王钊,曹学丽.高纯度苏丹红单体的高效逆流色谱纯化研究[J].食品科学技术学报,2016,34(3):67 -73.
LI Peigen,WANG Zhao,CAO Xueli.Purification of high pure Sudans by high performance countercurrent chromatography [J].Journal of Food Science and Technology,2016,34(3):67 -73.
2015- 11- 04
李培根,男,硕士研究生,研究方向为生物分离工程;*曹学丽,女,教授,博士,主要从事生物分离和分析方面的研究。通信作者。
