来氟米特通过PI3K/Akt/mTOR信号通路诱导大鼠系膜细胞凋亡的作用
2016-06-14李豫江
李豫江,张 伟,赵 磊
(1.石河子大学医学院第一附属医院普外二科,新疆石河子 832000;2.石河子大学医学院生理教研室,新疆石河子 832000)
来氟米特通过PI3K/Akt/mTOR信号通路诱导大鼠系膜细胞凋亡的作用
李豫江1,张伟1,赵磊2△
(1.石河子大学医学院第一附属医院普外二科,新疆石河子 832000;2.石河子大学医学院生理教研室,新疆石河子 832000)
[摘要]目的探讨来氟米特(A771726)对大鼠肾小球系膜细胞凋亡的影响及可能机制。方法体外培养大鼠肾小球系膜细胞,分为正常对照组(加入含5%胎牛血清的DMEM培养液)、A771726组(在对照组基础上加入A771726,使其终浓度为50 μg/mL)、LY294002组(在正常对照组基础上加入LY294002,使其终浓度为2 μg/mL),LY294002+A771726组(先加2 μg/mL的LY294002干预系膜细胞4 h后,加入50 μg/mL的A771726),采用流式细胞术检测各组干预48 h后对大鼠肾小球系膜细胞凋亡的影响,采用免疫荧光法检测各组干预48 h对大鼠系膜细胞中mTOR蛋白表达的影响,采用免疫印迹法检测各组干预48 h后对大鼠系膜细胞中Caspase-3表达的影响。结果与正常对照组比较,A771726、LY294002、LY294002+A771726组大鼠肾小球系膜细胞的凋亡率均明显升高,mTOR蛋白表达均明显降低,Caspase-3蛋白表达均明显增加;与A771726组比较,LY294002、LY294002+A771726组大鼠肾小球系膜细胞的凋亡率均明显升高,mTOR蛋白表达均明显降低,Caspase-3蛋白表达均明显增加;与LY294002组比较,LY294002+A771726组大鼠肾小球系膜细胞的凋亡率明显升高,mTOR蛋白表达明显降低,Caspase-3蛋白表达明显增加。结论来氟米特可能通过下调PI3K/Akt/mTOR信号通路而诱导大鼠肾小球系膜细胞的凋亡,且来氟米特可协同LY294002共同诱导大鼠系膜细胞的凋亡。
[关键词]肾小球系膜细胞;来氟米特;细胞凋亡;PI3K/Akt/mTOR信号通路
资料显示,我国慢性肾脏病的主要病因仍然是慢性肾小球肾炎,而其中又以系膜增生性肾小球肾炎的发病率最高。来氟米特(leflunomide,LEF)是一种新型免疫抑制剂,其药理作用主要是口服后在胃肠道和肝脏分解代谢为活性代谢产物 A771726 而发挥药理作用[1]。大量体内外实验研究发现:LEF具有抗炎、抗增殖、诱导细胞凋亡的作用[2-4],但是具体机制不清楚。研 究 证 实PI3K/Akt/mTOR信号通路参与细胞的增殖、凋亡的调节,通过通路下游凋亡蛋白而诱导细胞的凋亡[5]。2013年12月至2014年10月本课题组通过观察PI3K/Akt/mTOR信号通路在来氟米特对大鼠系膜细胞凋亡中的作用,从而为临床上治疗进展性肾小球肾炎提供依据。
1材料与方法
1.1材料与试剂
1.1.1细胞株大鼠肾小球系膜细胞株(HBZY-1)购自武汉博士德生物工程有限公司,保持了正常大鼠系膜细胞的形态与功能。
1.1.2主要试剂来氟米特活性代谢产物 A771726 (Sigma公司)、LY2940002(Sigma公司)、低糖DMEM培养基(Gibco公司)、无支原体胎牛血清(杭州四季青)、胰蛋白酶(Amresco公司)、AnnexinV-FITC凋亡试剂盒(Invitrogen公司)、PBS(上海生工生物)、兔抗大鼠mTOR单克隆抗体(Santa Cruz公司)、兔抗大鼠Caspase-3单克隆抗体(Santa Cruz公司)、罗丹明标记山羊抗兔IgG(北京中杉金桥)。
1.2仪器流式细胞仪(德国Partec公司)、倒置相差显微镜(日本Olympus公司)、离心机(美国Thermo公司)、细胞培养箱(美国Thermo公司)、激光共聚焦显微镜(德国Zeiss公司)、GEL-DOC2000凝胶电泳成像仪(美国Bio-Rad公司)。
1.3实验方法
1.3.1细胞培养大鼠肾小球系膜细胞培养方法参照赵丹等[6]的细胞培养方法。
1.3.2实验分组收集对数期大鼠肾小球系膜细胞,计数后接种于培养板中,待细胞完全贴壁,弃完全培养基,加入无血清DMEM培养液同步化24 h,按实验要求分为正常对照组(加入含5%胎牛血清的DMEM培养液)、A771726组(在对照组基础上加入A771726,使其终浓度为50 μg/mL)、LY294002组(在正常对照组基础上加入LY294002,使其终浓度为2 μg/mL),LY294002+A771726组(先加2 μg/mL的LY294002干预系膜细胞4 h后,加入50 μg/mL的A771726),各组均干预48 h。各组加药浓度和剂量根据本课题组前期预实验和相关文献报道而定。
1.3.3大鼠肾小球系膜细胞凋亡检测细胞以1×105个/mL接种于6孔板内,每孔2 mL,按照实验分组干预48 h,收集细胞,PBS洗涤2遍,严格按照AnnexinV-FITC凋亡试剂盒操作步骤,用流式细胞仪检测各组人肾小球系膜细胞的凋亡,实验重复3次。
1.3.4免疫荧光法检测各干预组系膜细胞中mTOR蛋白的表达大鼠系膜细胞以2×104个/mL接种于提前放有无菌盖玻片的24孔板内,每孔1 mL,按照实验分组干预培养48 h。48 h后取出细胞爬片,用PBS浸洗2次后,冷丙酮固定10 min,接着用10%正常山羊血清封闭液室温封闭30 min。向盖玻片细胞面滴加mTOR一抗(1∶100),4 ℃湿盒孵育过夜。过夜后向盖玻片细胞面滴加罗丹明标记山羊抗兔IgG,稀释浓度为1∶100,室温避光孵育2 h。最后用50%甘油缓冲液封片。每一步后均用PBS浸洗3次,每次5 min。最后用激光共聚焦显微镜观察并扫面成像。
1.3.5免疫印迹法检测各组干预48 h后Caspase-8蛋白的表达情况大鼠系膜细胞以1×106个/mL接种于6孔板中,每孔2 mL,按照实验分组干预48 h后,用PBS洗涤2次,加入细胞裂解液,冰上静置30 min后,12 000 r/min离心25 min,取上清液,统一蛋白浓度为10 g/L,100 ℃蛋白变性后待用。每孔每次加样10 μL,在SDS-PAGE凝胶中电泳分离,半干转法将蛋白从凝胶中转移至PVDF膜上,4 ℃冰箱中用5%脱脂奶粉封闭3 h,加兔抗人Caspase-3单克隆一抗(1∶1 000),4 ℃冰箱过夜,TBST洗膜后加入辣根过氧化物酶标记的二抗(1∶30 000),室温下孵育2 h,TBST洗膜后加入化学发光试剂曝光,显影、定影后将胶片置于凝胶成像分析仪进行定量分析,用同样方法检测β-actin内参蛋白的表达。
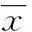
2结果
2.1流式细胞术检测各实验组对大鼠系膜细胞凋亡的影响正常对照组大鼠系膜细胞的凋亡较少,其凋亡率为(2.66±0.34)%。与正常对照组比较,A771726、LY294002、LY294002+A771726组干预大鼠系膜细胞48 h后,其凋亡率均升高,凋亡率分别为(6.48±0.37)%、(6.64±0.37)%、(9.54±0.50)%,差异有统计学意义(均P<0.01)。与A771726组比较,LY294002组干预系膜细胞48 h后细胞凋亡率无明显变化(P>0.05),而LY294002+A771726组干预系膜细胞48 h后细胞凋亡率明显升高,差异有统计学意义(P<0.01)。与LY294002组比较,LY294002+A771726组干预系膜细胞48 h后细胞凋亡率明显升高,差异有统计学意义(P<0.01),见图1。

A:正常对照组;B:A771726(50 μg/mL)组;C:LY294002(2 μg/mL)组;D:LY2940002+ A771726组。
图1各干预组作用系膜细胞48 h后对系膜细胞凋亡的影响
2.2免疫荧光法检测各干预组系膜细胞中mTOR蛋白的表达情况与正常对照组比较,A771726、LY294002、LY294002+A771726组干预大鼠系膜细胞48 h后,mTOR荧光强度均明显下降,差异有统计学意义(均P<0.01)。与A771726组比较,LY294002组干预大鼠系膜细胞48 h后,mTOR荧光强度无明显变化,差异无统计学意义(P>0.05),LY294002+A771726组干预系膜细胞48 h后,mTOR荧光强度明显下降,差异有统计学意义(P<0.01)。与LY294002组比较,LY294002+A771726组干预系膜细胞48 h后,mTOR荧光强度亦明显下降,差异有统计学意义(P<0.01),见表1及图2。
2.3免疫印迹法检测各干预组系膜细胞中Caspase-3蛋白的表达情况与正常对照组比较,A771726、LY294002、LY294002+A771726组干预大鼠系膜细胞48 h后,Caspase-3蛋白表达均明显增加,差异有统计学意义(均P<0.01)。与A771726组比较,LY294002组干预大鼠系膜细胞48 h后,Caspase-3蛋白表达无明显变化,差异无统计学意义(P>0.05),LY294002+A771726组干预系膜细胞48 h后,Caspase-3蛋白表达明显增加,差异有统计学意义(P<0.01)。与LY294002组比较,LY294002+A771726组干预系膜细胞48 h后,Caspase-3蛋白表达亦明显增加,差异有统计学意义(P<0.01),见表2及图3。
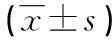
表1 各干预组作用系膜细胞48 h后对系膜细胞mTOR蛋白表达情况
▲:P<0.05,与正常对照组比较;□:P>0.05,■:P<0.05,与A771726组比较;★:P<0.05,与LY294002组比较。
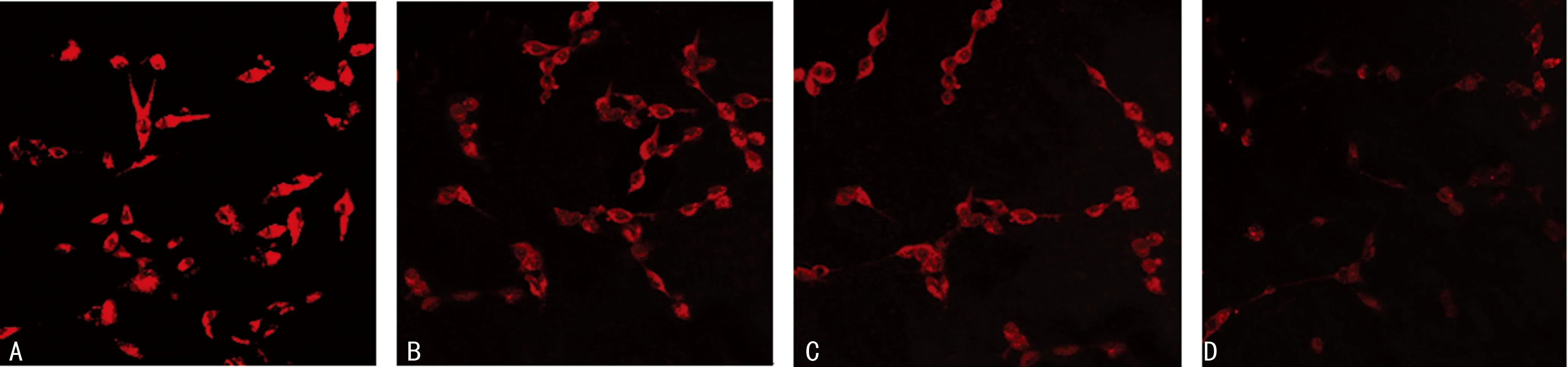
A:正常对照组;B:A771726(50 μg/mL)组;C:LY294002(2 μg/mL)组;D:LY2940002+A771726组。
图2各干预组作用系膜细胞48 h后系膜细胞mTOR蛋白表达情况(×100)
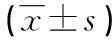
表2 各干预组作用系膜细胞48 h后系膜细胞Caspase-3蛋白表达情况
▲:P<0.05,与正常对照组比较;□:P>0.05,■P<0.05,与A771726组比较;★:P<0.05,与LY294002组比较。

N:正常对照组;A:A771726组;L:LY294002组;A+L:LY2940002+ A771726组。
图3各干预组作用系膜细胞48 h后对系膜细胞Caspase-3蛋白表达情况
3讨论
正常情况下,肾小球系膜细胞的增殖与凋亡均较少,且二者处于动态平衡。当外界细胞因子、炎症介质等持续作用下,系膜细胞增殖与凋亡的这种平衡将被打破,特别系膜细胞将大量增殖,而其凋亡将相应减少。研究发现,系膜细胞的凋亡又对肾小球损伤的修复起关键作用。因此,通过外界因素诱导系膜细胞凋亡,可能是控制和治疗系膜增生性肾小球肾炎的重要靶点。
本研究通过体外培养正常大鼠肾小球系膜细胞,予以不同干预因素作用相同时间后,采用流式细胞术检测大鼠系膜细胞凋亡,结果显示:正常对照组大鼠系膜细胞凋亡率为(2.66±0.34)%。而与正常对照组比较,A771726(50 μg/mL)组大鼠系膜细胞的凋亡率从(2.66±0.34)%升高为(6.48±0.37)%,这说明来氟米特可明显诱导大鼠系膜细胞的凋亡。大量研究发现:PI3K/Akt/mTOR 信号通路活化可以抑制多种细胞凋亡、促进细胞周期及细胞增殖,在细胞增殖与凋亡中起重要作用。张春江等[7]研究发现:大鼠系膜细胞中存在PI3K/Akt/mTOR 信号通路,且该通路与肾小球系膜细胞增殖与凋亡密切相关。而LY294002是PI3K特异性阻断剂,其可特异性阻断PI3K/Akt/mTOR 信号通路。本课题组应用LY294002干预大鼠系膜细胞48 h后,系膜细胞的凋亡率从(2.66±0.34)%升高为(6.64±0.37)%,而A771726组、LY294002组大鼠系膜细胞的凋亡率确无明显差异,进一步在LY294002干预系膜细胞的基础上,加用A771726,大鼠系膜细胞的凋亡进一步升高,这说明A771726诱导大鼠系膜细胞的凋亡可能是通过PI3K/Akt/mTOR 信号通路实现的,且A771726可协同LY294002诱导大鼠系膜细胞的凋亡。
Caspases家族作为凋亡调节基因,在细胞中以无活性的酶原形式存在,当凋亡机制启动后,形成具有活性的Caspase。Caspase-3被称为刽子手胱天蛋白酶,无论是在内在和外在的凋亡途径中都有Caspase-3的激活,激活的Caspase-3将导致一些结构和调节蛋白的裂解从而引起细胞凋亡[8]。所以Caspases-3的表达增加,可以说标志着细胞内凋亡机制的启动。本研究发现,正常对照组中Caspase-3蛋白表达较低,而与正常对照组比较,A771726组、LY294002组中Caspase-3蛋白的表达明显增加,然而与A771726组比较,LY294002组中Caspase-3蛋白的表达无明显变化,而A771726联合LY294002组中Caspase-3蛋白的表达较A771726组、LY294002组明显增加,这进一步说明A771726可诱导大鼠系膜细胞的凋亡,且A771726可协同LY294002诱导大鼠系膜细胞的凋亡,因此笔者推测A771726诱导大鼠肾小球系膜细胞的凋亡可能是通过上调Caspase-3活性而实现的。
为进一步探讨PI3K/Akt/mTOR 信号通路在A771726对大鼠系膜细胞凋亡中的作用,本实验采用免疫荧光法检测mTOR蛋白的表达,结果显示:与正常对照组比较,A771726组mTOR荧光强度明显减弱,而LY294002组mTOR荧光强度与A771726组无明显差异,这说明A771726可能是通过下调PI3K/Akt/mTOR 信号通路而诱导大鼠系膜细胞凋亡。而A771726联合LY294002组mTOR荧光强度较A771726组、LY294002组明显降低,这说明A771726可协同LY294002抑制PI3K/Akt/mTOR 信号通路。因此,笔者推测A771726可抑制PI3K/Akt/mTOR信号通路,且其作用靶点可能是PI3K。
综上所述,A771726可诱导大鼠肾小球系膜细胞的凋亡,其机制可能是通过下调PI3K/Akt/mTOR 信号通路,且A771726可协同LY294002诱导大鼠系膜细胞的凋亡。
参考文献
[1]程秋梅,潘延斌,谭美乐,等.来氟米特对脂多糖诱导下HaCaT细胞增殖和凋亡的影响[J].中国临床新医学,2014,7(4):302-305.
[2]Ren Q,Zeng HS,Zeng XF.Leflunomide inhibits the apoptosis of human embryonic lung fibroblasts infected by human cytomegalovirus[J].Eur J Med Res,2013,18(1):3.
[3]韦丽,刘春,陶林,等.来氟米特对糖尿病大鼠肾组织单核趋化蛋白1、转化生长因子β1表达的影响[J].临床荟萃,2012,27(3):202-205.
[4]Zhu SQ,Yan XM,Xiang ZH,et al.Leflunomide reduces proliferation and induces apoptosis in neuroblastoma cells in vitro and in vivo[J].PLoS One,2013,8(8):e71555.
[5]D′anglemont DA,Berdeaux A,Souktani R,et al.The volume-sensitive chloride Channel inhibitors prevent both contractile dysfunction and apoptosis induced by doxorrbicin through PI3 kinase,Akt and Erk 1/2[J].Eur J Heart Fail,2008,10(1):39-46.
[6]赵丹,罗星,杨晓萍.活性维生素D_3对系膜细胞增殖的影响[J].广东医学,2013,34(23):3551-3553.
[7]张春江,赵丹,贺德刚,等.1,25-(OH)_2D_3对大鼠系膜细胞增殖的影响及机制探讨[J].山东医药,2011,51(47):32-34.
[8]Feinstein-Rotkopf Y,Arama E.Can′t live without them,can live with them:roles of caspases during vital cellular processes[J].Apoptosis,2009,14(8):980-995.
Effect of leflunomide on rat mesangial cells apoptosis by PI3K/Akt/mTOR signaling pathway
Li Yujiang1,Zhang Wei1,Zhao Lei2△
(1.Department of 2nd General Surgery,First Affiliated Hospital of the Medical College Shihezi University,Xinjiang 832000,China;2.Department of Physiology,Medical College of Shihezi University,Shihezi,Xinjiang 832000,China)
[Abstract]ObjectiveTo investigate the effects of leflunomide(A771726) on the apoptosis of the rat glomerular mesangial cells and its possible mechanism.MethodsThe cultured rat glomerular mesangial cells were divided into the normal control group(adding DMEM culture solution containing 5% fetal calf serum),A771726 group(adding 50 A771726 on the basis of control group,making it a concentration as 50 μg/mL),LY294002 group (adding LY294002 on the basis of normal control group,making its final concentration as 2 μg/mL) and the LY294002+A771726 group(first adding 2 μg/mL LY294002 to interfere the mesangial cells for 2 h,then adding A771726 50 μg/mL).After 48 h intervention,its influence on mesangial cell apoptosis in each group were measured by flow cytometry.The expression of mTOR was measured by immunofluorescence.The expression of Caspase-3 was measured by Western-blot.ResultsCompared with the normal control group,the apoptosis rate of rat glomerular mesangial cells in the A771726 group,LY294002 group and LY294002+A771726 group were significantly increased,the expression of mTOR was decreased,the expression of Caspase-3 was increased;compared with the A771726 group,the apoptosis rates of rat glomerular mesangial cells in the LY294002 group and LY294002+A771726 group were significantly increased,the expression of mTOR was significantly decreased,the expression of Caspase-3 was significantly increased;compared with the LY294002 group,the apoptosis rate of rat glomerular mesangial cells in the LY294002+A771726 group was significantly increased,the expression of mTOR was significantly decreased,while the expression of Caspase-3 was significantly increased.ConclusionLeflunomide may induce the rat mesangial cells apoptosis through down-regulating the PI3K/Akt/mTOR signaling pathway,moreover,leflunomide may synergize with LY294002 to induce rat mesangial cells apoptosis.
[Key words]mesangial cells;leflunomide;cells apoptosis;PI3K/Akt/mTOR signaling pathway
doi:论著·基础研究10.3969/j.issn.1671-8348.2016.08.005
作者简介:李豫江(1970-),硕士,副主任医师,主要从事肿瘤外科学研究。△通讯作者,E-mail:2446514472@qq.com。
[中图分类号]R692
[文献标识码]A
[文章编号]1671-8348(2016)08-1022-04
(收稿日期:2015-08-08修回日期:2015-12-19)
