双醋瑞因对碘乙酸钠诱导的骨关节炎软骨细胞损伤的保护作用
2016-06-14张慧东
张慧东
(河北省唐山市工人医院骨二科 063000)
双醋瑞因对碘乙酸钠诱导的骨关节炎软骨细胞损伤的保护作用
张慧东
(河北省唐山市工人医院骨二科063000)
[摘要]目的探讨双醋瑞因对碘乙酸钠(MIA)诱导的骨关节炎软骨细胞的保护作用。方法实验分为正常组,模型组(4 μM MIA),双醋瑞因低、中、高剂量组(1、10、100 μM)。噻唑蓝(MTT)法检测各组软骨细胞活力;分光光度法检测各组半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)活性;Western blot分析核因子-κB (NF-κB)信号通路激活情况及下游靶蛋白Bax、Bcl-2、基质金属蛋白酶-9(MMP-9)、基质金属蛋白酶-13(MMP-13)的表达量。结果1、10、100 μM双醋瑞因能提高MIA诱导的大鼠软骨细胞的活力并降低Caspase-3活性(P<0.05);10、100 μM双醋瑞因能降低IκBα及NF-κB磷酸化水平,并下调Bax、MMP-9及MMP-13的表达,上调Bcl-2的表达(P<0.05)。结论双醋瑞因能够抑制MIA诱导的软骨细胞凋亡与细胞外基质降解,与NF-κB信号通路有关。
[关键词]骨关节炎;双醋瑞因;软骨细胞;凋亡;NF-κB信号通路
骨关节炎(osteoarthritis,OA)是一种多发于老年人的慢性退行性关节疾病,以关节软骨退行性变和关节周围骨质增生为主要病理特征,主要与年龄、性别、遗传因素等有关,而软骨病变是骨关节炎的中心环节[1-2]。现治疗OA的药物主要分为非特异性和特异性药物,非特异性药物只能缓解症状,无法改善病情,如非甾体抗炎药物等;而特异性药物不仅能抗炎镇痛,还能缓解基质降解,如双醋瑞因,可发挥抗炎、镇痛作用,并促进软骨修复。孙先润等[3]研究显示关节腔注射双醋瑞因可显著改善SD大鼠OA病理形态并提高二型胶原蛋白的表达。廖俊琳等[4]研究显示1、10、100 μM双醋瑞因显著抑制白细胞介素-1β(IL-1β)诱导的软骨细胞凋亡,但其作用机制尚不清楚。因此本课题主要探讨双醋瑞因是否可以抑制碘乙酸钠(MIA)诱导的骨关节炎软骨细胞损伤及其可能作用机制。
1材料与方法
1.1实验动物雄性SD大鼠,体质量(100±20)g,购自上海斯莱克实验动物有限公司,合格证SCXK(沪2012-0002)。室内温度控制在(23±2)℃,大鼠自由饮食和摄水。
1.2试剂双醋瑞因胶囊购自昆明积大制药有限公司;碘乙酸钠购自阿拉丁;兔抗Bax、Bcl-2、基质金属蛋白酶-9(MMP-9)、基质金属蛋白酶-13(MMP-13)、pp65、IκBα、p-IκBα抗体购自Epitmics公司;鼠抗p65、GADPH抗体、半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)检测试剂盒购自碧云天生物技术研究所;Ⅱ型胶原酶,新生牛血清(NCS),DMEM/F-12培养基购自Gibco公司。ChemiDocTM XRS凝胶成像系统购自Bio-Rad公司;Tecan Infinite F200/M200型多功能酶标仪购自瑞士TECAN集团公司。
1.3大鼠软骨细胞的制备[1-2]无菌环境下,小心刮取SD大鼠双侧膝关节胫骨坪、股骨髁状突及髌骨内侧透明软骨,充分漂洗软骨小块,用眼科剪剪碎至1 mm3大小。将软骨碎片转移至小锥形瓶中,依次用0.25%的胰蛋白酶及0.2%的胶原酶分别消化30 min 及2 h。胶原酶消化时每隔20 min振荡1 min。将消化液经200目筛网过滤,以便得到单细胞悬液,1 000 rpm/min离心10 min。用DMEM/F-12培养基重悬细胞(含20% NCS,100 U/mL 青霉素,100 U/mL链霉素),将细胞悬液转移至干净无菌的细胞培养瓶中,37 ℃5% CO2培养箱中培养,约48 h,细胞绝大部分贴壁,弃去未贴壁的细胞,更换新鲜的培养基继续培养,约4~5 d细胞开始融合,实验使用第2~3代细胞。
1.4软骨细胞活力检测采用噻唑蓝(MTT)法,将第2~3代的软骨细胞,用0.25%的胰蛋白酶消化细胞,用含10% NCS的DMEM/F-12培养基调整细胞浓度为每毫升1×105个,接种于96孔细胞培养板,37 ℃5% CO2培养箱中培养24 h,使细胞充分贴壁。加入含5% NCS的DMEM/F-12(含4 μM MIA及1、10、100 μM双醋瑞因)培养基,37 ℃ 5% CO2条件下培养48 h,每孔加MTT(5 mg/mL)20 μL,继续培养4 h后,小心吸出培养上清液,每孔加入DMSO 150 μL,待结晶充分溶解后,酶标仪570 nm处测定OD值。
1.5Caspase-3活性检测将第2~3代软骨细胞进行消化,调整细胞浓度为2×105/mL,接种于37 ℃ 5% CO2培养箱中培养24 h。加入含5% NCS的DMEM/F-12(含4 μM MIA及1、10、100 μM双醋瑞因)培养基,继续培养48 h。按Caspase-3分光光度法检测试剂盒进行检测。
1.6Western blot收集处理过的样本,加入预冷的RIPA裂解液裂解,冰浴30 min,每隔10 min震荡5 s,以1×104r/min 4 ℃离心15 min,获得蛋白样品。用BCA试剂盒检测蛋白浓度。以每孔(30~50 ng)蛋白上样,SDS凝胶电泳后湿法转膜,以5%脱脂奶粉室温封闭1 h加入一抗4 ℃孵育过夜。次日TBST漂洗3次,加二抗,室温孵育1 h后漂洗3次。采用Bio-rad曝光系统进行曝光。
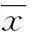
2结果
2.1双醋瑞因对MIA诱导的软骨细胞活力的影响与正常组比较,模型组中软骨细胞活力显著下降,差异具有统计学意义(P<0.01);与模型组比较,双醋瑞因低、中、高剂量组中软骨细胞活力显著上升,差异具有统计学意义(P<0.01);说明1、10、100 μM双醋瑞因对MIA诱导的大鼠软骨细胞的活力具有保护作用(图1)。

aa:P<0.05,与正常组比较;b:P<0.05,bb:P<0.01,与模型组比较。
图1双醋瑞因对MIA诱导的软骨细胞活力的影响
2.2双醋瑞因对MIA诱导的软骨细胞中NF-κB信号通路的影响骨与正常组比较,模型组中IκBα及NF-κB p65磷酸化水平显著提高,差异具有统计学意义(P<0.01);与模型组比较,双醋瑞因中、高剂量组中IκBα及NF-κB p65磷酸化水平下降,差异具有统计学意义(P<0.01);说明10、100 μM双醋瑞因可通过NF-κB信号通路保护MIA诱导的大鼠软骨细胞损伤(图2)。
2.3双醋瑞因对MIA诱导的软骨细胞中细胞凋亡相关蛋白表达量的影响与正常组比较,模型组中Bax表达量上升,Bcl-2表达量下降,差异具有统计学意义(P<0.01);与模型组比较,双醋瑞因中、高剂量组中Bax表达量下降,Bcl-2表达量上升,差异具有统计学意义(P<0.05);说明10、100 μM双醋瑞因可通过抑制细胞凋亡蛋白从而抑制MIA诱导的大鼠软骨细胞凋亡(图3)。
aa:P<0.05,与正常组比较;b:P<0.05,bb:P<0.01,与模型组比较。
图2双醋瑞因对MIA诱导的软骨细胞中NF-κB信号通路的影响

aa:P<0.05,与正常组比较;bb:P<0.01,与模型组比较。
图3双醋瑞因对MIA诱导的软骨细胞中细胞凋亡相关蛋白表达量的影响

aa:P<0.05,与正常组比较;bb:P<0.01,与模型组比较。
图4双醋瑞因对MIA诱导的软骨细胞中基质金属蛋白酶表达量的影响
2.4双醋瑞因对MIA诱导的软骨细胞中基质金属蛋白酶表达量的影响与正常组比较,模型组中MMP-9及MMP-13表达量上升,差异具有统计学意义(P<0.01);与模型组比较,双醋瑞因中、高剂量组中MMP-9及MMP-13表达量下降,差异具有统计学意义(P<0.05);说明10、100 μM双醋瑞因可通过抑制MMPs从而抑制MIA诱导的大鼠软骨细胞细胞外基质的降解(图4)。
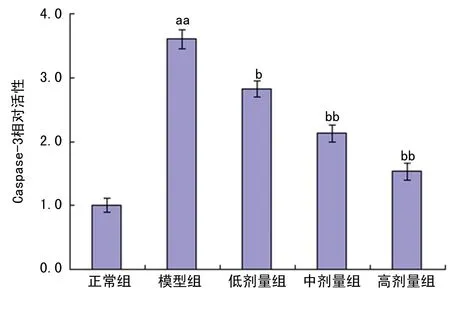
2.5双醋瑞因对MIA诱导的软骨细胞中Caspase-3活性的影响与正常组比较,模型组中Caspase-3活性显著提高,差异具有统计学意义(P<0.01);与模型组比较,双醋瑞因低、中、高剂量组中Caspase-3活性显著显著降低,差异具有统计学意义(P<0.05);说明1、10、100 μM双醋瑞因可通过降低Caspase-3活性从而抑制MIA诱导的大鼠软骨细胞凋亡(图5)。
aa:P<0.05,与正常组比较;b:P<0.05,bb:P<0.01,与模型组比较。
图5双醋瑞因对MIA诱导的软骨细胞中Caspase-3活性的影响
3讨论
软骨细胞是关节软骨唯一的细胞,在软骨形成、代谢以及修复中发挥重要作用。因此抑制软骨细胞的凋亡,可显著延缓OA进程。细胞因子、NO、能量代谢抑制剂(如MIA)等多种因素可引起软骨细胞损伤乃至死亡,其中MIA为糖酵解途径中3-磷酸甘油醛脱氢酶抑制剂,通过抑制细胞能量代谢而导致细胞因供养不足而死亡[5]。MIA体外刺激24 h能造成大鼠软骨细胞的死亡[6]。本实验亦表明MIA诱导24 h会降低软骨细胞活力,1、10、100 μM双醋瑞因可一定程度上抑制软骨细胞活力的下降。
NF-κB 是一类能与多种基因启动子或增强子部位 κB 位点发生特异性结合并促进其转录的蛋白质。正常生理状态下,在细胞质中与IκB结合,受外界环境或上游信号刺激,即可脱离IκB,进入细胞核,与下游靶基因相应DNA位点结合,促使其进行转录。它可以调控多种靶基因,包括细胞凋亡蛋白Bax,Bcl-2,MMPs等[1-2]。在DBA/1小鼠早期OA和类风湿关节炎中发现软骨细胞中NF-κB的核转位异常[7]。在关节炎患者血清中NF-κB p65活性显著提高[8]。用siRNA干扰NF-κB p65的表达,可减轻大鼠OA病理进程[9-10],说明抑制NF-κB的活性成为治疗OA的靶点。因此本实验通过Western blot检测各组中NF-κB的激活情况,发现了双醋瑞因(10、100 μM)能显著降低IκBα及NF-κB p65磷酸化水平,说明双醋瑞因可通过抑制NF-κB信号通路,从而发挥其抗OA作用。
软骨细胞的凋亡是OA中心环节。且软骨细胞凋亡严格受到癌基因的调控。其中Bcl-2家族是最常见的癌基因,能与Bax亚家族相互作用,启动软骨细胞内的凋亡信号转导,从而诱导细胞凋亡。研究已证实在关节炎患者血清中,Bax含量显著上升,Bcl-2含量下降[11],因此抑制此变化,一定程度也能缓解OA。本实验证实双醋瑞因提高OA软骨细胞中Bcl-2的表达,降低Bax的表达,从而抑制软骨细胞凋亡,达到治疗OA的目的。通过抑制NF-κB信号通路,可使大鼠软骨细胞Bax表达下降,Bcl-2上升,Caspase-3活性降低[1]。Caspase-3是一类进化上保守的天冬氨酸蛋白酶家族,依赖caspase的信号途径是细胞凋亡的主要途径。在OA患者中Caspase-3的表达高于正常,并随着OA程度的加重Caspase-3的表达也增加[12]。通过使用Caspase-3抑制剂Z-DEVD-FMK可抑制IL-1β引起的软骨细胞凋亡[13]。本实验也证实双醋瑞因可降低Caspase-3活性,从而抑制软骨细胞凋亡。
正常生理状态下,软骨组织时合成代谢和分解代谢处于动态平衡,当分解代谢速度快于合成速度后,会导致MMPs的大量产生。MMPs是一个含有锌指样结构细胞外蛋白酶大家族,是迄今为止发现的唯一能分解纤维类胶原的酶,其中MMP-9属于明胶酶类,MMP-13属于胶原酶类。OA时MMP-9,MMP-13的表达明显增高,导致关节软骨细胞外基质二型胶原,蛋白多糖过度降解,破坏关节软骨,使关节发生退变[14]。MMP-9、MMP-13表达量的下调,能显著缓解OA进程[15]。同时NF-κB信号通路的失活可显著抑制MMPs的表达[1-2]。因此本实验通过Western blot检测各组中MMPs的表达,证实了双醋瑞因可通过下调MMP-9及MMP-13的表达,从而缓解OA时细胞外基质降解。
综上所述,双醋瑞因可提高MIA诱导的大鼠软骨细胞活力并抑制Caspase-3活性,降低IκBα及NF-κB磷酸化水平,并下调Bax,MMP-9及MMP-13的表达,上调Bcl-2的表达。说明双醋瑞因能通过NF-κB信号通路够抑制MIA诱导的软骨细胞凋亡与细胞外基质降解。
参考文献
[1]Zhang XH,Xu XX,Xu T,et al.beta-Ecdysterone suppresses interleukin-1 beta-Induced apoptosis and inflammation in rat chondrocytes via inhibition of NF-kappa B signaling pathway[J].Drug Dev Res,2014,75(3):195-201.
[2]Zhang XH,Xu XX,Xu T.Ginsenoside Ro suppresses interleukin-1 beta-induced apoptosis and inflammation in rat chondrocytes by inhibiting NF-kappa B[J].Chin J Nat Med,2015,13(4):283-289.
[3]孙先润,姚绍平,叶吉云,等.关节腔注射双醋瑞因对SD大鼠骨关节炎形态及ED1和COL2表达的影响[J].中国矫形外科杂志,2014,22(6):539-543.
[4]廖俊琳,王声,刘日光.双醋瑞因对白细胞介素1β诱导软骨细胞凋亡的影响[J].中国组织工程研究,2012,16(7):1161-1164.
[5]Wang XD,Kou XX,He DQ,et al.Progression of cartilage degradation,bone resorption and pain in rat temporomandibular joint osteoarthritis induced by injection of iodoacetate[J].PLoS One,2012,7(9):e45036.
[6]TongP,XuS,CaoG,etal.ChondroprotectiveactivityofadetoxicatedtraditionalChinesemedicine
(Fuzi) of Aconitum carmichaeli Debx against severe-stage osteoarthritis model induced by mono-iodoacetate[J].J Ethnopharmacol,2014,151(1):740-744.
[7]Song X,Shen J,Wen H,et al.Impact of schistosoma japonicum infection on collagen-induced arthritis in DBA/1 mice:a murine model of human rheumatoid arthritis[J].PLoS One,2011,6(8):e23453.
[8]郭静,勾向博,张文丽,等.骨关节炎患者膝关节软骨和滑膜中p38MAPK、NF-κB的表达及其意义[J].河北联合大学学报:医学版,2013,15(6):749-751.
[9]Chen LX,Lin L,Wang HJ,et al.Suppression of early experimental osteoarthritis by in vivo delivery of the adenoviral vector-mediated NF-kappaBp65-specific siRNA[J].Osteoarthritis Cartilage,2008,16(2):174-184.
[10]陈连旭,于长隆.腺病毒介导核因子κBp65特异性小干涉RNA抑制骨关节炎[J].中国组织工程研究,2012,16(46):8551-8555.
[11]Wang SJ,Guo X,Zuo H,et al.Chondrocyte apoptosis and expression of Bcl-2,Bax,Fas,and iNOS in articular cartilage in patients with Kashin-Beck disease[J].J Rheumatol,2006,33(3):615-619.
[12]Sena P,Manfredini G,Benincasa M,et al.Up-regulation of the chemo-attractive receptor ChemR23 and occurrence of apoptosis in human chondrocytes isolated from fractured calcaneal osteochondral fragments[J].J Anat,2014,224(6):659-668.
[13]Shakibaei M,John T,Seifarth C,et al.Resveratrol inhibits IL-1 beta-induced stimulation of caspase-3 and cleavage of PARP in human articular chondrocytes in vitro[J].Ann N Y Acad Sci,2007(1095):554-563.
[14]王维山,史晨辉,李长俊,等.OA 患者关节液 uPA 和 MMP-3,9,13,14的表达水平与关节功能的相关性研究[J].中国骨质疏松杂志,2014,20(6):602-605,610.
[15]李卫平,蹇睿,胥方元.超声波治疗兔膝骨关节炎对MMP-1和MMP-13表达的影响[J].重庆医学,2012,41(16):1564-1566,封2.
Protective effect of diacerein on MIA-induced injury in rat osteoarthritis chondrocytes
Zhang Huidong
(Second Department of Orthopedics,Tangshan Municipal Workers Hospital,Tangshan,Hebei 063000,China)
[Abstract]ObjectiveTo investigate the protective effect of diacerein on monosodium iodoacetate (MIA) induced injury in rat osteoarthritis chondrocytes.MethodsThe experiment was divided into five groups,including the normal group,model group (4 μM MIA),diacerein low,middle and high doses groups (1,10,100 μM).The viability of chondrocytes was detected by MTT assay.The activity of cysteinyl aspartate specific proteinase-3 (Caspase-3) was measured by spectrophotography.The activation of nuclear factor kappa B (NF-κB) signaling pathway and expression level of downstream target molecule cell Bax,Bcl-2,matrix metalloproteinase-9 (MMP-9) and MMP-13 were detected by Western blot.Results1,10,100 μM diacerein could increase the viability of MIA-induced chondrocytes and reduce the activity of Caspase-3(P<0.05).10,100 μM diacerein could decrease the phosphorylation level of IκBα and NF-κB p65,furthermore downregulated the level of Bax,MMP-9 and MMP-13 protein,and upregulated the level of Bcl-2 protein (P<0.05).ConclusionDiacerein could inhibit cell apoptosis and degradation of extracellular matrix in MIA-induced rat chondrocytes,which might be related to the NF-κB signal pathway.
[Key words]ostearthritis;diacerein;chondrocytes;apoptosis,NF-κB signal pathway
doi:论著·基础研究10.3969/j.issn.1671-8348.2016.08.004
作者简介:张慧东(1970-),学士,主治医师,主要从事骨外科临床的研究。
[中图分类号]R684
[文献标识码]A
[文章编号]1671-8348(2016)08-1019-03
(收稿日期:2015-09-16修回日期:2015-11-08)
