(±)-N-叔丁氧羰基-3-乙基-戊氨酸的合成
2016-06-12庄金臣沈祖源楼开炎
庄金臣, 沈祖源, 楼开炎, 王 卫
(华东理工大学 药学院,上海 200237)
·研究简报·
(±)-N-叔丁氧羰基-3-乙基-戊氨酸的合成
庄金臣, 沈祖源, 楼开炎*, 王卫
(华东理工大学 药学院,上海200237)
摘要:在最优反应条件[海因2 mmol, n(3-戊酮)∶n(海因)=1.5,乙醇胺为碱,pH 4,于55 ℃反应6 h]下制得5-(1-乙基亚丙基)海因(4); 4用5%Pd/C催化加氢制得5-(3-戊基)海因(5); 5先在碱性条件下水解,再通过叔丁氧羰基保护氨基合成了(±)-N-叔丁氧羰基-3-乙基-戊氨酸,总收率43%,其结构经1H NMR,13C NMR和HR-ESI-MS确证。
关键词:非天然氨基酸; 3-戊酮; N-叔丁氧羰基-3-乙基-戊氨酸; 合成
非天然氨基酸因其结构多样性和良好的生理活性而被广泛应用于医药、食品、材料等领域[1-4]。如3-乙基戊氨酸,其结构虽与缬氨酸和异亮氨酸非常相似,但β-C上的双乙基使3-乙基戊氨酸具有更大的空间位阻和更强的疏水性。因此,3-乙基戊氨酸常用于多肽类药物的设计与合成[5-8]。
合成多肽药物的过程中还常使用氮端保护氨基酸,如N-叔丁氧羰基-3-乙基-戊氨酸(1)。1是重要的中间体,可用于多肽药物引入3-乙基戊氨酸结构片段。
目前,合成3-乙基戊氨酸和1的方法主要有:Vigneaud等[9]通过乙氧基甲叉丙二酸二乙酯与乙基溴化镁加成制得2-(1-乙基丙基)-丙二酸二乙酯,然后经水解,溴代脱羧制得2-溴-3-乙基戊酸,最后经氨化反应制得3-乙基戊氨酸。该反应过程中需用到中等毒性的液溴,操作复杂,收率较低。Resnick等[10]以2-乙基丁醛,甲基苄胺与氰化钾为原料,经Strecker反应制得中间体氨基氰化合物,再依次经酸解,还原等7步反应合成3-乙基戊氨酸。该方法虽可用于大量反应,但合成路线复杂,且需使用氰化钾,存在安全隐患。Saito等[8]以2-乙基丁醛为原料,在碱性条件下与氰化钠反应制得5-(3-戊基)海因,然后在氢溴酸作用下水解得3-乙基戊氨酸的氢溴酸盐,最后用氯甲酸苄酯保护氨基得N-苄氧羰基保护的3-乙基戊氨酸。该方法操作简便,但也需使用氰化钠,总收率较低(7.6%)。Mayer等[6]通过2-乙基溴丁烷的格式试剂与二氧化碳反应制得3-乙基戊酸,然后用4-苄基-2-唑烷酮保护羧基,通过与苯磺酰叠氮化合物反应,在羰基上引入叠氮基团,最后加氢还原合成3-乙基戊氨酸。该方法虽避免使用氰化物,但反应条件苛刻,路线繁琐。
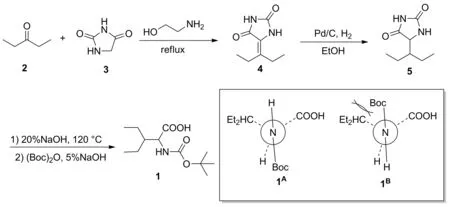
Scheme 1
针对已有合成路线的不足,本文以3-戊酮(2)和海因(3)为原料,在最优反应条件[3 2 mmol,n(2)∶n(3)=1.5,乙醇胺为碱,pH 4,于55 ℃反应6 h]下制得5-(1-乙基亚丙基)海因(4); 4用5%Pd/C催化加氢制得5-(3-戊基)海因(5); 5先在碱性条件下水解,再通过叔丁氧羰基保护氨基合成了(±)-N-叔丁氧羰基-3-乙基-戊氨酸(1, Scheme 1),总收率43%,其结构经1H NMR,13C NMR和HR-ESI-MS确证。该路线中,常压室温条件下用Pd/C选择性还原4的方法为首次报道。
1实验部分
1.1仪器与试剂
Bruker ADVANCE 400 MHz型核磁共振仪(CDCl3或DMSO-d6为溶剂,TMS为内标),Micromass GCTTM型质谱仪。
2, 3和乙醇胺,上海阿达玛斯试剂有限公司;10%Pd/C,上海安耐吉化学有限公司;其余所用试剂均为分析纯。
1.2合成
(1) 4的合成[11]
在反应瓶中依次加入3 1.00 g(10.0 mmol), 2 1.29 g(15.0 mmol),搅拌使其溶解;于55 ℃滴加乙醇胺约475 mg(7.8 mmol),滴毕,回流反应约6 h。冷却至室温,析出白色晶体,加水2 mL,用6 mol·L-1盐酸调至pH 4,过滤,滤饼用水洗涤,干燥得白色鳞状固体4 1.04 g,收率约62%;1H NMRδ: 10.81(s,1H), 9.76(s,1H), 2.61(q,J=7.4 Hz, 1H), 2.15(q,J=7.5 Hz, 1H), 0.97(t,J=7.5 Hz, 1H);13C NMRδ: 164.9, 154.5, 135.3, 124.8, 24.7, 22.1, 13.5, 12.3; HR-ESI-MSm/z: Calcd for C8H13N2O2{[M+H]+}169.097 7, found 169.098 3。
(2) 5的合成
在单口烧瓶中依次加入无水乙醇20 mL, 4 1.04 g(6.20 mmol)和10%钯碳52 mg,抽真空,用氢气置换3次,搅拌反应过夜(TLC检测)。过滤,滤液蒸除乙醇得白色固体5 1.01 g,收率96%;1H NMRδ: 10.60(s, 1H), 7.89(s, 1H), 1.54~1.50(ddd,J=8.1 Hz, 5.4 Hz, 2.7 Hz, 1H), 1.46~1.35(m, 1H), 1.33~1.13(m, 1H), 0.86(dt,J=15.1 Hz, 7.4 Hz, 1H);13C NMRδ: 176.7, 158.3, 60.1, 43.2, 22.9, 21.7, 12.2, 12.1; HR-ESI-MSm/z: Calcd for C8H14N2O2{[M+Na]+}193.095 3, found 193.095 0。
(3) 1的合成
在封管中依次加入5 1.01 g(5.95 mmol), 15%NaOH溶液3.7 mL,搅拌下于120 ℃反应12 h。冷却至室温,用6 mol·L-1盐酸调至pH≈9,依次加水10 mL,二氧六环5 mL,于0 ℃滴加二碳酸二叔丁酯[(Boc)2O]1.43 g(6.50 mmol)的二氧六环(7.7 mL)溶液,滴毕,搅拌下于室温反应约6 h(TLC检测)。加水10 mL,用0.5 mol·L-1盐酸调至pH 4,用乙酸乙酯(3×10 mL)萃取,合并有机相,用饱和食盐水洗涤,无水硫酸钠干燥,蒸除溶剂得白色固体1 1.05 g,收率72%。 1为旋转受阻构象异构体1A和1B的混合物,m(1A) ∶m(1B)=2 ∶1;1H NMRδ: 10.72(bs, 1H, OH), 6.21(d,J=7.6 Hz, NHB), 4.97(d,J=9.2 Hz, NHA), 4.46(dd,J=9.2 Hz, 3.6 Hz, NHCHA), 4.26(bs, NHCHB), 1.80~1.60(m, 1H, CHEt2), 1.44[s, 9H, C(CH3)3], 1.43~1.18(m, CH2), 1.00~0.85(m, CH3);13C NMRδ: 178.4, 166.0, 80.1, 55.1, 44.4, 28.4, 22.9, 22.6, 11.9(1A); 177.9, 157.1, 81.7, 56.2, 44.4, 28.3, 22.7, 22.2, 11.9(1B); HR-ESI-MSm/z: Calcd for C12H23NO4{[M+Na]+}268.152 5, found 268.152 7。
2结果与讨论
2.1合成
(1) 4的合成条件优化
为优化4的合成条件,分别考察了物料比r[n(2)∶n(3)],碱和pH对4收率的影响。
3 2 mmol,其余反应条件同1.2(1),研究r对4收率的影响,结果见表1。由表1可见,r增大,4收率提高,当r=1.4~1.6时,收率基本稳定(60%左右)。由于2也起溶剂作用,故最优r=1.5。
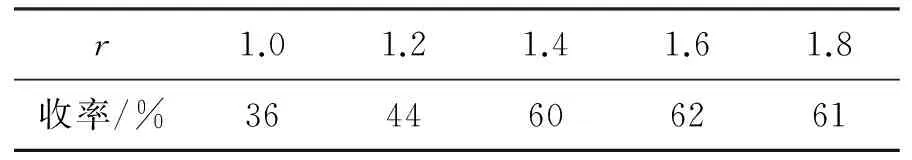
表1 r对4收率的影响*
*3 2 mmol,其余反应条件同 1.2(1)。

表2 碱对4收率的影响*
*3 2 mmol,r=1.5,其余反应条件同表1。
3 2 mmol,r=1.5,其余反应条件同1.2(1),研究碱对4收率的影响,结果见表2。由表2可见,有机碱效果优于无机碱,其主要原因在于:无机碱在反应液中溶解性差。乙醇胺效果最好,可能由于乙醇胺中的羟基与2中羰基可产生氢键作用,更有利于反应进行。因此,选择乙醇胺为碱。
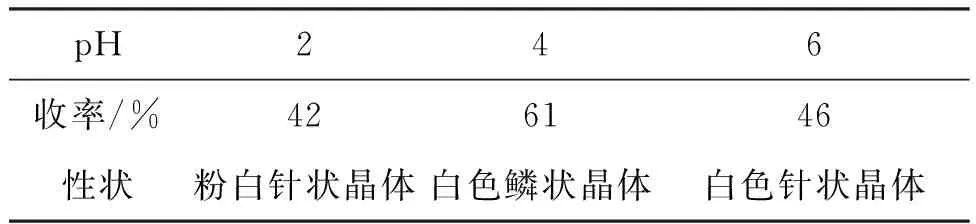
表3 pH对4收率的影响*
*3 2 mmol,r=1.5,乙醇胺为碱,其余反应条件同表2。
3 2 mmol,r=1.5,乙醇胺为碱,其余反应条件同1.2(1),研究pH对4收率的影响,结果见表3。由表3可见,pH=4时,4的性状较好,收率较高(61%)。
(2) 5的合成条件优化
我们分别尝试了镁-甲醇,常压Raney-Ni/H2[12]和Pd/C-H2等还原体系。结果表明:前两种还原体系不能还原4, Pd/C-H2体系可在室温常压下顺利实现4的还原,条件温和,后处理简单,收率较高。因此选择Pd/C-H2还原体系继续进行优化。
4 2 mmol,反应时间3 h,其余反应条件同1.2(2),研究了Pd/C用量对5收率的影响,结果见表4。由表4可见,Pd/C用量为5%时,收率较高,继续增大Pd/C用量,收率变化已不明显。因此,Pd/C最佳用量为5%。
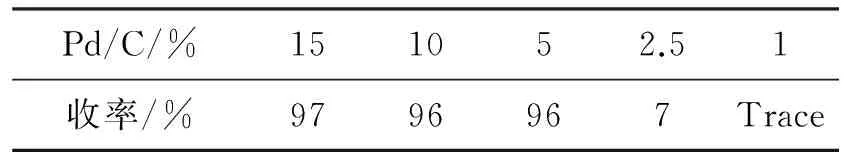
表4 Pd/C用量对5收率的影响*
*4 2 mmol,反应时间3 h,其余反应条件同1.2(2)。
(3) 1的合成条件优化
水解5可得3-乙基戊氨酸。我们曾尝试先分离提纯后再进行氨基保护,但由于3-乙基戊氨酸的氨基和羧基能以胺盐或羧酸根形式存在,水溶性较好,分离提纯和重结晶均比较困难。因此,最终使用“一锅法”合成1,即5先水解,调节pH后直接用(Boc)2O保护氨基。结果表明:该方法操作简单,收率较高(约72%)。
在“一锅法”合成1的过程中,对N-叔丁氧基保护反应前的pH进行了优化,结果见表5。由表5可知,pH过高,可能会破坏(Boc)2O,降低收率。因此,最佳pH=9。
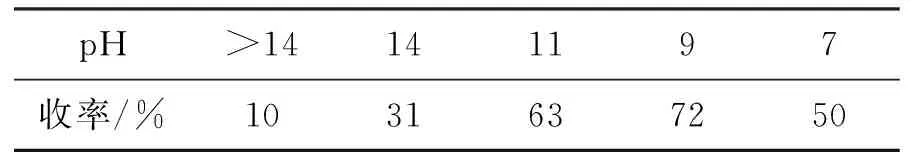
表5 pH对1收率的影响*
*5 2 mmol,其余反应条件同1.2(3)。
2.2表征
由1的1H NMR谱图可见,1为两种异构体1A和1B的混合物。其原因是:1中存在大位阻的N-Boc,造成氨基酸的C—N旋转受阻,导致产生旋转异构体。我们提出了两种旋转异构体的可能构象。其中,1B的N-Boc位于羧基和3-戊基之间,能量较高。因此,我们认为含量较高的异构体应为能量较低的1A。
为进一步确定1A和1B是旋转受阻构象异构体,我们在升温条件(40 ℃)下测定了1的1H NMR谱图(图略),只发现了一组核磁信号[13]。说明升高温度可有效克服旋转能垒,与预期一致。类似旋转受阻构象异构现象在于N-叔丁氧羰基异亮氨酸中也存在[14]。
报道了一种合成(±)-N-叔丁氧羰基-3-乙基-戊氨酸(1)的新路线,总收率43%。该路线不需使用剧毒反应试剂和高压加氢条件,具有路线简洁,原料廉价易得,条件温和,反应试剂安全,收率较高等优点。
参考文献
[1]Bell E A. Nonprotein amino acids of plants:Significance in medicine,nutrition and agriculture[J].J Agric Food Chem,2003,51(10):2854-2865.
[2]Siderius M, Wal M, Scholten D,etal. Unnatural amino acids for the study of chemokine receptor structure and dynamics[J].Drug Discovery Today:Technologies,2012,9(4):e301-e313.
[3]Hallam T, Wold E D, Wahl A,etal. Antibody conjugates with unnatural amino acids[J].Mol Pharmaceutics,2015,12(6):1848-1862.
[4]Lang K, Chin J W. Cellular incorporation of unnatural amino acids and bioorthogonal labeling of proteins[J].Chem Rev,2014,114(9):4764-4806.
[5]K Eisler, J Rudinger. Amino acids and peptides. LXV. Analogues of oxytocin with isoleucine replaced by L-diethylalanine,L-cyclopentylglycine,and L- and D-cyclohexylglycine[J].Collect Czech Chem Commun,1966,31(12):4563-4580.
[6]Mayer S C, Kreft A F, Harrison B,etal. Discovery of begacestat,a notch-1-sparing-γ-secretase inhibitor for the treatment of alzheime,s disease[J].J Med Chem,2008,51(23):7348-7351.
[7]D A 德格伊, W M 卡蒂. 抗病毒化合物:CN 103 153 988B[P].2011.
[8]Saito T, Obitsu T, Kohno H,etal. Pyrrolo[1,2-b]pyridazines,pyrrolo[2,1-f]triazin-4(3H)-ones,and related compounds as novel corticotropin-releasing factor 1 (CRF1) receptor antagonists[J].Bioorg Med Chem,2012,20(2):1122-1138.
[9]Vigneaud V, Stacy G W, Todd D. The synthesis of DL-β,β-diethylcysteine and DL-β-ethyl-β-methylcysteine[J].J Biol Chem,1948,176:907-914.
[10]Resnick L, Galante R J. A practical synthesis of 3-ethyl-L-norvaline[J].Tetrahedron:Asymmetry,2006,17(5):846-849.
[11]张之光, 叶松林. 另丁烯海因的制备方法:CN 101 302 202A[P].2008.
[12]崔国红. DL一异亮氨酸合成新工艺研究[J].四川化工,2010,13(4):12-15.
[13]1H NMRδ: 4.92(bs, 1H, NH), 4.46(bs, 1H, CH), 1.74(m, 1H, CHEt2), 1.45(s, 9H,t-Bu), 1.43~1.20(m, CH2), 1.02~0.85(m, CH3).
[14]King A M, Salome C, Dinsmore J,etal. Primary amino acid derivatives:Compounds with anticonvulsant and neuropathic pain protection activities[J].J Med Chem,2011,54(13):4815-4830.
Synthesis of (±)-N-Boc-3-ethyl-norvaline
ZHUANG Jin-chen,SHEN Zu-yuan,LOU Kai-yan*,WANG Wei
(School of Pharmacy, East China University of Science and Technology, Shanghai 200237, China)
Abstract:5-(Pentan-3-ylidene)imidazolidine-2,4-dione(4) was obtained at 55 ℃ for 6 h under the optimized reaction conditions[hydantoin 2 mmol, n(3-pentanone)∶n(hydantoin)=1.5, cholamine as base, pH 4]. 5-(Pentan-3-yl)imidazolidine-2,4-dione(5) was prepared with hydrogenation of 4 by 5%Pd/C. (±)-N-Boc-3-ethyl-norvaline was synthesized by hydrolyzation of 5 in alkaline condition, and then N-Boc protection reaction. The structure was confirmed by1H NMR,13C NMR and HR-ESI-MS.
Keywords:unnatural amino acid; 3-pentanone; N-Boc-3-ethyl-norvaline; synthesis
收稿日期:2015-05-08;
修订日期:2016-03-18
作者简介:庄金臣(1989-),男,汉族,山东临沂人,硕士研究生,主要从事药物合成的研究。通信联系人: 楼开炎,副教授, E-mail: kylou@ecust.edu.cn
中图分类号:O623.736
文献标志码:A
DOI:10.15952/j.cnki.cjsc.1005-1511.2016.05.15192
