海因连续水解生成海因酸及其动力学研究
2020-04-28赵航宇于荣华刘存礼
赵航宇,乔 浩,于荣华,刘存礼
(南京工业大学,江苏 南京 211816)
目前国内生产甘氨酸的主要工艺还是以氨水和氯乙酸为原料,乌洛托品为催化剂,同时添加大量的甲醇或者乙醇的氯乙酸法,该方法虽然有效解决了氯化铵难以除去的问题,但增加了成本,并且反应时间长、催化剂难以回收,对环境污染严重,在如今环保政策下,氯乙酸法无法达到政策要求,此工艺现已被国外所淘汰[1]。
国外生产甘氨酸的工艺主要是以氯化铵和氢氰酸为原料,但氢氰酸是剧毒物质,且该工艺耗时长,后处理较为复杂,操作要求苛刻[2]。
而海因法以海因、氢氧化钠、和水为原料,通过从管式反应器连续进样,在氢氧化钠用量足够的情况下,经历两步水解制得甘氨酸,过程时间短,原料无毒,反应全程在水溶液中进行,操作方便、安全。
目前全球采用的最有效的除草剂是草甘膦,且暂时还没有新型除草剂可以代替草甘膦[3]。甘氨酸作为生产除草剂草甘膦的主要原料,保证其产能是十分重要的。我国草甘膦的年总产能可以达到56万吨,但是在环保高压下,厂家开工率连年下降,对于甘氨酸的供给已稍显不足[4],并且甘氨酸在医药、食品及其他方面均有使用[5],因此,探究甘氨酸的新型生产工艺迫在眉睫。
本课题主要研究海因法制备甘氨酸的第一步——海因水解形成海因酸,探究了温度、水解时间、以及碱用量对反应的影响,并建立了水解动力学模型。
1 实 验
1.1 仪器和试剂
仪器:管式反应器(自制);MP0510中压恒流泵,上海三为科学仪器;安捷伦1260 Infinity 液相色谱仪,安捷伦仪器;MP511 pH检测仪,三星精密仪器;SHZ-D(Ⅲ)循环水式真空泵,巩义市予华仪器厂;KQ2200E超声波清洗器,昆山市超声仪器有限公司。
试剂:海因(自制);氢氧化钠(AR),西陇科学股份有限公司;磷酸二氢(HPLC),国药集团化学试剂有限公司;乙腈(HPLC),国药集团化学试剂有限公司;甲醇(HPLC),国药集团化学试剂有限公司;磷酸(AR),国药集团化学试剂有限公司;磷酸二氢铵(GR),国药集团化学试剂有限公司。
1.2 实验步骤
本课题采用的水解方式为连续水解。在烧杯中加入8.0 g海因以及一定摩尔比例的氢氧化钠,溶于500 mL纯水中,设置不同的流速从恒流泵进样,流经管式反应器,进样1 h后开始取样,每次取样时长15 min(保证取样量足够多,使得检测结果更准确),共取五次,反应液用高效液相色谱检测[6]。
1.3 液相色谱检测条件
液相色谱仪为安捷伦1260,采用C18液相色谱柱;室温;检测波长为205 nm;流动相为1:9:0.5(V/V/V)乙腈和磷酸盐缓冲溶液和三乙胺(pH 3.0);流速:1.2 mL/min;进样量20 μL。待测液配制:取1 mL反应液用流动相配制成25 mL待测液,用外标法计算海因酸和海因在反应液中的浓度。
1.4 水解过程影响因素探究
水解方程式为:
(1)海因水解生成海因酸
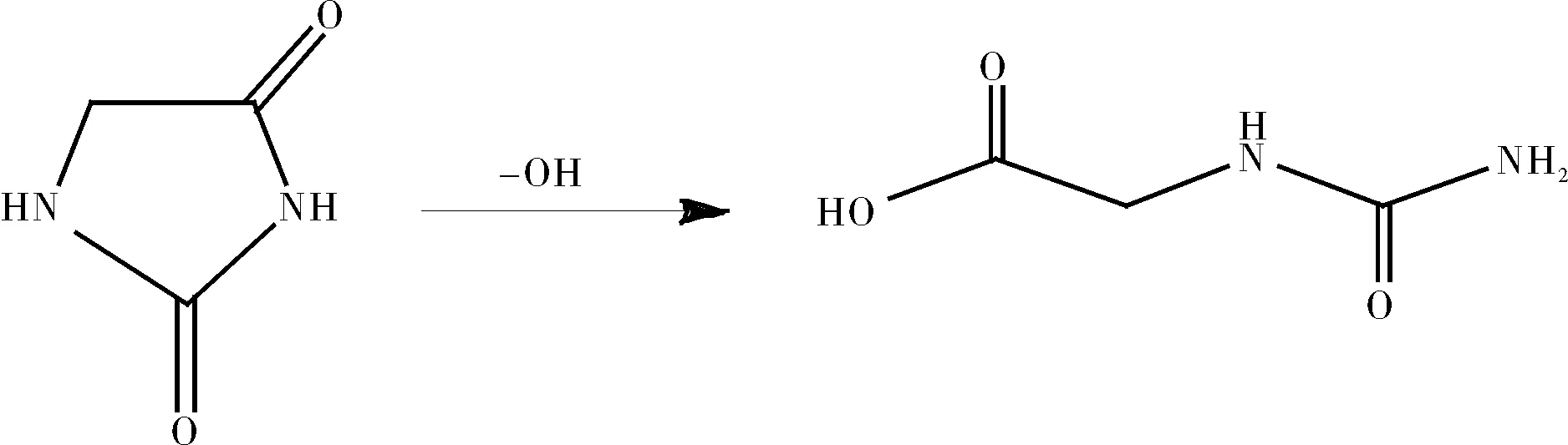
(2)海因水解生成N-甲羧基氨基乙腈(N-Carboxymethyl Aminoacetonitrile)
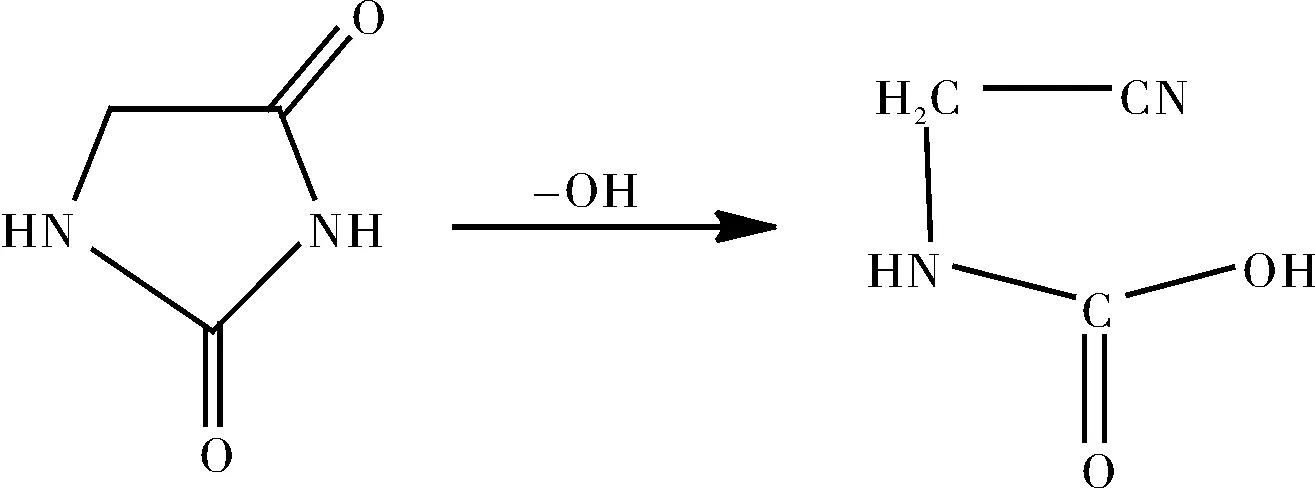
1.4.1 氢氧化钠与海因摩尔比及停留时间对水解过程的影响
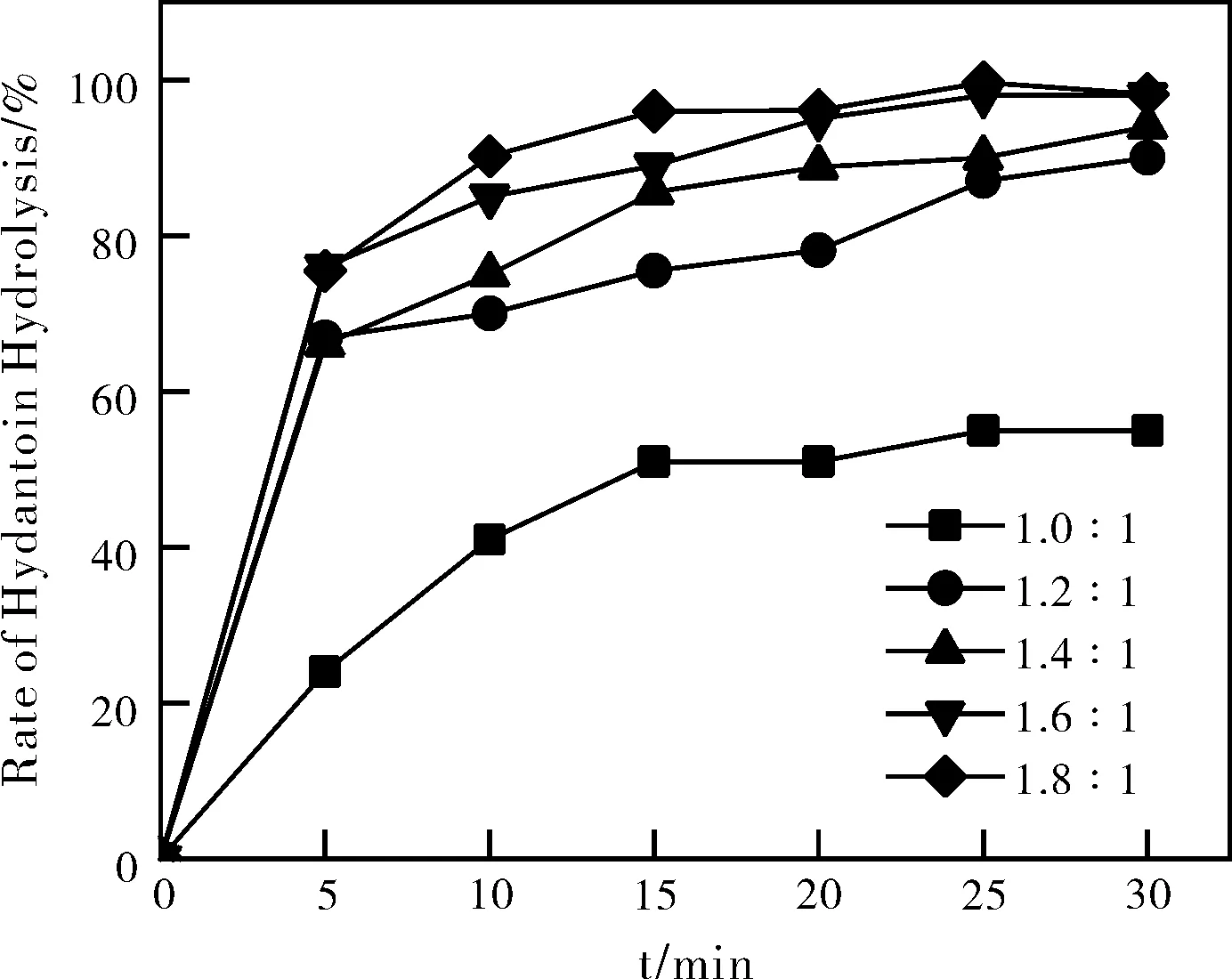
图1 氢氧化钠与海因的摩尔比及停留时间对海因水解的影响Fig.1 Effect of molar ratio of sodium hydroxide to Hydantoin and residence time on Hydrolyzation of Hydantoin
实验条件为:水解温度120 ℃,海因的浓度为0.1642 mol/L,氢氧化钠与海因的摩尔比分别为1.0:1;1.2:1;1.4:1;1.6:1;1.8:1,停留时间分别为5 min、10 min、15 min、20 min、25 min、30 min。图1显示,同温度下,在氢氧化钠用量较低并且停留时间较短的情况下,海因的转化率也较低,而当氢氧化钠用量的摩尔比在1.6和1.8,停留时间达到25 min以及30 min时,海因均接近完全水解,综合考虑,选择氢氧化钠与海因的摩尔比为1.6,停留时间25 min更为合适。
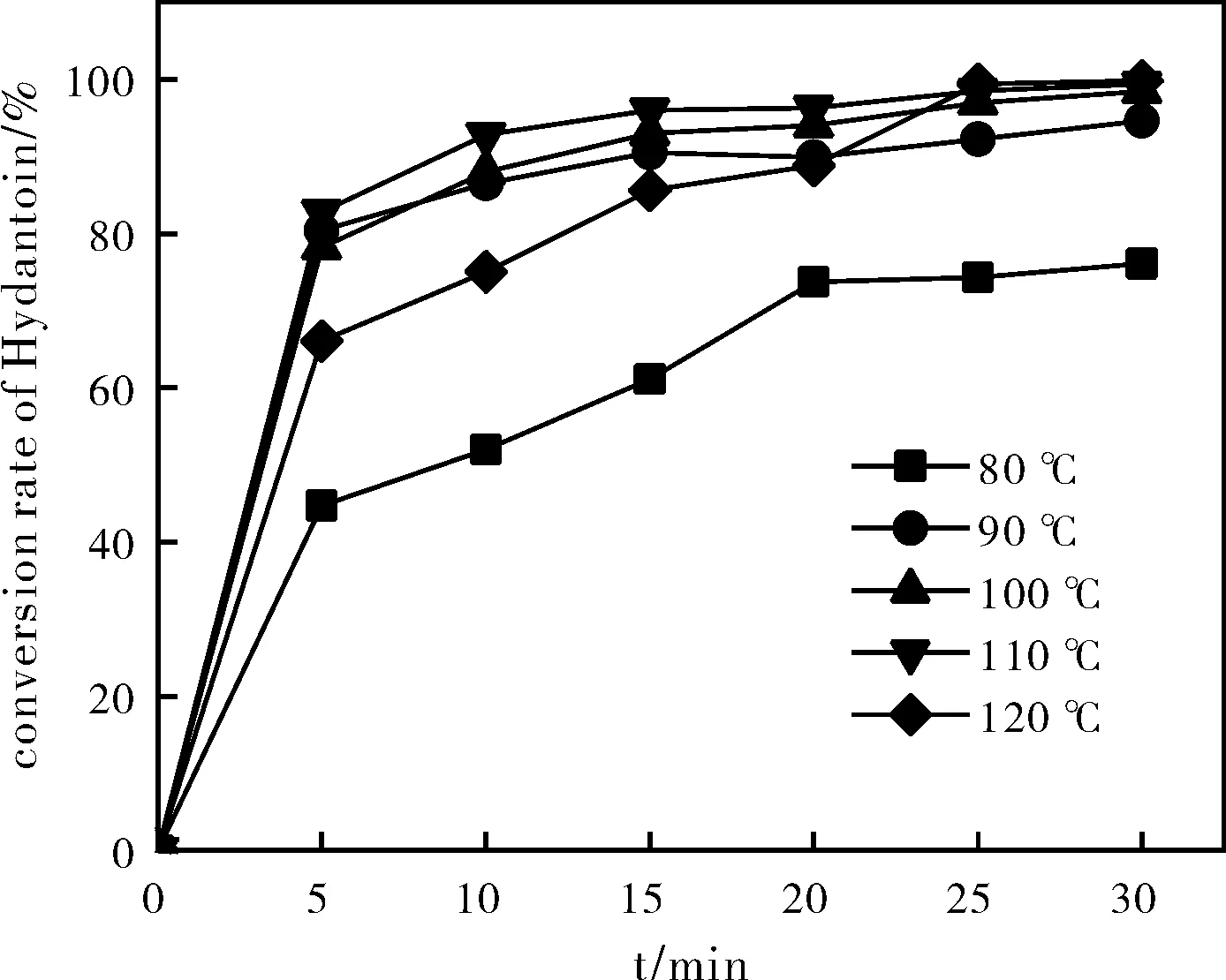
图2 不同温度对海因水解的影响Fig.2 Effects of different temperatures on Hydrolysis of Hydantoin
1.4.2 温度对水解过程的影响
氢氧化钠与海因摩尔比为1.6:1,停留时间为25 min,分别在80 ℃、90 ℃、100℃、110 ℃、120 ℃温度下进行水解。如图2所示,随着反应温度提高到110 ℃,海因接近完全水解,且各时刻的转化率较之其他温度都是最高的,如图3所示,110 ℃时海因酸的产率与120 ℃时的产率几乎相同。因此,选择110 ℃为较适宜的水解温度。
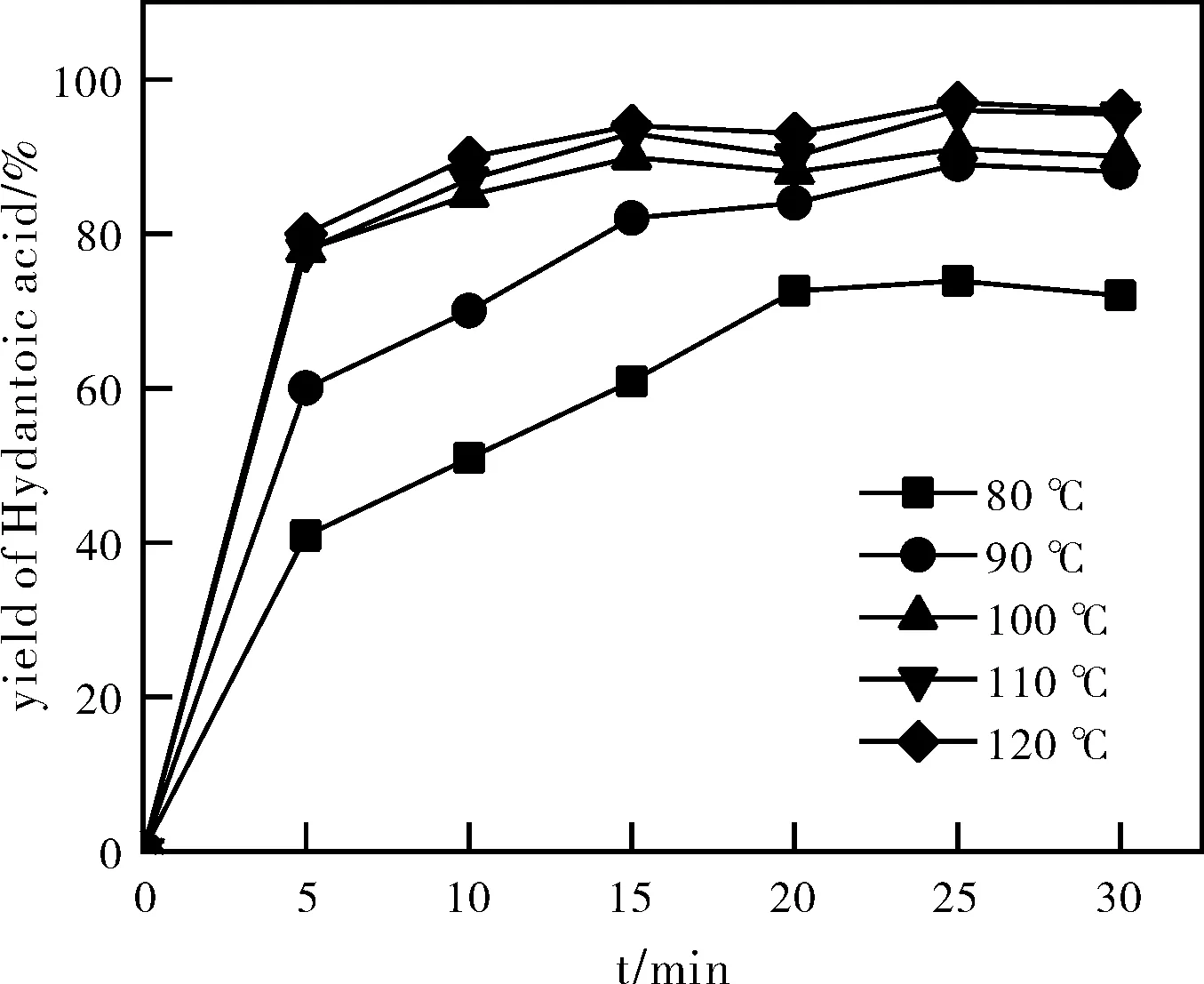
图3 不同温度对海因酸产率的影响Fig.3 Effect of different temperatures on the yield of Hydantoic Acid
1.5 水解条件的确定
由上述实验结果综合分析,确定反应温度110 ℃,停留时间25 min,氢氧化钠与海因摩尔比为1.6:1时,是海因水解生成海因酸较为适宜的条件。
2 动力学模型的确定
2.1 水解条件的确定
(1)高效液相色谱分析
海因、海因酸、N-甲羧基氨基乙腈标准品的液相色谱图,见图4~图6。

图4 海因标准品高效液色谱Fig.4 High performance liquid chromatography of hydantoin standard
图5 海因酸标准品高效液色谱Fig.5 High performance liquid chromatography of hydantoin acid standard
图6 N-甲羧基氨基乙腈标准品的液相色谱图Fig.6 High performance liquid chromatography of N-carboxymethyl aminoacetonitrile
(2)海因水解液的液相色谱检测图
根据液相检测结果见图7、图8,对照标准品的出峰时间发现,在80 ℃和90 ℃海因水解液的液相色谱图中只存在两个峰——海因以及海因酸的峰,而在图9和图10液相色谱检测结果中发现此时海因水解液中开始产生新的甘氨酸中间体,N-甲羧基氨基乙腈。由于海因酸在120 ℃以下并不会发生水解,因此,N-甲羧基氨基乙腈只能是海因的另一个水解产物。且随着温度的升高,该中间体略有增加,但经液相色谱测得的浓度极低,几乎可以忽略不计,且N-甲羧基氨基乙腈并非在每个时刻都会产生,此因对于副反应的k值不作计算,故只需对海因水解产生海因酸这一主反应进行动力学参数计算即可。
反应全程在水溶液中进行,反应物没有发生相变,且海因完全溶于碱液中,故认为该水解反应为均相反应[7]。
图7 80 ℃海因水解液液相相色谱Fig.7 High performance liquid of hydantoin hydrolysate at 80 ℃
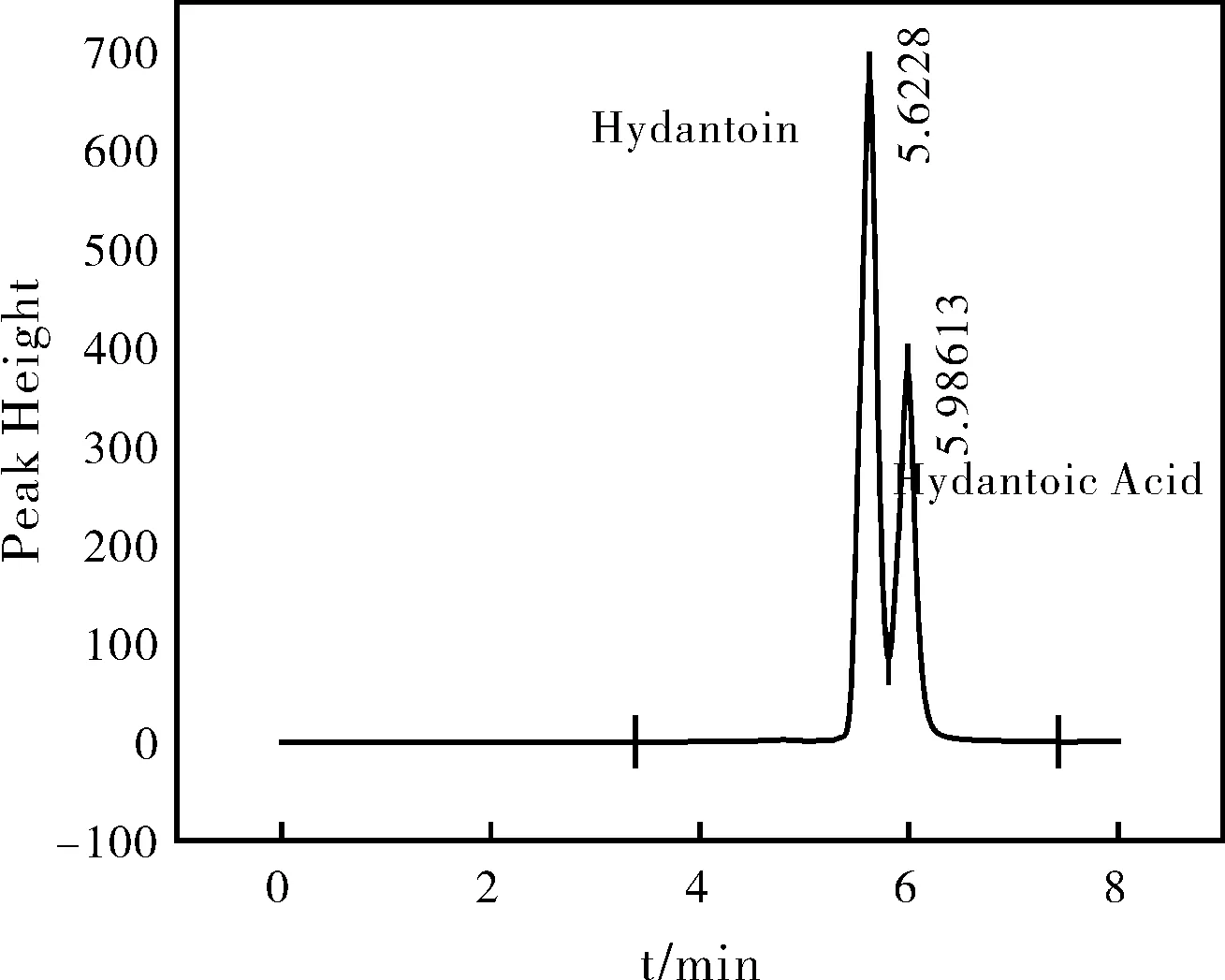
图8 90 ℃海因水解液液相色谱Fig.8 High performance liquid of hydantoin hydrolysate at 90 ℃
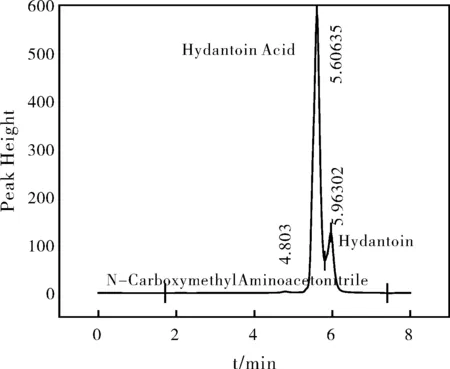
图9 100 ℃海因水解液液相色谱Fig.9 High performance liquid of hydantoin hydrolysate at 100 ℃
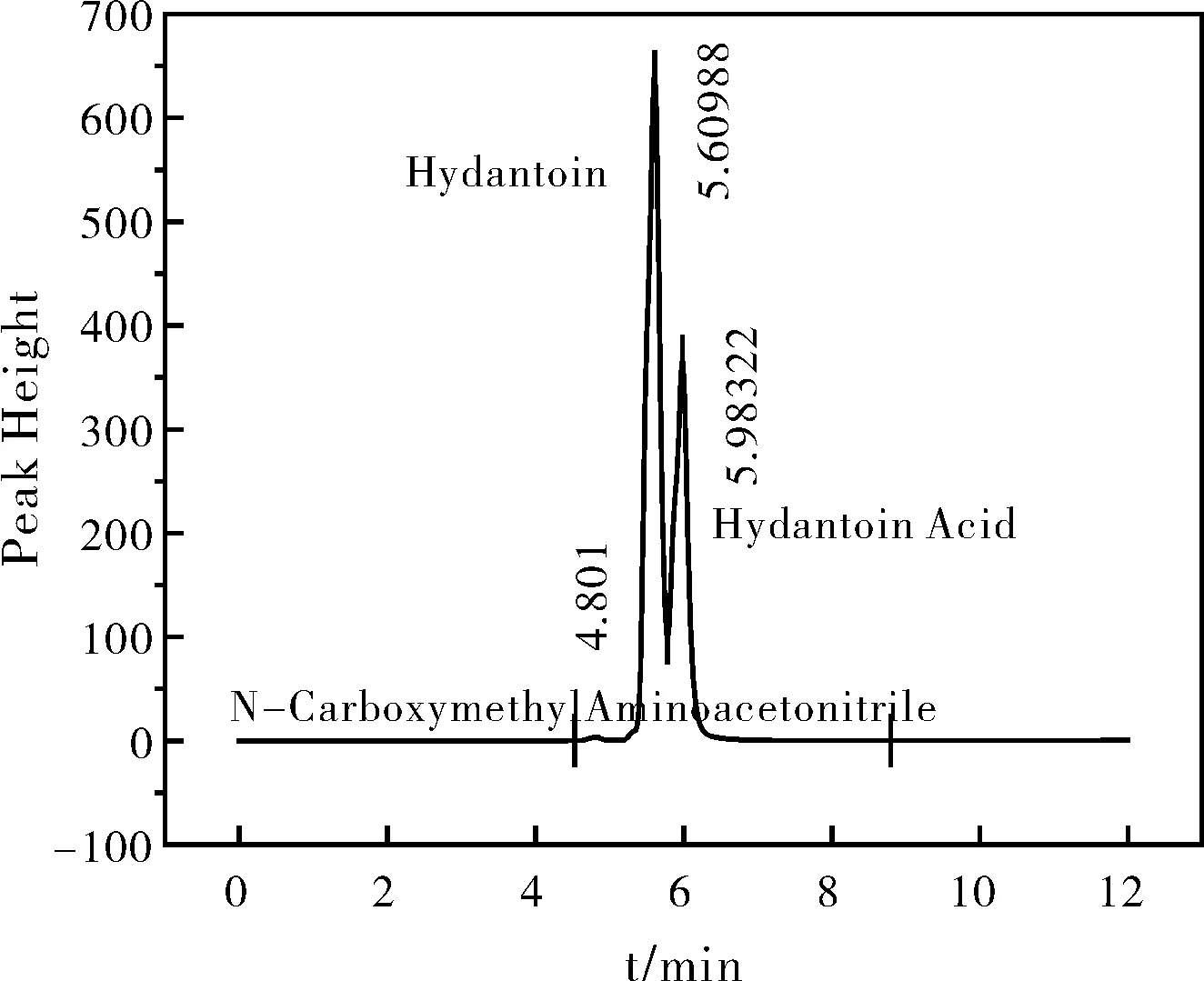
图10 110 ℃海因水解液液相色谱Fig.10 High performance liquid of hydantoin hydrolysate at 110 ℃

表1 标准品色谱检测出峰时间表Table 1 Peak time table for standard chromatographic detection
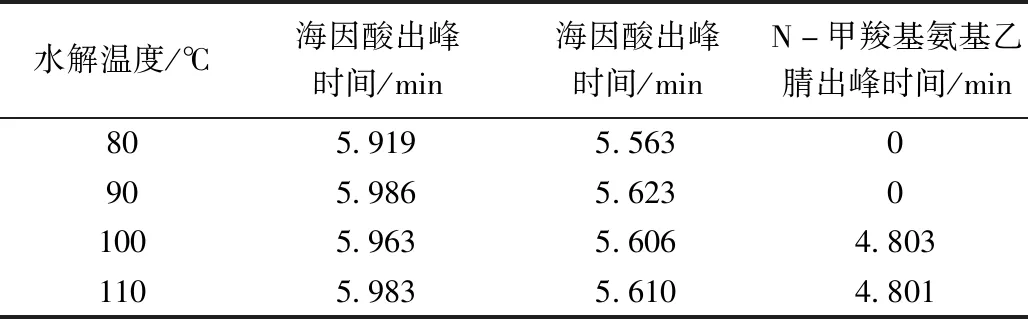
表2 各温度的海因水解液色谱检测出峰时间表Table 2 Chromatographic peak time table of hydantoin hydrolysate at various temperatures
2.2 水解方程
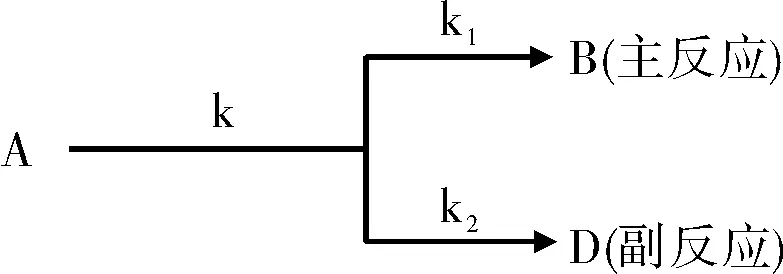
A为海因,B为海因酸,D为N-甲羧基氨基乙腈,k为总反应速率常数,k1为主反应速率常数,k2为副反应速率常数,CA为海因实验浓度,α为主反应级数,β副反应反应级数。
建立动力学方程:
(1)
(2)
(3)
在液相色谱检测结果中,副产物的含量几乎为0,且出现时段不固定,因此K2不作计算。
2.3 反应级数和速率常数确定
2.3.1 反应级数和速率常数的确定
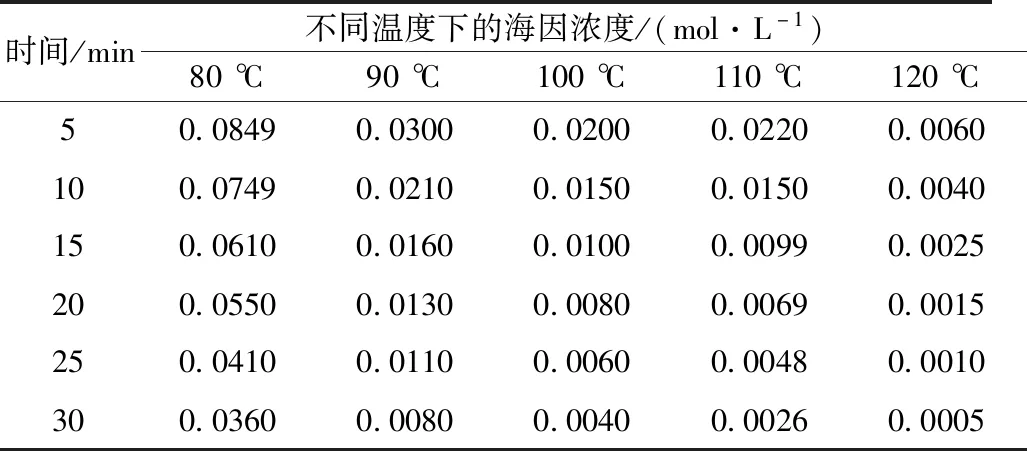
表3 海因实验浓度Table 3 Experimental concentration of hydantoin
确定反应级数方法通常有微分法、积分法、半衰期法[8]。但是仅用这些方法计算,工程量和误差都很大,本实验的反应级数采用Excel宏观规划求解。对于一级反应,lnc-t呈线性关系,而对于非一级反应,1/c(n-1)-t称线性关系。在Excel软件中输入不同温度下的反应时间以及对应时刻的实际浓度,当n等于1时,求解lnc-t的线性关系;当n不等于1时,通过设定不同的n(级数)值,应用correl函数求出在不同温度下,1/c(n-1)-t的最大r2值。
具体求解步骤:将实验测得浓度数据输入Excel单元格,A1~A7输入80 ℃各时刻浓度,B1~B7输入90 ℃各时刻,依此方法输入所有温度下测得的浓度数据。在F1~F7输入反应时间,设置可变单元格N1,输入初始值n值2,在G1-G7中输入公式1/c(n-1)把n=2以及80 ℃下的各时刻浓度带入,设置目标单元格K1,输入correl函数,采用宏观规划求解,设置约束条件:$K$1<=1,点击求解,即可求得最佳n值,使得目标单元格值最接近于1,n即为反应级数,1/c(n-1)记作M,依此方法,求得各温度反应级数。结果如表4所示。
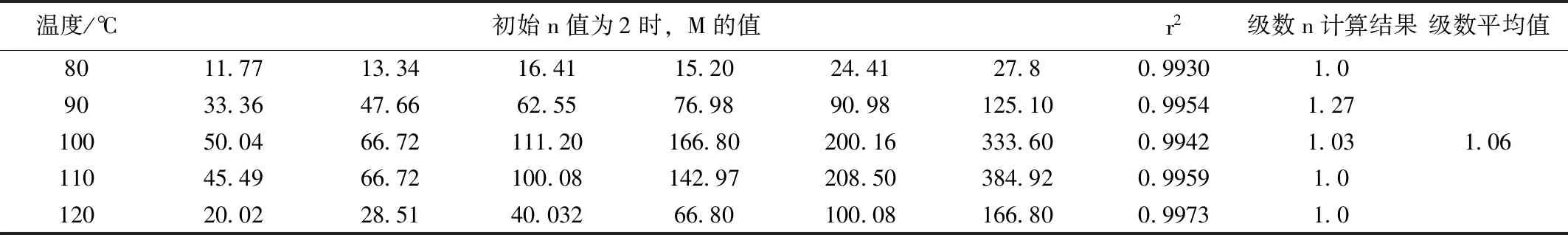
表4 各温度下的M值以及最佳n值Table 4 M value at various temperatures and the best n value
表4显示,不同温度下,除了90 ℃时,反应级数略微高于1,其他四个温度的级数均等于1,因此认为该反应是总反应级数为1的一级反应。
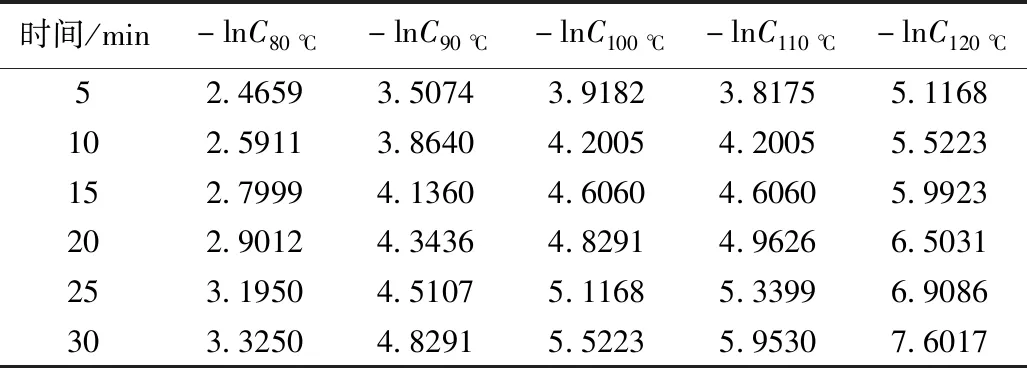
表5 -lnCA的值Table 5 Value of -lnCA
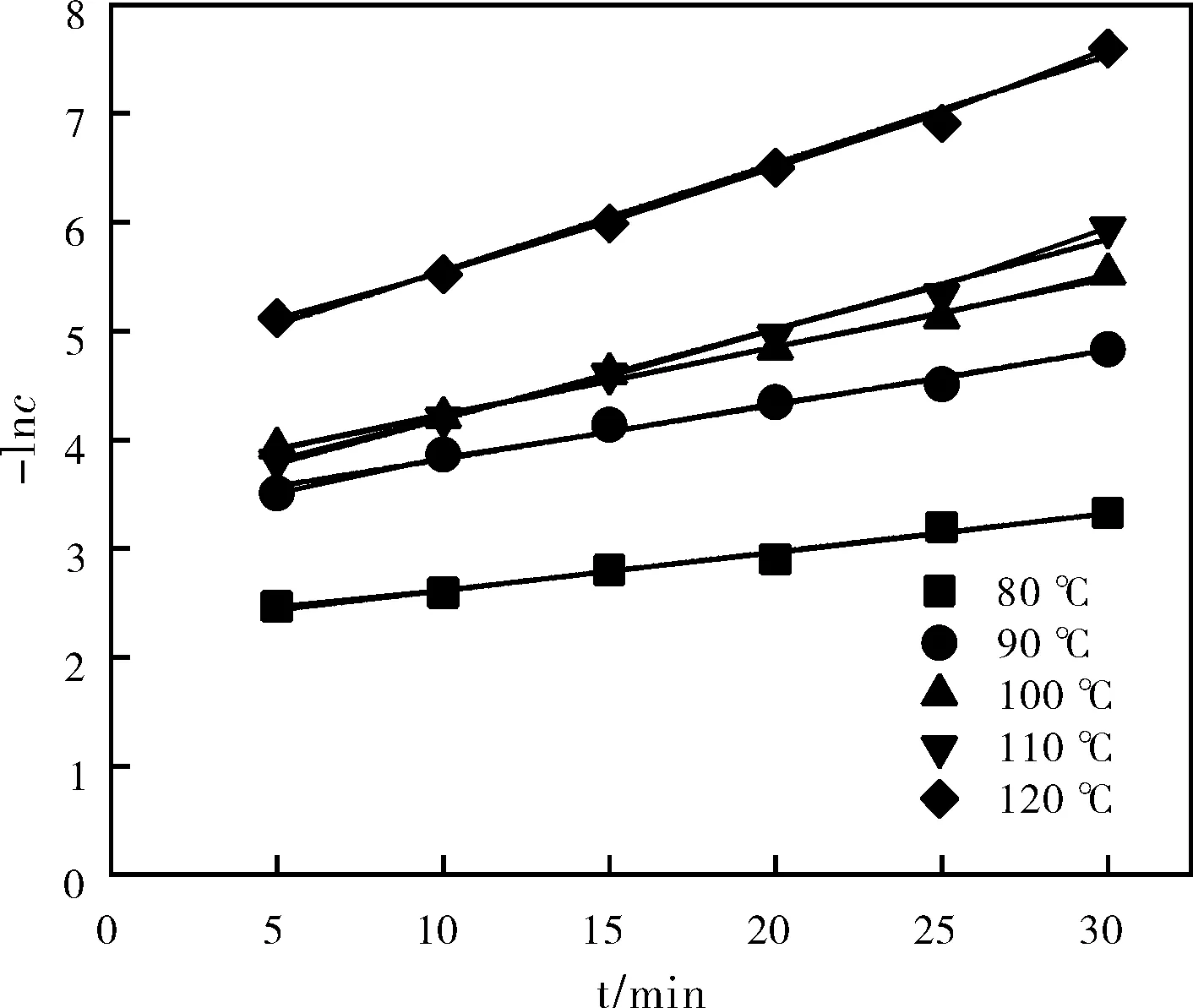
图11 -lnc对t的关系及其线性拟合结果Fig.11 The relationship between -lnc and t and its linear fitting results
不同温度下的-lnCA-t作图,各斜率即为反应速率常数,见图11。
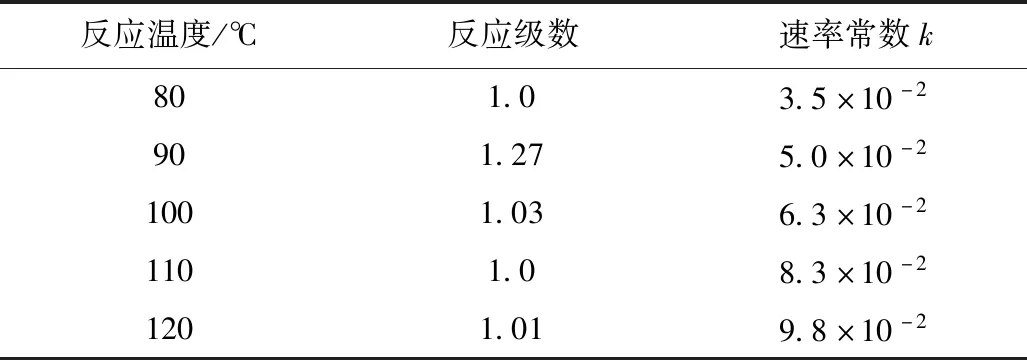
表6 速率常数计算结果Table 6 Calculation results of rate constants
相同温度下,比较两种水解方式的反应速率常数,我们可以发现,管式连续水解速率常数远远大于釜式水解,表明在相同温度下,管式连续水解速度要快于釜式水解。

表7 相同温度下文献报道的海因釜式水解[9]与实验测得管式连续水解速率常数比较Table 7 Comparisons between tubular hydrolysis rate constants and caldron hydrolysis rate constants
2.3.2 线性拟合分析
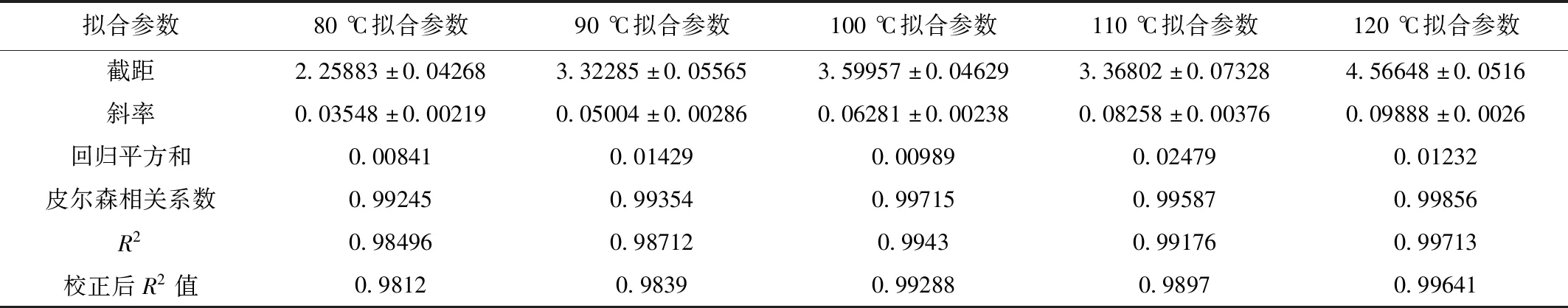
表8 线性拟合结果Table 8 Result of linear fitting
皮尔森相关系数计算公式:
残差平方和SSR计算公式:
从图11中可以看出,五组数据皆呈直线关系,关系表达式为-lnc=kt+b,而表8的拟合结果显示, 五组SSR的值均接近于0,且无论是皮尔森相关系数,还是R2值以及校正后的R2值均接近于1,表明拟合结果良好。
2.3.3 模型显著性分析
为验证该动力学模型的适用性,采用Origin软件中样本t检验和方差分析,对模型回归系数以及整体显著性进行检验。统计检验结果如表9所示。
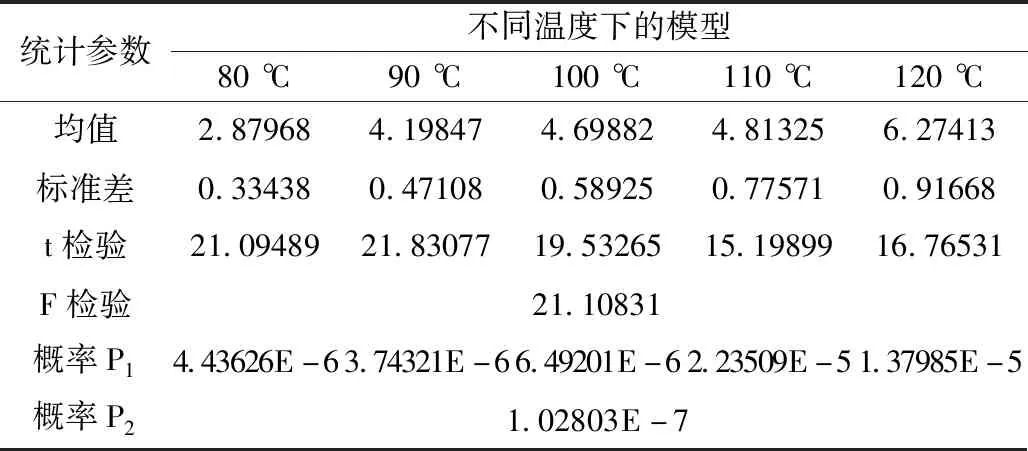
表9 模型显著性检验结果Table 9 Test result of model saliency
根据表9显示,t检验样本结果中P1远小于0.01,方差分析中P2远小于0.01,表明回归系数显著性以及模型整体显著性都极好。证明该动力学模型在此温度区间内是较为合适的。
2.3.4 活化能计算[10]
根据阿伦尼乌斯方程k=A0exp[-Ea/(RT)],得
lnk=InA0[-Ea/(RT)],以lnk-T-1作图,得图12。
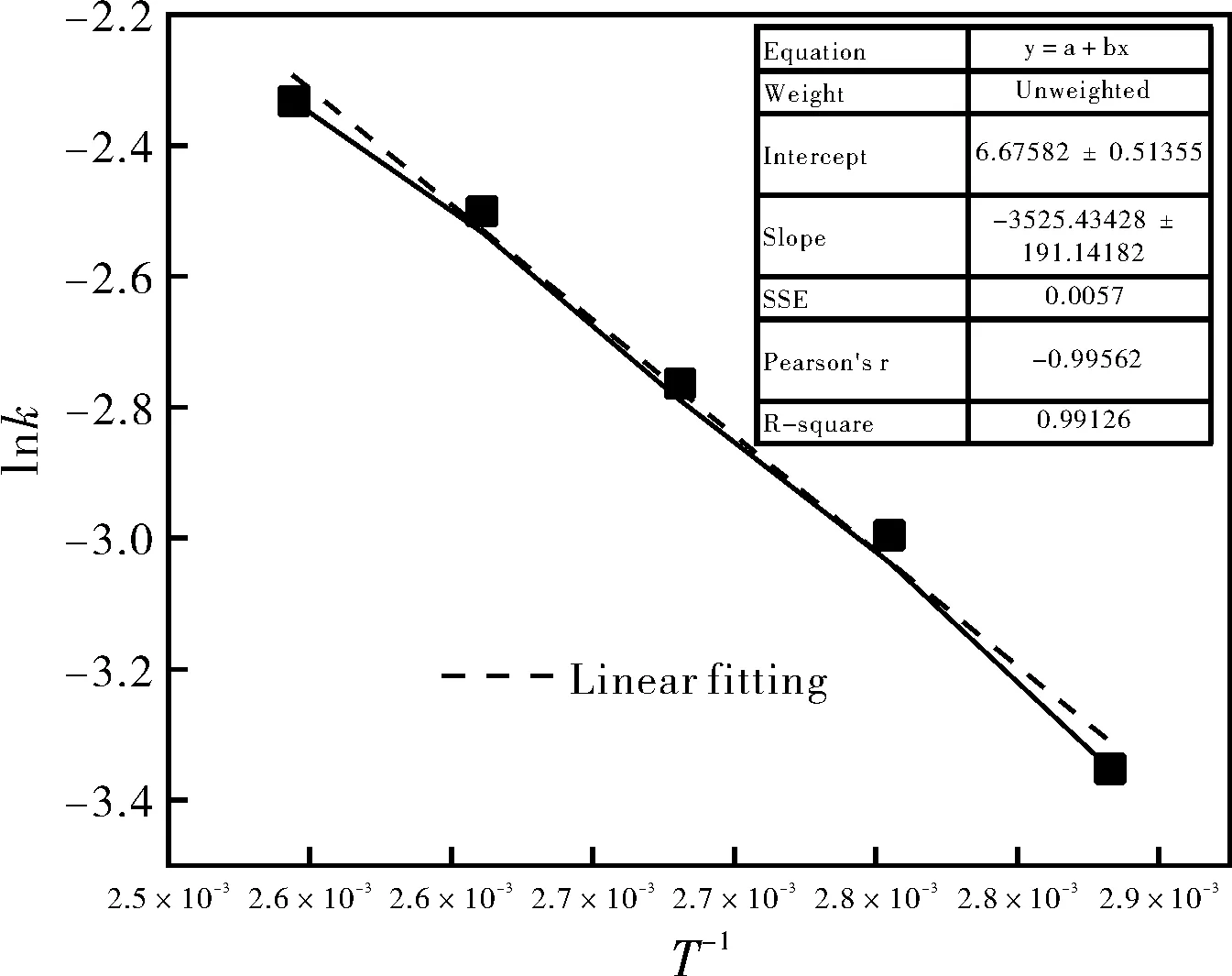
图12 lnk与T-1的关系图Fig.12 Relationship between lnk and T-1
根据图12,由线性拟合得到直线斜率γ,且R2=0.99126,拟合结果较好。把γ代入阿伦尼乌斯推导公式lnk=lnA0-Ea/(RT)得:
Ea/R=γ
Ea=R×γ=2.9307×104J·mol-1
海因水解反应活化能E为2.9307×104J·mol-1,指前因子A0为7.92×102。
3 结 论
(1)本课题通过实验考察了温度、碱用量、反应时间对于海因水解制备海因酸过程的影响,确定了110 ℃,碱用量1.6,反应时间25 min为最适反应条件,并且确定海因水解制备海因酸的反应是总反应为一级的平行反应,通过速率常数求得活化能E为2.9307×104J·mol-1,指前因子A0为7.92×102,同时建立了水解动力学模型。
(2)随着反应温度的升高,速率常数开始增大。管式连续水解速率常数比一般的釜式水解速率常数大上许多,且管式水解的活化能较低,这表明管式连续水解,除了能有效解决釜式水解耗时长这个问题之外,其反应本身所耗能更低,且不影响海因水解率及产物的产率,使得海因法生产甘氨酸这一工艺的时间和成本降低,为将来管式连续化生产甘氨酸的中试工艺以及产业化提供了一个可行性的依据。
