蛋白质与多酚相互作用研究进展
2016-06-07刘夫国马翠翠王迪高彦祥
刘夫国,马翠翠,王迪,高彦祥
(中国农业大学 食品科学与营养工程学院,北京,100083)
蛋白质与多酚相互作用研究进展
刘夫国,马翠翠,王迪,高彦祥*
(中国农业大学 食品科学与营养工程学院,北京,100083)
摘要植物多酚因其独特的化学结构而具有抗肿瘤、抗氧化、抑菌、抗病毒等多种生理功能,在农业、食品、医药等领域得到了广泛应用。多酚可以与蛋白质形成复合物从而导致2种化合物的结构、功能和营养特性的变化。影响蛋白质与多酚非共价相互作用的因素包括温度、pH、蛋白质的类型和浓度,以及酚类化合物的类型和结构。与非共价相互作用相比,蛋白质与多酚共价相互作用将不可逆地改变2种分子的理化性质和功能特性。文中介绍了蛋白质和多酚之间相互作用的生化机制,讨论了用于研究蛋白质与多酚相互作用的方法及所面临的主要挑战。同时,指出了分析蛋白质-多酚产物应考虑的主要问题。
关键词蛋白质;多酚;相互作用;机理;功能特性
酚类化合物是植物体内一类最重要的次生代谢产物,具有较强的抗氧化作用,以及明显的抑菌、抗癌、抗衰老和抑制胆固醇升高等功效。摄取一定量的植物多酚能够有效地预防和抑制疾病的发生。随着现代分离提取技术的迅猛发展,大量植物多酚已从植物中分离鉴定出来。科学研究表明,多元酚结构具有独特的理化性质,如能与蛋白质、多糖、生物碱等结合,能与金属离子络合,具有还原性,能清除羟自由基等[1]。在食品加工及人体消化过程中,多酚能与多种化合物发生相互作用,其中蛋白质是最主要的化合物。
蛋白质与多酚通过可逆和不可逆的方式发生相互作用。可逆的复合过程通常涉及非共价相互作用,而大分子和多酚之间形成共价键的过程是不可逆的。共价复合物的形成主要源于多酚的氧化和亲核加成过程。但是,在多数情况下,共价和非共价相互作用可能同时发生,例如绿原酸与蛋白质的结合[2-3]。本文将重点介绍蛋白质与多酚的相互作用、蛋白质与多酚相互作用的潜在机制及相互作用对蛋白质和多酚性质的影响。
1蛋白质与多酚的结构和性质
蛋白质是生命存在和运动的物质基础,是高度复杂的聚合物。自然界中,生物体内的蛋白质由20种结构不同的氨基酸组成。蛋白质的结构和功能的不同主要取决于氨基酸的种类、数量、排列顺序和肽链的空间结构。在食品体系中,蛋白质能够与其他食品组分复合,例如多糖和多酚等,复合方式包括共价与非共价相互作用,如图1所示。研究表明,蛋白质与多酚相互作用会引起蛋白质的二级和三级结构发生改变,溶解性降低而热稳定性可能会提高[4]。
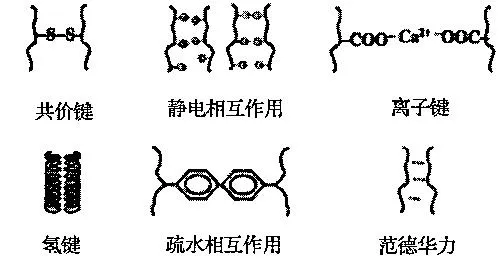
图1 蛋白质与食品组分间的相互作用示意图Fig.1 Schematic diagram of interactions between proteins and food ingredients
多酚类化合物是植物中一组化学物质统称,通常含有羟基基团连接苯环的结构,常见的多酚化合物如图2所示。多酚可分为两大类:一类是多酚单体,即非聚合物,包括各种黄酮类化合物、绿原酸类、没食子酸和鞣花酸,也包括一些接有糖苷基的复合类多酚化合物(如芸香苷等);另一类则是由单体聚合而成的低聚体或多聚体,统称单宁类物质,包括缩合型单宁中原花青素和水解型单宁中没食子单宁和鞣花单宁等。
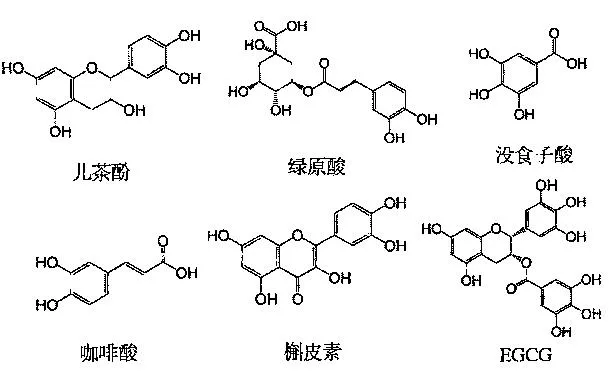
图2 常见多酚化合物的结构Fig.2 Chemical structures of the common polyphenolic compounds
多酚与蛋白质非共价和共价相互作用是2个影响富含多酚食品品质的根本因素。在加工食品中,多酚与大分子非共价相互作用主要源于弱结合,即氢键和疏水性相互作用的结果。同时,由于含酚羟基的化学结构,多酚具有高反应活性,它们很容易经过酶和非酶途径被氧化,形成邻醌或邻半醌,与蛋白质的氨基酸侧链基团发生反应。
2蛋白质与多酚非共价相互作用
蛋白质与多酚非共价键的作用包括疏水相互作用、氢键、范德华力等。虽然非共价相互作用很弱(一般小于10 kJ/mol,比通常的共价键键能小1~2个数量级),作用范围为0.3~0.5 nm,但这些分子间弱相互作用力可在一定条件下起协同作用,形成具有一定方向性和选择性的强作用力[5]。 例如啤酒、葡萄酒、茶饮料、果蔬汁等在销售期间容易形成混浊,严重影响到产品的质量和货架期,而蛋白质与多酚非共价相互作用即是引起混浊或沉淀最常见、最重要的原因之一[6]。由于多酚分子结构的多样性及蛋白质分子中存在多种不同功能基团,原则上氢键、疏水键、共价键都可能发生于蛋白质与多酚的相互作用中。至于共价键的形成则是一个不可逆变化过程,而许多由冷却造成的混浊当重新加热后又会部分或全部溶解,这表明在蛋白质与多酚的相互作用中没有共价键合[6]。
2.1分析方法
为了探究蛋白质-多酚的相互作用和形成复合物的性质,在分子水平上认知蛋白质与多酚体系是非常重要的。蛋白质与多酚的非共价相互作用主要通过3种方法来进行研究:直接研究溶液中蛋白质与多酚形成的复合物;通过多酚来沉淀蛋白质;间接研究蛋白质与多酚相互作用对蛋白质活性(主要是酶)造成的影响[4]。由于蛋白质-多酚的相互作用较为复杂,没有单一的技术能提供全面的信息,一般通过多种技术进行表征。这些技术包括荧光光谱、圆二色光谱、傅立叶变换红外(FTIR)光谱、动态光散射(DLS)、等温滴定量热法(ITC)、核磁共振、平衡透析法、浊度测定法、蛋白质沉淀法、体积排阻色谱和亲和色谱等,表1描述了这些方法的优缺点。

表1 直接用于评价蛋白质-多酚非共价结合方法的对比
2.2非共价相互作用机理及影响因素
蛋白质与多酚的相互作用受到蛋白质和多酚的结构、相对浓度、溶剂组成以及溶液参数(pH、离子强度、温度等)的影响[7]。所有这些因素可以用来解释蛋白质与多酚相互作用的机理。溶剂组成对蛋白质和单宁相互作用的影响表明,复合物的形成主要源于氢键和疏水相互作用[8]。疏水相互作用被认为是蛋白质与多酚相互作用最主要的驱动力,氢键会进一步加强这种作用。疏水相互作用主要是由多酚的芳香环和蛋白质的疏水位点引起的,如脯氨酸残基的吡咯环。氢键主要发生在蛋白质的氢原子受体位点和多酚的羟基基团上;其他的相互作用比如离子键主要发生在蛋白质带正电的基团(如赖氨酸的ε-氨基基团)和多酚带负电的羟基基团上[4]。
氢键和疏水键都受温度的影响,因此,在蛋白质和多酚形成非共价复合物的过程中,温度是重要因素之一。SASTRY等[9]研究指出,温度显著影响葵花籽11S蛋白与绿原酸的结合。当温度从30 ℃增加到45 ℃,葵花籽11S蛋白与绿原酸的结合能力显著降低,在55℃下无相互作用力。Prigent等[10]研究了在5 、25和60 ℃条件下牛血清白蛋白(BSA)与绿原酸非共价相互作用,结果表明,随着温度的增加,两者结合能力降低。
pH也是影响蛋白质与多酚非共价相互作用的重要因素之一。在低于蛋白质等电点0.3~3.1时,蛋白质-多酚非共价复合物的溶解度最低[11]。低pH值时,蛋白质有更多的结合位点,蛋白质和多酚的结合程度较大。在pH≤7条件下,绿原酸能够与BSA、溶菌酶和α-乳清蛋白非共价结合,当pH值较低时,绿原酸与BSA结合量较多[2]。在较高pH值条件下,由于绿原酸被氧化形成自由基或醌类化合物,绿原酸和蛋白质的共价结合能力也较强[3]。
多酚和蛋白质的相对浓度也会影响两者的相互作用。当一种蛋白质和一种多酚以各种比例混合时,可能会出现以下现象:如果蛋白质浓度保持恒定,随着多酚添加量的增加,混浊形成量先是增加,到达一个最大值后开始下降;同样,如果多酚添加量保持不变,改变蛋白质浓度,混浊形成量的变化具有类似的趋势。Siebert等[12]采用模型解释了这种现象。如图3所示,假设蛋白质含有固定数目的多酚结合位点,同时多酚含有2个能与蛋白质结合的末端,当末端数目与蛋白质的结合位点数相等时,此时就会形成很大的网状结构,产生较大的胶体粒子和最强的光散射。当蛋白质含量高于多酚含量,如啤酒体系,每个多酚可以桥连2个蛋白质分子,但是蛋白质不能连接到其他蛋白质上,因此形成蛋白质二聚体结构,产生少量混浊。当多酚含量超过蛋白质含量,如苹果汁体系,几乎所有的蛋白质的结合位点都被多酚所占据。因此,只被结合了一个末端的多酚分子很难在另一个蛋白质上找到合适的位点而把2个蛋白质连起来,同样也只是形成很小的胶体粒子。该模型能够预测蛋白质与多酚浓度增加时溶液体系浊度的变化。例如,当单宁酸与BSA相互作用时,过度增加BSA的含量,不溶复合物出现溶解现象[13]。
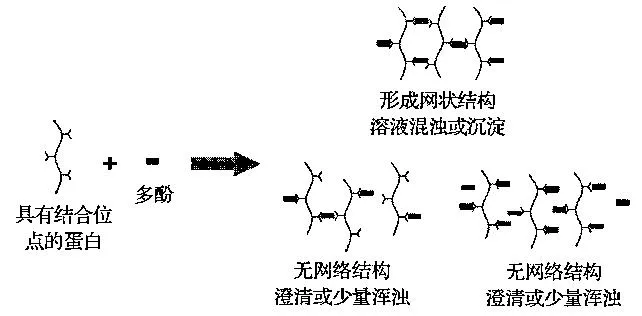
图3 蛋白质与多酚相对浓度对其相互作用的影响Fig.3 Effect of relative concentration of proteins to polyphenols on their interactions
此外,多酚和蛋白质结构也影响两者的结合[14]。多酚含有大量的酚羟基使其具有一定的亲水性,在水中以胶体形式存在。而低亲水性多酚能与蛋白质发生强烈的相互作用,同时多酚分子质量越高,越能有效地沉淀蛋白质。蛋白质与多酚结合取决于蛋白质的分子大小、二级和三级结构、表面疏水性及氨基酸的组成。一般来说,具有高碱性残基含量、高脯氨酸含量、分子质量较大、疏水性较强,且结构展开的蛋白质更易与多酚发生非共价相互作用[4]。
3蛋白质与多酚共价相互作用
酚类化合物具有较高的反应活性,许多多酚都能够被氧化成其相应的半醌和醌,它们能够与亲核试剂发生共价反应,如蛋白质的侧链赖氨酸或半胱氨酸基团[15]。在食品加工中(例如热处理),醌的形成是一个重要因素,它可能成为分子相互反应的底物。例如阿魏酸或香豆酸被氧化形成半醌,然后通过自由基可参与非酶反应,包括聚合及分解反应等[16]。反应的先决条件是产生亲电物质,进行亲核(迈克尔型Michael-type)加成[15]。一般来讲,反应的酚类化合物结构越复杂,反应产物越复杂。
由于反应产物难以拆分,因此蛋白质-多酚共价复合物的分析具有一定的挑战性。目前,多采用理化方法和光谱特征相结合的方法来分析反应产物。
3.1分析方法
研究蛋白质与多酚反应产物时,可采用理化分析或质谱分析。理化分析方法集中于评价修饰的氨基酸,分析酚类化合物结合程度或者评价2种化合物性质的变化。质谱分析常常用于鉴定蛋白质特定的结合位点。目前2种方法仍有一定的局限性,其主要原因在于:(1)反应产物结构复杂;(2)蛋白质以及酚类化合物在反应后仍然能保持一定的活性。
3.1.1理化分析方法
评价蛋白质反应程度最简单的方法是分析反应前后氨基酸侧链的变化。因此可以通过分析氨基酸组成,或通过简单的比色法来完成。例如采用三硝基苯磺酸测定游离氨基的变化。研究表明,与不同植物多酚共价结合后,乳清蛋白的游离氨基含量显著下降[17]。同时可以通过荧光法来分析巯基含量的变化。与游离氨基基团的分析类似,蛋白质与多酚共价反应会导致游离巯基基团下降[18]。荧光测量也可用于色氨酸修饰的变化。在295 nm处激发的色氨酸是唯一吸收荧光的芳香族氨基酸,通常可在320 nm和390 nm之间发射荧光。因此采用荧光测定可以表征色氨酸基团的荧光淬灭。为了证实形成的键是共价键,常在含8 mol/L尿素的条件下测定色氨酸荧光的变化(排除非共价相互作用)。
同时,可以通过测定多酚含量来分析多酚与蛋白质的共价结合,常用的方法有:(1)通过福林酚法测定结合的酚酸含量;(2)通过碱水解获得酚酸底物。另外可以利用紫外可见吸收光谱表征蛋白质-多酚复合物来确定结合的多酚[19]。
蛋白质与多酚生成共价复合物会改变蛋白质的理化和功能特性,因此共价反应的结果可以通过蛋白质性质的变化来进行评价。蛋白质与多酚共价结合后,亲水-疏水性和溶解性会发生改变,并且这些变化会影响蛋白质的功能性质(例如乳化性、起泡性)[18]。蛋白质结构的变化可通过采用荧光探针来研究蛋白质的表面疏水性,蛋白质表面疏水性增加与溶解度的降低通常呈良好的相关性[15]。
这些理化分析方法可以反映蛋白质在共价相互作用中被修饰的程度,但存在较大的缺点是具有不同氨基酸侧链的蛋白质和蛋白质-多酚共价复合物的结构尚未被系统地表征。
3.1.2质谱分析方法
分析蛋白质-多酚共价复合物的主要目的在于检测特定的反应产物并鉴定相应的结合位点。通常,质谱技术具有一定的优势。研究表明,添加不同分子后,基质辅助激光解吸/电离飞行时间质谱(MALDI-TOF-MS)能够揭示不同分子质量的变化[20]。在一定程度上,通过使用蛋白酶对蛋白质进行水解,通过比对修饰的和未修饰肽的指纹图谱,可以鉴定蛋白质的反应位点[21]。研究表明,在反应产物中,未修饰的蛋白质仍然占主导地位,因此样本的纯化成为产物分析不可缺少的部分[15]。然而,MALDI-TOF-MS和色谱为基础的表面增强激光解吸/电离飞行时间质谱(SELDI-TOF-MS)也有其局限性。它们的分辨率取决于蛋白质是否被修饰以及修饰程度。多数情况下只有少量的与蛋白质复合物具有较大差异的反应产物被成功鉴定。
3.1.3其他分析方法
目前,荧光猝灭、多光谱方法、电泳、电喷雾质谱、高性能亲和层析和NMR光谱等已被用来表征蛋白质-多酚共价相互作用[4, 22]。然而,鉴定多酚在蛋白质序列中的特定的结合位点和相应的构象仍然具有一定的挑战性。高性能薄层色谱(HPTLC)作为一种新型的分析方法,在多酚-蛋白质相互作用表征方面具有一定的应用潜力。一维HPTLC和二维HPTLC已经成功地应用于肽图谱的测定[23],其分离机理不仅取决于电荷,同样取决于蛋白质的亲水/疏水性,因此可通过种类繁多的吸附剂、溶剂和色谱技术来进行优化[15]。
3.2共价相互作用的复杂性及反应机理
如前所述,在与氨基酸反应之前,酚类化合物可能被氧化并反应到一定程度。同时,当多酚与蛋白质反应后,酚类化合物仍保持活性,因此具有再次被氧化的可能性,并进一步与蛋白质分子产生第二个结合位点。这种蛋白质交联会生成高相对分子质量的蛋白质复合物。因此,反应混合物可能包含3种类型的反应产物:简单的反应产物,其中酚类化合物被结合到特定的氨基酸侧链;混合的反应产物,由结合的低聚物及底物组成;复杂的交联蛋白质及其衍生物等。
制备蛋白质-多酚共价复合物的方法主要包括碱法[18]、酶法[3]和自由基法[24]。碱法和酶法的应用较早,通常是在氧气存在的条件下,通过碱处理或者酶催化的方法诱导多酚氧化形成醌,再与蛋白质的亲核侧链形成共价产物。这些亲和基团包括赖氨酸侧链的ε氨基基团,巯基基团,或色氨酸的吲哚基团等。IEMMA的研究团队提出了多酚与蛋白质接枝的羟基自由基诱导法[24]。通过双氧水和抗坏血酸进行氧化还原反应产生羟自由基,然后该自由基进攻蛋白质侧链的敏感氨基酸残基,产生活性中间产物,该物质随后同小分子的多酚形成共价键。由于自由基法在室温下进行,反应程序简单,不会产生有毒副产物,近年来广泛用于合成蛋白质-多酚共价复合物[25-29]。YOU等[25]分别采用碱法和自由基法制备卵转铁蛋白-儿茶素共价复合物,研究表明,与卵转铁蛋白相比,通过碱法和自由基制备的共价复合物具有更高的分子质量(图4)。通过串联质谱技术研究发现,儿茶素主要与卵转铁蛋白的赖氨酸和谷氨酸残基发生了共价复合反应。

共价复合物1: 通过自由基法制备的卵转铁蛋白-儿茶素共价复合物;共价复合物2: 通过碱法制备的卵转铁蛋白-儿茶素共价复合物图4 卵转铁蛋白和卵转铁蛋白-儿茶素共价复合物的基质辅助激光解吸/电离飞行时间质谱Fig.4 MALDI-TOF-MS of ovotransferrin and ovotransferrin-catechin conjugates.
4相互作用对蛋白质性质的影响
4.1对蛋白质结构和功能性质的影响
目前,有关蛋白质影响多酚的相关机理仍不明确,但有关多酚对蛋白质结构的影响研究较为深入。蛋白质与多酚相互作用会引起蛋白质结构的改变,导致蛋白质的疏水-亲水性的相应变化以及溶解度的改变。这些变化将会影响蛋白质的功能性质(例如乳化性、起泡性等)。HASNI等[30]采用傅里叶变换红外光谱、紫外可见光谱、圆二色光谱、荧光光谱法和分子模拟技术,在分子水平上研究了α-酪蛋白和β-酪蛋白与茶多酚的相互作用。研究表明,茶多酚主要通过疏水相互作用与α-酪蛋白和β-酪蛋白结合。由于β-酪蛋白具有更强的疏水性,因此,其与茶多酚结合得更紧密。多酚减少了酪蛋白的α-螺旋和β-折叠结构,增加了无规则卷曲,酪蛋白的构象改变。RAWEL等[31]研究了大豆蛋白和多酚(如绿原酸、咖啡酸和没食子酸)之间的相互作用,发现这些蛋白质和多酚的结合使复合物的分子质量增加。绿原酸-BSA共价复合物的圆二色光谱表明,BSA经共价修饰后,蛋白质的α-螺旋下降,无规则卷曲结构增加[32]。
蛋白质在食品体系中有多种功能特性,例如溶解性、持水能力、凝胶作用、乳化性等。酚类化合物与蛋白质的反应可能会引起蛋白质交联。这种相互作用也改变了蛋白质分子的净电荷,从而影响了蛋白质的溶解性。PRIGENT等[2]研究表明,当pH≥8.0时,由于绿原酸氧化形成醌类化合物,绿原酸的存在会使溶菌酶的溶解性下降。当肌红蛋白与酚类化合物混合后,其溶解性也发生变化[33]。由于这些相互作用,蛋白质的二级结构和三级结构发生了改变,影响了蛋白质分子的表面性能,使它们具有亲水性。亲水/疏水性的改变不仅影响了蛋白质的溶解性,也会影响乳化性、凝胶作用和起泡性等其他功能特性。
4.2对蛋白质消化特性的影响
在胃肠道中,多酚与蛋白质的相互作用将影响蛋白质的消化率,导致其营养质量下降,这主要归因于必需氨基酸的破坏及对蛋白酶的抑制作用。同时,饮食中蛋白质与多酚的结合将形成可溶或不可溶的复合物,影响它们的生物利用度。体外实验表明,多酚修饰会使胃肠道酶对溶菌酶衍生物的消化产生不利影响[20]。然而,由于蛋白质构象的差异,每种蛋白质具有不同的消化特性。
多酚共价修饰会影响蛋白质及酶的生物活性,导致蛋白质的营养价值降低。大鼠生长和氮平衡实验表明蛋白质与绿原酸共价结合会影响β-乳球蛋白的营养特性[34]。此外,酚类化合物性质可能也会受到影响,例如,因以化学键的形式连接到蛋白质上,酚类化合物的抗氧化活性下降[35]。
有研究指出,由于浓缩单宁的存在,蛋白质在体内和体外的消化率有所下降。蛋白质与单宁类物质相互作用会形成不易消化的蛋白质-单宁复合物[14]。研究表明,高粱浓缩单宁能与高粱醇溶蛋白形成复合物,降低蛋白质的消化率[36]。综上所述,分析蛋白质在一定条件下(如食品加工、消费、消化)被多酚修饰的程度至关重要,因为这将影响到蛋白质的消化吸收特性。
5研究展望
目前除了对多酚的植物学和营养学方面有较为全面的研究,多酚与植物、食品甚至人体中成分的相互作用的研究仍很稀缺。蛋白质和酚类化合物的相互作用是一个复杂的现象,从蛋白质与多酚相互作用的几种可能性来说,共价反应产物似乎是最重要的部分,因为它们不可逆地影响蛋白质和多酚的性质。多酚与蛋白质共价反应后,反应产物在很大程度上保持了植物多酚的化学性质,同时赋予蛋白质分子许多新的性能,明显拓宽了植物多酚和蛋白质的应用领域。因此应加强蛋白质与多酚复合物的性质研究,开发新型功能材料。同时,应详细研究蛋白质与多酚相互作用的最适条件以改善食品加工过程,最大限度地提高食品的营养和功能特性。
近年来分析技术得到了快速发展,但仍然难以运用传统蛋白质化学技术来确定蛋白质与多酚相互作用的结合位点。因此新技术的开发应不仅关注蛋白质结构变化,同时也应考虑到参与反应的多酚的性质。采用传统蛋白质化学技术和光谱联用技术,例如实现高性能薄层色谱与质谱的组合,可能会激发新的研究蛋白质与多酚共价复合物的方法。
参考文献
[1]鲁玉妙, 马惠玲. 我国植物多酚研究文献计量及研究热点分析 [J]. 食品科学, 2012, 33(17): 290-296.
[2]PRIGENT S V E, GRUPPEN H, VISSER A J W G, et al. Effects of non-covalent interactions with 5-O-caffeoylquinic acid (chlorogenic acid) on the heat denaturation and solubility of globular proteins [J]. Journal of Agricultural and Food Chemistry, 2003, 51(17): 5 088-5 095.
[3]PRIGENT S V E, VORAGEN A G J, VISSER A J W G, et al. Covalent interactions between proteins and oxidation products of caffeoylquinic acid (chlorogenic acid) [J]. Journal of the Science of Food and Agriculture, 2007, 87(13): 2 502-2 510.
[4]LE BOURVELLEC C, RENARD C. Interactions between polyphenols and macromolecules: quantification methods and mechanisms [J]. Critical Reviews in Food Science and Nutrition, 2012, 52(3): 213-248.
[5]李锐, 任海平, 孙艳亭, 等. 小分子与生物大分子间非共价相互作用分析方法研究进展 [J]. 分析化学, 2006, 34(12): 1 801-1 806.
[6]SIEBERT K J. Protein-polyphenol haze in beverages [J]. Food Technology, 1999, 53(1): 54-57.
[7]BANDYOPADHYAY P, GHOSH A K, GHOSH C. Recent developments on polyphenol-protein interactions: effects on tea and coffee taste, antioxidant properties and the digestive system [J]. Food & Function, 2012, 3(6): 592-605.
[8]HAGERMAN A E, KLUCHER K M. Tannin-protein interactions[C]/Plantflavonoids in biology and medicine: biochemical, pharmacological, and structure relationships. Liss, Inc., New York (USA), 1986: 67-76.
[9]SASTRY M C S, RAO M S N. Binding of chlorogenic acid by the isolated polyphenol-free 11 S protein of sunflower (Helianthusannuus) seed [J]. Journal of Agricultural and Food Chemistry, 1990, 38(12): 2 103-2 110.
[10]PRIGENT S V E, GRUPPEN H, VISSER A J W G, et al. Effects of non-covalent interactions with 5-O-caffeoylquinic acid (chlorogenic acid) on the heat denaturation and solubility of globular proteins [J]. Journal of Agricultural and Food Chemistry, 2003, 51(17): 5 088-5 095.
[11]NACZK M, GRANT S, ZADERNOWSKI R, et al. Protein precipitating capacity of phenolics of wild blueberry leaves and fruits [J]. Food Chemistry, 2006, 96(4): 640-647.
[12]SIEBERT K J, TROUKHANOVA N V, LYNN P Y. Nature of polyphenol-protein interactions [J]. Journal of Agricultural and Food Chemistry, 1996, 44(1): 80-85.
[13]DE FREITAS V, CARVALHO E, MATEUS N. Study of carbohydrate influence on protein-tannin aggregation by nephelometry [J]. Food Chemistry, 2003, 81(4): 503-509.
[14]OZDAL T, CAPANOGLU E, ALTAY F.A review on protein-phenolic interactions and associated changes [J]. Food Research International, 2013, 51(2): 954-970.
[15]ROHN S. Possibilities and limitations in the analysis of covalent interactions between phenolic compounds and proteins [J]. Food Research International, 2014, 65: 13-19.
[16]SELINHEIMO E, AUTIO K, KRUUS K, et al. Elucidating the mechanism of laccase and tyrosinase in wheat bread making [J]. Journal of Agricultural and Food Chemistry, 2007, 55(15): 6 357-6 365.
[17]RAWEL H M, KROLL J, HOHL U C. Model studies on reactions of plant phenols with whey proteins [J]. Food/Nahrung, 2001, 45(2): 72-81.
[18]KROLL J, RAWEL H M, ROHN S. Reactions of plant phenolics with food proteins and enzymes under special consideration of covalent bonds [J]. Food Science and Technology Research, 2003, 9(3): 205-218.
[19]ROHN S, RAWEL H M, KROLL J. Inhibitory effects of plant phenols on the activity of selected enzymes [J]. Journal of Agricultural and Food Chemistry, 2002, 50(12): 3 566-3 571.
[20]RAWEL H M, KROLL J, ROHN S. Reactions of phenolic substances with lysozyme—physicochemical characterisation and proteolytic digestion of the derivatives [J]. Food Chemistry, 2001, 72(1): 59-71.
[21]RAWEL H M, RONH S, KROLL J, et al. Surface enhanced laser desorptions ionization-time of flight-mass spectrometry analysis in complex food and biological systems [J]. Molecular Nutrition & Food Research, 2005, 49(12): 1 104-1 111.
[22]XIAOJ, KAI G. A review of dietary polyphenol-plasma protein interactions: Characterization, influence on the bioactivity, and structure-affinity relationship [J]. Critical reviews in Food Science and Nutrition, 2012, 52(1): 85-101.
[23]TSCHERCH K, BILLER J, LEHMANN M, et al. One- and two-dimensional high-performance thin-layer chromatography as an alternative analytical tool for investigating polyphenol-protein interactions [J]. Phytochemical Analysis, 2013, 24(5): 436-445.
[24]SPIZZIRRI U G, IEMMA F, PUOCI F, et al. Synthesis of antioxidant polymers by grafting of gallic acid and catechin on gelatin [J]. Biomacromolecules, 2009, 10(7): 1 923-1 930.
[25]YOU J, LUO Y, WU J. Conjugation of ovotransferrin with catechin shows improved antioxidant activity [J]. Journal of Agricultural and Food Chemistry, 2014, 62(12): 2 581-2 587.
[26]YI J, ZHANG Y, LIANG R, et al. Beta-carotene chemical stability in nanoemulsions was improved by stabilized with β-lactoglobulin-catechin conjugates through free radical method [J]. Journal of Agricultural and Food Chemistry, 2014, 63(1): 297-303.
[27]CIRILLO G, MAURO M V, SPIZZIRRI U G, et al. Synthesis, characterization and antimicrobial activity of conjugates based on fluoroquinolon-type antibiotics and gelatin [J]. Journal of Materials Science: Materials in Medicine, 2014, 25(1): 67-77.
[28]LIU F, SUN C, YANG W, et al. Structural characterization and functional evaluation of lactoferrin-polyphenol conjugates formed by free-radical graft copolymerization [J]. RSC Advances, 2015, 5(20): 15 641-15 651.
[29]刘夫国, 王迪, 杨伟, 等. 乳铁蛋白-多酚对β-胡萝卜素乳液稳定性的影响 [J]. 农业机械学报, 2015, 46(6): 212-217, 225.
[30]HASNI I, BOURASSA P, HAMDANI S, et al. Interaction of milk α-and β-caseins with tea polyphenols [J]. Food Chemistry, 2011, 126(2): 630-639.
[31]RAWEL H M, CZAJKA D, ROHN S, et al. Interactions of different phenolic acids and flavonoids with soy proteins [J]. International Journal of Biological Macromolecules, 2002, 30(3): 137-150.
[32]RAWEL H M, ROHN S, KRUSE H P, et al. Structural changes induced in bovine serum albumin by covalent attachment of chlorogenic acid [J]. Food Chemistry, 2002, 78(4): 443-455.
[33]KROLL J, RAWEL H M. Reactions of plant phenols with myoglobin: influence of chemical structure of the phenolic compounds[J]. Journal of Food Science, 2001, 66(1): 48-58.
[34]PETZKE K J, SCHUPPE S, ROHN S, et al. Chlorogenic acid moderately decreases the quality of whey proteins in rats [J]. Journal of Agricultural and Food Chemistry, 2005, 53(9): 3 714-3 720.
[35]ROHN S, RAWEL H M, KROLL J. Antioxidant activity of protein-bound quercetin [J]. Journal of Agricultural and Food Chemistry, 2004, 52(15): 4 725-4 729.
[36]EMMAMBUX N M, TAYLOR J. Sorghum kafirin interaction with various phenolic compounds [J]. Journal of the Science of Food and Agriculture, 2003, 83(5): 402-407.
Recent research progress on interactions between polyphenols and proteins
LIU Fu-guo, MA Cui-cui, WANG Di, GAO Yan-xiang*
(College of FoodScience and Nutritional Engineering, China Agricultural University, Beijing 100083, China)
ABSTRACTBecause of its unique chemical structure, plant polyphenol has a variety of physiological functions, such as anti-tumor, anti-oxidation, anti-bacterial, anti-viral, et al. Polyphenols have been widely used in the fields of agriculture, food and medicine. Polyphenols can make complexes with proteins which leading the changes in the structure, functional and nutritional properties of the two compounds. Polyphenol-protein interactions depend on several factors, such as temperature, pH, structure and concentration of proteins, as well as the type and structure of the phenolic compounds. Compared with the non-covalent interactions, covalent interactions between protein and polyphenols will irreversibly alter the physicochemical properties and functional characteristics of the two molecules. This article described the biochemical mechanisms of interaction between proteins and polyphenols, discussed methods for the study of the interactions and the main challenges faced. Meanwhile, it also pointed out the main issues to be considered when analyzing the complexes. This article gives a better understanding of the functional consequences of these interactions on food/biological systems.
Key wordsproteins; polyphenols; interactions; mechanism; functional properties
收稿日期:2015-07-31,改回日期:2015-08-28
基金项目:国家自然科学基金资助项目(No. 31371835)
DOI:10.13995/j.cnki.11-1802/ts.201602048
第一作者:博士研究生(高彦祥教授为通讯作者,E-mail:gyxcau@126.com)。
