破囊壶菌二十二碳六烯酸(DHA)的制备工艺及应用前景
2016-06-07吴海龙崔岩成家杨
吴海龙,崔岩,成家杨
(北京大学环境与能源学院,广东深圳,518055)
综述与专题评论
破囊壶菌二十二碳六烯酸(DHA)的制备工艺及应用前景
吴海龙,崔岩,成家杨*
(北京大学环境与能源学院,广东深圳,518055)
破囊壶菌具有二十 碳六烯酸( docosahexaenvic acid,DHA)含量高、油脂组成简单、生长速率快等优点,是DHA商业开发的潜在来源。目前,破囊壶菌DHA的制备工艺还处于尝试和探索阶段,特别是破囊壶菌的发酵工艺、油脂的提取工艺和DHA的纯化工艺。该文对上述工艺的研究进展进行了综述,并对破囊壶菌DHA的产业化潜力进行了分析,为破囊壶菌DHA的工业化研究提供参考。
破囊壶菌;发酵;油脂提取;二十 碳六烯酸( DHA)纯化;产业化
破囊壶菌( Thraustochytrids)是一类异养的海洋真菌,在分类学上属于不等毛门( Heterokontophyta)、网黏菌纲( Labyrinthulomycetes)、破囊壶菌目( Thraustochytriales)、破囊壶菌科( Thraustochytriaceae)[1]。一般认为,破囊壶菌科有7属[2],包括: Althorni、Ulkenia、Aplanochytrium、Japonochytrium、Labyrinthuloides、Schizochytrium和Thraustochytrium。破囊壶菌中的油脂含量能达到干重的50%以上,胆固醇含量低,90%以上脂肪酸以甘油三酯的形式存在[3];油脂的主要成分为DHA( 40%以上)和棕榈酸( C16∶0)[4-5],其他脂肪酸含量很少。
DHA( docosahexaenoic acid,C22∶6)全称是二十二碳六烯酸,又称“脑黄金”,也是人体自身难合成的必需脂肪酸之一,它是大脑和视网膜的重要组成部分,对胎婴儿智力和视力的发育至关重要。DHA能防治心脑血管疾病,预防老年痴呆症和神经性疾病,抑制炎症和改善视力,在保健品和食品领域均有广泛应用。其中,以配方形式添加到婴儿奶粉中,占DHA消费总量的67%[6]。预计今后全球每年的DHA需求量将高达10万t,总价值在300~800亿美元,市场潜力巨大[7]。
破囊壶菌合成DHA的途径主要有2个:脂肪酸合成酶( FAS)途径和聚酮合酶( PKS)途径[8]。脂肪酸合成酶( FAS)途径是破囊壶菌中使用较多的合成途径,具体过程见图1。首先在脂肪酸合成酶的催化下由乙酰辅酶A和丙二酸单酰辅酶A经过反应,生成C18∶0,然后在脱饱和酶、延长酶的作用下,经C18∶3、C20∶5,最终生成C22∶6,即为DHA。聚酮合酶( PKS)途径由乙酰辅酶A和丙二酸单酰辅酶A提供碳原子,先转化为含有酰基载体蛋白质( ACP)的酯类,并在缩合酶的作用下生成3-酮丁酰中间物。随后在酮乙基还原酶、脱水酶和烯酰还原酶的作用下转化为丁酰-ACP。最后,丙二酰辅酶A再次按上述方式连接到脂肪酰链上[1],每次增加2个碳原子,逐渐延长碳链,最终生成DHA。
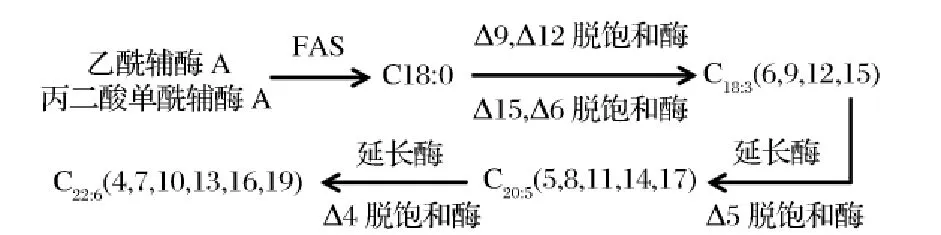
图1 FAS途径
Fig.1 FAS pathway
目前,破囊壶菌DHA的制备工艺还处于尝试和探索阶段。图2列出了DHA的简要生产流程。
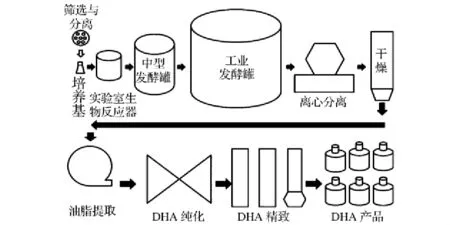
图2 DHA的简要生产流程
Fig.2 Production process of DHA from Thraustochytrids
为制备出高质量的DHA产品,首先要对菌株进行筛选,适宜工业化生产的菌株应具备生长速率快、DHA含量高、耐低盐等特性[3]。之后,是对筛选出的菌株进行发酵培养,研究菌株的发酵条件[9-11]。最后,收集生物质并进行油脂提取、DHA纯化工艺的研究,制备出高纯度的DHA产品。本文将对破囊壶菌发酵、油脂提取和DHA纯化的研究进展进行综述,并对DHA的产业化潜力进行分析。
1 破囊壶菌发酵工艺
温度、pH、盐度和培养基成分等环境因子对破囊壶菌中DHA的含量均有巨大影响[12]。首先,应优化发酵条件,使破囊壶菌的代谢向着有利于DHA积累的方向进行。随后,在最佳条件下逐步扩大发酵规模,最终达到工业规模[13]。表1列出了部分高产DHA的菌株以及各自的发酵规模和DHA产量。从表1中可以看出,这些菌株经过培养后DHA含量基本都接近或达到了40%,而且全部来自于Schizochytrium和Aurantiochytrium。
表1部分高产DHA的破囊壶菌
Table 1 Some Thraustochytrids of high DHA productivity
发酵方式 菌种 规模/L 时间/ h油脂产量/ ( g·L-1) DHA含量/% DHA产量/ ( g·L-1)参考文献摇瓶Schizochytrium limacinum SR21 0.05 48 24.3 23.5 5.7 [20]Aurantiochytrium sp.strainTC020 0.1 69 37.0 38.9 14.4 [21]Aurantiochytrium sp.T66 0.5 167 52 30.0 15.6 [22]Aurantiochytrium sp.BL10 1 120 42.3 39.7 16.8 [14]分批培养Schizochytrium sp.Strain SR21 3 96 37.3 35.6 13.3 [23]Schizochytrium sp.KH105 3 96 13.2 25.8 3.4 [24]Schizochytrium sp.LU310 - 144 52.1 47.5 24.7 [15]分批补料培养Schizochytrium sp.S31 Aurantiochytrium limacinum SR21 Schizochytrium sp.CCTCC M209059 7.5 5 5 7 1 0 50 1 500 7 000 96 96 165 136 140 76.2 37.9 28.9 74.1 43.7 32.4 28.0 72.5 20.3 48.9 37.6 18.4 36.2 38.6 14.0 37.4 38.7 14.4 35.2 40.3 14.2 49.2 40.1 19.7 [16][17][18][25][19]
从表1还可以看出,摇瓶培养得到的DHA产量都在20 g/L以下,但随着摇瓶体积的扩大,DHA产量也在增大。YANG等[14]在1 L的摇瓶中培养Aurantiochytrium sp.BL10,120 h后油脂中DHA含量达到了39.7%,DHA产量达到了16.8 g/L。
部分研究采用了分批培养模式,DHA产量较摇瓶培养有了显著提高。LING等[15]在发酵罐中分批培养Schizochytrium sp.LU310,144h后油脂中DHA含量达到了37.9%,DHA产量达到了24.7 g/L。
分批补料培养模式下的DHA产量则明显高于上述两种培养方式。CHANG等[16]在7.5 L发酵罐中分批培养Schizochytrium sp.S31,96 h后油脂中DHA含量达到了47.5%,DHA产量达到了28.9 g/L。LI等[17]在5 L的发酵罐中分批补料培养Aurantiochytrium limacinum SR21,96 h后油脂中DHA含量达到了43.7%,产量达到了32.4 g/L。但HUANG等[]在5 L的发酵罐中分批补料培养Aurantiochytrium limacinum SR21,165 h后得到的油脂中DHA含量虽然达到了72.5%,但最终的DHA产量却只有20.3 g/L,远低于LI等得到的DHA产量。
总体来说,破囊壶菌的发酵规模还停留在实验室规模,基本都在10 L以下。QU等[]将Schizochytrium sp.CCTCC M209059进行分批补料培养,将发酵规模从10,50 L扩大到了1 500,7 000 L,DHA的产量和产率稳中有升,7 000 L时DHA产量达到了19.7 g/L,占到总脂含量的40.1%。
2 油脂提取工艺
由于破囊壶菌的油脂主要存在于由细胞壁所包裹的破囊壶菌菌体细胞内[26],难分离出来,所以需要在油脂提取前对其进行破壁处理。常见的破壁处理方法可分为物理破壁法和生化破壁法。物理破壁法包括高压均质法、机械匀浆法、反复冻融法、超声法、微波法和研磨法。生化破壁法主要包括化学渗透法、酸热法、碱热法和酶溶法。吴克刚等[25]对超声波破碎破囊壶菌细胞进行了研究,结果表明,超声波可以有效破碎破囊壶菌细胞,使脂质得率提高60%。破壁处理后,需要将油脂提取出来,常用的提取方法有:溶剂萃取法、直接酯化法、直接皂化法和超临界流体萃取法。
2.1 溶剂萃取法
溶剂萃取法是目前国内外广泛应用的油脂提取法之一,按操作形式可分为浸提法、搅拌热回流法和索氏提取法等。溶剂萃取法的优点是出油率高、可在低温下进行、动力消耗小、易实现大规模和自动化生产,缺点是溶剂有易燃性和毒性,且油脂中会有溶剂残留。溶剂萃取法的关键是选出合适的溶剂。实验室常用的溶剂有氯仿、石油醚、丙酮、己烷、甲醇和乙醇,也可使用混合溶剂,如氯仿-甲醇-水。氯仿-甲醇-水混合溶剂法是由BLIGH和DYER[27]于1959年建立的较为成熟的方法,该法的提取过程简单、快速、彻底,但由于溶剂较大的毒性和易燃性,不适合用于食品工业中。BURJA等[28]用小型化的BLIGH-DYER法提取Thraustochytrium sp.ONC-T18中的油脂,油脂提取率虽然达到了71.4%(干重),但DHA含量仅为16.8%。
2.2 直接酯化法
直接酯化法是指原料与酯化试剂(乙酰氯或三氟化硼的醇溶液)进行酯交换,该方法的优点是提取率高,缺点是酯化试剂毒性较大。KIM等[29]用直接酯化法提取Aurantiochytrium sp.中的DHA,DHA含量达到了57.4%(干重)。
2.3 直接皂化法
直接皂化法是指原料与醇碱溶液( KOH与CH3OH或C2H5OH)反应后提取,该方法快速简便。ADAM等[27]用直接皂化法提取Thraustochytrium sp.中的油脂,油脂提取率达到了69.7%(干重)。
2.4 超临界流体萃取法
超临界流体萃取法( supercritical fluid extraction,SFE)是一种新型的高效分离技术,特点是提取完成后溶剂与产品自动分离,最常用的是超临界二氧化碳萃取法( supercritical carbon dioxide,SC-CO2)。SCCO2能有效分离碳数差别较大的脂肪酸,但要把碳原子数相近的脂肪酸分开,必须结合其他分离技术。适当添加夹带剂能提高溶剂的萃取能力,降低操作压力和成本,但夹带剂的添加也会带来一些问题。NILSSON[30]等发现,若添加乙醇作为夹带剂,在增大脂肪酸溶解度的同时也会降低选择性。SC-CO2不需要使用有机溶剂,萃取速度快,DHA提取率高,不影响萃取物的有效成份,适合生产DHA产品,但成本较高。TANG等[]采用超临界CO2萃取法提取Schizochytrium limacinum中的DHA,在35 MPa、40℃、95%乙醇为夹带剂的最佳条件下,油脂提取率达到干重的33.9%,其中的DHA含量达到了27.5%。
3 DHA纯化工艺
将破囊壶菌中的油脂提取出后,需要对DHA进行纯化,进一步提高纯度。目前常用的纯化方法包括低温结晶法、银离子络合法、分子蒸馏法、尿素包合法和脂肪酶催化反应法。
3.1 低温结晶法
低温结晶法利用双键数不同的脂肪酸在有机溶剂中溶解度的差异进行分离纯化,而这种差异在低温下更显著。该法操作简单方便,但产率较低,需使用大量有机溶剂,且溶剂会有残留,故常作为预浓缩方法与其他方法配合使用[32]。
3.2 银离子络合法
银离子络合法是按脂肪酸碳双键数目的差异分离各组分。研究表明[33],当不饱和脂肪酸的碳数与其所含的双键数的比值小于等于6时络合反应才可能进行,对于饱和、单不饱和脂肪酸,其比值肯定大于6。这种方法的优点是提纯度高,但由于硝酸银价格昂贵,且硝酸银的大量回收问题尚未解决,所以目前只停留在实验室阶段。
3.3 分子蒸馏法
分子蒸馏法利用不同脂肪酸分子运动的平均自由程的差异,在极高的真空度下,使液体在远低于其沸点的温度下进行分离。在一定的温度和压力条件下,饱和、单不饱和脂肪酸分子由于运动的平均自由程大,首先蒸出;不饱和脂肪酸的分子运动的平均自由程短,最后蒸出[34]。通过多级蒸馏,便可有效地分离不同组分,获得高纯度的DHA[35-36]。分子蒸馏法是目前工业生产高纯度EPA和DHA最常用的方法之一,但提纯度只有50%~60%[37]。此外,分子蒸馏法能耗高,且不能有效分离分子量相近的组分[38]。
3.4 尿素包合法
尿素包合法主要是基于不饱和程度和碳链长度分离脂肪酸,通常在有机溶剂中进行,如甲醇或乙醇,不宜使用能与尿素相结合的溶剂,如丙酮。尿素包合法的缺点在于难以分开双键数相近的脂肪酸,而且得到的产物需要进一步纯化。尿素包合过程的主要影响因素包括:尿素与脂肪酸的质量比、结晶温度。尿素的质量分数越高,除去的饱和、低不饱和脂肪酸就越多,但会导致一部分不饱和脂肪酸的损失[39]。温度越低,越易形成尿素结合物,但也会导致一些不饱和脂肪酸与尿素结合。TANG等[31]用尿素包合法富集Schizochytrium limacinum中的DHA,在2∶1尿脂比、-10℃结晶温度和8 h结晶时间的最佳条件下,DHA纯度从29.7%提高到了60.4%,富集率为60.6%。
3.5 高效液相色谱法
不同双键数和碳数的脂肪酸具有不同极性,从而导致其在固定相和流动相之间分配系数存在差异,高效液相色谱法( HPLC)利用分配系数的差异分离脂肪酸,可分为银离子高效液相色谱法( Ag-HPLC)和反相高效液相色谱法( RP-HPLC)。高效液相色谱法分离脂肪酸时常用的流动相为甲醇-水或乙腈-水。HPLC法具有回收率高、灵敏度高、纯化过程条件温和等优点,是获得高纯度DHA最有效的方法。YAMAMURA等[40]从Schizochytrium sp.SR21油脂中提取DHA,使用工业高效液相色谱法( HPLC),流动相为甲醇/水(体积比98∶2),得到了纯度超过99% 的DHA乙酯。
3.6 脂肪酶催化反应法
酶法的优点是催化效率高、用量少、反应条件温和、DHA结构不易变化、能重复利用,缺点是不能直接得到产品,需要反应后将目标产物分离出来。脂肪酶催化反应法富集DHA的关键在于找到合适的脂肪酶。酶法主要包括:酶选择性水解法、酶选择性酯化法和酶选择性酯交换法。酶选择性水解法和酶选择性酯交换法得到的甘油酯中EPA和DHA的含量一般不超过50%,并且EPA和DHA是混合在一起的,要获得高纯度的DHA产品,酶选择性酯化法是一条有效途径[41]。
依靠单一的方法较难获得高纯度DHA产品,实际应用中可以根据需要,将多种方法结合起来,通过建立合理的工艺路线,降低成本,制备出高纯度DHA产品。孙兆敏等[42]以Schizochytrium sp.干粉为原料,将酶选择性酯交换法与分子蒸馏联用,得到了DHA含量高于80%的乙酯产品。
4 破囊壶菌DHA的产业化潜力
深海鱼油是DHA的传统和主要来源,主要是从沙丁鱼、金枪鱼等鱼的头部和眼窝脂肪中提取,DHA含量在12%左右,经过浓缩处理后,含量可提高到20%以上[43]。我国的鱼油大部分依赖进口,据统计,2013年我国鱼油进口高达65 540 t,同比增加了50.40%[44]。目前,从鱼油中提取DHA面临着不少问题:①复杂的加工处理过程导致生产成本提高;②鱼油中的胆固醇含量较高;③鱼腥味难以完全去除;④重金属和持久性有机物带来的污染问题、⑤氢化处理工艺造成DHA的产量下降;⑥鱼油产量存在季节性波动,这些问题都极大地影响了产品的品质。随着渔业资源的日渐紧缺,从鱼油中获取DHA无论是数量上还是质量上都将难以满足社会的需求,所以寻求廉价的DHA提取途径受到了国内外学者的广泛关注。
DHA的另一来源是微藻。微藻油脂中DHA含量最高可达35%以上[42]。从藻油中提取DHA也面临着一些问题:①藻油的脂肪酸成分复杂,导致DHA的纯化成本较高;②微藻在培养中易受污染,生长速率也较慢。这些缺点导致微藻生产DHA在成本上没有优势,极大地阻碍了微藻生产DHA的产业化发展。
海洋真菌是DHA商业开发的潜在来源。目前,利用真菌发酵生产DHA的研究主要集中在破囊壶菌。破囊壶菌生产DHA有如下几点优势:①破囊壶菌生长速率快,一般2~3 d就进入平台期,而发酵生产可以人为控制温度、pH、溶解氧等参数,有利于实现DHA产量的稳定化和规模化;②破囊壶菌的DHA含量高,脂肪酸组成简单,大大降低了DHA的纯化成本;③破囊壶菌中的DHA主要以甘油三酯型存在,相比于乙酯型,甘油三酯型是DHA的天然存在形式,有口感好、易被人体消化吸收等优点,是保健品和药品的最佳产品型式;④破囊壶菌DHA没有鱼腥味,氧化稳定性更高;⑤破囊壶菌的发酵培养不会受到重金属和持久性有机物的污染,其产品对人体更健康。上述几点表明,破囊壶菌是代替深海鱼类成为主要来源的最佳选择,利用破囊壶菌生产DHA拥有巨大的产业化潜力。
5 展望
利用破囊壶菌生产DHA仍处于尝试和探索阶段,目前已经筛选出不少适宜工业化的菌株,但发酵培养的规模还较小;此外,制备高纯度DHA的成本仍然很高。因此,下一步的目标是逐步扩大发酵培养规模,并建立成本低廉的油脂提取和DHA纯化的工艺路线。
[1]李晶晶,刘瑛,马炯.破囊壶菌生产DHA的应用前景[J].食品工业科技,2013,34( 16) : 367-371.
[2] MOSS S T.Biology and phylogeny ofthe labyrinthulales and thraustochytriales[A].In: Moss,S T.The Biology of marine fungi[C].Cambridge: Cambrige Univ Press,1986: 105-129.
[3] WINWOOD R J.Recent developments in the commercial production of DHA and EPA rich oils from micro-algae [J].OCL,2013,20( 6) : D604.
[4] HUANG J,AKI T,YOKOCHI T,et al.Grouping newly isolated docosahexaenoic acid-producing Thraustochytrids based on their polyunsaturated fatty acid profiles and comparative analysis of 18S rRNA genes[J].Marine Biotechnology,2003,5( 5) : 450-457.
[5]BURJA A M,RADIANINGTYAS H,WINDUST A,et al.Isolation and characterization of polyunsaturated fatty acid producing Thraustochytrium species: screening of strains and optimization of omega-3 production[J].Applied Microbiology and Biotechnology,2006,72( 6) : 1 161-1 169.
[6]黄菊华,李蕴成.DHA的功能及在食品添加中的应用研究[J].中国食物与营养,2014,20( 4) : 76-79.
[7]刘官军,张兴灿,朱维忠.DHA工艺产业化研究[J].科技视界,2014( 25) : 248-248.
[8]赵肖为,周茂洪.破囊壶菌及其廿二碳六烯酸生物合成[J].温州师范学院学报,2004,25( 5) : 90-94.
[9] SUBHADRA B G.Sustainability of algal biofuel production using integrated renewable energy park ( IREP) and algal biorefineryapproach[J].Energy Policy,2010,38 ( 10) : 5 892-5 901.
[10]SCHUHMANN H,LIM D K Y,SCHENK P M.Perspectives on metabolic engineering for increased lipid contents in microalgae[J].Biofuels,2012,3( 1) : 71-86.
[11]BOELEN P,VAN DIJK R,DAMSTJ S S,et al.On the potential application of polar and temperate marine microalgae for EPA and DHA production[J].AMB Express,2013,3( 1) : 1-9.
[12]SHENE C,LEYTON A,ESPARZA Y,et al.Microbial oils and fatty acids: effect of carbon source on docosahexaenoic acid ( C22∶6 N-3,DHA) production by Thraustochytrid strains[J].Journal of Soil Science&Plant Nutrition,2010,10( 3) : 207-216.
[13] HEATH C,KISS R.Cell culture process development: advances in process engineering[J].Biotechnol Prog,2007,23: 46-51.
[14] YANG H L,LU C K,CHEN S F,et al.Isolation and characterization of Taiwanese heterotrophic microalgae: screening of strains for docosahexaenoic acid ( DHA) production [J].Mar Biotechnol,20012( 2) : 173-185.
[15] LING Xue-ping,GUO Jing,LIU Xiao-ting,et al.Impact of carbon and nitrogen feeding strategy on high production of biomass and docosahexaenoic acid ( DHA) by Schizochytrium sp.LU310[J].Bioresource Technology,2015,184: 139-147
[16] CHANG Gui-ping,GAO Ni-si,TIAN Gui-wei,et al.Improvement of docosahexaenoic acid production on glycerol by Schizochytrium sp.S31 with constantly high oxygen transfer coefficient[J].Bioresource Technology,2013,142: 400-406.
[17] LI Jing,LIU Rui-jie,CHANG Gui-fang,et al.A strategy for the highly efficient production of docosahexaenoic acid by Aurantiochytriumlimacinum SR21 using glucose and glycerol as the mixed carbon sources[J].Bioresource Technology,2015,177: 51-57.
[18] HUANG T Y,LU W C,CHU I M.A fermentation strategy for producing docosahexaenoic acid in Aurantiochytriumlimacinum SR21 and increasing C22∶6 proportions in total fatty acid[J].Bioresource Technology,2012,123: 8-14.
[19] QU Liang,REN Lu-jing J,HUANG He.Scale-up of docosahexaenoic acid production in fed-batch fermentation by Schizochytrium sp.based on volumetric oxygen-transfer coefficient[J].Biochemical Engineering Journal,2013,77: 82-87.
[20] PATIL K P,GOGATE P R.Improved synthesis of docosahexaenoic acid ( DHA) using Schizochytriuml imacinum SR21 and sustainable media[J].Chemical Engineering Journal,2015,268: 187-196.
[21]CHANG K J L,NICHOLS C M,BLACKBURN S I,et al.Comparison of thraustochytrids Aurantiochytrium sp.,Schizochytrium sp.,Thraustochytrium sp.,and Ulkenia sp.for production of biodiesel,long-chain ω-3 Oils,and exopolysaccharide[J].Marine Biotechnology,2014,16 ( 4) : 396-411.
[22]AKOBSEN A N,AASEN I M,JOSEFSEN K D,et al.Accumulation of docosahexaenoic acid-rich lipid in thraustochytrid Aurantiochytrium sp.strain T66: effects of N and P starvation and O2limitation[J].Appl Microbiol Biotechnol,2008,80: 297-306.
[23]J YAGUCHI T,TANAKA S,YOKOCHI T,et al.Production of high yields of docosahexaenoic acid by Schizochytrium sp.strain SR21[J].Journal of the American Oil Chemists'Society,1997,74( 11) : 1 431-1 434.
[24] YAMASAKI T,AKI T,SHINOZAKI M,et al.Utilization of shochu distillery wastewater for production of polyunsaturated fatty acids and xanthophylls using thraustochytrid [J].J Biosci Bioeng,2006,102: 323-327.
[25] QU L,REN L J,SUN G N,et al.Batch,fed-batch and repeated fed-batch fermentation processes of the marine thraustochytrid Schizochytrium sp.for producing docosahexaenoic acid[J].Bioprocess and Biosystems Engineering,2013,36( 12) : 1 905-1 912.
[26] 吴克刚,杨连生,黄通旺.超声波破碎Thraustochytrium提取脂质的研究[J].郑州工程学院学报,2001,22 ( 4) : 31-34.
[27] BLIGH E G,DYER W J.A rapid method of total lipid extraction and purification[J].Can J Biochem Physiol,1959,37( 8) : 911-917.
[28]BURJA A M,ARMENTA R E,RADIANINGTYAS H,et al.Evaluation of fatty acid extraction methods for Thraustochytrium sp.ONC-T18[J].Journal of Agricultural and Food Chemistry,2007,55( 12) : 4 795-4 801.
[29]CHANG K J L,DUNSTAN G A,ABELL G C J,et al.Biodiscovery of new Australian thraustochytrids for production of biodiesel and long-chain omega-3 oils[J].Applied Microbiology and Biotechnology,2012,93 ( 5) : 2 215-2 231.
[30]NILSSON W B,SEABORN G T,HUDSON J K.Partition coefficients for fatty acid esters in supercritical fluid CO2with and without ethanol[J].JAOCS,1992,69( 4) : 305 -308.
[31] TANG S,QIN C,WANG H,et al.Study on supercritical extraction of lipids and enrichment of DHA from oil-rich microalgae[J].The Journal of Supercritical Fluids,2011,57( 1) : 44-49.
[32]胡爱军,丘泰球,梁汉华.海藻EPA、DHA含量及分离浓缩方法[J].海洋通报,2002,21( 2) : 84-91.
[33]陈钧,邱榕,陈庶来,等.银离子络合萃取法及其在分离鱼油活性成分中的应用[J].江苏理工大学学报(自然科学版),2000( 6) : 23-27.
[34]秦昌蓉.富油微藻中油脂的提取及DHA富集纯化的研究[D].天津:天津大学,2010.
[35]CVENGROJ,MICOV M,LUTIAN J.Modelling of fractionation in a molecular evaporator with divided condenser [J].Chemical Engineering and Processing: Process Intensification,2000,39: 191-199.
[36] BASTISTELLA C B,MACIEL M R W,MACIELFILHO R.Rigorous modeling and simulation of molecular distillators: development of a simulator under conditions of non ideality of the vapor phase[J].Computers&Chemical Engineering,2000,24: 1 309-1 315.
[37]王丽华,丁红军,李尔春,等.分子蒸馏技术在食品工业中的应用[J].食品与药品,2007( 9) : 72-73.
[38] 傅红,裘爱泳.分子蒸馏法富集鱼油ω-3脂肪酸[J].中国粮油学报,2006,21( 3) : 156-159.
[39]吴庆,蔡昭玲,丛威,等.从微藻中提取多不饱和脂肪酸[J].北京化工大学学报:自然科学版,2004( 4) : 5-8.
[40]YAMAMURA R,SHIMOMURA Y.Industrial high-performance liquid chromatography purification of docosahexaenoic acid ethyl ester and docosapentaenoic acid ethyl ester from single-cell oil[J].Journal of the American Oil Chemists'Society,1997,74( 11) : 1 435-1 440.
[41]全文琴.ω-3多不饱和脂肪酸甘油酯富集的研究[D].无锡:江南大学,2008.
[42]孙兆敏,张芹,郭正霞,等.酶促乙酯化和分子蒸馏联用制备高DHA乙酯的工艺[J].食品工业科技,2014,( 12) : 167-171.
[43]温雪馨,李建平,侯文伟,等.微藻DHA的营养保健功能及在食品工业中的应用[J].食品科学,2010( 21) : 446-450.
[44]霍卫.我国鱼油产品进出口贸易高速增长[J].中国现代中药,2014,16( 6) : 478-480.
Perspective in the production and application of DHA from Thraustochytrids
WU Hai-long,CUI Yan,CHENG Jay
( School of Environment and Energy,Peking University,Shenzhen 518055,China)
Thraustochytrids have recently attracted much attention due to its high DHA content,simple fat composition and fast growth rates.In this review of the present research,developments in the fermentation process,DHA extraction and purification were introduced.The problems existed in the future application of DHA were also mentioned,which would be helpful for its industrialization.
Thraustochytrids; fermentation; lipid extraction; docosahexaenvic acid ( DHA) purification; industrialization
10.13995/j.cnki.11-1802/ts.201602044
硕士研究生(成家杨教授为通讯作者,E-mail: chengjy @ pkusz.edu.cn)。
海洋公益性行业科研专项经费项目( No.201305022) ;中国博士后科学基金( No.2014M560855)。
2015-07-11,改回日期: 2015-09-07
