快速高分辨率液相色谱-串联质谱法测定牛肉中24种镇静剂类兽药残留量
2016-06-07魏晋梅周围解迎双张丽方素栎罗玉柱张咏梅
魏晋梅,周围,解迎双,张丽,方素栎,罗玉柱*,张咏梅
1(甘肃农业大学研究测试中心,甘肃省草食动物生物技术重点实验室,甘肃 兰州, 730070) 2(甘肃出入境检验检疫局,甘肃 兰州,730020) 3(甘肃农业大学食品科学与工程学院,甘肃 兰州,730070) 4(甘肃农业大学动物科学技术学院,甘肃 兰州,730070)
快速高分辨率液相色谱-串联质谱法测定牛肉中24种镇静剂类兽药残留量
魏晋梅1,周围2,解迎双2,张丽3,方素栎4,罗玉柱1*,张咏梅1
1(甘肃农业大学研究测试中心,甘肃省草食动物生物技术重点实验室,甘肃 兰州, 730070)2(甘肃出入境检验检疫局,甘肃 兰州,730020) 3(甘肃农业大学食品科学与工程学院,甘肃 兰州,730070)4(甘肃农业大学动物科学技术学院,甘肃 兰州,730070)
摘要建立了牛肉中 24 种镇静剂类药物残留量的检测方法。样品经氨水-乙腈溶液(体积比10∶90)和 30 μL β-葡糖苷酸酶/芳基硫酸酯酶提取后,用HLB 固相萃取小柱净化,采用快速高分辨率液相色谱-串联质谱(RRLC-MS/MS)检测,以信噪比(S/N)分别为3和10时测定药物的检出限(LODs)和定量限(LOQs)。各药物在添加浓度水平范围均有良好的线性关系,相关系数(r2)在 0.963 9~0.999 8之间,LODs 为 0.2~2.5 μg/kg,LOQs 为0.5~5 μg/kg,平均添加回收率为 74.1%~123.9%,日内相对标准偏差(RSD)为2.6~9.9%,日间相对标准偏差(RSD)为2.9~9.9%。该方法灵敏度高、回收率高,为镇静剂类药物残留量检测提供了基础方法,可满足同类实验室的检测需求。
关键词镇静剂;高分辨率液相色谱-串联质谱;牛肉
镇静剂是临床常用的能使动物中枢神经系统产生轻度抑制、减弱机能活动,起到消除躁动不安、恢复安静的一类药物,常被不法分子作为生长促进剂用于动物养殖中,从而对公众健康造成一定的危害。许多国家都将此类药物列为禁用药物。我国农业部 176 号[1]和235 号[2]公告规定严禁在动物饲料和饮用水中使用此类药物,在动物源食品中不得检出此类药物。
目前,国内外报道的镇静剂类药物及其代谢物的检测方法有气相色谱法(GC)[3]、气相色谱-质谱联用法(GC-MS)[4-5]、高效液相色谱法(HPLC)[6]、液相色谱-质谱联用法(LC-MS)[7]、液相色谱-串联质谱联用法(LC-MS/MS)[8-11]等。涉及的样品主要有猪肉、猪肾、猪肝、保健品和水产品等。严丽娟等[12]建立了超高效液相色谱-飞行时间质谱法高通量筛查乳制品中 20 种镇静剂的方法,吴宁鹏等[13]采用超高效液相色谱-串联四极杆飞行时间质谱法筛查饲料中 11 种镇静剂类药。外源性化合物在畜牧业中的使用已经引起了消费者的焦虑与恐慌,食品安全已经成为全世界关注的焦点之一。因此,深入研究兽药残留检测方法是保证我国食品质量安全的迫切需要。
本文建立了牛肉中24 种镇静剂类药物残留量的快速高分辨率液相色谱-串联质谱(RRLC-MS/MS)检测方法,该方法灵敏度高、回收率高,可为镇静剂类药物的残留检测提供科学参考依据。
1材料与方法
1.1材料与仪器
牛肉样品:购自桃海市场(兰州)。
对照品:唑吡坦(171258-200601,100%)、氟哌啶醇(100313-200301,100%)、氯氮卓(171248-200301,100%)、氯丙嗪(100460-200501,100%)、奋乃静(100133-200602,100%)、氟奋乃静(100162-201003,≥ 98.8%)、奥沙西泮(171229-201104,100%)、艾司唑仑(171219-201003,≥ 99.7%)、阿普唑仑(171218-201104,≥ 99.1%)、三唑仑(171230-201203,≥ 99.6%)、地西泮(171225-201304,≥ 99.9%)、咪达唑仑(171265-201001,≥ 99.8%)、氯硝西泮(171227-201103,100%)、硝西泮(171217-200402,100%)、异丙嗪(100422-201002,≥ 99.4%)等购自中国药品生物制品检定所;甲苯噻嗪(11010,≥ 98.0%)、丙酰丙嗪(10404,≥ 99.0%)、咔唑心安(00421,≥ 99.0%)、阿扎哌隆(20124 ,≥ 98.5%)、乙酰丙嗪(20010,≥ 99.0%),购自Dr. Ehrenstorfer GmbH公司 (德国);氟哌利多(CDCU-1229001)为 USP标准品;安眠酮(Y000701)为欧洲药典对照品,去甲地西泮(FE110410-01,1.0 mg/mL甲醇溶液)和替马西冸Temazepam (FE012111-06,1.0 mg/mL甲醇溶液)购自Cerilliant公司(美国);巴比妥酸(WXBB2078,≥99.0%)购自Sigma-Aldrich公司(德国)。
试剂:甲醇和乙腈为色谱纯试剂,购自Merck 公司(德国);β-葡糖苷酸酶/芳基硫酸酯酶购自Sigma-Aldrich公司(德国);其他试剂均为国产分析纯试剂。
超快速液相色谱串联质谱仪(RRLC-MS/MS):Agilent 1290 series液相色谱仪,配有G1322A 脱气系统,G1312B SL二元泵,G1357D 高精确度自动进样器(HiP ALS SL+);Agilent 6460四级杆串联质谱仪,配有电喷雾离子源(ESI,G1948B)(Agilent Technologies,美国)。AB104-N 电子天平(Mettler Toledo 公司,瑞士);RE-52C 旋转蒸发仪( 郑州市亚荣仪器有限公司);SUPRA 22K 高速离心机( Hanil 公司,韩国);KH3200B 型超声波清洗器 (昆山禾创超声仪器有限公司);Milli-Q超纯水系统(Millipore公司,美国);Oasis HLB (6 mL,200 mg)固相萃取小柱(Waters 公司,美国)。
1.2实验方法
1.2.1标准贮备液和工作溶液的制备
分别称取 24 种对照品 和内标物质5 mg,用甲醇溶解,并定容至 25 mL 的容量瓶中,此贮备液浓度均为 200 μg/mL;混合标准中间工作溶液用0.027 mol/L甲酸-乙腈溶液稀释贮备液而得,浓度为 50、30、10、5、2、1 和 0.5 μg/L,此工作液中均含有20μg/L巴比妥酸;基质匹配标准工作溶液为空白牛肉样品的提取液。所有的标准溶液于棕色瓶中置于-18 ℃保存。
1.2.2样品制备
牛肉样品绞碎、混合、均质,置于-18 °C 保存,以备后用。分析之前,从冰箱中拿出均质好的样品,解冻至室温。准确称取 5 g 样品于聚丙烯离心管中(50 mL),加入 1 mL 20μg/L内标、15 mL 0.26 mol/L氨水-乙腈溶液(体积比10∶90)和 30 μL β-葡糖苷酸酶/芳基硫酸酯酶,置于黑暗中 37 ℃涡旋振荡 10 h,30 ℃超声提取 10 min后,2 810×g 离心 5 min,移取上清液于聚丙烯离心管中(50 mL),残渣中加入15 mL 0.26 mol/L的氨水-乙腈溶液(体积比10∶90),30 ℃超声提取 10 min,重复此步骤2次,合并上清液。上清液中加入 5 g NaCl 和 5 mL 正己烷,涡旋混合,静置10 min,弃去上层液体(正己烷层),过滤。滤液于 37 °C 减压旋转蒸发至近干,残渣用 3 mL 甲醇溶解。
HLB固相萃取小柱分别用 5 mL 甲醇活化、5 mL 水平衡,保持柱体湿润。将上述甲醇溶液加入 HLB 小柱中,用5 mL 水淋洗小柱,抽干,5 mL 乙腈洗脱,洗脱液于37 ℃减压旋转蒸发至近干,残渣用1 mL 0.027 mol/L甲酸-乙腈(体积比90∶10)溶解,过0.22 μm 水相滤膜,供 RRLC-MS/MS测定。
1.2.3RRLC-MS/MS分析
液相色谱分离条件:Acquity UPLC CSHTMC18色谱柱 (100 mm × 2.1 mm i.d.,粒径 1.7 μm,Waters 公司,美国);柱温 30 °C;流动相为乙腈(A)和 0.027 mol/L甲酸溶液( B ),梯度洗脱程序为 10% A → 70% A (1~15 min)→ 10% A (15~16 min),流速 0.3 mL/min, 进样量 5 μL。
质谱条件:电喷雾离子源(ESI),正离子扫描、多反应监测(MRM)模式;毛细管电压 +3.2 kV;锥孔电压 +1 kV;离子源温度 120 ℃;脱溶剂温度 350 ℃;喷雾气为氮气(0.31 MPa);载气流速 10 L/min,温度 350 ℃;鞘气流速 11 L/min,温度 350 ℃;脱溶剂气流速 500 L/h;锥孔反吹气流速 50 L/h;质量扫描范围 m/z 80~1 000;扫描时间 0.05 ms。每种药物优化后的锥孔电压、毛细管电压、定性离子和定量离子等参数见表 1。Agilent Mass Hunter 工作站(Agilent Technologies,美国)用于控制仪器、数据采集和结果分析。
1.2.4方法验证
本研究在实验室内进行分析方法的验证。在空白牛肉的提取液中加入系列混合标准工作溶液,经 RRLC-MS/MS 测定,以药物的峰面积为纵坐标 y,以添加浓度为横坐标 x 建立各药物的线性回归方程,并以信噪比(S/N)分别为 3 和 10 确定方法的定性限(LOD)和定量限(LOQ)。基质匹配溶液中的混合标准工作溶液的浓度为:
(1)阿扎哌隆、甲苯噻嗪、咔唑心安、氯丙嗪、氯氮卓、丙酰丙嗪和氟哌丁醇:5、10、20、30、 50 μg/kg。
(2)硝西泮、唑吡坦、乙酰丙嗪、氟哌利多和氟奋乃静:0.5、1、10、30、50 μg/kg。
(3)奋乃静、异丙嗪:1、5、10、30 、50 μg/kg。
(4)氯硝西泮:2、10、20、30 、50 μg/kg。
(5)三唑仑、替马西冸、地西泮、阿普唑仑、艾司唑仑和奥沙西冸:5、10、25、50、100 μg/kg。
(6)安眠酮、咪达唑仑和去甲地西泮:10、25、50、100、200 μg/kg。
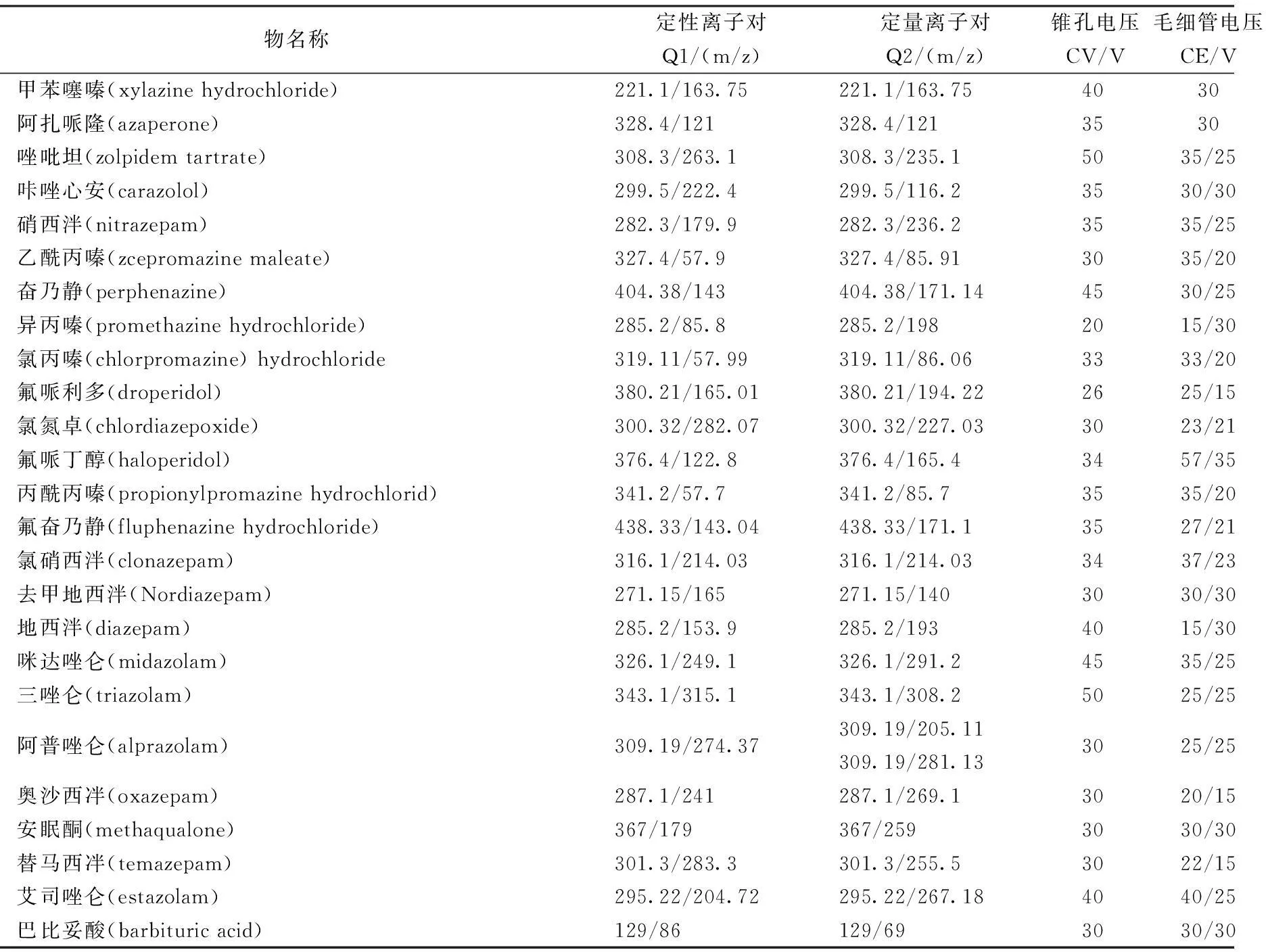
表1 优化后的质谱参数
方法的准确度和精密度通过测定日内和日间加标回收率评价,加标浓度为1、5 和 10 μg/kg。日内分析时,每个浓度水平重复测定 6 次;日间分析时,每个浓度水平重复测定 3 次,连续测定3 d。
2结果与分析
2.1样品制备
24种镇静剂具有不同的化学结构和性质,对不同溶剂的溶解性也不同,为了有效地同时从牛肉样品中提取 24 种镇静剂类兽药,本实验尝试了分别用乙腈、甲醇、乙酸乙酯、氨水-二氯甲烷(体积比5∶95)、氨水-乙酸乙酯(体积比5∶95)、氨水-乙腈(体积比10∶90)、氨水-甲醇(体积比10∶90)、甲醇-乙酸乙酯(体积比1∶1)、0.1 mol/L HCl-乙腈(体积比5∶95)、以及水与甲醇或乙腈组成的不同配比的溶液等试剂对样品进行提取。实验发现,碱性试剂的提取溶液中药物的回收率高于其他试剂,其中氨水-乙腈(体积比10∶90)的提取液中药物的回收率较其他溶液的回收率高,但各药物的回收率仍低于 65%。提取液中加入 30 μL β-葡糖苷酸酶/芳基硫酸酯酶进行提取时,各药物的回收率可达到 80%以上,说明弱碱性条件和酶解作用有利于样品中镇静剂类药物的溶出。这可能是有些药物的化学结构中含有氨基或(和)羟基,这些基团可与葡糖醛酸、芳基硫酸糖苷或动物代谢过程中形成的酯结合,从而从肉样品中析出至提取液中,因此回收率得到了提高[8]。
用活化并平衡好的固相萃取小柱 Oasis HLB对提取液进行净化,结果表明Oasis HLB小柱能有效地去除检测中的干扰杂质,因此,实验选择Oasis HLB 固相萃取小柱为净化柱。
2.2MRM离子选择
检测兽药残留时,欧盟委员会规定(Commission Decision 2002/657/EC)[14]至少有 4 个识别点才能对药物进行确证。RRLC-MS/MS 检测中,母离子和子离子分别可获得 2 个和 2.5 个识别点。阿扎哌隆、甲苯噻嗪和氯硝西泮分别获得4.5识别点,阿普唑仑有1个母离子和3个子离子,可获得 9.5 个识别点,其他药物均获得7个识别点。因此,所有的分析物可以在 MRM 监测模式和 ESI+扫描模式下进行确证和测定。24 种药物和内标化合物的MRM 色谱图见图 1。
2.4方法验证
2.4.1线性关系与检出限
被分析物的色谱峰峰型对称、没有干扰因素时,根据保留时间和质量检测可以对被分析物进行定性,根据 MRM 色谱峰面积定量。本实验以信噪比(S/N)分别为 3 和 10 时测定各药物的 LODs 和 LOQs。各药物的 LODs 在 0.2~2.5 μg/kg,LOQs 在 0.5~5 μg/kg。在基质匹配工作溶液中添加系列混合标准工作液进 RRLC-MS/MS 分析测定,以化合物的定量离子色谱峰面积(经内标校正)为纵坐标,化合物添加浓度为横坐标进行线性回归,得到标准曲线方程。24 种镇静剂类兽药在添加浓度水平范围均匀良好的线性关系,相关系数(r2)在 0.963 9~0.999 8之间(表 2)。
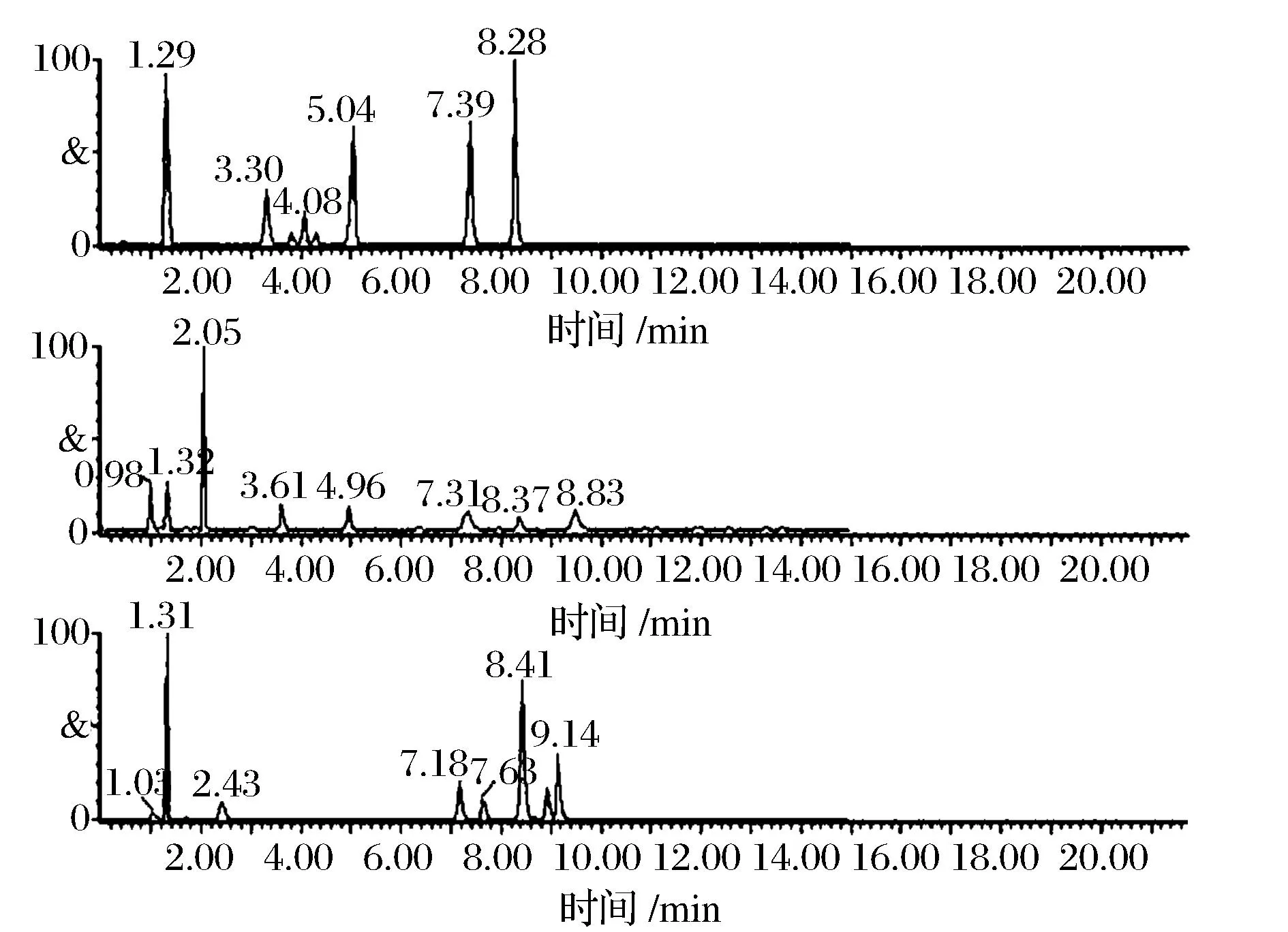
图1 空白牛肉中添加 24 种镇静剂类兽药和内标物质的 MRM 色谱图Fig. 1 MRM chromatograms of a blank mutton spiked with 24 sedatives and internal standard
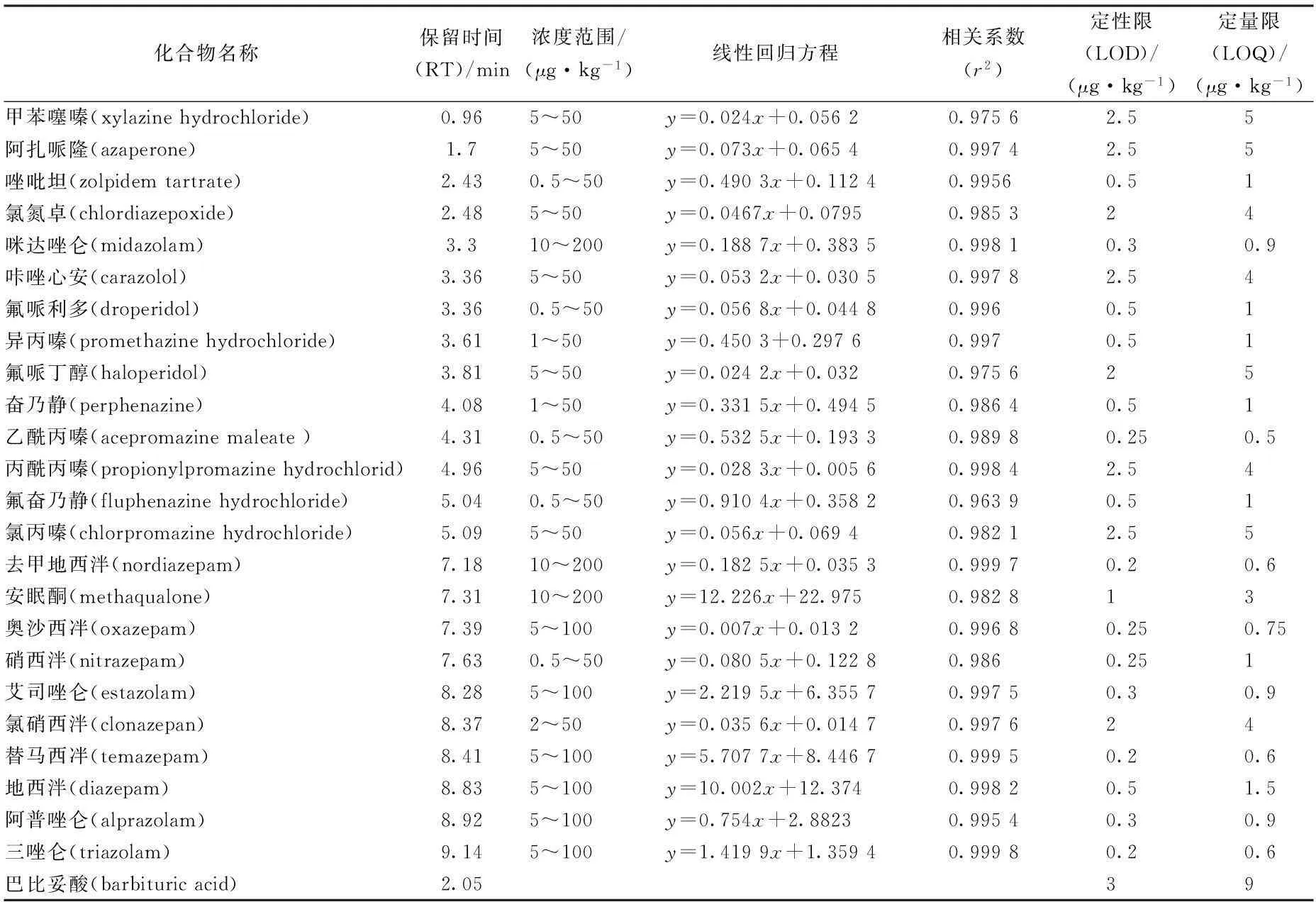
表2 24种药物的标准曲线、相关系数、定性限和定量限
2.4.2方法的准确度和精确度
在空白牛肉样品中,添加1、5和10 μg/kg 3个水平标准工作溶液,进行提取回收实验,以评价方法的准确度和精密度。日内分析时,每个添加浓度水平进行6个重复测定,日间分析时,每个添加浓度水平进行3个重复测定,连续3 d重复测定。24种镇静剂药物在空白牛肉中的平均添加回收率为 74.1%~ 123.9%日内相对标准偏差(RSD)为2.6%~ 9.9%,日间相对标准偏差(RSD)为 2.9%~ 9.9% (表 3),日内、日间相对标准偏差均小于 10%,回收率和相对标准偏差均符合国内外相关标准和法规的要求。方法有足够的灵敏度,可用于检测实际样品。
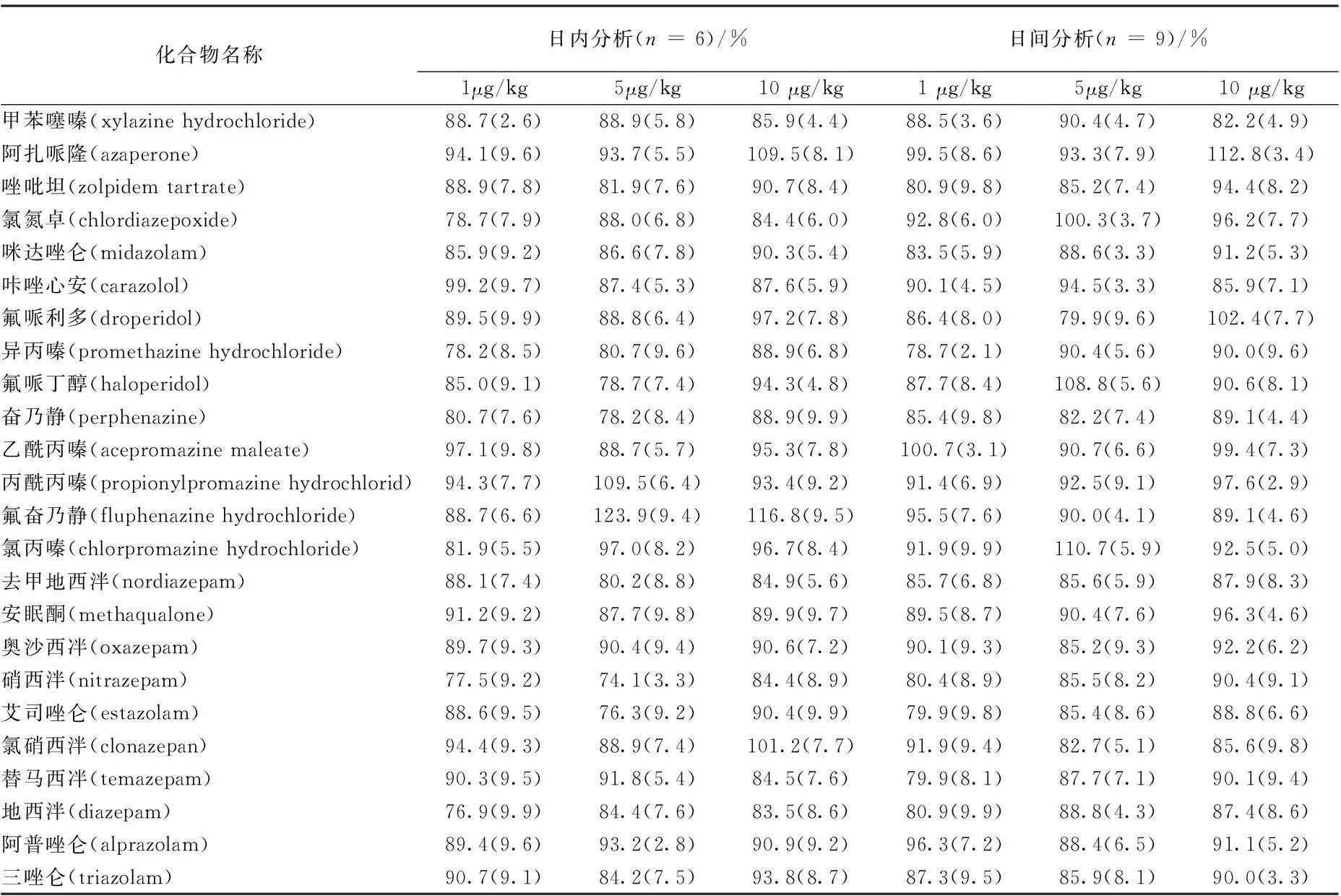
表3 24种镇静剂类药物的回收率实验结果
3结论
建立了RRLC-MS/MS 测定牛肉中24 种镇静剂类药物残留量的方法。在信噪比(S/N)分别为 3 和 10 时各药物的 LODs 在 0.2~2.5 μg/kg、LOQs 在 0.5~5 μg/kg。24种镇静剂药物在空白牛肉中的平均添加回收率为 74.1%~ 123.9%日内相对标准偏差(RSD)为2.6%~ 9.9%,日间相对标准偏差(RSD)为 2.9%~ 9.9%,日内、日间相对标准偏差均小于 10%,回收率和相对标准偏差均符合国内外相关标准和法规的要求。RRLC -MS/MS能够为牛肉样品的分析提供足够的分析灵敏度和精度。该方法回收率高、精密度好,能够满足兽药残留分析的要求。
参考文献
[1]《禁止在饲料和动物饮用水中使用的药物品种目录》, 中华人民共和国农业部公告 第176号, 2002.
[2]《动物性食品中兽药最高残留限量》, 中华人民共和国农业部公告 第235号, 2002.
[3]张力群, 吴平谷, 金铨, 等. 镇静剂残留分析的色谱检测技术研究进展[J].中国卫生检验杂志, 2013, 23(6): 1 634-1 648.
[4]CHENG L L, ZHANG Y J, SHEN J Z, et al. GC-MS method for simultaneous determination of four sedative hypnotic residues in swine tissues [J]. Chromatographia, 2010, 71(1): 155-158.
[5]汪丽萍, 李翔, 孙英, 等. 气相色谱/质谱法测定猪肉中 4 种苯二氮卓类镇静剂残留[J]. 分析化学, 2005, 33(7): 951-954.
[6]范盛先, 黄玲利, 袁宗辉, 等. 猪肾脏中氯丙嗪和异丙嗪残留检测方法的建立[J]. 中国兽医学报, 2005, 25(4): 412-414.
[7]POKAR M KABRA, HOWARD Y K, et al. Simultaneous liquid- chromatographic determination of 12 common sedatives and hypnotics in serum [J]. Clinical Chemistry, 1978, 24(4): 657-662.
[8]WANG M L, GUO B, HUANG Z Q, et al. Improved compatibility of liquid chromatography with electrospray tandem mass spectrometry for tracing occurrence of barbital homologous residues in animal tissues [J]. Journal of Chromatography A, 2010, 1217(7): 2 821-2 831.
[9]孙雷, 张骊, 徐倩, 等. 超高效液相色谱-串联质谱法检测猪肉和猪肾中残留的 10 种镇静剂类药物[J]. 色谱, 2010, 28(1): 38-42.
[10]祝波, 赵宗阁, 王尊文, 等. LC-MS/MS法分析保健品及中成药中添加的15种镇静催眠剂[J]. 药物分析杂志, 2010, 30(4): 745-751.
[11]钱晓东, 于慧娟, 惠芸华, 等. 水产品中镇静剂残留的高效液相色谱-串联质谱法测定[J]. 湖南农业科学, 2010(19): 134-137.
[12]严丽娟, 张洁, 潘晨松, 等. 超高效液相色谱-飞行时间质谱法高通量筛查乳制品中 20 种镇静剂[J]. 分析化学, 2013, 41(1): 31-35.
[13]吴宁鹏, 班付国, 彭丽, 等. 超高效液相色谱一串联四极杆飞行时间质谱法筛查饲料中11种镇静剂类药物[J]. 质谱学报, 2012, 33(2): 94-99.
[14]Commission Decision 2002/657/EC [S].Official Journal of the European Communities, 2002, 221: 8-36.
Determination of 24 sedative residues in beef by rapid resolution liquid chromatography-tandem mass spectrometry
WEI Jin-mei1, ZHOU Wei2, XIE Ying-shuang2, ZHANG Li3,FANG Su-li4, LUO Yu-zhu1*, ZHANG Yong-mei1
1( Instrumental Research and Analysis Center, Gansu Agricultural University, Gansu Key Laboratory of Herbivorous Animal Biotechnology, Lanzhou 730070, China) 2( Gansu Entry-Exit Inspection and Quarantine Bureau, Lanzhou, 730020, China) 3(College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070, China) 4( College of Animal Science and Technology, Gansu Agricultural University,Lanzhou 730070, China)
ABSTRACTA rapid resolution liquid chromatography-tandem mass spectrometry (RRLC-MS/MS) method was established for the determination of 24 sedatives residues in beef. After enzymolysis, sedatives residues in beef were extracted by ammonium hydroxide-acetonitrile (10∶90, v/v) and determined by RRLC-MS/MS and quantified by standard curve . The calibration curves showed good linearity within the concentrations of spiked levels with the correlation coefficients (r2) ranged from 0.9639 to 0.999 8. The limits of detection (LODs) and quantification (LOQs) were 0.2~2.5 and 0.5~5 μg kg(-1), respectively. The average recoveries of spikes samples were in the ranges of 74.1 ~ 123.9% with relative standard deviations of intra- and inter-day ranged from 2.6% to 9.9% and from 2.9% to 9.9%, respectively. This method is simple, sensitive and accurate in the determination of sedative residues.
Key wordssedatives; rapid resolution liquid chromatography-tandem mass spectrometry (RRLC-MS/MS); beef
收稿日期:2015-05-13,改回日期:2015-09-06
基金项目:甘肃省自然科学基金项目(1208RJZA156);甘肃省自然科学基金重点项目(1010RJZA202);甘肃省财政厅项目(基于指纹图谱技术的牦牛产地鉴别与新鲜度评价研究)
DOI:10.13995/j.cnki.11-1802/ts.201602033
第一作者:博士,副研究员(罗玉柱教授为通讯作者,E-mail:yuzhuluo@yeah.net)。
