Paenibacillus spp. BD3526发酵小麦麸皮生产凝乳酶
2016-06-07杭锋洪青陶源王钦博刘振民陈卫
杭锋,洪青,陶源,王钦博,刘振民,陈卫*
1(江南大学 食品学院,食品科学与技术国家重点实验室,江苏 无锡, 214122) 2(乳业生物技术国家重点实验室,光明乳业股份有限公司乳业研究院,上海,200436)
Paenibacillusspp. BD3526发酵小麦麸皮生产凝乳酶
杭锋1,2,洪青2,陶源1,王钦博2,刘振民2,陈卫1*
1(江南大学 食品学院,食品科学与技术国家重点实验室,江苏 无锡, 214122)2(乳业生物技术国家重点实验室,光明乳业股份有限公司乳业研究院,上海,200436)
摘要对Paenibacillus spp. BD3526凝乳酶的发酵条件和凝乳性能进行了研究,探讨了不同培养基、发酵时间、碳源、氮源和装液量对凝乳酶活力和活菌数的影响,并与商业化的小牛皱胃酶、重组凝乳酶、Rhizomucor miehei来源凝乳酶进行凝乳性能比较。实验结果表明:发酵时间、碳源、氮源和装液量对BD3526凝乳酶活力(milk-clotting activity, MCA)和蛋白水解活力(proteolytic activity, PA)均有不同程度的影响。选用小麦麸皮培养基进行发酵至24 h时,MCA达到最大至3 279.76±67.11 SU/mL,凝乳性能强,PA值在整个发酵期间变化不大;添加碳源或氮源会不同程度地降低MCA值;装液量为30 mL时,发酵上清液中菌体浓度最高、MCA达到6 000 SU/mL。与商业化的凝乳酶相比,BD3256凝乳酶在凝乳过程中未使凝乳块产生过度水解,也无乳清析出现象,具有应用到干酪生产中的潜力。
关键词Paenibacillus spp.;凝乳酶;小麦麸皮;凝乳酶活力;蛋白酶活力
凝乳酶(milk-clotting enzyme, MCE)是制作干酪时凝固牛乳用的酶制剂,通过水解κ-酪蛋白中的Phe105-Met106肽键导致牛乳凝结[1]。传统干酪加工中使用的凝乳酶是小牛皱胃酶,具有高凝乳酶活性与低蛋白水解活力的特性[2]。随着世界干酪产业规模的不断扩大,小牛皱胃酶的供应量已无法满足干酪生产的需求。为此,国内外学者在动物、植物、基因工程及微生物四大方面进行了大量研究,以寻找小牛皱胃酶的替代物。
微生物来源凝乳酶因生产成本低,具有更加广泛的生化多样性以及简便的基因改造方法,被认为最有可能成为小牛皱胃酶替代物。目前研究发现,产凝乳酶的微生物以真菌为主,如Rhizomucorspp.、Mucorspp.、Aspergillusspp.等,同时部分Bacillusspp.等细菌也能够产凝乳酶[3-6]。然而,微生物凝乳酶通常具有较高的蛋白水解能力(proteolytic activity, PA),导致蛋白质降解并转化为乳清,对干酪得率具有负面作用,因此只有部分适于干酪生产[7]。如嗜热菌Rhizomucormiehei产生的MCE的MCA/PA比值较小牛皱胃酶低,但PA和耐热性较小牛皱胃酶强,导致了干酪得率降低,55 ℃热处理30 min残存PA达95%,成熟过程中对酪蛋白进行非特异性水解,造成干酪苦味形成及质构缺陷;随乳清排除的MCE对乳清蛋白也存在过度水解现象,降低了经济利用价值。但也有研究发现,纯化的真菌MCE与小牛凝乳酶混合物较单独的小牛凝乳酶在干酪成熟和风味形成具有优势。
目前,有关类芽孢杆菌(Paenibacillusspp.)产凝乳酶的研究报道较少,本文从西藏羌塘草原牧民牦牛乳中分离出1株Paenibacillusspp.BD3526,对其发酵小麦麸皮产凝乳酶的影响因素、凝乳活力、蛋白水解活力进行研究,同时与商业化的小牛皱胃酶、重组凝乳酶、R.miehei来源凝乳酶的凝乳性能进行了比较,为该菌所产凝乳酶在干酪生产中的应用奠定理论基础。
1材料与方法
1.1主要材料与仪器
1.1.1菌株
Paenibacillusspp. BD3526(CGMCC No.8333=DSM No.28815)从西藏羌塘草原牦牛乳中分离。
1.1.2实验材料
小麦麸皮(蛋白质18.6%,脂肪6.2%,总碳水化合物63.9%,水分7.89%,灰分3.38%),购于农贸市场;脱脂乳粉(脂肪33.4%,脂肪0.8%,乳糖54.1%,矿物质7.9%,水分3.8%),新西兰恒天然公司;干酪素,化学纯,国药集团化学有限公司;福林酚试剂,国药集团化学试剂有限公司;小牛皱胃酶,阿敏生物;R.miehei来源凝乳酶Marzyme®150 MG,杜邦丹尼斯克;Aspergillusnigervar.awamori重组凝乳酶Chy-Max®,Chris Hansen;其他试剂均为分析纯。
1.1.3培养基
脱脂乳培养基:配置100 g/L的脱脂乳溶液,经充分溶解和水化后,于118 ℃灭菌15 min。
脱脂乳琼脂培养基:150 g/L脱脂乳和1.67 g/L琼脂溶液118 ℃各自灭菌15 min,冷却至45 ℃后,脱脂乳和琼脂溶液按1∶9的体积比无菌混匀并倾注平板。
LB培养基(g/L):胰蛋白胨10,酵母提取物5,NaCl 10,pH7.0。
TYC液体培养基(g/L):酪蛋白胨15,蔗糖50,酵母膏5.0,L-胱氨酸0.2,乙酸钠20,Na2SO40.1,NaCl 1.0,Na2HPO4·12H2O 2.0,NaHCO32.0,pH7.3。
30 g/L麸皮培养基:称取1.5 g小麦麸皮至250 mL三角瓶中并加入50 mL去离子水(不同装液量条件下小麦麸皮质量按比例称取),121 ℃,灭菌20 min后配用。
1.1.4主要仪器
XB.K.25血球计数板,上海求精生化试剂仪器有限公司;HZQ-X500C摇床,上海一恒科学仪器有限公司;恒温水浴槽,英国Grant公司;Olympus BX60显微镜,日本Olympus公司;Specord 205分光光度计,德国耶拿公司;Sorvall Stratos台式高速冷冻离心机,美国Thermo公司。
1.2实验方法
1.2.1Paenibacillusspp. BD3526的保存与活化
Paenibacillusspp. BD3526原始菌株已提交中国普通微生物菌种保藏管理中心(CGMCC No.8333)和德国微生物菌种保藏中心保藏(DSM No.28815),实验室采用冻干脱脂乳管保存于-80 ℃;原始菌株使用前采用脱脂乳培养基活化2次,BD3526接种于脱脂乳中30 ℃、180 r/min摇床培养20 h作为种子液备用。
1.2.2Paenibacillusspp. BD3526培养方法
配置30 g/L的小麦麸皮为产酶培养基,250 mL三角瓶装样分别为20、30、40、50和60 mL,接种体积分数3%的种子液,30 ℃、180 r/min条件培养48 h,分别测定0、3、6、9、12、15、18、24、36和48 h发酵液中活菌数、发酵上清凝乳酶活力和蛋白酶活力。
1.2.3碳源和氮源对凝乳酶活力的影响
以30 g/L的小麦麸皮为基础培养基,分别添加5 g/L的葡萄糖、乳糖、蔗糖、麦芽糖、麦芽糊精和可溶性淀粉;分别添加3 g/L的胰蛋白胨、酵母抽提物、酪蛋白水解物、酪蛋白胨、豆粕、尿素、玉米浆、糖蜜、(NH4)2SO4、KNO3,并以未添加碳源的麸皮培养基作为对照。250 mL三角瓶装样50 mL,接种量为3%,30 ℃、180 r/min条件培养24 h,测定发酵上清MCA。
1.2.4凝乳酶活力的测定
采用Arima方法进行凝乳酶活力测定[8]。配置100 g/L含有0.01 mol/L的CaCl2脱脂乳,充分水化后用1 mol/L的HCl调节至pH 6.0。取10 mL脱脂乳溶液于试管中并在35 ℃水浴中孵育10 min,将0.5 mL未稀释或采用0.05 mol/L、pH 6.0的PBS稀释一定倍数的发酵上清加入至35 ℃的脱脂乳中,每15 s将样品取出并倾斜45°观察样品组织状态,以形成不连续颗粒的时间计作凝乳时间。1个凝乳酶单位(SU)定义为:35 ℃条件下,使1 mL脱脂乳在40 min发生凝乳所需酶量[9],并按照公式(1)计算:
(1)
式中:T,凝乳时间,s;VS,底物体积,mL;VE,酶液体积,mL;D,稀释倍率。
1.2.5蛋白酶活力的测定
以酪蛋白为底物,采用Folin-Ciocalteu phenol方法进行蛋白水解活力测定。将0.5 mL未稀释或经一定倍数稀释的发酵上清加至2.5 mL 12 g/L的酪蛋白溶液中(用0.05 mol/L pH 6.0的PBS配置),混合均匀并在35 ℃水浴10 min后,加入2.5 mL 0.44 mol/L TCA终止反应,于4 ℃、10 000×g离心5 min取上清。取1 mL上清液加入2.5 mL(0.28 mol/L)的NaOH溶液和按1∶1比例稀释0.75 mL的Folin-Ciocalteu phenol试剂,35 ℃水浴孵育15 min后,测定A660 nm[10]。配置100 μg/mL的酪氨酸溶液,分别测定0,20,40,60,80和100 μg/mL酪氨酸溶液的A660 nm,建立标准曲线。1个蛋白水解活力定义为1 min释放1 μmol/mL酪氨酸所需的酶量。
1.2.6活菌数的测定
种子液与发酵液中菌体浓度采用血球板计数法进行测定。
1.2.7Paenibacillusspp. BD3526 凝乳酶与商业化凝乳酶的比较
分别将商业化的小牛皱胃酶、重组凝乳酶、R.miehei来源凝乳酶配置成160 SU/mL的酶液,将BD3526发酵上清液稀释至160 SU/mL,按照方法1.2.4凝乳并将凝乳时间控制在10 min,并在10,20,40,60,90 min观察其组织状态。
2结果与分析
2.1BD3526产酶培养基的筛选
以脱脂乳平板法(菌落周围形成酪蛋白水解圈和沉淀圈)从西藏羌塘草原采集的牦牛乳中筛选得到1株具有产凝乳酶潜质的细菌,经生理生化、细胞脂肪酸组成、G+C含量、同源杂交(数据未公布)和16S rRNA等方法进行鉴定,确定该菌株属Paenibacillusspp.,命名为Paenibacillusspp. BD3526。其16S rRNA序列已提交GenBank(http://www.ncbi.nlm.nih.gov/nuccore/758205658,编号:KM978955.1)。
将BD 3526于LB、TYC、100 g/L脱脂乳和30 g/L小麦麸皮培养基中30 ℃、180 r/min培养48 h,上清液中MCA分别为8.30±0.81、9.21±0.75、274.28±3.29和2483.17±68.35 SU/mL。小麦麸皮是微生物发酵生产凝乳酶理想的培养基质,且发酵生产的凝乳酶具有最高的MCA/PA[11,12],为此,后续实验过程中均采用小麦麸皮作为产酶培养基。
2.2BD3526凝乳酶的凝乳性能
将种子液(约5×108CFU/mL)按体积分数3%接种至30 g/L的小麦麸皮培养基中,30 ℃、180 r/min培养48 h,发酵上清中的MCA达到2483.17±68.35 SU/mL,具有较高的凝乳酶活力和良好的凝乳特性(图1)。

图1 BD 3526于30 g/L小麦麸皮培养基发酵上清凝乳效果Fig.1 Skim milk clotted by the supernant of BD 3526 clutivated in 30 g/L wheat bran broth(注:未添加凝乳酶的脱脂乳为空白对照)
为了进一步评价BD3526凝乳酶在干酪制作中的应用潜力,考察是否存在过度水解的问题,比较了BD3526凝乳酶(发酵上清)与商业化凝乳酶添加至脱脂中10,20,40,60和90 min后凝乳组织状态(图2)。

1-小牛皱胃酶;2-重组凝乳酶;3-R.miehei来源凝乳酶;4-BD3526发酵上清液图2 BD 3526凝乳酶与商业化凝乳酶凝乳效果比较Fig.2 Comparison of the protein hydrolysis between BD3526 milk-clotting enzyme (MCE) and commercial coagulants(注:0.5 mL凝乳酶(160 SU/mL)添加至10 mL 100 g/L脱脂乳中10 min(A)、40 min(B)、60 min(C)和90 min(D)后的凝乳状态)
不同来源的凝乳酶(160 SU/mL)添加至脱脂乳10 min(图2,A)和40 min(图2,B)后,凝乳组织状态良好,未发生酪蛋白水解和乳清析出的现象;60 min时(图2,C),R.miehei和BD3526凝乳酶组的凝乳已发生较为显著的酪蛋白水解和乳清析出的现象;90 min时(图2,D),所有凝乳均发生了酪蛋白水解的现象,R.miehei和BD3526凝乳酶组的酪蛋白水解和乳清析出的程度较小牛皱胃酶和重组凝乳酶组更强一些。为了避免酪蛋白和乳清蛋白发生过度水解,干酪生产过程中凝乳时间一般控制在40 min左右,本实验中凝乳酶活力较实际生产中提高了4倍,在40 min时BD3526凝乳酶与商业化凝乳酶相比未使凝乳发生过度水解和乳清析出的现象,说明该菌株来源的凝乳酶具有较低的PA。
2.3发酵过程中菌体浓度和酶活变化
为确定BD3526在小麦麸皮培养基中MCA、PA与菌体浓度的关系,在30 ℃、180 r/min摇床发酵条件下,分别测定了其在30 g/L小麦麸皮培养基中培养0,3,6,9,12,15,18,24,36和48 h的发酵液中菌体浓度和发酵上清的MCA、PA(图3)。发酵上清液中蛋白水解活力采用福林-酚法测定,标准曲线方程为:y=1.700 82x+0.015 90(R2=0.999 49)。
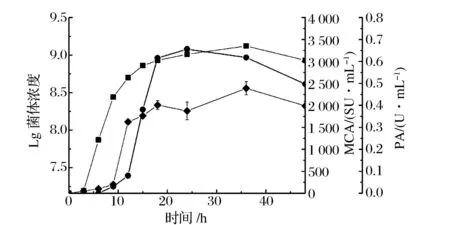
■菌体浓度;●MCA;◆PA图3 发酵过程中菌体浓度和酶活变化Fig.3 Biomass, MCA and PA during the fermentation
由图3可见,BD3526接种至麸皮培养基中0~3 h为延滞期,此后进入了生长对数期,15 h后进入稳定期,36 h则进入衰亡期;而发酵上清中的MCA和PA从9 h开始迅速增加,MCA至24 h达到最大值(3 279.76±67.11 SU/mL),此后呈逐渐下降的趋势;而PA的变化趋势亦与MCA相似,但较为稳定,因此,作为凝乳酶重要评价指标之一的MCA/PA则主要由MCA决定,并在24 h达到最大值(表1)。微生物蛋白酶往往由于氮源和碳源的胁迫作用在对数生长后期或稳定期产生[13],发酵上清从9 h开始具有MCA并在24 h时达到最大,说明BD3526凝乳酶是在对数期生长期后期分泌表达的。
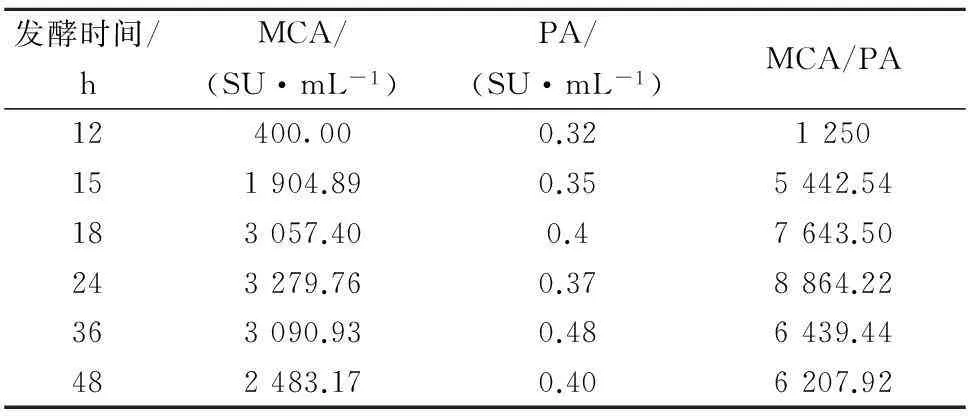
表1 发酵过程中凝乳酶活力和蛋白水解能力的变化
2.4碳源对发酵上清液MCA的影响
不同碳源对发酵上清MCA的影响如图4所示,添加5 g/L的葡萄糖组、乳糖组和麦芽糖组发酵上清中的MCA显著低于对照组;蔗糖组、麦芽糊精组和可溶性淀粉组发酵上清中的MCA与对照组无显著性差异。在补充葡萄糖、乳糖和麦芽糖的发酵上清中的MCA均显著降低,且各组菌体浓度较对照组低(数据未给出),酶活高低与菌体浓度有一定的相关性,这可能是由于该菌在补充碳源的情况下不存在碳源胁迫的情况,菌体快速增殖而酶产量降低了,这一现象与M.miehei[14-15]和M.circinelloides[16]在营养物质丰富的条件下,凝乳酶产量降低相似。

Glu-葡萄糖; Lac-乳糖; Suc-蔗糖; Mal-麦芽糖; MD-麦芽糖糊精; SS-可溶性淀粉图4 碳源对发酵上清液凝乳酶活力的影响Fig.4 Effects of carbon sources on MCA in the supernatants(**-P<0.01)
2.5氮源对发酵上清MCA的影响
不同氮源添加对发酵上清MCA的影响如图5所示。BD3526在补充氮源的麸皮培养基中发酵上清的MCA活力均显著低于空白组(P<0.01),其中,尿素组和KNO3组的发酵上清中的MCA仅为71.14±9.90 SU/mL和41.01±2.11 SU/mL。基于酶学的结构特性,微生物凝乳酶应当在蛋白类物质存在的条件下更利于合成,如足够蛋白质作为氮源补充可促进A.nigerLBA02在最初48 h发酵过程中MCE产量[12]。然而BD3526在有限的氮源的条件下却更利于合成微生物凝乳酶,补充无机和有机氮源均会显著抑制酶产量。该特性与B.subtilisnatto和Mucormiehei在补充无机氮源MCE产量显著降低的现象类似[10, 17],但与Mucormiehei选取小麦麸皮、小麦面粉和脱脂乳[17],Mucorbaciliformis选取小麦麸皮[18]作为有机氮源的条件下MCE产量提高不同。Penicilliumoxalicum[19]和Aspergillusversicolo[10]在添加酵母抽提物和蛋白胨或烘焙酵母作为氮源有利于MCE的合成,而玉米浆和豆粕均不利于P.oxalicumMCE产量的提高;以酪蛋白为补充氮源对T.indicae-seudaticaeN31的凝乳酶产量无影响[11,20]。
通过对生长曲线的比较发现,补充氮源组(除尿素组和KNO3组)的活菌数的增殖速度在对数生长期较空白组略快,但至稳定期时的菌体较空白组低,如24 h空白组菌体浓度为9.25×108CFU/mL,硫酸铵组为7.42×108CFU/mL;KNO3组(3.68×108CFU/mL)和尿素组(2.48×108CFU/mL)的菌体浓度均显著低于较空白组,可能是硝酸盐代谢产生的亚硝酸盐对菌体生产具有抑制作用(BD3526硝酸盐还原能力为(+)),而脲酶(-)可能导致尿素对菌体生长具有抑制作用。
2.6摇瓶装液量对菌体浓度和酶活的影响
摇瓶培养中的氧传递系数(KLa)随着装液量的增加而降低、转速的提高而增加[21]。为了考察培养基中的溶解氧对菌体增殖和发酵上清中的MCA和PA的影响,将250 mL三角瓶的装液量由60 mL逐渐降低至20 mL(麸皮培养基浓度为30 g/L),考察了30 °C和180 r/min的培养24 h后,各组发酵液中菌体浓度以及发酵上清中的MCA和PA(图6)。

图6 摇瓶装液量对菌体浓度和酶活的影响Fig.6 Effect of liquid volume on biomass mass concentration, MCA and PA
由图6可知,装液量对24 h发酵液中菌体浓度、MCA和PA均有显著的影响,其中,30 mL装液量时,发酵液中的菌体浓度最高(1.10×109CFU/mL),此时的MCA和PA均具有最高值;随着装液量的提高,发酵液中菌体浓度呈逐渐下降的趋势,MCA和PA也呈下降趋势,MCA降低则更为显著:由6 000 SU/mL(装液量30 mL)降低至3 000 SU/mL(装液量60 mL);由此,可以推测装液量的减少增加了培养基中溶氧水平,促进了BD3526增殖,进而增加了MCA和PA的表达。但装液量为20 mL时,此时菌体浓度为各组最低(6.0×108CFU/mL),而此时的MCA和PA仅较30 mL组略低,这可能是此时剪切力较大导致细胞的破裂和胞内目标蛋白酶的释放所致。
3结论
目前,国内外有关类芽孢杆菌(Paenibacillusspp.)产凝乳酶的研究报道还较少,本研究考察了Paenibacillusspp. BD3526生产凝乳酶的培养介质,对其发酵小麦麸皮产凝乳酶的影响因素(发酵时间、碳氮源和装液量)、凝乳活力、蛋白水解活力进行研究,同时与商业化小牛皱胃酶、重组凝乳酶、R.miehei来源凝乳酶的凝乳性能进行了比较,结论如下:
(1)Paenibacillusspp. BD3526在不同培养基中产凝乳酶差异显著,小麦麸皮是该菌株发酵生产凝乳酶理想的培养基质。整个发酵期间,上清中酶活随发酵时间的延长先上升后下降,在24 h具有最高的MCA,但PA变化不大。
(2)发酵时间和碳、氮源能够影响BD3526产酶能力,补充碳源或氮源会不同程度的降低MCA。
(3)提高溶氧水平有利于菌体生长和酶的产量。装液量30 mL时,上清发酵液中MCA和PA均达到最大,装液量的增加会降低溶解氧水平,进而导致菌体浓度和MCA的显著下降。
(4)与商业化凝乳酶相比,BD3256凝乳酶具有较高的MCA/PA值和良好的凝乳特性,凝乳过程中未出现凝乳过度水解和乳清析出的现象,具有很高的应用潜力。
参考文献
[1]BRUNO M A,LAZZA C M,ERRASTI M E, et al. Milk clotting and proteolytic activity of an enzyme preparation fromBromeliahieronymifruits [J].LWT-Food Science and Technology,2010,43(4):695-701.
[2]NEELAKANTAN S,MOHANTY A K,KAUSHIK J K.Production and use of microbial enzymes for dairy processing [J]. Current Science,1999,77(1):143-148.
[3]DE LIMA C J B,CORTEZI M,LOVAGLIO R B,et al.Production of rennet in submerged fermentation with the filamentous fungusMucormieheiNRRL 3420 [J].World Applied Science Journal,2008,4:578-585.
[4]VENERA G D,MACHALINSKI C,ZUM’ARRAGA H,et al.Further characterization and kinetic parameter determination of a milk-clotting protease fromMucorbacilliformis[J].Applied Biochemistry and Biotechnology,1997,68(3): 207-216.
[5]FAZOUANE-NAIMI F,MECHAKRA A,ABDELLAOUI R,et al.Characterization and cheese-making properties of rennet-like enzyme produced by a local Algerian isolate ofAspergillusniger[J].Food Biotechnology,2010,24(3): 258-269.
[6]LI Y,LIANG S,ZHI D,et al.Purification and characterization ofBacillussubtilismilk-clotting enzyme from Tibet Plateau and its potential use in yak dairy industry [J].European Food Research and Technology,2012,234(4): 733-741.
[7]JACOB M,JAROS D,ROHM H.Recent advances in milk clotting enzymes[J].International Journal of Dairy Technology,2011,64(1):14-33.
[8]IWASAKI S,YASUI T,TAMURA G,et al.Milk clotting enzyme from microorganisms [J].Agricultural and Biological Chemistry,1967,31(12):1 427-1 433.
[9]HE X,ZHANG W,REN F,et al.Screening fermentation parameters of the milk-clotting enzyme produced by newly isolatedBacillusamyloliquefaciensD4 from the Tibetan Plateau in China[J].Annals of Microbiology,2012,62(1): 357-365.
[10]SHIEH C J,THI L A P,SHIH L.Milk-clotting enzymes produced by culture ofBacillussubtilisnatto[J]. Biochemical Engineering Journal,2009,43(1): 85-91.
[11]SILVA B,GERALDES F,MURARI C,et al.Production and Characterization of a milk-clotting protease produced in submerged fermentation by the thermophilic fungusThermomucorindicae-seudaticaeN31[J].Applied Biochemistry and Biotechnology,2014,172(4):1 999-2 011.
[12]DE Castro R J S,NISHIDE T G,SATO H H.Production and biochemical properties of proteases secreted byAspergillusnigerunder solid state fermentation in response to different agroindustrial substrates[J].Biocatalysis and Agricultural Biotechnology,2014,4(3):236-245.
[13]ALVAREZ V,VON Der Weid I,SELDIN L,et al.Influence of growth conditions on the production of extracellular proteolytic enzymes inPaenibacilluspeoriae NRRL BD-62 andPaenibacilluspolymyxa SCE2[J].Letters in Applied Microbiology,2006,43(6):625-630.
[16]ANDRADE V S,SARUBBO L A,FUKUSHIMA K,et al.Production of extracellular proteases byMucorcircinelloidesusingD-glucose as carbon source/substrate [J].Brazilian Journal of Microbiology,2002,33(2):106-110.
[17]THAKUR M,KARANTH N,NAND K.Production of fungal rennet byMucormieheiusing solid state fermentation [J]. Applied Microbiology and Biotechnology,1990,32(4):409-413.
[18]ARECES L B,BONINO M B D J,PARRY M A,et al.Purification and Characterization of a milk clotting protease fromMucorbacilliformis[J].Applied Biochemistry and Biotechnology,1992,37(3):283-294.
[19]HASHEM A M.Optimization of milk-clotting enzyme productivity byPenicilliumoxalicum[J].Bioresource Technology,1999,70(2):203-207.
[20]MERHEB-DINI C,GOMES E,BOSCOLO M,et al.Production and characterization of a milk-clotting protease in the crude enzymatic extract from the newly isolatedThermomucorindicae-seudaticaeN31:(Milk-clotting protease from the newly isolatedThermomucorindicae-seudaticaeN31)[J].Food Chemistry,2010,120(1):87-93.
[21]LIU Y S,WU J Y,HO K P.Characterization of oxygen transfer conditions and their effects onPhaffiarhodozymagrowth and carotenoid production in shake-flask cultures[J].Biochemical Engineering Journal,2006, 27(3):331-335.
Study on milk-clotting enzyme produced byPaenibacillusspp. BD3526 in wheat bran broth
HANG Feng1,2,HONG Qing2,TAO Yuan1,WANG Qin-bo2,LIU Zhen-min2,CHEN Wei1
1(State Key Laboratory of Food Science and Technology, School of Food Science and Technology,Jiangnan University, Wuxi 214122, China)2(State Key Laboratory of Dairy Biotechnology, Dairy Research Institute, Bright Dairy and Food Co., Ltd., Shanghai 200436,China)
ABSTRACTProteinase with milk-clotting activity (MCA) produced by Paenibacillus spp. BD3526 in fermented wheat bran broth were studied. The effects of different mediums, fermentation time, carbo sources, nitrogen sources and liquid volume in flask on MCA and proteolytic activity (PA) were discussed in this paper. The results indicated that MCA reached 3279.76±67.11 SU/mL and showed excellent coagulation property after fermentation in wheat bran broth for 24 hours. Addition of carbo source and nitrogen source would reduce MCA. The biomass, MCA and PA reached maximum when liquid volume in flask was 30 mL. No excessive hydrolysis of curds and whey syneresis were found after 40 minutes of coagulation of curd with BD3526 enzyme in comparison with the commercial coagulants, which suggested that it would have a great potential application in the cheese production.
Key wordsPaenibacillus spp.;coagulant;wheat bran;milk-clotting activity(MCA); proteolytic activity; PA
收稿日期:2015-08-03,改回日期:2015-09-14
基金项目:上海市科委启明星人才计划(14QB1400200);国家“十二五”科技支撑计划(2013BAD18B02)
DOI:10.13995/j.cnki.11-1802/ts.201601007
第一作者:博士研究生,高级工程师(陈卫教授为通讯作者,E-mail:chenwei66@jiangnan.edu.cn)
