1株产顺式-4-羟基-L-脯氨酸基因工程菌的构建及发酵初步优化
2016-06-07王付才张震宇孙付保姚动邦周杨
王付才,张震宇,孙付保,姚动邦,周杨
(江南大学 工业生物技术教育部重点实验室,糖化学与生物技术教育部重点实验室,江苏 无锡,214122)
1株产顺式-4-羟基-L-脯氨酸基因工程菌的构建及发酵初步优化
王付才,张震宇*,孙付保*,姚动邦,周杨
(江南大学 工业生物技术教育部重点实验室,糖化学与生物技术教育部重点实验室,江苏 无锡,214122)
摘要顺式-4-羟基-L-脯氨酸是一种可用于合成多种药物和香料的手性结构物质。通过对L-脯氨酸顺式-4-羟化酶基因的优化设计,并引入色氨酸串联启动子,构建出1株能表达L-脯氨酸顺式-4-羟化酶的重组大肠杆菌JM109/pEHC4,从而可以将游离的L-脯氨酸转化为顺式-4-羟基-L-脯氨酸。对该菌株进行摇瓶发酵优化,得出优选培养基为(g/L):葡萄糖10,甘油10,蛋白胨10,NaCl 6,FeSO4 ·7H2O 0.278,L-抗坏血酸0.528,(NH4)2SO(4 ) 5,K2HPO4 1,MgSO4 0.2,CaCl(2 )0.015,L-脯氨酸4。在该条件下发酵12 h,顺式-4-羟基-L-脯氨酸的产量达到657.08 mg/L,比优化前提高了3.76倍;在24 h时产量达到1 582.75 mg/L。研究结果为顺式-4-羟基-L-脯氨酸的微生物转化法生产提供了基础。
关键词L-脯氨酸顺式-4-羟化酶;密码子优化;重组大肠杆菌;微生物转化;发酵优化
L-羟脯氨酸(L-hydroxyproline,L-Hyp),是L-脯氨酸羟基化后的产物。根据其羟基化位置及空间结构的不同,可形成4种立体异构体:反式-4-羟基-L-脯氨酸(trans-4-Hyp)、顺式-4-羟基-L-脯氨酸(cis-4-Hyp)、反式-3-羟基-L-脯氨酸(trans-3-Hyp)和顺式-3-羟基-L-脯氨酸(cis-3-Hyp)。其中cis-4-Hyp是一种重要的手性结构物质,可以用于药物以及香料制造。特别是在制药领域,cis-4-Hyp可以防止前胶原折叠成稳定的三级螺旋构象,从而减少纤维化和肿瘤细胞生长过程中胶原的过度沉积[1-2],因此其可用作抗纤维化、抗肿瘤[3]和抗高血压药物[4]。
在自然界中,cis-4-Hyp存在于鬼笔鹅膏毒性肽的水解产物鬼笔毒素中[5],也以游离的形式存在于檀香木中[6],但在哺乳动物系统中未知。目前cis-4-Hyp主要通过trans-4-Hyp的差向异构化反应[7]或者复杂的化学全合成[8]来获得,然而差向异构化合成中用到的trans-4-Hyp本身就是一种价格昂贵的化学物质,而化学合成法生产cis-4-Hyp难度大,工艺繁琐,生产成本高。与化学合成法相比,微生物转化法生产cis-4-Hyp具有操作简便、反应条件温和、副产物少、无环境污染、成本低等多种优点,所以以微生物转化法为基础的cis-4-Hyp生产方法必然成为趋势。
据报道,有多种微生物表现出L-脯氨酸顺式-4-羟化酶(cis-P4H)活性[9]。2009年,HARA等[10]人首次发现可以将游离的L-脯氨酸转化为cis-4-Hyp的微生物,包括百脉根中慢生根瘤菌(Mesorhizobiumloti)以及苜蓿中华根瘤菌(Sinorhizobiummeliloti)。并且发现cis-P4H属于2-酮戊二酸依赖型双加氧酶家族[10-11],酶催化反应需要非血红素亚铁离子以及O2的参与。然而,其在cis-4-Hyp生产过程中需要用到有毒性的诱导剂异丙基-β-D-硫代半乳糖苷(IPTG),以及菌体培养与酶转化过程分步进行的问题使得整个过程较为复杂并且增加了生产成本。目前,国内尚没有微生物转化法生产cis-4-Hyp的报道。
本研究中通过优化cis-P4H基因后,构建出1株适合在大肠杆菌中表达的含有色氨酸串联启动子(Ptrp2)的cis-P4H表达工程菌E.coliJM109/pEHC4。并对其发酵培养基进行优化,确定了cis-4-Hyp生产的最佳培养基组成及浓度,为以后的工业化生产奠定基础。
1材料与方法
1.1材料
1.1.1菌株
菌株E.coliBL21(DE3)、JM109、DH5α、W3110、SCS110为本实验室保存;克隆表达载体pES(pUC19改造型)购于上海旭冠公司。
1.1.2酶和试剂
限制性内切酶EcoR I、Hind III和BamH I以及T4DNA连接酶、DNA Marker均购自Takara公司;胰蛋白胨、蛋白胨、DNA胶回收试剂盒和质粒小量抽提试剂盒均购自上海生工生物公司;cis-4-Hyp标准品购自梯希爱(上海)化成工业发展有限公司;酵母提取物购自Oxoid公司;其他常用试剂均购自国药试剂。
1.1.3培养基
LB培养基(g/L):胰蛋白胨10 ,酵母提取物5 ,NaCl 10 ,pH 7.0;固体培养基需加入15~20 g/L的琼脂粉。初始发酵培养基(g/L):葡萄糖10,甘油5,胰蛋白胨8,(NH4)2SO45,K2HPO41,NaCl 2,FeSO4·7H2O 0.278,MgSO40.2,CaCl20.015,L-脯氨酸 4,pH 6.5。
1.2实验方法
1.2.1cis-P4H基因的优化
根据已公布的苜蓿中华根瘤菌(Sinorhizobiummeliloti)的cis-P4H基因序列(其原始基因序列见NCBI Gene ID: 14808181),在Jcat(http://www.jcat.de/)上进行密码子优化,使目的基因更适合在大肠杆菌中表达,同时消除常用酶切位点,并将原始序列中的终止密码子修改为TAAT强终止子,再使用RNAstructure 5.3软件优化mRNA的二级结构。在经两次优化的序列5’端加上Hind III,3’端加上BamH I酶切位点,以利于后续的操作。优化后的cis-P4H基因由上海旭冠公司合成并连接到pES载体上,即pES-hypc4。
1.2.2重组质粒的构建
在cis-P4H基因表达的过程中选用了不需要诱导剂的强组成型启动子——色氨酸串联启动子(Ptrp2)。将已合成好的含cis-P4H基因的质粒pES-hypc4与本实验室保藏含Ptrp2的载体同时经Hind III、BamH I双酶切,胶回收后用T4DNA连接酶连接,构建重组质粒pES-Ptrp2-hypc4(pEHC4)。
1.2.3重组菌培养及cis-4-Hyp的微生物转化方法
种子培养:挑取活化后的JM109/pEHC4单菌落接种到含有氨苄抗性的30 mL(250 mL锥形瓶)LB培养基中,37 °C,220 r/min培养大约8 h。发酵培养:按6%的接种量将种子液接入30 mL(250 mL锥形瓶)发酵培养基中,30 °C,220 r/min培养12 h。微生物转化:过滤除菌后的4 g/L的底物L-脯氨酸在接种时一并加入培养基中,L-脯氨酸随着菌体的生长和产酶过程一同转化,12 h后测定发酵液中底物L-脯氨酸转化为cis-4-Hyp的量。
1.2.4cis-4-Hyp浓度测定方法
参考文献[12]利用氯胺T法测定,由于培养基的影响,其中空白对照实验为10.74 mg/L。
1.2.5cis-P4H酶活测定
cis-P4H酶活测定参考文献[9-10]进行,cis-P4H细胞活性以每1 g湿细胞的酶活性(U/g)表示,每分钟催化生成1 μmol的cis-4-Hyp的酶活性被定义为1个单位的酶活(1 U)。酶活测定时,cis-4-Hyp的浓度利用氯胺T法测定。
1.2.6发酵培养基组分及浓度的选择
实验采用单因素条件对重组大肠杆菌JM109/pEHC4的发酵培养基进行优化,包括碳源葡萄糖(1、5、10、15、20 g/L)和甘油(0、2、5、10、15 g/L)、氮源来源(分别为8 g/L的玉米浆、蛋白胨、胰蛋白胨和酵母提取物),及蛋白胨质量浓度(5、8、10、15、20 g/L)、硫酸亚铁浓度(0.01、0.1、1、2 mmol/L)和氯化钠质量浓度(2、4、6、8、10 g/L)。每个因素的实验都是在上一因素实验确定的最佳条件基础上进行的。
2结果与分析
2.1cis-P4H基因的优化与合成
生物体之间密码子使用偏爱性的差异导致了各种异源基因表达问题,但可以通过合理的基因优化设计来克服。按1.2.1方法优化cis-P4H基因,通过同义密码子的替换调整mRNA的5’端结构,使起始密码子后的数个碱基组成的密码子翻译口袋呈现打开状态(图1)。

图1 cis-P4H基因mRNA 5’末端二级结构预测结果Fig. 1 Potential mRNA secondary structures around the ATG start codon of the unadjusted gene (A) and the adjusted gene (B)
2.2重组大肠杆菌表达载体的构建
目前cis-P4H基因表达所用到的启动子都属于诱导型T7启动子[8,10],该启动子的表达需要IPTG的诱导,并且基因表达时需要严格控制诱导时间以及诱导剂浓度。由于IPTG具有一定的毒性,一些国家规定在生产人用重组蛋白的生产工艺中不能使用IPTG。因此,本研究通过引入不需要诱导的Ptrp2来解决上面的问题,并且有助于进一步降低生产成本。
按1.2.2方法,构建重组质粒pEHC4(图2A)。将其转化至E.coliJM109中,提取质粒经EcoR I和BamH I双酶切后得到1 093 bp和2 692 bp左右的两条片段(图2B),结果表明重组质粒构建成功。
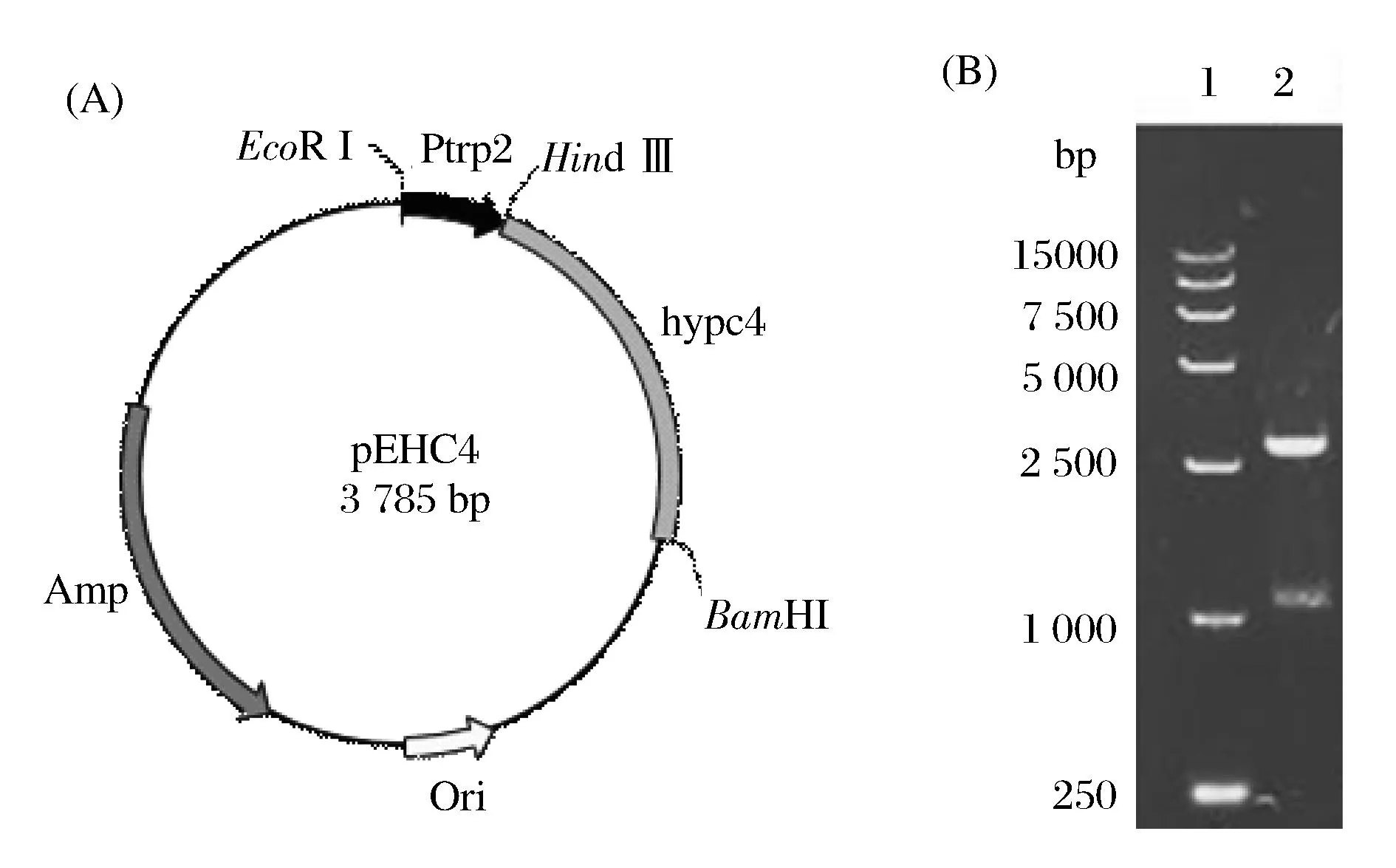
1-DNA Marker DL15 000; 2-Double digestion of pEHC4 图2 cis-P4H表达载体构建Fig. 2 cis-P4H expression vector construction (A) The profile of the recombinant plasmid. (B) EcoR I, BamH I Double digestion of pEHC4
2.3宿主菌的选择及cis-P4H酶活分析
将测序正确的质粒pEHC4分别转化至BL21(DE3)、JM109、DH5α、W3110、SCS110五种宿主菌中,分别测定5株重组菌的cis-P4H酶活及cis-4-Hyp产量,结果表明重组大肠杆菌JM109/pEHC4中的酶活最高,达到285.63 mU/g,同时,cis-4-Hyp产量达到174.90 mg/L(表1)。
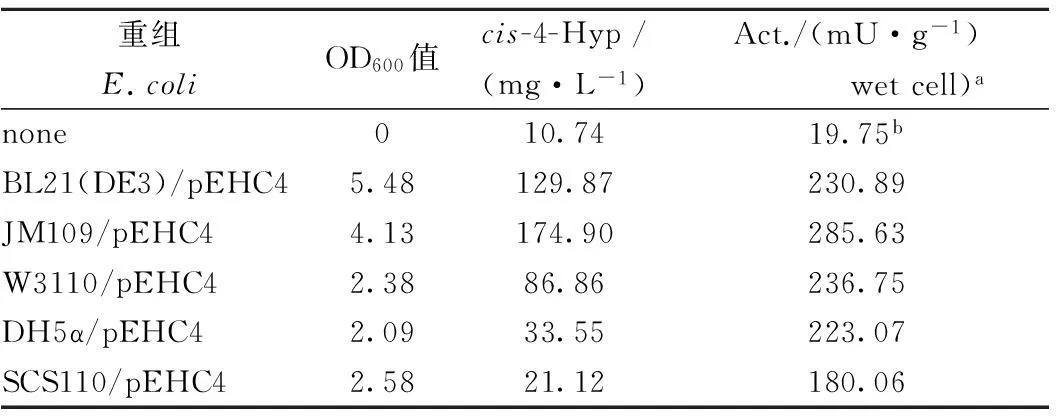
表1 不同重组菌的cis-P4H细胞活性
注:a重组菌培养12 h后的cis-P4H细胞活性,测定见材料与方法;b无细胞空白对照。
2.4重组菌生长曲线及种龄的选择
种龄对微生物发酵周期有着重要影响,种龄过嫩或者过老,不但延长发酵周期,而且还会降低产量,发酵中一般选择菌种生长的对数中后期为宜。挑取E.coliJM109/pEHC4单菌落接种于LB中,培养方法按1.2.3所述。菌种OD600与时间的关系如图3所示。

图3 重组大肠杆菌JM109/pEHC4生长曲线Fig.3 The growth curve of recombinant E.coli JM109/pEHC4
从图3可以看出,菌种接入LB后,4 h开始进入对数期,4~9 h为菌种的对数生长期,9 h后进入稳定期。一般而言,处于对数中后期的菌种活力最高而且性状稳定,生命力强可以及时适应新环境。因此,选择最佳种龄时间为7 h。
2.5发酵培养基单因素优化
2.5.1碳源葡萄糖质量浓度及甘油质量浓度对cis-4-Hyp产量的影响
对葡萄糖质量浓度的优化见图4A。结果表明,随着葡萄糖质量浓度的增高,cis-4-Hyp的产量随之增加,在葡萄糖质量浓度为10 g/L时达到最大值。当葡萄糖质量浓度大于10 g/L时,cis-4-Hyp的产量和OD600值开始下降,因为发酵培养基初始pH为6.5,偏酸性,并且葡萄糖过量会加速菌体的呼吸,在通气不足、溶氧不能满足需要的情况下,其代谢中间产物如乙酸等[13]不完全氧化而积累,导致培养基pH下降,不仅会限制菌体的生长还会影响cis-P4H的酶活。一般将葡萄糖和缓慢利用的碳源组成混合碳源,这样既有利于菌体的生长又有利于产物的形成。在葡萄糖质量浓度为10 g/L的条件下,对迟效碳源甘油浓度进行优化(图4B),结果表明甘油质量浓度在10 g/L时,cis-4-Hyp的产量达到最大,并且过高浓度的甘油并不利于产量的提升。

图4 葡萄糖质量浓度(A)和甘油质量浓度(B)对cis-4-Hyp产量的影响Fig.4 Effect of glucose (A) and glycerol (B) concentration on the production of cis-4-Hyp
2.5.2氮源来源及其质量浓度对cis-4-Hyp产量的影响
对氮源进行单因素筛选发现其对菌体生长状况的影响较显著,酵母提取物虽然有利于菌体的生长,但是并不利于cis-4-Hyp的转化生成。当蛋白胨作为氮源时,cis-4-Hyp的产量达到最大(图5A),其余产量大小依次为胰蛋白胨>酵母提取物>玉米浆。蛋白胨富含有机氮化合物,也含有一些维生素和糖类,不仅为微生物提供氮源还提供碳源以及生长因子等。对蛋白胨浓度进行优化后得出最佳浓度为10 g/L,结果表明继续增加蛋白胨的浓度,并不利于cis-4-Hyp产量和OD600的提升(图5B)。
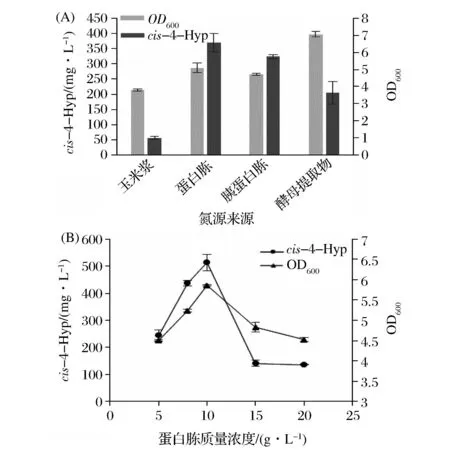
图5 氮源来源(A)和蛋白胨质量浓度(B)对cis-4-Hyp产量的影响Fig.5 Effect of different organic nitrogen(A) and peptone concentrations (B) on the production of cis-4-Hyp
2.5.3硫酸亚铁浓度对cis-4-Hyp产量的影响
cis-P4H属于2-酮戊二酸依赖型双加氧酶家族,需要非血红素亚铁离子的参与。在L-抗坏血酸存在与否的条件下对发酵培养基中的亚铁离子浓度进行优化,结果表明,cis-4-Hyp的产量最高时的亚铁浓度为1 mmol/L左右(图6),而且适量的L-抗坏血酸增加了cis-4-Hyp的产量。这种效应被观察到普遍存在于2-酮戊二酸依赖型双加氧酶家族中,一般解释为L-抗坏血酸的存在能够减少Fe2+催化过程中Fe3+的产生[8]。但是,在L-抗坏血酸浓度>3 mmol/L时,抑制作用占据优势。

图6 在L-抗坏血酸存在与否的条件下,FeSO4浓度(摩尔比FeSO4/L-抗坏血酸=1∶3)对cis-4-Hyp产量的影响Fig.6 cis-4-Hyp production at different concentrations of FeSO4 alone and in the presence of L-ascorbate(由于浓度范围大小超过3个数量级,所以使用对数坐标)
2.5.4氯化钠质量浓度对cis-4-Hyp产量的影响
脯氨酸的高亲和力转运通过由PutP基因[14]编码的次级主动转运系统介导。大肠杆菌中的Na+/脯氨酸转运体(PutP)是一种充分表征的次级主动转运体,脯氨酸进入细胞的跨膜转运依赖于Na+或Li+的电化学梯度[15]。通过对NaCl浓度的优化发现,随着浓度的增大菌体的OD600逐渐减小,浓度在6 g/L时cis-4-Hyp的产量最高(图7)。

图7 NaCl质量浓度对cis-4-Hyp产量的影响Fig.7 Effect of NaCl concentration on the production of cis-4-Hyp
2.6优化后发酵培养基的验证
经过初步优化后得出最佳培养基(g/L):葡萄糖10,甘油10,蛋白胨10,NaCl 6,FeSO4·7H2O 0.278(1 mmol/L),L-抗坏血酸0.528(3 mmol/L),(NH4)2SO45,K2HPO41, MgSO40.2,CaCl20.015,脯氨酸4,pH 6.5。对优化后的培养基进行验证,相同的发酵条件下,12 h后cis-4-Hyp的产量达到657.08 mg/L,比优化前提高了3.76倍。并且随着时间的延长产量继续增加,在24 h达到1 582.75 mg/L(图8)。
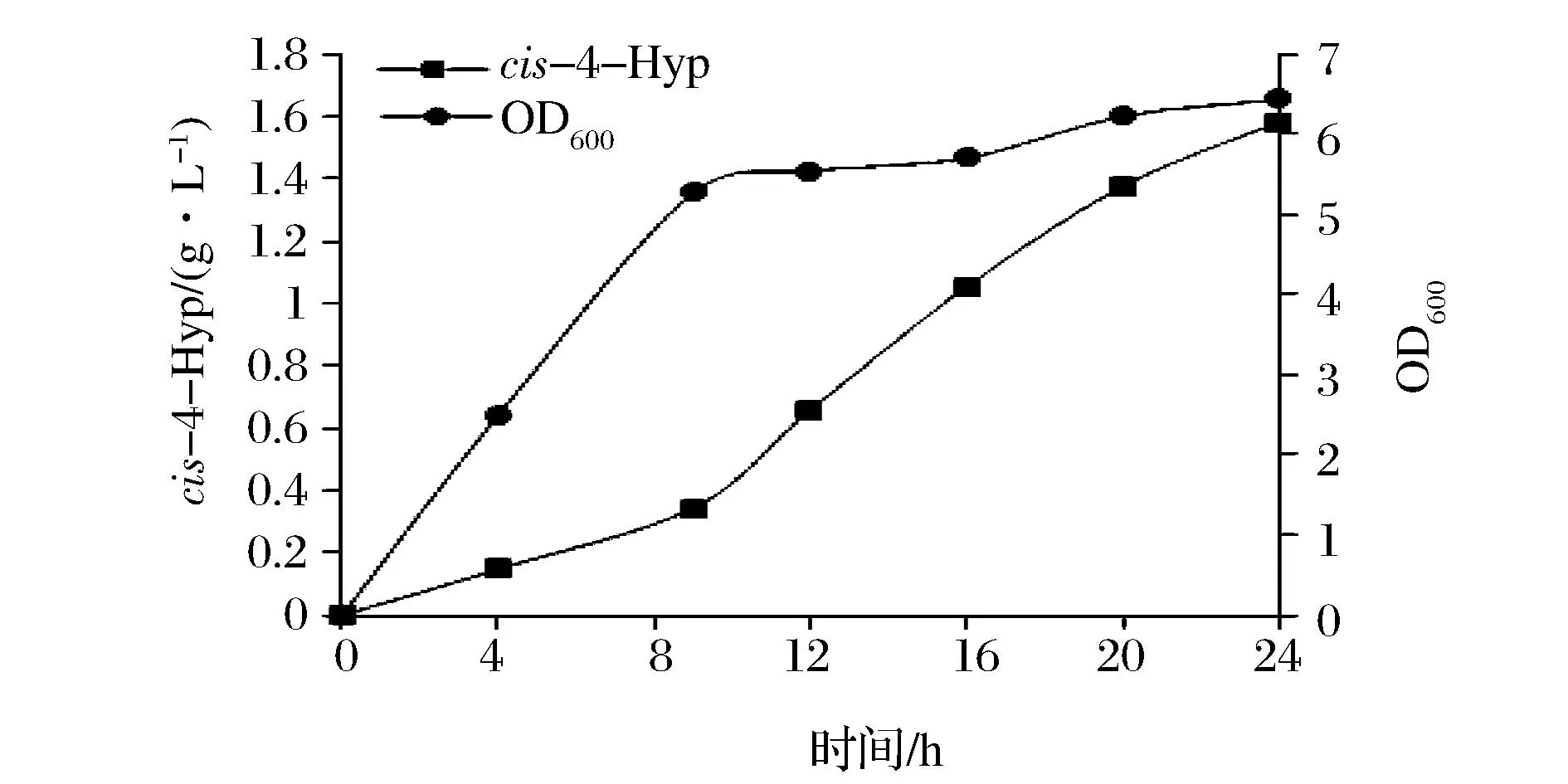
图8 重组菌JM109/pEHC4发酵验证Fig.8 Fermentation verification of recombinant E. coli JM109/pEHC4
3结论
cis-4-Hyp不仅可以用于香料制造而且可作为药物中间体合成多种药物,所以具有重要的商业价值。本研究通过从苜蓿中华根瘤菌中获取cis-P4H基因,构建了pEHC4表达载体,并在大肠杆菌JM109中成功表达。在发酵初始即将底物L-脯氨酸一同添加到发酵培养基中,无需收集菌体作为酶源再进行催化的分步工序,通过一步酶催化反应生产cis-4-Hyp,简化了工艺。并通过引入色氨酸串联启动子(Ptrp2),在避免诱导剂IPTG使用的同时,进一步降低了生产成本。对培养基初步优化之后,重组菌JM109/pEHC4 12 h的cis-4-Hyp产量达到657.08 mg/L,比优化前提高了3.76倍。此外,由于添加的底物L-脯氨酸并未消耗完全,随着时间的延长cis-4-Hyp的产量还会继续增加。本方法为工业上生产cis-4-Hyp提供了良好的技术基础。
[1]RILEY DJ, BERG RA, EDELMAN N H, et al. Prevention of collagen deposition following pulmonary oxygen toxicity in the rat bycis-4-hydroxy-L-proline[J]. Journal of Clinical Investigation, 1980, 65(3): 643-651.
[2]KERR J S, RUPPERT C L, TOZZI C A , et al. Reduction of chronic hypoxic pulmonary hypertension in the rat by an inhibitor of collagen production[J]. American Review of Respiratory Diseases, 1987, 135(2): 300-306.
[3]DIETRICH S, CLAUDIA M, DAGMAR B, et al.cis-Hydroxyproline-mediated pancreatic carcinoma growth inhibition in mice[J]. International Journal of Colorectal Disease, 2010, 25(8): 921-929.
[4]BACH Thi Mai Hoa, TAKAO H , RYO N, et al. Production of N-acetylcis-4-hydroxy-L-proline by the yeastN-acetyltransferase Mpr1[J]. Journal of Bioscience and Bioengineering, 2012, 114(2): 160-165.
[5]WIELAND T. Poisonous principles of mushrooms of the genus Amanita, four-carbon amines acting on the central nervous system and cell-destroying cyclic peptides are produced[J].Science, 1968, 159(3 818): 946-952.
[6]GOPALKRISHNAN K S, GIRI K V, RADHAKRISHNAN A N, et al. Proline and hydroxyproline in leaves[J]. Nature, 1952, 170(4 327): 579-580.
[7]SMITH J A, SAVAGE G P, HUTT O E. Studies on the synthesis ofcis-4-Hydroxy-L-proline[J]. Australian Journal of Chemistry, 2011, 64(11): 1 509-1 914.
[8]CHRISTIAN K, WOLFGANG H. A simple procedure for selective hydroxylation ofL-proline andL-pipecolic acid with recombinantly expressed proline hydroxylases[J]. Advanced Synthesis & Catalysis, 2011, 353(8): 1 375-1 383.
[9]MORI H, SHIBASAKI T, UOZAKI Y, et al. Detection of novel proline 3-hydroxylase activities inStreptomycesandBacillusspp. by regio- and stereospecific hydroxylation ofL-proline[J]. Applied and Environmental Microbiology, 1996, 62(6): 1 903-1 907.
[10]RYOTARO H, KUNIKI K. Characterization of novel 2-oxoglutarate dependent dioxygenases convertingL-proline tocis-4-hydroxy-L-proline[J]. Biochemical and Biophysical Research Communication, 2009, 379(4): 882-886.
[11]RYOTARO H, NAOKO U, KUNIKI K. Identification and characterization of 2-oxoglutarate-dependent dioxygenases catalyzing selective cis-hydroxylation of proline and pipecolinic acid from actinomycetes[J]. Journal of Biotechnology, 2014, 172: 55-58.
[12]REDDY G K, ENWEMEKA C S. A simplified method for the analysis of hydroxyproline in biological tissues[J]. Clinical Biochemistry, 1996, 29(3): 225-229.
[13]KO Y F, BENTLEY W E, WEIGAND W A. An integrated metabolic modeling approach to describe the energy efficiency ofEscherichiacolifermentations under oxygen-limited conditions: Cellular energetics, carbon flux, and acetate production[J]. Biotechnology and Bioengineering, 2004, 42(7): 843-853.
[14]MOGI T, YAMAMOTO H, NAKAO T, et al. Genetic and physical characterization ofputP, the proline carrier gene ofEscherichiacoliK12[J]. Mol Gen Genet, 1986, 202(1): 35-41.
[15]CHEN C C, TSUCHIYA T, YAMANE Y, et al. Na+(Li+)-proline cotransport inEscherichiacoli[J]. Journal of Membrane Biology, 1985, 84(2): 157-164.
Construction ofcis-4-hydroxy-L-proline producing recombinantE.coliand preliminary optimization of its fermentation conditions
WANG Fu-cai, ZHANG Zhen-yu*, SUN Fu-bao*,YAO Dong-bang, ZHOU Yang
(Key Laboratory of Industrial Biotechnology, Ministry of Education, Key Laboratory of Carbohydrate Chemistry and Biotechnology, Ministry of Education, Jiangnan University, Wuxi 214122, China )
ABSTRACTcis-4-hydroxy-L-proline is a valuable chiral building block for the organic synthesis of pharmaceuticals and perfume. By optimizing the target gene and introducing a tryptophan tandem promoter recombinant strain expressing the L-proline cis-4-hydroxylases, E. coli JM109/pEHC4, was constructed. Through the expression of L-proline cis-4-hydroxylases, free L-proline was converted to cis-4-hydroxy-L-proline. The optimized medium composition contained glucose 10 g/L, glycerol 10 g/L, peptone 10 g/L, NaCl 6 g/L, FeSO4 ·7H2O 0.278 g/L, L-ascorbate 0.528 g/L, (NH4)2SO4 5 g/L, K2HPO4 1 g/L, MgSO4 0.2 g/L, CaCl2 0.015 g/L, and L-proline 4 g/L. Finally, after fermentation under the optimal conditions for 12 h, cis-4-hydroxy-L-proline production reached 657.08 mg/L, which was 3.76 times higher than that before fermentation, and then reached 1 582.75 mg/L after 24 h. Microbial transformation by L-proline cis-4-hydroxylases is a potential approach for cis-4-hydroxy-L-proline production.
Key wordsL-proline cis-4-hydroxylases; codon optimization, recombinant Escherichia coli; microbial transformation; fermentation optimization
收稿日期:2015-09-07,改回日期:2015-11-16
基金项目:国家自然科学基金(30970058);江苏省自然科学基金(BK2012554);工业生物技术教育部重点实验室(江南大学)开放课题基金(KLIB-ZR200801)
DOI:10.13995/j.cnki.11-1802/ts.201602002
第一作者:硕士研究生(张震宇教授,孙付保副教授为通讯作者,E-mail:zhangzy@jiangnan.edu.cn;fubaosun@jiangnan.edu.cn)。
