氨酚曲马多缓释片的研制及体外释放度考察
2016-06-07武汉大学人民医院湖北武汉430060武汉大学药学院湖北武汉43007
何 文,伯 古,,谈 弋(.武汉大学人民医院,湖北武汉 430060;.武汉大学药学院,湖北武汉 43007)
氨酚曲马多缓释片的研制及体外释放度考察
何文1,伯古1,2,谈弋2
(1.武汉大学人民医院,湖北武汉430060;2.武汉大学药学院,湖北武汉430071)
摘要:目的制备氨酚曲马多缓释片,并进行体外释放度考察。方法以羟丙甲纤维素(HPMC K4M)为骨架材料制备对乙酰氨基酚(PT)颗粒,以HPMC K4M及乙基纤维素(EC)为骨架材料制备盐酸曲马多(TH)颗粒,并分别用单因素考察法确定两种颗粒的组成。两种颗粒以适当比例混合后(每片含PT 250 mg及TH 60 mg),压片制备氨酚曲马多缓释片。采用高效液相色谱(HPLC)法同时测定两种主药的含量,用转篮法对其体外释药特性进行考察,对其质量进行初步考察,并与市售氨酚曲马多片进行比较。结果氨酚曲马多缓释片各项检查指标均符合药典规定,建立的HPLC法可同时测定两种主药的含量,体外释药特性均符合一级释药方程,与市售普通片比较,该缓释片具有明显的缓释特性。结论氨酚曲马多酚缓释片制备工艺简单,质量理想,含量测定方法可靠,具有较好的缓释特性。
关键词:对乙酰氨基酚;盐酸曲马多;缓释片;制备;体外释药
盐酸曲马多(TH)常用于治疗严重疼痛,但用药过量或长期使用可产生药物依赖性,当与对乙酰氨基酚(PT)合用时,有较好的协同作用,可降低TH的剂量进而减少毒副反应[1]。目前,国内外均有氨酚曲马多复方片上市,临床应用效果较好。本试验中拟针对两种主药的溶解特性,选用合适的高分子材料,采取简单的骨架技术,分别制备PT及TH的缓释骨架颗粒后,混合压片制备氨酚曲马多缓释片,并对其体外质量进行考察,拟为缓释片的研制奠定基础。
1 仪器与试药
1.1仪器
LC-20AT型高效液相色谱仪(日本岛津公司);ZRS-8型药物溶出度仪(天津市天大天发科技有限公司);ZP-19型旋转压片机(国营九四五厂);YPD-300D型片剂硬度仪(上海黄海药检仪器有限公司);CSD-1型脆碎度检测仪(上海黄海药检仪器有限公司)。
1.2药品及试剂
TH(广州慈铭生物有限公司,含量为99.56%,批号为20110917);PT(国药集团化学试剂有限公司,含量为99.56%,批号为100018~200907);羟丙基甲基纤维素(HPMC K4M,K15M及K100M,上海Colorcon公司,批号为2C26012N02);乳糖(上海Colorcon公司,批号为EM036);聚乙烯吡咯烷酮K30(PVP K30,天津远航化学品有限公司,批号为20130618);乙基纤维素(EC,国药集团化学试剂有限公司,批号为20130812);硬脂酸镁(安徽山河药用辅料有限公司);氨酚曲马多片(商品名及通安,北京双鹭药业股份有限公司,批号为20141211)。
2 方法与结果
2.1PT缓释颗粒的制备及工艺优选
2.1.1制备工艺
取PT原料及辅料(过80目筛)混匀,以10%PVP K30的醇溶液(含醇量80%)为黏合剂,30目筛湿法制粒,60℃干燥1 h。
2.1.2药物释放度影响试验
HPMC型号:分别选用K4M,K15M,K100M的HPMC,用量均为25%,以同量乳糖调节质量,测定累积释放百分率。结果见图1。可见12 h内,随着HPMC分子量的增大,药物释放越缓慢,12 h时累积释放百分率以HPMC K4M最大,故选用HPMC K4M作为缓释材料。
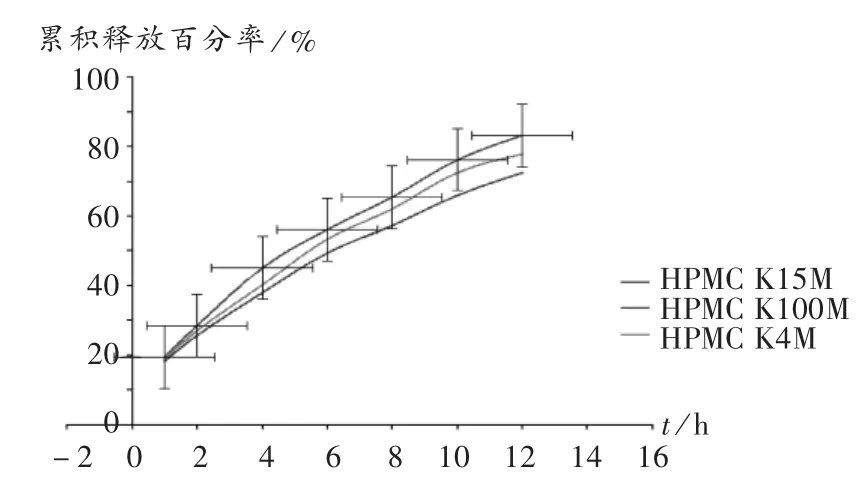
图1 不同型号HPMC对PT释放的影响(n=6)
HPMC用量:选用HPMC K4M作为骨架材料,用量分别为15%,25%,35%,用同量乳糖调节质量,测定其累积释放百分率,结果见图2。可见,随着用量的增加,药物释放速度减慢,12 h时含15%HPMC K4M的PT颗粒释放量达到80%,故HPMC选用15%的用量。

图2 HPMC K4M用量对PT释放的影响(n=6)
乳糖用量:固定HPMC K4M的用量为片重的25%,以乳糖为填充剂,用量分别为片重的10%和20%,分别测定不同时间点PT颗粒的累积释放百分率。结果见图3。可见,随着乳糖用量的增加,药物释放加快,12 h时含20%的乳糖的PT颗粒释放量为80%,故本品选用20%的用量。
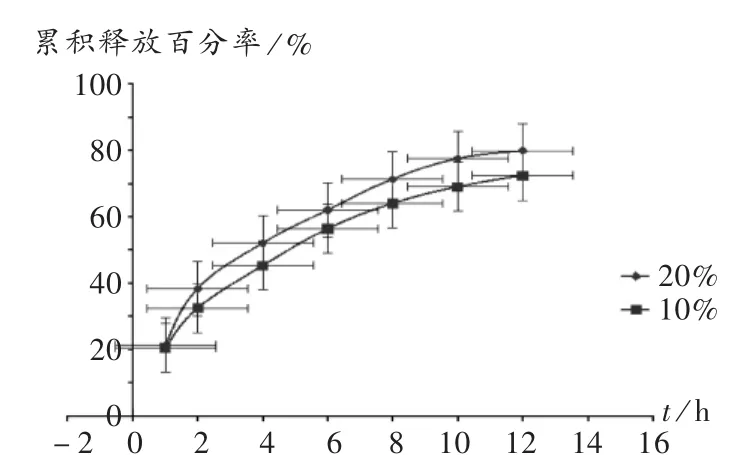
图3 乳糖用量对PT释放的影响(n=6)
2.1.3优选工艺
综合以上因素,拟订PT缓释颗粒的处方为:PT 250 mg,HPMC K4M 23 mg,乳糖77 mg。平行制备3批PT颗粒,并进行释放度考察,结果见图4。可见,缓释特性明显,重现性良好。

图4 PT颗粒体外释放度考察结果(n=3)
2.2TH缓释颗粒的制备及工艺优选
2.2.1制备工艺
取TH原料及辅料(过80目筛)混匀,以10%PVP K30的醇溶液(含醇量80%)为黏合剂,30目筛湿法制粒,60℃干燥1 h。
2.2.2正交试验优选处方
根据单因素考察结果,选取EC(因素A)、乳糖(因素B)及HPMC K4M(因素C)的用量(%)为影响因素,每个因素选取3个水平,见表1。以12 h的累积释放百分率(X,%)为评价指标,进行正交试验,结果见表2和表3。可见,3个因素对释药影响大小为B > C > A,最佳组合为A2B2C1。

表1 TH缓释颗粒处方优选正交试验因素水平

表2 TH缓释颗粒处方优选正交试验结果(n=5)
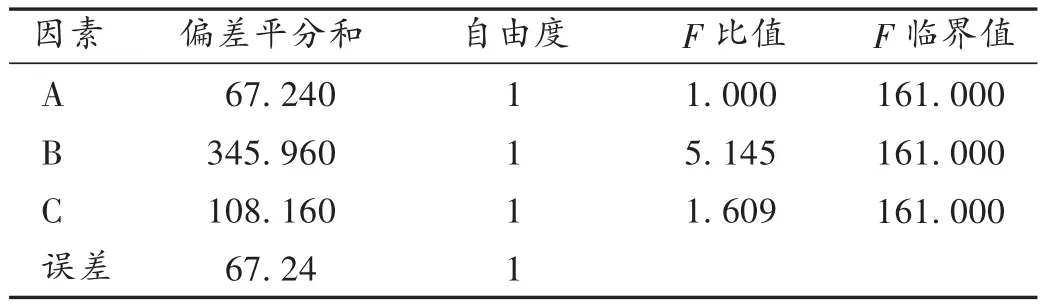
表3 TH缓释颗粒处方优选方差分析结果
2.3氨酚曲马多缓释片的制备
将PT及TH两种颗粒以一定的比例混合均匀,加1%硬脂酸镁混匀,压片即得(φ8 mm冲模),片重为每片0.4 g,每片含PT 250 mg,TH 60 mg。
2.4含量测定
2.4.1色谱条件[2]
色谱柱:YMC-C18柱(150 mm×4.6 mm,5 μm);流动相:甲醇-水-磷酸(22∶78∶0.1);检测波长:250 nm,流速:1.0 mL/min,进样量:20 μL,柱温:25℃。
2.4.2方法学考察
标准曲线与辅料干扰试验:精密称取105℃干燥至恒重的TH对照品12.6 mg和PT对照品44.7 mg加入100 mL的容量瓶中,加甲醇-水(1∶4,V∶V)混合溶剂溶解,稀释至刻度,摇匀,即得对照品贮备液;再精密吸取对照品贮备液2.0,4.0,6.0,8.0,10.0 mL,分别置25 mL容量瓶中,定容,摇匀,PT质量浓度分别为17.88,35.76,53.64,71.52,89.4 μg/mL,TH质量浓度分别为10.8,20.16,30.24,43.2,54 μg/mL。按处方比例称取各辅料,同法配制,0.45 μm微孔滤膜过滤后进样检测。结果见图5。以质量浓度(C,μg/mL)对峰面积(A)进行线性回归,得回归方程,TH为A=1.2× 105C-131 223(r=0.999 6),PT为A=3.7×105C + 132 478(r=0.999 4)。由图5可知,各辅料对主药的测定无干扰。

图5 高效液相色谱图
精密度试验:配制低、中、高3种质量浓度的对照品溶液(分别含TH10,30,54μg/mL,PT18,54,90μg/mL),分别在日内和日间重复测定,进行精密度考察。结果日内精密度的RSD PT为0.12%,0.19%,0.24%,TH为0.27%,0.32%,1.2%;日间精密度RSD PT为1.22%,0.83%,1.84%,TH为2.13%,1.46%,1.81%(n=3)。以上结果表明仪器精密度良好。
加样回收试验:取处方量辅料、PT及TH,按外标法测定含量,计算回收率。结果平均回收率TH为100.57%,RSD为0.27%(n=3);PT为99.26%,RSD为0.59(n=3)。
2.5体外释放度考察
分别取本品及市售氨酚曲马多片各6片,采用转篮法进行试验[3-4]。转速100 r/min,释放介质为0.1 mol/L 的HCl(37℃)900 mL,分别在1,2,4,6,8,10,12 h时定位取样5 mL(同时补加等量同温新鲜介质),取出的样品经0.45 μm微孔滤膜过滤,精密取续滤液1.0 mL稀释,摇匀,进样检测,并计算累积释放百分率。结果见图6,可见市售片中TH及PT释放均十分迅速,而本品中两种主药均具有明显缓释性。方程拟合结果见表4,由系数r可知,两种主药的体外释放符合一级释药模型,释药机制主要以扩散为主。
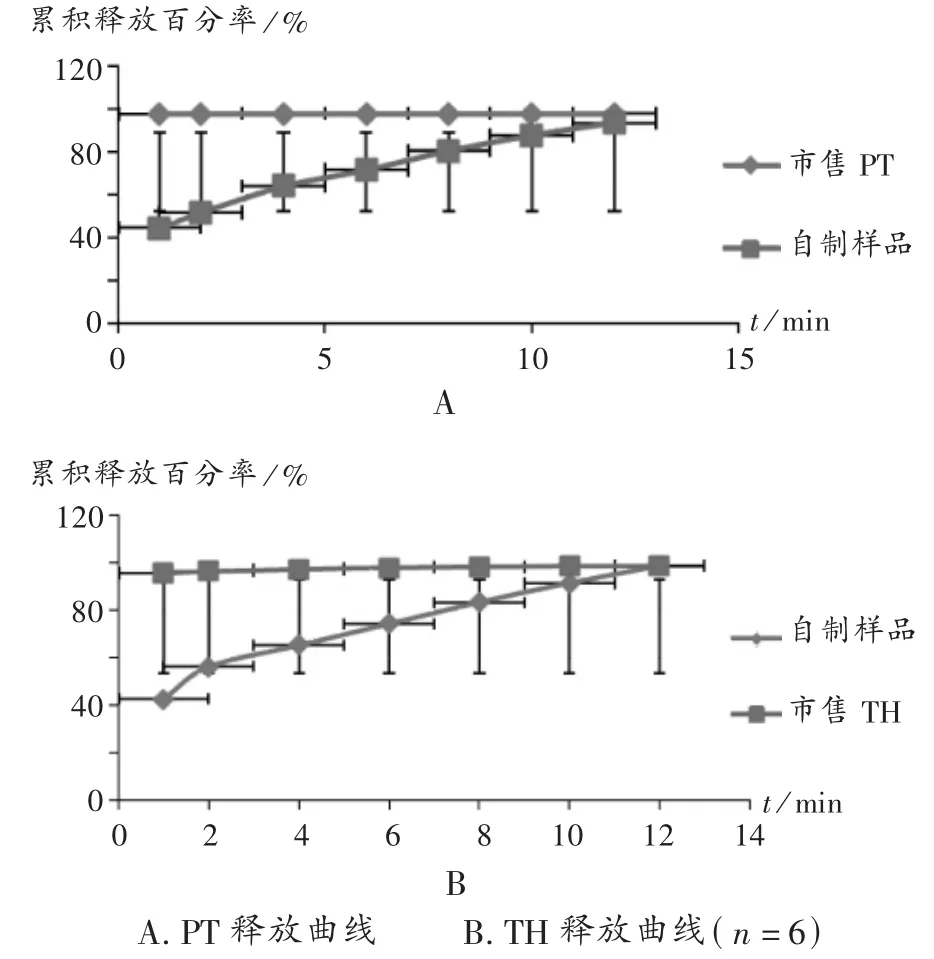
图6 氨酚曲马多缓释片及市售普通片的体外释药曲线
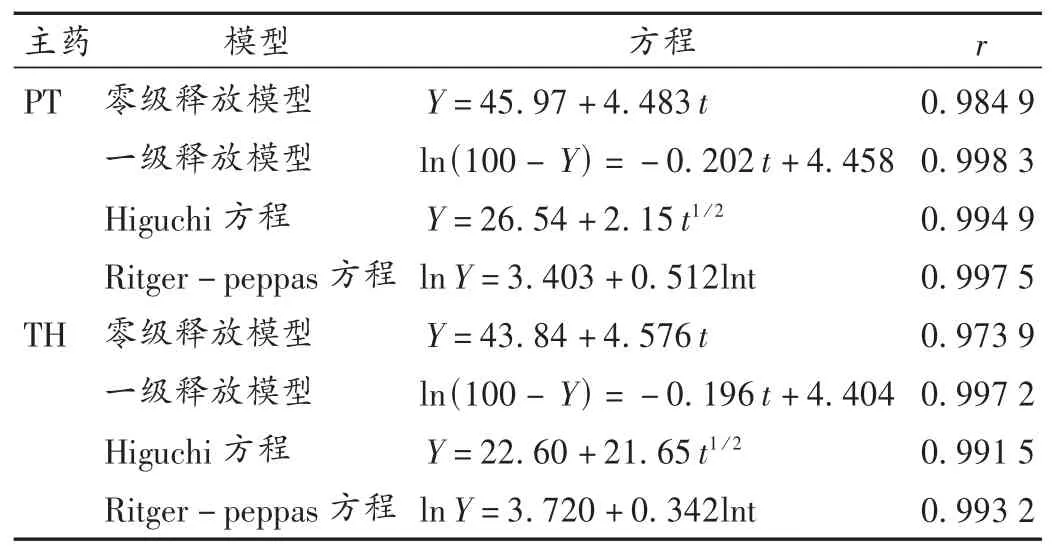
表4 氨酚曲马多缓释片体外释药的拟合方程
2.6一般质量检测
2.6.1外观检查
随机抽取自制样品20片,裸眼观察,本品为白色,片面无明显杂斑。
2.6.2硬度检查
将药片垂直固定在微调夹头与定头之间,待药片破碎时读取指示读数,重复6片。结果硬度在54.0~71.7 N。
2.6.3脆碎度检查
取本品20片,精密称重后置脆碎度测定仪中,振动4 min,除去细粉和碎粒,称重后与原药片重量比较。结果减重率为0.74%,符合规定(<0.80%)。
2.6.4片重差异检查
随机取药片20片,精密称定总质量,求得平均片重后,再分别精密称定各片质量,按药典规定0.3 g或0.3 g以上者片重差异限度为±5%。结果20片的平均片重为0.461 g,片重差异均在限度范围内。
3 讨论
对乙酰氨基酚为较难溶解的药物,故本品采用低黏度的HPMC作为骨架材料,制备其骨架颗粒,而盐酸曲马多水溶性较好,故考虑用难溶性的EC为骨架材料。体外释药试验结果表明,两种主药均具有较好的缓释性,可达到试验目的。
本试验中研制的氨酚曲马多缓释片与市售的普通片相比具有明显的缓释性。市售普通片释药太快,虽有利于迅速控制疼痛症状,但药效持续时间也过于短暂,患者需要频繁用药;而本品释药缓慢而持久,有利于减少给药频率,降低胃肠道刺激性,提高患者的依从性。建议临床可先用普通片迅速控制症状,再使用缓释片达到长效的目的[5]。
自制样品中两种主药的含量是参考普通片的含量而定的,根据其缓释性及临床用药特点,可进一步降低其含量。
参考文献:
[1]彭东明,黄可龙,刘艳飞,等.高效液相色谱法同时测定氨酚曲马多片中2种组分的含量[J].中国新药杂志,2006,15(2):120-122.
[2]杨静伟,刘晓放.HPLC法测定外用对乙酰氨基酚凝胶中对乙酰氨基酚的含量[J].黑龙江医药杂志,2007,20(3):198-199.
[3]国家药典委员会.中华人民共和国药典(二部)[M].北京:中国医药科技出版社,2010:附录28-附录73.
[4]黄丽萍.国家药品标准溶出度释放度测定方法研究[D].广州:广州中医药大学,2014.
[5]Nossols,Schwarzbold M,Stadles TH.先期投放市场用于治疗疼痛的曲马多缓释片,100、150、200 mg,3组剂量的售后调查研究[J].中国疼痛医学杂志,2000,6(1):59-63.
Preparation and in Vitro Drug Release of Paracetamol and Tramadol Hydrochloride Substained Release Tablets
He Wen1,Bo Gu1,2,Tan Yi2
(1.Renmin Hospital of Wuhan University,Wuhan,Hubei,China 430060;2.School of Pharmaceutical Science,Wuhan University,Wuhan,Hubei,China 430071)
Abstract:Objective To prepare paracetamol(PT)and tramadol hydrochloride(TH)sustained release tablets and study the in vitro drug release.Methods Hydroxypropyl methylcellulose(HPMC K4M)was used as the matrix to prepare PT granules,and ethyl cellulose (EC)combined with HPMC4M was applied as the matrix to prepare tramadol hydrochloride granules,and single factor investigation was used to optimize the granules.The above two granules were mixed in the proper proportion(respectively 250 mg and 60 mg per tablet)and compressed for the preparation of paracetamol and tramadol hydrochloride sustained release tablets.The quality of the tablets was investigated,and an HPLC method was used to determine the two drugs simultaneously.The in vitro release behavior of the sustained release tablets was studied using a basket method,and compared with that of the marketed common tablets.Results The quality of paracetamol and tramadol hydrochloride sustained release tablets met the requirements in Chinese pharmacopeia.The established HPLC method could be used for the simultaneous determination of the two drugs.The in vitro release behavior of the sustained release tablets fitted first-order equation,suggesting notable sustained release property when compared with that of the common tablets.Conclusion The preparation of paracetamol and tramadol sustained release tablets is simple with promising quality,reliable content determination method and notable sustained release property.
Key words:paracetamol;tramadol hydrochloride;sustained release tablets;preparation;in vitro drug release
中图分类号:TQ460.6;R971 +.1
文献标识码:A
文章编号:1006-4931(2016)07-0013-05
作者简介:何文,博士研究生,主任药师,研究方向为药物新制剂与新技术,(电子信箱)hwzxd@163.com;谈弋(1970-),硕士研究生,工程师,研究方向为药物新制剂与新技术,本文通讯作者,(电子信箱)tan@whu.edu.cn。
收稿日期:(2015-07-28)
