运动骨骼肌ERK1/2与mTOR通路关系的研究
2016-06-07王孝强曾凡星
王孝强,李 荀,曾凡星
(1.北京体育大学运动人体科学学院,北京100084;2.山东体育学院体育科学研究院,山东济南250102)
◀运动人体科学
运动骨骼肌ERK1/2与mTOR通路关系的研究
王孝强1,李 荀2,曾凡星1
(1.北京体育大学运动人体科学学院,北京100084;2.山东体育学院体育科学研究院,山东济南250102)
目的:通过阻断ERK1/2和mTOR通路,探讨运动中ERK1/2通路和mTOR通路在促进骨骼肌蛋白质合成中的关系。方法:7w龄SD雄性大鼠随机分为9组:安静对照组(C)、mTOR阻断组(R)、ERK1/2阻断组(P)、m TOR+ERK1/2阻断组(RP)、运动组(E)、运动mTOR阻断组(ER)、运动ERK1/2阻断组(EP)、运动+mTOR+ERK1/2阻断组(ERP)、DMSO组(D)。mTOR阻断干预组于运动前2h以1.5mg/kg剂量腹腔注射雷帕霉素,ERK1/2阻断干预组于运动前30m in以5mg/kg剂量腹腔注射PD98059,连续注射10d。于末次运动后6h取趾长伸肌,测定其湿重以及ERK1/2通路和mTOR通路信号分子的磷酸化表达。结果:与C组相比,R组趾长伸肌湿重减少了15.9%(P<0.01),P组未有显著变化,RP组减少了20.3%(P<0.01),E组增加了5.3%,但无显著性差异;与E组相比,ER组减少了16.1%(P<0.01),ERP组减少了19.8%(P<0.01),而EP组未有显著变化。与C组相比,P组mTOR通路的蛋白磷酸化表达均显著下降(P<0.01-0.05),R组MEK1/2的磷酸化表达增强(P<0.01),RP组ERK1/2通路和mTOR通路的磷酸化表达均显著下降(P<0.01-0.05),E组mTOR通路和ERK1/2通路的磷酸化表达显著升高(P<0.01-0.05)。与E组相比,EP组mTOR通路的蛋白磷酸化表达显著下降(P<0.01-0.05),而ER组ERK1/2通路的磷酸化表达未有显著变化,ERP组ERK1/2通路和mTOR通路的磷酸化表达均显著下降(P<0.01)。结论:在运动中mTOR通路和ERK1/2通路可协同促进骨骼肌蛋白质合成;并且ERK1/2通路位于mTOR通路的上游,可正向调节mTOR通路的活性。
运动;mTOR通路;ERK1/2通路;骨骼肌
mTOR通路与ERK1/2通路是骨骼肌蛋白质合成中较重要的信号通路。研究证实[1-8],运动可调控骨骼肌mTOR和ERK1/2通路,促进蛋白质合成。本实验拟采用大鼠腹腔注射mTOR通路阻断剂雷帕霉素(Rapamycin,Rapa)及ERK1/2通路阻断剂PD98059并结合中等强度运动,观察在运动条件下,骨骼肌mTOR通路及ERK1/2通路的变化,以探讨在运动中骨骼肌mTOR通路和ERK1/2通路的关系。
1 研究对象与方法
1.1 研究对象
7周龄SPF级SD雄性大鼠60只,体重(229.0 ±7.0)g,购于北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001。大鼠的饲养、训练均于北京体育大学实验动物中心内进行。分笼饲养,每笼4只,自由饮水、进食,以国家标准啮齿类动物常规饲料喂养。环境温度20~24℃,相对温度45%~55%,通风良好,昼夜12 h/12 h循环照明。
1.2 研究方法
1.2.1 实验分组
所有大鼠进行为期4 d的跑台适应性训练,休息3 d,适应性训练负荷设定如表1所示。随后随机分为9组,每组6只:①安静对照组(C):无任何干预,自由活动。②DMSO组(D):腹腔注射含10% DMSO的PBS溶液,自由活动。③mTOR阻断剂组(R):腹腔注射Rapa 10 d,自由活动。④ERK1/2阻断剂组(P):腹腔注射PD98059 10 d,自由活动。⑤mTOR+ERK1/2阻断剂组(RP):腹腔注射Rapa及PD98059 10 d,自由活动。⑥运动组(E):进行中等强度运动10 d。⑦运动+mTOR阻断剂组(ER):腹腔注射Rapa 10 d,同时进行中等强度运动10 d。⑧运动+ERK1/2阻断剂组(EP):腹腔注射PD98059 10 d,同时进行中等强度运动10 d。⑨运动+mTOR阻断剂+ERK1/2阻断剂组(ERP):腹腔注射Rapa及PD98059 10 d,同时进行中等强度运动10 d。

表1 大鼠适应性训练方案[9]

表2 大鼠分组
1.2.2 实验干预方案
1.2.2.1 运动方案 运动干预的大鼠进行为期10 d的中等强度跑台运动。运动方案为上坡跑,坡度10%,速度20 m/min,60 min/d。负荷设定参照国际通用的Bedford运动负荷标准[10]。
1.2.2.2 mTOR通路抑制剂给药方案 雷帕霉素(Rapamycin,Rapa),购于美国LC Laboratories(Wbbum,MA),为mTOR抑制剂,可与FK506结合蛋白FKBP12结合形成FKBP12-Rapamycin复合物,特异性地结合在mTOR的FRB结构域,并阻碍mTOR与Raptor结合,进而抑制mTOR生物活性[11]。将Rapa溶解于DMSO中,配制成储备液,于-20℃冰箱保存。注射时,用PBS稀释成注射液,进行腹腔注射,1.5 mg/kg(体重)[12],1次/d,连续注射10 d。注射Rapa并进行运动干预的大鼠(ER组、ERP组)在运动前2 h注射Rapa;注射Rapa的对照组大鼠(R组、RP组)在取样前9 h注射Rapa,以保证Rapa在对照组和运动组体内滞留相同的时间。
1.2.2.3 ERK1/2通路抑制剂给药方案PD98059,购于美国LC Laboratories(Wbbum,MA),是一种非ATP竞争的MEK1/2特异性抑制剂,能够特异性抑制MEK1/2介导的ERK1/2磷酸化激活。将PD98059溶解于DMSO中,配制成储备液,于-20℃冰箱保存。注射时,用PBS稀释成注射液,进行腹腔注射,5 mg/kg(体重),1次/d[13],连续注射10 d。注射PD98059并进行运动干预的大鼠(EP组、ERP组)在运动前30 min注射PD98059;注射PD98059的对照组大鼠(P组、RP组)在取样前7.5 h注射PD98059,以保证PD98059在对照组和运动组体内滞留相同的时间。
1.2.3 组织取样及处理
运动干预组大鼠于末次运动后6 h麻醉并取材,各相应对照组大鼠于用药相应时间后麻醉并取材。以3 m l/kg体重腹腔注射10%水合氯醛麻醉,行腹主动脉取血。取大鼠右侧完整趾长伸肌,去除肌腱及筋膜组织后称其湿重,分装并置于-80℃保存,用于Western Blot测定。
1.2.4 Western Blot测定
本实验采用Western Blot方法对p-mTORSer2448、p-p70S6KThr389、p-4EBP1Thr37/46、p-MEK1/2Ser217/221、p-ERK1/2T202/Y204、p-p90RSK Thr573蛋白进行测定。1)总蛋白提取:取100 mg趾长伸肌,于研钵内液氮环境下研磨成粉,置于EP管中,加入1 m l含有蛋白酶抑制剂、蛋白磷酸酶抑制剂及PMSF的RIPA裂解液,混匀,低温静置20 min后,于4℃,12000 r/min,离心15 min,取上清液,置于-80℃冰箱,备用。采用BCA试剂盒(碧云天生物技术有限公司)进行蛋白浓度测定。2)Western Blot:取40μg总蛋白,加入5×loading buffer,混匀后,100℃煮沸15 min。将样品加入到SDS-PAGE凝胶中,浓缩胶90 V,分离胶120 V,恒压电泳。采用半干式转膜法将蛋白转移至PVDF膜,根据膜面积以2 mA/cm2恒流转膜2 h。用5%BSA室温封闭1h后,加入浓度1:2 000-1:400的一抗p-mTOR(Ser2448)、p-p70S6K(Thr389)、p-4EBP1(Thr37/46)、p-MEK1/2(Ser217/221)、p-ERK1/2(T202/Y204)、p-p90RSK(Thr573)(Cell Signaling),GAPDH(6C5)(Santa curz),4℃过夜。TBST清洗后,加入适当浓度的二抗,室温孵育1 h。清洗后,与Super ECL底物发光液反应,X光胶片压片、曝光,经显影、定影后,用扫描仪扫描胶片。用Gel-Pro Analyzer软件测定条带光密度值。将目的条带与相应GAPDH光密度值的比值作为其蛋白的相对表达量;以各组的蛋白表达量与安静对照组的比值作为其蛋白的相对表达量。
1.2.5 统计学分析
应用SPSS 16.0软件进行数据统计分析。实验数据用平均数±标准差表示。属正态分布者,采用单因素方差分析(One-way ANOVA)进行组间比较,采用LSD方法进行组间多重比较(Post Hoc)分析。P<0.05表示有显著性差异,P<0.01表示有非常显著性差异。
2 结果
2.1 趾长伸肌湿重变化
如表3和图1所示,R组趾长伸肌湿重与C组相比显著下降,减少了15.9%(P<0.01)。RP组与C组相比减少了20.3%(P<0.01),与P组相比减少了18.7%(P<0.01),与R组相比无显著差异。P组、D组与C组相比均无显著性差异。
E组趾长伸肌湿重与C组相比上升了5.3%,无显著性差异。ER组与C组相比显著下降,减少了11.6%(P<0.01),与E组相比减少了16.1%(P<0.01),与R组相比无显著性差异。EP组与C组、E组、P组相比均无显著性差异。ERP组与C组相比显著下降,减少了15.5%(P<0.01),与E组相比减少了19.8%(P<0.01),与EP组相比减少了15.1%(P<0.01),与RP组、ER组相比无显著性差异。

表3 注射阻断剂及运动后各组趾长伸肌湿重
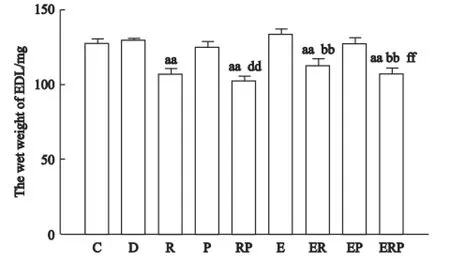
图1 注射阻断剂及运动后各组趾长伸肌湿重及MHC的变化
2.2 mTOR信号通路蛋白磷酸化的变化
如表4和图2所示,R组p-mTORSer2448、pp70S6KThr389、p-4EBP1Thr37/46蛋白表达量与C组相比显著下降,分别减少了51.1%(P<0.01)、29.7%(P<0.05)、39.1%(P<0.01)。表明注射Rapa后,mTOR通路活性受到抑制。P组p-mTORSer2448、pp70S6KThr389、p-4EBP1Thr37/46蛋白表达量与C组相比显著下降,分别减少了41.5%(P<0.01)、28.5%(P<0.05)、35.9%(P<0.05)。表明注射PD98059后,ERK1/2通路活性受到抑制。RP组与C组相比分别减少了57.1%(P<0.01)、68.0%(P<0.01)、46.4%(P<0.01),与P组相比分别下降了26.7%(P=0.054)、55.2%(P<0.01)、16.3%,与R组相比分别下降了12.2%、54.5%(P<0.01)、11.9%(P<0.01)。D组与C组相比无显著性差异。
E组p-mTORSer2448、p-p70S6KThr389、p-4EBP1Thr37/46蛋白表达量与C组相比分别增加了24.5%(P<0.05)、26.7%(P<0.05)、15.7%。ER组与E组相比分别减少了38.1%(P<0.01)、36.7%(P<0.01)、39.8%(P<0.01),与R组相比增加了57.8%(P<0.01)、14.3%、14.8%。EP组与E组相比减少了42.8%(P<0.01)、36.6%(P<0.01)、27.8%(P<0.05),与P组相比增加了21.7%(P=0.111)、12.5%、30.4%(P=0.164)。ERP组与E相比下降了59.4%(P<0.01)、61.1%(P<0.01)、47.6%(P<0.01),与ER组相比减少了34.4%(P<0.01)、38.4%(P<0.05)、12.9%,与EP组相比减少了28.9%(P<0.05)、38.6%(P<0.05)、27.5%(P=0.105),与RP组相比分别增加了18.6%、54.2%(P=0.182)、13.0%。
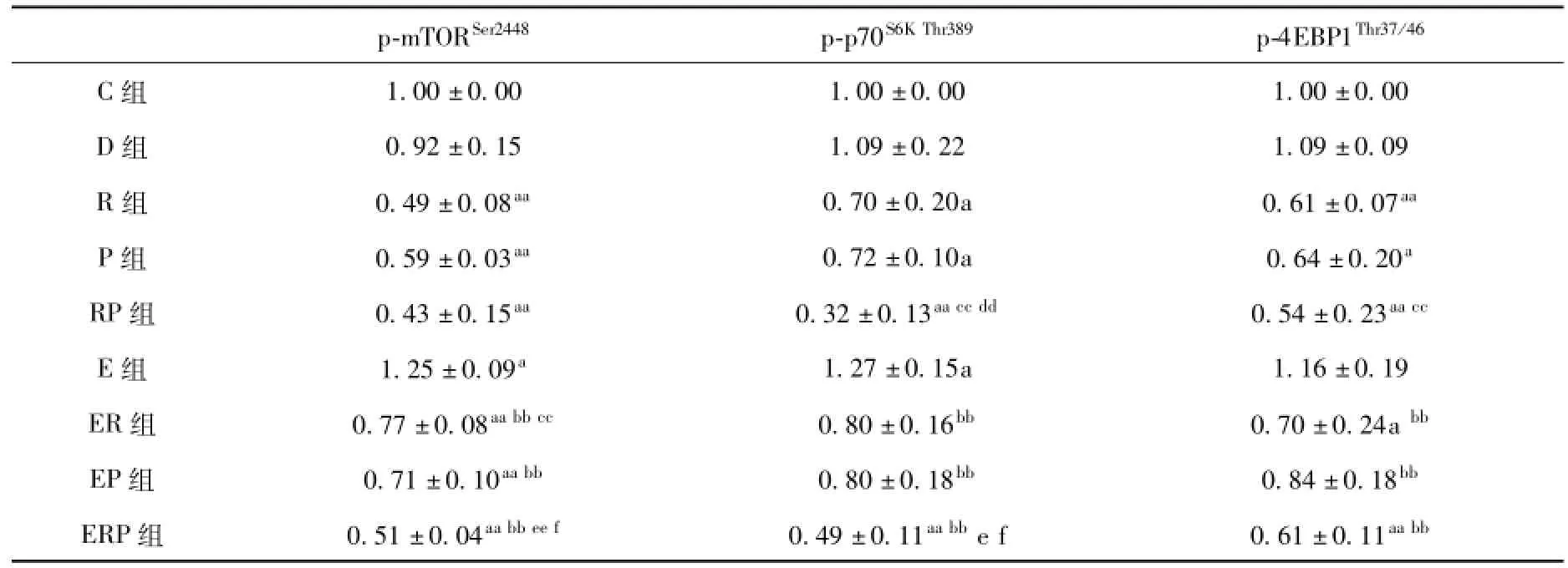
表4 各组趾长伸肌m TOR通路磷酸化蛋白的表达量

图2 各组趾长伸肌m TOR通路磷酸化蛋白表达量的变化
2.3 ERK1/2信号通路蛋白磷酸化的变化
如表6和图4所示,P组p-MEK1/2Ser217/221、p-ERK1/2T202/Y204、p-p90RSK Thr573蛋白表达量与C组相比减少了40.5%(P<0.01)、32.6%(P<0.05)、12.6%(P=0.288),表明注射PD98059后,骨骼肌ERK1/2通路受到抑制。R组与C组相比增加了44.6%(P<0.01)、22.1%(P=0.066)、3%。RP组与C组相比减少了59.4%(P<0.01)、52.9%(P<0.01)、27.0%(P<0.05),与R组相比下降了71.9%(P<0.01)、61.4%(P<0.01)、29.1%(P<0.05),与P组相比下降了31.8%(P=0.122)、30.2%(P=0.089)、16.4%(P=0.231)。D组与C组相比均无显著性差异。
E组p-MEK 1/2Ser217/221、p-ERK 1/2T202/Y204、pp90RSK Thr573蛋白表达量与C组相比增加了30.4%(P<0.05)、32.8%(P<0.01)、16.5%(P=0.171)。EP组与E组相比减少了8.5%、26.6%(P<0.05)、29.8%(P<0.01),与P组相比增加了98.9%(P<0.01)、44.6%(P<0.01)、-0.6%。ER组与E组、R组相比均无显著差异。ERP组与E相比下降了73.1%(P<0.01)、67.3%(P<0.01)、35.0%(P<0.01),与ER组相比减少了76.1%(P<0.01)、67.4%(P<0.01)、28.3%(P<0.05),与EP组相比减少了70.4%(P<0.01)、55.4%(P<0.01)、12.2%,与RP组相比均无显著性差异。
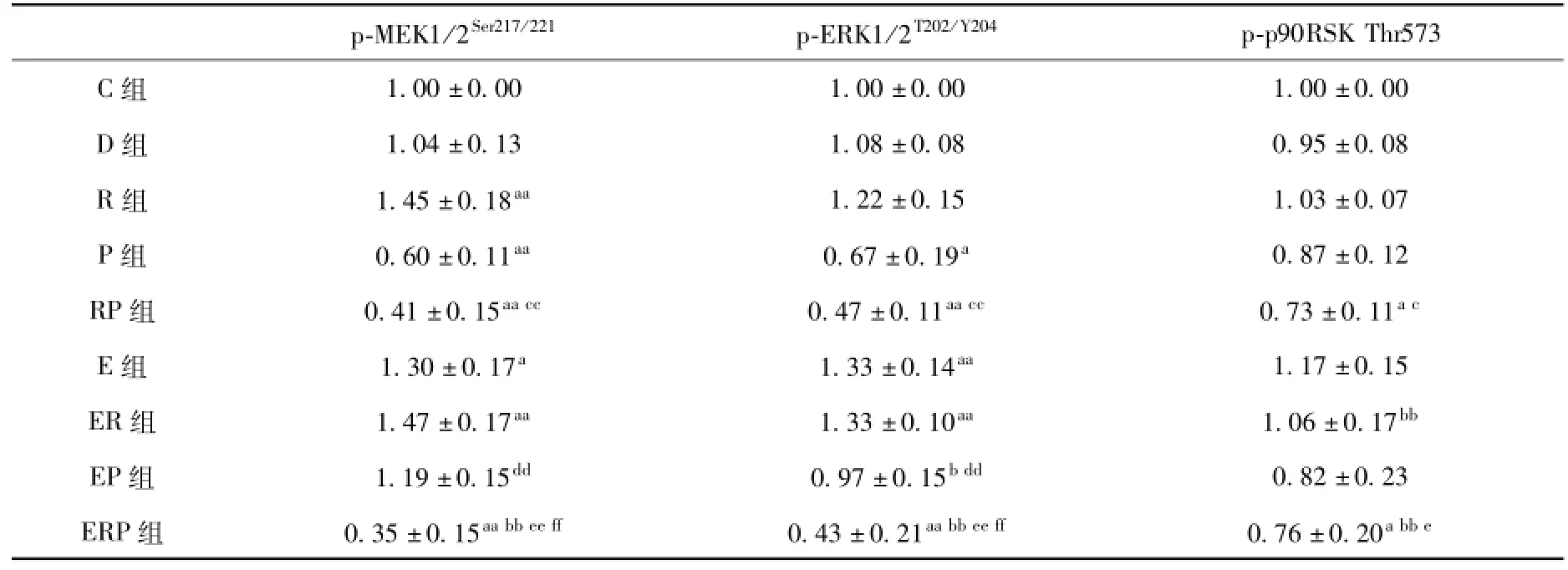
表6 各组趾长伸肌ERK1/2通路磷酸化蛋白表达量的变化
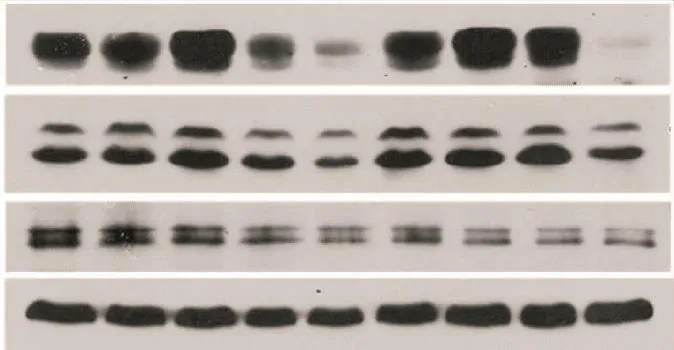
图4 各组趾长伸肌ERK1/2通路磷酸化蛋白表达量的变化
3 分析与讨论
3.1 mTOR通路、ERK1/2通路对运动骨骼肌湿重的影响
mTOR在调控骨骼肌蛋白质合成中居于核心地位[14],其主要通过磷酸化下游效应因子核糖体S6蛋白激酶(p70S6K)及真核起始因子4E结合蛋白(4EBP1),来调节下游蛋白质翻译。Rapa是一种mTOR活性抑制剂,本研究以1.5 mg/kg的剂量连续10 d腹腔注射Rapa后,发现mTORSer2448磷酸化与对照组相比下降了51.1%(P<0.01),其下游信号分子p70S6KThr389和4EBP1Thr37/46磷酸化也相应受到抑制,分别下降了29.7%(P<0.05)、39.1%(P<0.01),表明Rapa抑制了mTOR通路的活性。趾长伸肌湿重与对照组相比显著下降,减少15.9%(P<0.01),表明阻断mTOR可以抑制骨骼肌湿重增加。这与朱一力等[12]研究结果基本一致,以相同剂量腹腔注射雷帕霉素连续2w后,发现腓肠肌湿重与安静对照组相比下降20.27%(P<0.01)。
ERK1/2信号通路是MAPK家族成员,对于维持骨骼肌肌肉量是不可或缺的[15]。其主要由1个三级酶联功能单位构成,即Raf、MEK1/2、ERK1/2激酶依次被磷酸化激活,激活的ERK1/2进一步磷酸化其下游激酶,如P90核蛋白体S6激酶(ribosomal protein S6 kinase,RSK),或其下游核转录激活因子等,进而发挥其生物学作用。PD98059是ERK1/2通路的抑制剂。本实验以5 mg/kg的剂量连续10 d腹腔注射PD98059后,发现p-MEK1/2 Ser217/221下降了40.5%(P<0.01),p-ERK1/2T202/Y204下降了32.6%(P<0.05),表明PD98059抑制了ERK1/2通路的活性。其趾长伸肌湿重与对照组相比下降了2.0%,且比单纯注射Rapa组下降幅度小,表明ERK1/2通路对趾长伸肌湿重的影响较mTOR通路小。本实验对大鼠进行Rapa和PD98059联合用药,发现趾长伸肌湿重比两者单独用药时下降幅度大,并且其下降百分比不是两者单独阻断时之和,而是小于两者之和,提示mTOR通路和ERK1/2通路对趾长伸肌湿重的影响呈现出协同作用。
众多研究表明[1-6],运动可以激活mTOR通路和ERK1/2通路。本研究也发现,运动后mTOR通路、ERK1/2通路活性显著升高,骨骼肌蛋白质合成增加,趾长伸肌湿重增加了5.3%。而当阻断mTOR通路或ERK1/2通路后进行运动,发现运动不能诱导骨骼肌蛋白质合成增加,表明在运动引起的骨骼肌蛋白质合成增加的过程中,mTOR通路和ERK1/2通路起到重要的作用。与此同时,本实验对运动干预大鼠进行Rapa和PD98059联合用药,发现趾长伸肌湿重比两者单独用药时下降幅度大,并且小于两者下降幅度之和,提示在运动时mTOR通路和ERK1/2通路对骨骼肌的影响呈现出协同作用。
3.2 阻断ERK1/2通路对运动骨骼肌mTOR通路的影响
细胞的每条信号通路之间并非决然独立分开,往往存在交互对话,即“Cross Talk”。ERK1/2和mTOR通路是促进骨骼肌蛋白质合成中较为重要的信号通路,两者之间也存在着密切的联系。研究显示[16],mTOR信号通路和ERK1/2信号通路经一系列不同的途径,最终作用于eIF4B,共同促进蛋白质合成;并且mTOR下游蛋白p70S6K和ERK1/2下游蛋白p90RSK都能直接作用于S6蛋白,两者所不同的是激活S6蛋白的磷酸化位点不同[17]。此外,在对小鼠癌症模型的研究中已证实,mTOR通路的抑制剂和ERK1/2通路的抑制剂可以协同方式作用,抑制肿瘤生长[18]。也有研究发现,p70S6K受到ERK1/2通路的影响,Wang等[19]在对心肌细胞施加ERK1/2直接上游信号MEK1/2的抑制剂时,发现p70S6K的活性受到影响;而当MEK1/2持续激活时,p70S6K也表现出持续激活。由此推断,ERK1/2通路可正向调节mTOR通路活性。
本研究在注射PD98059后,发现骨骼肌mTOR、p70S6K和4EBP1磷酸化水平也显著下降,表明抑制ERK1/2通路也抑制了mTOR通路活性;而在此基础上同时注射雷帕霉素,mTOR、p70S6K和4EBP1磷酸化水平下降幅度更大,表明雷帕霉素可以加强对mTOR通路的抑制作用。提示在骨骼肌中,ERK1/2通路位于mTOR通路的上游,且可正向调控mTOR通路。在运动条件下注射PD98059后,发现骨骼肌mTOR、p70S6K和4EBP1磷酸化水平与运动组相比显著下降,表明在运动条件下,抑制ERK1/2通路也可抑制mTOR通路活性;同样在此基础上同时注射雷帕霉素,加强对mTOR通路的抑制作用。由此推断,ERK1/2通路对mTOR通路的正向调节作用,在运动骨骼肌也得以证实。
3.3 阻断mTOR通路对运动骨骼肌ERK1/2通路的影响
近来研究发现,抑制mTOR活性可通过负反馈方式激活ERK1/2通路;在mTOR活化时,会相应抑制ERK1/2通路。有研究对乳腺癌大鼠应用mTOR抑制剂雷帕霉素,发现雷帕霉素可诱导ERK1/2磷酸化水平升高[20];在应用雷帕霉素治疗肿瘤患者时,其肿瘤样本的ERK1/2磷酸化水平也明显升高[21]。有研究者在对结节硬化症细胞应用mTOR抑制剂雷帕霉素也发现[22],应用雷帕霉素可抑制mTOR,进而消除mTOR对ERK1/2通路的抑制作用,表现为ERK1/2通路的激活;当同时应用ERK1/2通路抑制剂PD98059时,ERK1/2通路的活化现象减弱。ERK1/2通路因mTOR抑制而激活也是由于p70S6K抑制和PI3K激活而导致[21]。也有研究表明,雷帕霉素可增强ERK1/2磷酸化水平与细胞类型有关,并且需要雷帕霉素较长的时间作用[20]。
本研究在注射Rapa后,发现MEK1/2、ERK1/2磷酸化水平增加,ERK1/2通路活性增高,表明抑制mTOR可解除mTOR对ERK1/2通路的抑制作用。进而激活ERK1/2通路。而在此基础上同时注射PD98059、MEK1/2、ERK1/2和p90RSK磷酸化水平下降,ERK1/2通路活性下降,表明PD98059可削弱因抑制mTOR导致的ERK1/2通路的活化作用。在运动时注射Rapa发现骨骼肌MEK1/2、ERK1/2和p90RSK磷酸化水平与单纯运动组相比未有显著变化,表明在运动条件下抑制mTOR通路并未显著激活ERK1/2通路。在此基础上同时注射PD98059,骨骼肌MEK1/2、ERK1/2和p90RSK磷酸化与单纯注射雷帕霉素显著下降,表明PD98059抑制了运动引起的ERK1/2通路的活性增强。
4 结论
1)mTOR通路和ERK1/2通路可协同促进骨骼肌蛋白质合成。
2)阻断ERK1/2通路可抑制运动骨骼肌mTOR通路活性,在此基础上阻断mTOR通路,两者具有协同抑制作用由此证实,ERK1/2通路位于mTOR通路的上游,可正向调节mTOR通路活性。
[1]Taylor LW,Wilborn C D,Kreider R B,et al.Effects of resistance exercise intensity on extracellular signal-regulated kinase1/2 mitogen-activated protein kinase activation in men[J].The Journal of Strength&Conditioning Research,2012,26(3):599-607.
[2]Burd N A,Holwerda AM,Selby K C,et al.Resistance exercise volume affects myofibrillar protein synthesis and anabolic signalling molecule phosphorylation in young men[J].The Journal of Physiology,2010,588(16):3119-3130.
[3]Tannerstedt J,ApróW,Blomstrand E.Maximal lengthening contractions induce different signaling responses in the type Iand type II fibers of human skeletal muscle[J].Journal of Applied Physiology,2009,106(4):1412-1418.
[4]Moore DR,Atherton P J,Rennie M J,et al.Resistance exercise enhances mTOR and MAPK signalling in human muscle over that seen at rest after bolus protein ingestion[J].Acta Physiologica,2011,201(3):365-372.
[5]Dreyer H C,Fujita S,Glynn E L,et al.Resistance exercise increases leg muscle protein synthesis and mTOR signalling independent of sex[J].Acta Physiologica,2010,199(1):71-81.
[6]Goodman C A,Frey JW,Mabrey D M,et al.The role of skeletal muscle mTOR in the regulation of mechanical load-induced growth[J].The Journal of Physiology,2011,589(22):5485-5501.
[7]李荀,曾凡星,吴迎.AR阻断剂对运动骨骼肌ERK1/2信号通路的影响[J].北京体育大学学报,2015(2):48-53.
[8]李荀,李俊涛,曾凡星.AR阻断剂对运动骨骼肌mTOR信号通路的影响[J].中国运动医学杂志,2015,34(2):134-141.
[9]曾凡星,朱晗,赵华.PI3K阻断剂对大鼠运动骨骼肌Akt/mTOR信号的影响[J].北京体育大学学报,2010,33(11):46-49.
[10]Bedford TG,Tipton CM,Wilson N C,et al.Maximum oxygen consumption of rats and its changes with various experimental procedures[J].Journal of Applied Physiology,1979,47(6):1278-1283.
[11]Sengupta S,Peterson T R,Sabatini D M.Regulation of the mTOR complex1 pathway by nutrients,growth factors,and stress[J].Molecular Cell,2010,40(2):310-322.
[12]朱一力.骨骼肌mTOR信号通路在运动后变化规律及对蛋白合成调控机制[D].北京:北京体育大学,2008.
[13]Marques C A,Hähnel P S,Wölfel C,et al.An immune escape screen reveals Cdc42 as regulator of cancer susceptibility to lymphocyte-mediated tumor suppression[J].Blood,2008,111(3):1413-1419.
[14]Bodine SC,Stitt T N,Gonzalez M,et al.Akt/mTOR pathway is a crucial regulator of skeletal muscle hypertrophy and can prevent muscle atrophy in vivo[J].Nature Cell Biology,2001,3(11):1014-1019.
[15]ShiH,Scheffler JM,Zeng C,etal.Mitogen-activated protein kinase signaling is necessary for the maintenance of skeletal muscle mass[J].American Journal of Physiology-Cell Physiology,2009,296(5):C1040-C1048.
[16]Shahbazian D,Roux P P,Mieulet V,et al.The mTOR/PI3K and MAPK pathways converge on eIF4B to control its phosphorylation and activity[J].The EMBO Journal,2006,25(12):2781-2791.
[17]Roux P P,Shahbazian D,Vu H,et al.RAS/ERK signaling promotes site-specific ribosomal protein S6 phosphorylation via RSK and stimulates cap-dependent translation[J].Journal of Biological Chemistry,2007,282(19):14056-14064.
[18]Carracedo A,Baselga J,Paolo Pandolfi P.Deconstructing feedbacksignaling networks to improve anticancer therapy with mTORC1 inhibitors[J].Cell Cycle,2008,7(24):3805-3809.
[19]Wang L,Gout I,Proud C G.Cross-talk between the ERK and p70 S6 kinase(S6K)signaling pathways MEK-dependent activation of S6K2 in cardiomyocytes[J].Journal of Biological Chemistry,2001,276(35):32670-32677.
[20]Saito T,Kinoshita S,Fujii T,et al.Development of novel steroid sulfatase inhibitors:II.TZS-8478 potently inhibits the growth of breast tumors in postmenopausal breast cancer model rats[J].The Journal of Steroid Biochemistry and Molecular Biology,2004,88(2):167-173.
[21]Gamage N,Barnett A,Hempel N,et al.Human sulfotransferases and their role in chemical metabolism[J].Toxicological Sciences,2006,90(1):5-22.
[22]米蕊芳.联合阻断mTOR和ERK/MAPK信号通路抑制结节硬化症细胞增殖[D].中国协和医科大学,2009.
责任编辑:郭长寿
Relationship Between mTOR and ERK1/2 Pathway in Rat’s Skeletal Muscle During Exercise
WANG Xiaoqiang1,LI Xun2,ZENG Fanxing1
(1.Sport Science College,Beijing Sport University,Beijing 100084,China;2.Sport Science Research Center,Shandong Sport University,Jinan 250102,Shandong,China)
Objective:The study is to investigate the relationship between mTOR and ERK1/2 pathway in promoting skeletal muscle protein synthesis during exercise by blocking the ERK1/2 and mTOR pathway.Methods:54 7w-old male SD rats were randomly divided into 9 groups:control group(C),blocking mTOR group(R),blocking ERK1/2 group(P),blocking m TOR and ERK1/2 group(RP),exercise group(E),exercise+blocking m TOR group(ER),exercise+blocking ERK1/2 group(EP),exercise+blocking m TOR and ERK1/2 group(ERP);DMSO group(D).Rats that were blocked mTOR pathway were injected intraperitoneally(i.p.)with 1.5mg/kg/d of Rapamycin at2h before exercise;and rats that were blocked ERK1/2 pathway,were injected i.p.5mg/kg/d of PD98059 at 30m in before exercise.After 10 days,Extensor Digitorum Longus(EDL)was isolated at 6 h after last exercise.The protein phosphorylation expression of m TOR,p70S6K,4EBP1,MEK1/2,ERK1/2 and p90RSK of EDL was examined by western blotting analysis.All data were analyzed using SPSS 16.0 statistical software.Results:Com pared with C group,the wet weight of EDL in R group was reduced by 15.9%(P<0.01),but not in Pgroup,and decreased by 20.3%(P<0.01)in RP group and 5.3%in E group;Compared with E group,the wet weight of EDL in ER group decreased by 16.1%(P<0.01),and decreased by 19.8%(P<0.01)in ERP group,while the EP group had no significant change.Compared with C group,the phosphorylation expression of m TOR pathway in P group was significantly decreased(P<0.01-0.05),and the phosphorylation of MEK1/2 in R group was enhanced(P<0.01).Exercise can activate phosphorylation of mTOR pathway and ERK1/2 pathway(P<0.01-0.05).Com pared with E group,the protein phosphorylation of mTOR pathway in EP group was significantly decreased(P<0.01-0.05),but the phosphorylation expression of ERK1/2 pathway in ER group had no significant change,and ERK1/2 pathway and mTOR pathway were significantly decreased(all P<0.01).Conclusion:Exercise-induced protein synthesis of skeletal muscle can be affected by mTOR and ERK1/2 pathway,and ERK1/2 pathway may belocated in the upstream of them TOR pathway,which can positively regulate the activity of the mTOR pathway during exercise.
exercise;m TOR Pathway;ERK1/2 Pathway;skeletal muscle
G804.21
A
1004-0560(2016)05-0049-07
2016-08-26;
2016-09-21
国家自然科学基金项目(31071034)。
王孝强(1987—),男,博士研究生,主要研究方向为运动生理学。
曾凡星(1956—),男,教授,博士生导师,主要研究方向为体育运动中内分泌变化及适应机制。
