吗啡与gp120致大鼠学习记忆障碍的作用及机制*
2016-06-06陈桂玲刘思思江明亮行妍妍林丽清
陈桂玲, 龚 正, 刘思思, 江明亮, 潘 锐, 行妍妍, 林丽清, 董 军△
( 暨南大学 1医学院病理生理学系, 2国家中医药管理局病理生理学实验室, 3粤港澳中枢神经再生研究院,4附属第一医院骨科, 广东 广州 510632)
吗啡与gp120致大鼠学习记忆障碍的作用及机制*
陈桂玲1,2,3▲,龚正1,2,3▲,刘思思1,2,3,江明亮1,2,3,潘锐4,行妍妍1,2,3,林丽清1,2,3,董军1,2,3△
( 暨南大学1医学院病理生理学系,2国家中医药管理局病理生理学实验室,3粤港澳中枢神经再生研究院,4附属第一医院骨科, 广东 广州 510632)
[摘要]目的: 探讨吗啡与gp120致大鼠学习记忆障碍的作用与机制。方法: 4~6周的SD大鼠,侧脑室注射吗啡与gp120 V3环,Morris水迷宫评价空间记忆能力。TUNEL染色观察大鼠海马组织的阳性凋亡细胞数。Western blot法检测p-ERK的表达情况。结果: 与对照组相比,100 μg/kg吗啡组、200 μg/kg吗啡组以及gp120 V3环组均能使大鼠的逃避潜伏期延长(P<0.05),目标象限停留时间以及穿越目标象限次数减少(P<0.05),海马区阳性细胞数增多(P<0.01),海马区p-ERK的表达增多(P<0.01);200 μg/kg吗啡+gp120 V3环组与200 μg/kg吗啡组或gp120 V3环组相比,逃避潜伏期延长(P<0.05),目标象限停留时间以及穿越目标象限次数减少(P<0.05),海马区阳性细胞数增多(P<0.01),海马区p-ERK的表达增多(P<0.01)。结论: 侧脑室注射gp120 V3环可致大鼠学习与记忆障碍,吗啡能增强其效应,机制可能与增强海马区p-ERK的表达有关。
[关键词]HIV相关神经认知障碍; 吗啡; HIV-1 gp120 V3环; 海马神经元; 细胞凋亡
艾滋病是当今人类最具灾难性的流行病之一。截至2013年底,全球感染人类免疫缺陷病毒(human immunodeficiency virus,HIV)人数已超过3 500万[1]。HIV-1病毒感染不仅对外周免疫系统造成损伤,在很大程度上对神经认知功能的丧失也有影响。尽管高效抗逆转录疗法(highly active antiretroviral therapy, HAART)的应用有效降低了艾滋病患者的死亡率,但由于其在血脑屏障中的渗透性差[2],生物利用度低,因此HIV相关神经认知障碍(HIV-associated neurocognitive disorders,HAND)的患者明显增多。流行病学数据显示,大约有50%的HIV-1阳性患者伴随着神经认知功能障碍的发生。
大量研究证明,毒品滥用者更容易感染HIV,更有可能遭受神经功能异常和其它机会性感染[3]。吗啡是全球最流行的毒品海洛因的脑内代谢物,脑室内浓度极高[4]。然而,吗啡与HIV联用致神经系统损伤的机制尚未阐明。
本实验拟通过侧脑室注射吗啡与HIV-1 gp120 V3环(以下简称gp120 V3环),观察大鼠的行为学以及海马神经元形态的改变,旨在探讨gp120 V3环与吗啡联用致大鼠学习记忆障碍的作用及其机制。
材料和方法
1动物
200只SD大鼠,雌雄各半,4~6周龄,体重120~160 g,购自广东省实验动物中心[合格证号: SCXK(粤)2008-0002,粤监证字:2008A015]。实验第一部分分为对照组、假手术组、10 μg/kg吗啡组、100 μg/kg 吗啡组和 200 μg/kg 吗啡组;第二部分分为对照组、假手术组、gp120 V3环组、吗啡组和gp120 V3环+吗啡组。每部分大鼠各100只,随机分为5组(每组20只),实验程序通过暨南大学实验动物伦理委员会严格审查。
2主要试剂
gp120 V3环购自Raybiotech;吗啡购自沈阳第一制药厂;人工脑脊液配方(mmol/L):124.0 NaCl,3.0 KCl,2.0 CaCl2,2.0 MgCl2,1.25 NaH2PO4,26.0 NaHCO3,10.0 glucose。
3主要方法
3.1 立体定位手术与侧脑室注射腹腔注射40 mg/kg的戊巴比妥钠麻醉大鼠,并将其固定于立体定位仪上。在前囟向后1.0 mm,中线左或右旁开1.5 mm处放置一根聚乙烯塑料管,植入颅骨下4.0 mm处,用502胶及牙托粉充分固定。术后4只大鼠因手术意外被剔出实验。 62.5万 U/kg青霉素钠肌肉注射3 d。手术恢复4~5 d后,开始侧脑室注射给药。给药过程中固定大鼠,自脑表皮垂直将微量进样器针深入塑料管3.5~4.0 mm,假手术组给予人工脑脊液 5 μL,gp120 V3环组大鼠给予50 ng/d(5 μL) 剂量药物,吗啡组给予低(10 μg/kg)、中(100 μg/kg)、高(200 μg/kg)剂量,gp120 V3环+吗啡组给予gp120 V3环(50 ng/d)和200 μg/kg吗啡(gp120 V3环与吗啡均溶于5 μL 人工脑脊液),均注入侧脑室,留针5 min,给药速度为1 μL/min,以保证溶液充分弥散,然后缓慢撤针。连续给药3 d,每天1次,均为上午10时左右给药,第4天行水迷宫测试。对照组未经任何手术处理。吗啡剂量参考文献执行[5-6]。
3.2Morris水迷宫实验定位航行实验(place navigation)测量大鼠学习记忆的能力:实验历时5 d,第1 天让大鼠自由游泳2 min,然后选择N象限中点为第1入水点,将大鼠面向池壁放入水中,观察并记录大鼠寻找并爬上平台所需时间 (逃避潜伏期)。随后按照北(north,N)-东(east,E)-南(south,S)-西(west,W)的顺序将训练大鼠逐一放入水池,训练第2天将E象限中点作为第一入水点,按照E-S-W-N顺序逐一将大鼠放入水池中,第3天将S象限中点作为第一入水点,按照S-W-N-E顺序逐一将大鼠放入水池,第4、5天依次类推。训练过程中,如果大鼠在60 s内未找到平台,需将其引至平台休息30 s,这时潜伏期记录为60 s。 空间搜索实验(spatial probe test)测量大鼠学会寻找平台后,对平台空间位置记忆能力:选用目标象限(平台所在象限)的逗留时间和穿越目标象限的次数作为测试参数。定位航行实验结束后撤除平台,然后在S象限的同一入水点将大鼠面向池壁放入水中,利用检测跟踪系统对其游泳过程进行监控,记录其在60 s内的游行轨迹。
3.3原位末端标记法(TdT-mediated dUTP nick-end labeling,TUNEL)染色冰冻切片的TUNEL染色按说明书步骤进行。首先,切片用4%多聚甲醛固定10 min,用PBS冲洗2 次;然后,加TUNEL反应液37 ℃避光孵育1 h。阴性对照组未加入TdT。接着加TdT终止缓冲液终止反应,PBS冲洗2 次。最后放入荧光素标记的抗鼠抗体中孵育。每只动物取5张切片并进行阳性细胞计数。
3.4Western blot实验取100 mg大鼠海马组织,提取各组蛋白,BCA法蛋白定量。定量后的蛋白与5×上样缓冲液混匀后煮沸变性,约5~10 min。使用8%或者15%的SDS-PAGE分离蛋白,再转移到PVDF膜上,转膜条件15~30 V,时间20~40 min。BSA室温封闭1 h,I 抗4 ℃孵育过夜,II 抗室温孵育1 h,DAB显色,灰度扫描做定量分析。
4统计学处理
采用SPSS 13.0软件进行数据分析,结果数据以均数±标准误(mean±SEM)表示,各组间比较行单因素方差分析(one-way ANOVA),各组方差齐时,组间两两比较采用SNK法,各组方差不齐时,采用Tamhane’s T2法。以P<0.05为差异有统计学意义。
结果
1不同剂量吗啡对大鼠定位航行实验及空间探索实验的影响
日间对比发现,组间大鼠的自发活动没有差异(数据未显示),期间引导大鼠进行行为学实验。到第2~5天,在一个隐藏平台的水迷宫受训实验中,吗啡100 μg/kg组和200 μg/kg组大鼠的逃避潜伏期延长,出现学习障碍。空间探索实验中,大鼠受训24 h后,吗啡 100 μg/kg组和200 μg/kg组大鼠的穿越目标象限的次数与停留时间减少,差异有统计学显著性(P<0.05);但是吗啡10 μg/kg组与对照组相比差异不大。提示吗啡能降低空间学习能力,见图1A~C。

Figure 1.Rat showed impaired spatial learning and recognition after treated with morphine and/or gp120 V3 loop. A: the latency to escape the hidden platform in the rats treated with morphine at different doses; B: probe tests for frequency of crossing target quadrant in the rats treated with morphine at different doses; C: probe tests for retention time in target quadrant in the rats treated with morphine at different doses; D: the latency to escape the hidden platform in the rats treated with morphine and/or gp120 V3 loop; E: probe tests for frequency of crossing target quadrant in the rats treated with morphine and/or gp120 V3 loop; F: probe tests for retention time in target quadrant in the rats treated with morphine and/or gp120 V3 loop.Mean±SEM. n=20.*P<0.05 vs control group;##P<0.05vsgp120 V3 loop group or 200 μg/kg morphine group.
图1吗啡和gp120 V3环使大鼠学习与认知能力减弱
2吗啡与gp120 V3环致大鼠空间以及学习记忆障碍的改变
为了模拟滥用药物的HAND患者的学习以及空间记忆障碍,我们采用了吗啡的最大容许剂量(200 μg/kg)来进行第二部分的实验。结果显示,gp120 V3环组大鼠的逃避潜伏期延长,穿越目标象限与停留时间减少,出现学习以及空间记忆障碍,gp120 V3 环+ 200 μg/kg 吗啡组与吗啡或gp120 V3 环单独组相比逃避潜伏期更长,停留目标象限时间更短,差异有统计学显著性(P<0.05),见图1D~F。
3吗啡与gp120 V3环诱导的大鼠海马组织形态学的改变
由图2可看出,海马组织中,吗啡组与gp120 V3环组TUNEL阳性细胞数高于对照组(P<0.01),吗啡+gp120 V3环组TUNEL阳性细胞数比吗啡或gp120 V3环单独组高(P<0.01),提示吗啡能增强gp120 V3环的诱导海马神经元凋亡的毒性。
4吗啡和gp120 V3环诱导大鼠海马组织的细胞外信号调节激酶(extracellular signal-regulated kinases,ERK)的磷酸化
吗啡组和gp120 V3 环组的 p-ERK 蛋白水平较对照组增高,与对照组相比差异有统计学显著性(P<0.01),吗啡+gp120 V3 环组的p-ERK 蛋白水平比吗啡或gp120 V3环单独组增高,差异有统计学显著性(P<0.01),表明吗啡和gp120 V3环激活了 ERK 信号通路。吗啡与 gp120 V3环联用对 ERK激活作用强于单用,见图3。
讨论
在HAART广泛应用以前,HAND的平均患病率为55%。其最严重形式HIV相关痴呆症(HIV-associated dementia,HAD)的患病率为20%~30%,每年发病率为7%[7]。另外,HAD/HAND的发病率和严重性的上升和加重与滥用可卡因、大麻以及麻黄碱[8]密切相关。
吸食吗啡一直以来都是一个严重社会卫生问题。吗啡是一种阿片样肽,前期报导称内源性的多肽类物质能影响中枢神经系统的发育[9],通过促进神经元的存活、影响神经元以及胶质细胞的增殖、神经元的迁移、树突的生长以及脊髓的形成[10]。离体神经元培养中,低剂量的吗啡对血清剥夺以及十字孢碱产生的神经毒素具有保护性,长期应用低剂量的吗啡可能利于细胞的存活[11]。然而Turchan-Cho-lewo等[12]发现HIV感染者合并鸦片滥用以及ApoE4等位突变能增加患痴呆的风险。原代海马神经元体外实验表明,高浓度的吗啡有更强的神经毒性[13],因为吗啡能杀死高度敏感的神经元件[14]。

Figure 2.TUNEL positive cells in the hippocampal zone of the rats treated with morphine and/or gp120 V3 loop. The scale bar=100 μm. Mean±SEM. n=10.**P<0.01 vs control group;##P<0.01 vs gp120 V3 loop group or 200 μg/kg morphine group.
图2大鼠海马区域的TUNEL阳性细胞数的比较
gp120是HIV中最高效的神经毒性成分之一。在大脑组织中,HIV能在感染的巨噬细胞/小胶质细胞中增殖并释放HIV蛋白如gp120、Tat等,这些蛋白可与多巴胺转运体结合并削弱其功能,引起神经元损伤,从而参与HAND的发病机制。另外,有研究证实,gp120 转基因鼠可造成神经元的缺失以及树突的减少[15]。
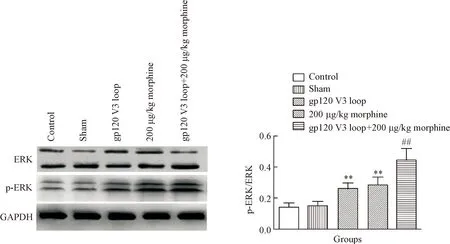
Figure 3.Morphine and/or gp120 V3 loop induced phosphorylation of ERK in the hippocampus determined by Western blot analysis. Mean±SEM. n=10.**P<0.01 vs control group;##P<0.01 vs gp120 V3 loop group or 200 μg/kg morphine group.
图3海马区吗啡与gp120 V3环诱导ERK的磷酸化
对艾滋病患者而言,长期高剂量滥用毒品,其大脑以及脊髓中的吗啡浓度较高[4]。因此我们采用侧脑室注射吗啡(200 μg/kg)建立毒品滥用的大鼠模型,观察长期大剂量使用吗啡能否造成神经元的损伤。结果表明中剂量吗啡(100 μg/kg)以及高剂量吗啡(200 μg/kg)连续注射3 d能降低大鼠的学习以及记忆能力。但低剂量吗啡(10 μg/kg)对大鼠的学习以及记忆能力没有影响。在本实验中,我们发现侧脑室注射gp120 V3环可导致大鼠学习及记忆障碍,海马神经元凋亡增多。而gp120 V3 环+吗啡组与吗啡或gp120 V3 环单独组相比逃避潜伏期更长,停留目标象限时间更短。
ERK是一个重要的凋亡通路蛋白,它的激活可调控细胞的增殖和凋亡、凋亡相关蛋白Bax的表达以及线粒体膜去极化,阻断ERK会抑制线粒体细胞色素C的释放和caspase-3的活化[16]。另外,在大鼠缺血再灌注的脊髓模型中,抑制MEK/ERK通路能减少小胶质细胞的活化以及IL-1β的表达,提示此通路在防治神经相关疾病中的作用不容忽视[17]。还有研究显示,急性和亚慢性吗啡处理组动物的多巴胺能边缘系统p-ERK的水平升高[18]。本实验通过检测吗啡组、gp120 V3环组和gp120 V3环+吗啡组大鼠海马区的p-ERK蛋白水平,发现ERK蛋白过度激活并诱导神经元的凋亡,提示吗啡与gp120 V3环可能通过ERK通路引起神经元的凋亡。
因此,本实验侧脑室注射gp120 V3环可致大鼠学习与记忆障碍,吗啡能增强其效应,其机制可能是通过增强海马区p-ERK的表达来实现。这一结果为HIV感染合并毒品滥用致HAND的防治提供了新靶点。
[参考文献]
[1]Albarillo F, O’Keefe P. Opportunistic neurologic infections in patients with acquired immunodeficiency syndrome (AIDS)[J]. Curr Neurol Neurosci Rep, 2016, 16(1):10.
[2]Hult B, Chana G, Masliah E, et al. Neurobiology of HIV[J]. Int Rev Psychiatry, 2008, 20(1):3-13.
[3]Reddy PV, Pilakka-Kanthikeel S, Saxena SK, et al. Interactive effects of morphine on HIV infection: role in HIV-associated neurocognitive disorder[J]. AIDS Res Treat, 2012, 2012:953678.
[4]Andersen JM, Ripel A, Boix F, et al. Increased locomotor activity induced by heroin in mice: pharmacokinetic demonstration of heroin acting as a prodrug for the mediator 6-monoacetylmorphine in vivo[J]. J Pharmacol Exp Ther, 2009, 331(1):153-161.
[5]Conroy JL, Nalwalk JW, Phillips JG, et al. CC12, a P450/epoxygenase inhibitor, acts in the rat rostral, ventromedial medulla to attenuate morphine antinociception[J]. Brain Res, 2013, 1499: 1-11.
[6]Adams JU, Geller EB, Adler MW. Receptor selectivity of icv morphine in the rat cold water tail-flick test[J]. Drug Alcohol Depend, 1994, 35(3): 197-202.
[7]Cysique LA, Maruff P, Brew BJ. Prevalence and pattern of neuropsychological impairment in human immunodeficiency virus-infected/acquired immunodeficiency syndrome (HIV/AIDS) patients across pre- and post-highly active antiretroviral therapy eras: a combined study of two cohorts[J]. J Neurovirol, 2004, 10(6):350-357.
[8]Purohit V, Rapaka R, Shurtleff D. Drugs of abuse, dopamine, and HIV-associated neurocognitive disorders/HIV-associated dementia[J]. Mol Neurobiol, 2011, 44(1):102-110.
[9]Goel A, Kunnumakkara AB, Aggarwal BB. Curcumin as "Curecumin": from kitchen to clinic[J]. Biochem Pharmacol, 2008, 75(4):787-809.
[10]Martinez-Vicente M, Cuervo AM. Autophagy and neurodegeneration: when the cleaning crew goes on strike[J]. Lancet Neurol, 2007, 6(4):352-361.
[11]Iglesias M, Segura MF, Comella JX, et al. Mu-opioid receptor activation prevents apoptosis following serum withdrawal in differentiated SH-SY5Y cells and cortical neurons via phosphatidylinositol 3-kinase[J]. Neuropharmacology, 2003, 44(4):482-492.
[12]Turchan-Cholewo J, Liu Y, Gartner S, et al. Increased vulnerability of ApoE4 neurons to HIV proteins and opiates: protection by diosgenin and L-deprenyl[J]. Neurobiol Dis, 2006, 23(1):109-119.
[13]Cui J, Chen Q, Yu LC, et al. Chronic morphine application is protective against cell death in primary human neurons[J]. Neuroreport, 2008, 19(18):1745-1749.
[14]Hu S, Sheng WS, Lokensgard JR, et al. Morphine potentiates HIV-1 gp120-induced neuronal apoptosis[J]. J Infect Dis, 2005, 191(6): 886-889.
[15]Toggas SM, Masliah E, Rockenstein EM, et al. Central nervous system damage produced by expression of the HIV-1 coat protein gp120 in transgenic mice[J]. Nature, 1994, 367(6459):188-193.
[16]Kim YK, Kim HJ, Kwon CH, et al. Role of ERK activation in cisplatin-induced apoptosis in OK renal epithelial cells[J]. J Appl Toxicol, 2005, 25(5):374-382.
[17]Lu K, Cho CL, Liang CL, et al. Inhibition of the MEK/ERK pathway reduces microglial activation and interleukin-1-beta expression in spinal cord ischemia/reperfusion injury in rats[J]. J Thorac Cardiovasc Surg, 2007, 133(4): 934-941.
[18]Haghparast A, Fatahi Z, Alamdary SZ, et al. Changes in the levels of p-ERK, p-CREB, and c-Fos in rat mesocorticolimbic dopaminergic system after morphine-induced conditioned place preference: the role of acute and subchronic stress[J]. Cell Mol Neurobiol, 2014, 34(2):277-288.
(责任编辑: 陈妙玲, 罗森)
TGF-β上调胰腺导管腺癌微管相关蛋白MAP1S的表达和自噬流
自噬是细胞重复利用错误折叠/聚集的蛋白质或功能失调的细胞器(如受损的线粒体)的自我调节过程。作为神经元细胞特有的MAP1A和MAP1B的同源物,微管相关蛋白MAP1S(最初被称为C19ORF5)广泛分布于机体内,最初曾与自噬的标志物微管相关蛋白1轻链3(light chain 3, LC3)一起被分离。MAP1S通过LC3把自噬小体与微管和线粒体连接起来,从而可以调节自噬过程中自噬前体的形成和降解。在小鼠肝癌模型和膀胱癌患者,MAP1S诱导的自噬均可抑制肿瘤的发生。转化生长因子β(transforming growth factor β, TGF-β)信号通路在胰腺癌的发生发展过程中处于重要地位,并且高表达TGF-β具有抑制肿瘤的作用,还可改善胰腺导管腺癌切除术患者的预后。为了了解胰腺导管腺癌中TGF-β和MAP1S诱导的自噬之间的关系,一个由中美科学家组成的研究小组随机挑选了33位胰腺导管腺癌患者,收集他们的肿瘤组织和癌旁正常组织,检测其TGF-β与自噬标志物MAP1S和LC3的关系,并在体外培养的胰腺癌细胞系中检测TGF-β和自噬标志物的变化的原因和结果。研究结果发现胰腺导管腺癌患者的肿瘤组织中,TGF-β与自噬标志物MAP1S和LC3的表达水平显著升高。TGF-β促使MAP1S蛋白表达增加,并使自噬流增强。以上结果提示TGF-β可增强MAP1S对自噬的诱导作用,从而抑制胰腺导管腺癌的进展。
PLoS One, 2015, 10(11):e0143150(周晗)
Role of morphine and gp120 V3 loop in learning and memory dysfunction in rats
CHEN Gui-ling1, 2, 3, GONG Zheng1, 2, 3, LIU Si-si1, 2, 3, JIANG Ming-liang1, 2, 3, PAN Rui4, XING Yan-yan1, 2, 3, LIN Li-qing1, 2, 3, DONG Jun1, 2, 3
(1DepartmentofPathophysiology,2LaboratoryofPathophysiology,StateAdministrationofTraditionalChineseMedicine,SchoolofMedicine,3GHMInstituteofCNSRegeneration,4DepartmentofOrthopaedics,TheFirstAffiliatedHospital,JinanUniversity,Guangzhou510632,China.E-mail:dongjunbox@163.com)
[ABSTRACT]AIM: To explore the role of morphine and gp120 V3 loop in learning and memory dysfunction in rats. METHODS: SD rats (4~6 weeks old) were infused by the intracerebroventricular injection with gp120 V3 loop and morphine. The Morris water maze was used to evaluate spatial memory. The apoptotic cells in the hippocampal zone were observed by TUNEL staining. The protein level of p-ERK was determined by Western blot. RESULTS: Compared with control group, the rats exhibited a longer latency to escape the hidden platform, shorter retention and less frequency of crossing target quadrant in 100 μg/kg morphine group, 200 μg/kg morphine group and gp120 V3 loop group. The TUNEL positive cells in the hippocampal zone of the rats in 100 μg/kg morphine group, 200 μg/kg morphine group and gp120 V3 loop group were increased. The levels of p-ERK were also increased in 100 μg/kg morphine group, 200 μg/kg morphine group and gp120V3 loop group as compared with the controls. The same results were observed in 200 μg/kg morphine + gp120 V3 loop group as compared with 200 μg/kg morphine group or gp120 V3 loop group. CONCLUSION: Intracerebroventricular injection of gp120 V3 loop induces learning and memory dysfunction in SD rats, and morphine enhances this effect. The mechanism may be related to the combined effect on the increase in p-ERK by gp120 V3 loop and morphine.
[KEY WORDS]HIV-associated neurocognitive disorders; Morphine; HIV-1 gp120 V3 loop; Hippocampal neurons; Apoptosis
[文章编号]1000- 4718(2016)05- 0825- 06
[收稿日期]2016- 02- 08[修回日期] 2016- 04- 22
*[基金项目]国家自然科学基金资助项目(No. 81171134; No. 81471235);广东省自然科学基金资助项目(No. 2014A030313360);广东省科技计划(No.2010B030700016);广州市科技计划(No. 2010Y1-C291); 高等学校学科创新引智计划(No. B14036)
通讯作者△Tel: 020-85228289; E-mail: dongjunbox@163.com
[中图分类号]R363
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.05.009
杂志网址: http://www.cjpp.net
▲并列第1作者
