健脾方对克罗恩大鼠结肠NF-κBP65、IL-23和CCL20及其受体表达的影响*
2016-06-05吴璐一刘慧荣翁志军
吴璐一,刘慧荣,翁志军,陆 颖,季 光
(1.上海中医药大学 上海市气功研究所 上海 200030;2.上海市针灸经络研究所 上海 200030;3.上海中医药大学 脾胃病研究所 上海 200030)
健脾方对克罗恩大鼠结肠NF-κBP65、IL-23和CCL20及其受体表达的影响*
吴璐一1,刘慧荣2,翁志军2,陆 颖1,季 光3**
(1.上海中医药大学 上海市气功研究所 上海 200030;2.上海市针灸经络研究所 上海 200030;3.上海中医药大学 脾胃病研究所 上海 200030)
目的:观察核因子NF -κB p65信号通路介导细胞因子IL-23、趋化因子巨噬细胞炎症蛋白-3α(CCL20)及其受体CCR6表达的影响,及健脾方防治三硝基苯磺酸(TNBS)诱导的克罗恩病中相关作用机制。方法:24只清洁级雄性SD大鼠随机分为:①正常对照组(NG,n=8):从造模第2周起双蒸水灌胃,每日1次,灌胃量按0.1 mL·kg-1,共3周;②TNBS模型组(MG,n=8):从第1周开始TNBS灌肠,灌肠剂量(mL)=体质量(g)×0.003 ml·g-1,每周1次,造模持续共4周;③模型+健脾方防治组(JP,n=8):从造模第2周开始,在TNBS灌肠后的第2天予以中药健脾方灌胃治疗,灌胃量按0.1 mL·kg-1,每日1次,灌胃持续3周;采用结肠组织学损伤评分及HE组织病理的方法观察健脾方的疗效,免疫荧光、ELISA、原位杂交等技术观察各组大鼠结肠黏膜中NF-κB P65、IL-23、CCL20、CCR6蛋白与基因的表达差异;结果:免疫荧光和原位杂交结果显示,CCL20及其受体CCR6在正常组大鼠结肠中呈低表达,在模型组中呈高表达状态(P<0.05)。健脾方可显著降低大鼠结肠趋化因子CCL20及其受体CCR6的表达水平(P<0.05)。正常组大鼠结肠中NF-κB P65呈低表达,在模型组中呈高表达状态(P<0.05),健脾方可显著降低大鼠结肠NF-κB P65表达水平(P<0.05)。ELISA结果显示IL-23在正常组大鼠结肠中呈低表达,在模型组中呈高表达状态(P<0.05)。健脾方可显著降低大鼠结肠细胞因子IL-23的表达水平(P<0.05)。结论:健脾方可减轻TNBS诱导的CD大鼠结肠炎症程度,其潜在的机制与抑制NF-κB P65、IL-23和CCL20/CCR6的表达有关。
克罗恩病 NF-κB P65 IL-23 CCL20 健脾方
克罗恩病(Crohn’s disease,CD)是一种慢性非特异性肠道炎症性疾病,趋化因子介导细胞在炎症部位聚集、活化以及组织损伤的修复,在常规免疫监督、炎症、生长发育等过程中发挥着重要作用[1]。趋化因子巨噬细胞炎症蛋白-3α(又称作CCL20)及其受体CCR6有重要的免疫调节作用[2,3],近年来在炎症性肠病中备受关注。CCL20主要由表皮细胞或黏膜上皮细胞分泌,可表达于正常细胞,也可表达于异常细胞[4]。CCR6表达于淋巴与非淋巴组织,主要表达于脾脏、淋巴结、阑尾、胰腺,较少表达于外周血粒细胞、胸腺、小肠等[5-8]。NF-κB p65是参与炎症反应的基因调控中的重要转录因子,参与CD的发生与发展。有研究表明,CCL20是NF-κB的靶基因[4],且NF-κB的激活可促进CCL20以及CCR6的表达。同时NF-κB信号转导通路的激活,还会促IL-6、IL-21、IL-23、TNF-α等细胞因子释放,进一步加重炎症反应。中医药治疗IBD的特点是多途径、多层次、多靶点并且可以长期维持用药治疗[9,10],越来越广地应用于临床,能有效缓解IBD临床症状[11,12],但其潜在的机制尚未明确,对此进行深入研究,将有助于提高临床疗效,促进临床进一步推广与应用。本研究采用三硝基苯磺酸(TNBS)灌肠的方法建立CD大鼠模型,通过观察健脾方对CD模型大鼠饮食、神态、皮毛、体质量、排便、活动情况、反应能力等一般情况,结肠大体形态损伤及组织病理学评分,结肠细胞因子IL-23、CCL20及其受体CCR6、以及NF-κB表达,初步揭示健脾方在防治IBD的可能作用机制,为推广健脾方在临床预防和治疗IBD方面的应用提供实验依据。
1 实验材料与方法
1.1 实验动物
24只SPF级雄性SD大鼠,体质量160±10 g,购于上海斯莱克实验动物有限责任公司[生产许可证号:SCXK(沪)2012-0002],饲养于上海中医药大学附属龙华医院实验动物中心,所有大鼠均自由饮水(药)、摄食,饲养室内温度为24±2℃,湿度为55±10%,光照时间为12 h(8:00-20:00),所有实验对动物的处理符合中国科学技术部的相关指导建议。
1.2 模型制备
按照Morris[13]等方法制备结肠炎大鼠模型,5%TNBS与50%的乙醇按2:1比例混合而成,3%戊巴比妥钠麻醉大鼠(按体质量计,0.01 mL·kg-1),使其身体垂直,处于倒立位,每次灌肠剂量:灌肠液(mL)=体质量(g)×0.003 mL·g-1,5 mL注射器连接灌肠针顺大鼠直结肠生理曲度缓缓从肛门插入约6-9 cm,注入灌肠液。灌肠后将大鼠倒立体位约5 min。每周第1天灌肠1次,共4次,持续4周。
1.3 药物来源及加工
健脾方由以下中药(补骨脂15 g、茯苓9 g、白术9 g、白头翁15 g、马齿苋30 g、炙诃子15 g、石榴皮15 g、藿香9 g)组成,根据《中药药理学研究方法学》标准,将中药加入蒸馏水中,煎煮2次,合并两次药液,4层纱布过滤,水浴锅95℃浓缩体积为555.5 mL的药液。置4℃冰箱保存备用。根据《中药药理学》(全国高等中医药院校教材《中药药理学》陈长勋主编,上海科学技术出版社,2006年10月第一版,191页表22-3)用药剂量按人鼠等效剂量灌胃,大鼠为0.1 mL·kg-1。
1.4 实验分组与治疗
24只清洁级雄性SD大鼠随机分为:①正常对照组(NG,n=8):从造模第2周起双蒸水灌胃,每日1次,灌胃量按0.1 mL·kg-1,共3周;②TNBS模型组(MG,n=8):从第1周开始TNBS灌肠,灌肠剂量(mL)=体质量(g)×0.003 mL·g-1,每周1次,造模持续共4周。③模型+健脾方防治组(JP,n=8):从造模第2周开始,在TNBS灌肠后的第2天予以中药健脾方灌胃治疗,灌胃量按0.1 mL·kg-1,每日1次,灌胃持续3周。
1.5 标本采集与处理
以 3% 戊巴比妥钠麻醉大鼠(按体质量计,0.0.1 mL·kg-1),截取距离肛门6-9 cm处病变明显结肠,沿肠系膜纵行剖开,用预冷的4℃生理盐水冲洗后,肉眼观察并记录黏膜损伤情况,结肠分为两部分保存,一部分置于液氮保存,一部分用10%的中性缓冲甲醛溶液固定,石蜡包埋组织,切片厚度为4 μm。所有实验对动物的处理符合中国科学技术部指导建议。
1.6 观察指标与方法
1.6.1 大鼠结肠组织损伤评分和HE染色
HE染色步骤:①切片常规脱蜡至水;②苏木素1 min;③盐酸酒精2 s;④伊红10 s;⑤二甲苯透明;⑥中性树胶封片,光学显微镜下观察。
1.6.2 大鼠结肠CCL20、CCR6、NF-κB P65原位杂交检测
试剂盒采用针对C-C motif chemokine 20(MIP3α)、CCR6、NF-κB P65的寡核苷酸探针,经地高辛标记(武汉博士德公司)。由于采用多相寡核苷酸探针和高敏感标记技术,并配合使用敏感性加强型的原位检测方法,可以检测出常规福尔马林固定,石蜡包埋标本的MIP3α、CCR6、NF-κB P65之mRNA序列。针对大鼠MIP3α靶基因的mRNA 序列为:①5’-TACAC AAAGA ACGTG TATCA TCATG CGAGA AATTT-3’;②5’-CAGAT GGCCG ACGAA GCTTG TGACA TTAAT GCTAT-3’;③5’-TGCGC TGACC CAAAG CAGAT CTGGG TGAAA AGGAT-3’。针对大鼠CCR6 靶基因的mRNA 序列为:①5’-CATGC CACTG ACACT TGGAT CTTTG GCAAC ACGAT-3’;②5’-TTCTT CAACA AGCAA TACAA GCTGC AGGGC CGTGA-3’;③5’-TACTT CATGA AGATC ATGAA GGATG TGTGG TGTAT-3’。针对大鼠P65靶基因的mRNA 序列为:①5’-AGCGG GGCAT GCGTT TCCGT TACAA GTGCG AGGGC-3’;②5’-GCCAG ACACA GACGA TCGCC ACCGG ATTGA AGAAA-3’;③5’-ATGCT GATGG AGTAC CCTGA AGCTA TAACT CGCCT-3’。
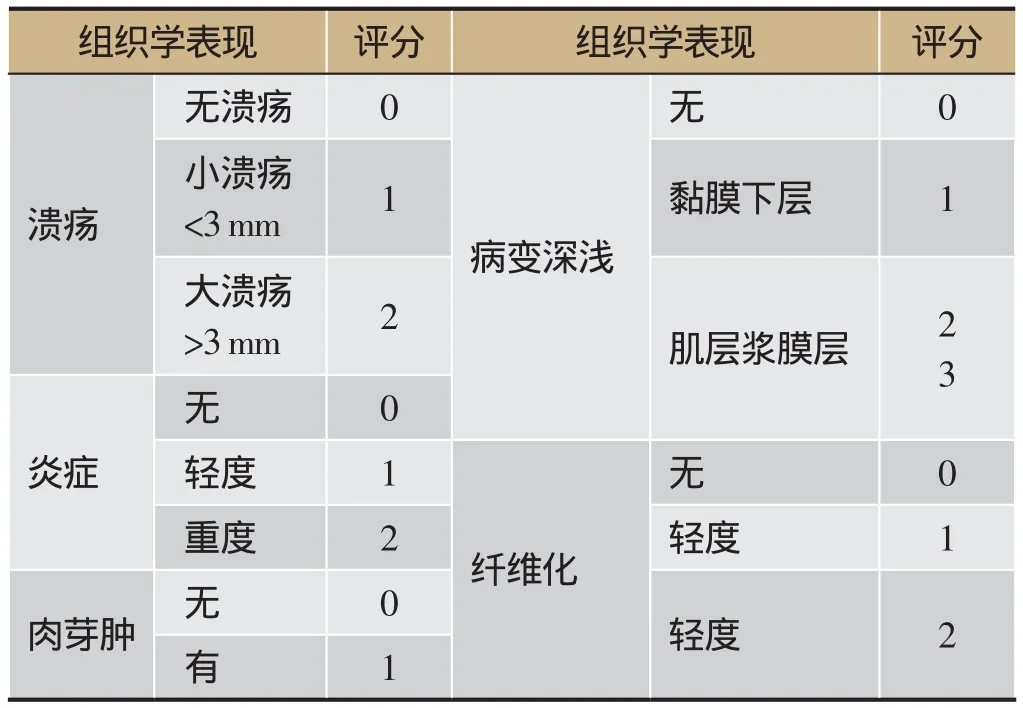
表1 组织学损伤评分标准
具体步骤:①石蜡切片常规脱蜡至水;②按30% H2O2:10份=1:10(体积比)混合,室温10 min灭活内源性酶;③暴露mRNA 核酸片段:切片上滴加3%柠檬酸新鲜稀释的胃蛋白酶(1 mL3%柠檬酸加2 滴浓缩型胃蛋白酶,混匀),37℃或室温消化20 min;④后固定:固定液为1%多聚甲醛/0.1 M PBS(PH7.2-7.6),含有1/1 000 DEPC。室温固定10 min。⑤预杂交:湿盒的准备——干的杂交盒底部加20%甘油20 mL以保持湿度,按每张切片滴加20 μL预杂交液,恒温箱42℃ 4 h;⑥杂交:按每张切片20 μL杂交液(内含多聚寡核苷酸探针MIP3-α,2 μg·mL-1),加在切片上。将原位杂交专用盖玻片的保护膜揭开后,盖在切片上。恒温箱38-42℃杂交过夜。⑦杂交后洗涤:揭掉盖玻片,37℃左右水温的2×SSC 洗涤5 min×2 次;⑧滴加封闭液:37℃30 min。⑨滴加生物素化鼠抗地高辛(试剂盒内带即用型):37℃60 min。⑩滴加SABC-HRP(试剂盒内带即用型):室温30 min。11、滴加生物素化过氧化物酶(试剂盒内带即用型),增加检测的敏感性:室温30 min。12、DAB 显色:使用DAB 显色试剂盒—1mL 蒸馏水加显色剂A、B、C各一滴,混匀,加至标本上,显色20 min。13、苏木素复染,酒精脱水,二甲苯透明,封片。此部分试剂盒根据实验检测指标在博士得试剂公司定制。
1.6.3 大鼠结肠CCL20、CCR6、NF-κB P65免疫荧光检测
①柠檬酸盐缓冲液微波98℃抗原修复:;②一抗羊抗大鼠CCL20、CCR6、NF-κB P65(美国Santa cruz公司)37℃温孵2 h;③兔抗羊IgG-FITC 1:100(美国Santa cruz公司)室温温孵2h;④封片增强剂(美国Sigma公司)封片;⑤每张标本随机采集3个视野,BX53荧光显微镜(日本Olympus公司)图像采集,对每个标本的3个视野的荧光强度取均值后纳入统计分析,采用Image Pro Plus分析荧光灰度。
1.6.4 ELISA法检测大鼠结肠黏膜IL-23
新鲜结肠黏膜组织匀浆离心后取上清液,加入100 μL标准品、100 μL已适当稀释标本于相应板孔中;加入100 μL兔抗鼠IL-23;温育20 min后洗板,加入100 μL 1x HRP,洗板后每孔加入100 μL TMB显色液,轻轻混匀10s,每孔加入100 μL终止液。轻轻混匀30 s,15 min内脏450 nm处读OD值。IL-23(ng·mL-1)=标准曲线上查出的浓度×标本的稀释倍数。
1.7 数据统计分析
数据分析采用SPSS 18.0统计软件进行统计学处理。对数据作正态分布检验。数据若符合正态分布,组间差异采用单因素方差分析(One-way ANOVA),取检验水准α=0.05,以P<0.05为差异有统计学意义,数据以表示。
2 结果
2.1 健脾方对CD大鼠一般情况的影响
第4周干预结束后,观察各组大鼠的一般情况,可见正常组大鼠活动自如、精神振奋、饮食自如、大便正常、毛色有光泽;CD模型组大鼠精神欠佳、饮食减少、活动及反应能力下降、皮毛稀疏、大便次数增多、肛门红肿明显、肛门处有稀便附着、偶有便血、质稀不成形,符合中医中湿邪困脾纳呆、重浊黏腻的特征。经健脾方治疗后的大鼠一般状态已较CD模型组好转、精神尚可、饮食增加、大便时可见成形但较软、健脾方发挥了健脾化湿、解毒凉血的功效。
2.2 CD大鼠结肠组织学损伤评分及HE染色
正常组大鼠结肠组织肉眼观察结肠肠管粗细均匀,结肠壁厚薄一致,柔软有弹性,肠黏膜面光滑整齐,黏膜皱襞完整,无出血点、糜烂及溃疡。HE染色镜下显示,结肠黏膜上皮无缺损,腺体排列整齐,黏膜及黏膜下层无充血、水肿、炎细胞浸润等异常改变,结构完好。见图1(A)。
CD模型组大鼠肉眼观察肠管局部狭窄,肠壁厚薄不均,局部增厚变硬,结肠黏膜充血水肿,血管纹理模糊,广泛分布的糜烂及溃疡,溃疡大小、形状和深度不一,多数为小块状甚至连接成片,多累及黏膜、黏膜下层,深达肌层。HE染色镜下显示结肠黏膜上皮细胞坏死、脱落,肠壁全层大量炎症细胞浸润,肉芽肿形成,纤维组织增生。见图1(B)。
与正常组相比,模型组大鼠结肠组织大体形态评分、结肠组织学损伤评分均明显增加(P<0.05)。这说明CD模型大鼠制备成功,其病理表现与前期报道一致[13-16]。健脾方治疗后,肉眼观察大鼠结肠黏膜表面欠光滑,可见少许黏液,少量散在糜烂,其周围黏膜组织充血水肿。HE染色镜下显示结肠黏膜腺体排列紊乱,黏膜下有水肿。见图1(C)。
与模型组相比,健脾方组大鼠结肠组织大体形态评分、结肠组织学损伤评分均显著降低(P<0.05)。这说明健脾方可有效改善CD大鼠结肠组织结构,减轻结肠组织损伤,具有良好的修复CD受损结肠组织的作用。各组大鼠结肠HE染色及组织学损伤评分如下,评分标准详见表1[17,18]。见图1(D)。
2.3 健脾方对CD大鼠结肠CCL20、CCR6、NF-κB P65 mRNA表达的影响
通过原位杂交方法检测大鼠结肠黏膜间质中CCL20 mRNA的表达情况见图2 (A-D)。研究结果显示:与正常大鼠图2(A)相比,CD模型大鼠结肠黏膜间质CCL20 mRNA表达明显增强(P<0.05)。健脾方可显著降低大鼠结肠CCL20 mRNA表达的积分光密度值(P<0.05),见图2(C),图像分析结果见图2(D)。
采用同样的方法检测CCL20受体CCR6的表达情况,见图2(E-H)。与正常组图2(E)相比,模型组大鼠结肠CCR6 mRNA阳性的积分光密度也明显增强(P<0.05),见图2(F),健脾方可显著降低大鼠结肠CCR6 mRNA阳性积分光密度值(P<0.05),见图2(G)。
同时,笔者也观察了TNBS诱导的炎症过程中重要的转录因子NF-κB p65的mRNA的表达见图2(I-L),与正常组图2(I)相比,模型组大鼠结肠黏膜间质内的淋巴细胞、单核/巨噬细胞胞质内,NF-κB P65 mRNA阳性表达明显增强(P<0.05),见图2(J),健脾方可显著降低大鼠结肠NF-κB P65 mRNA阳性积分光密度值(P<0.05),少量表达于黏膜间质内的淋巴细胞、单核/巨噬细胞胞质和胞核内,见图2(K)。提示健脾方能够下调CD大鼠结肠异常增高的NF-κB P65 mRNA表达,图像分析结果见图2(L)。
2.4 健脾方对CD大鼠结肠CCL20、CCR6、NF-kappaB P65蛋白表达的影响
免疫荧光技术检测大鼠结肠黏膜间质CCL20蛋白的表达情况(图3 A-D),研究结果显示:与正常大鼠(图3-A)相比,CD模型大鼠结肠黏膜间质CCL20表达明显增强(P<0.05)(图3-B),健脾方能够明显下调大鼠结肠黏膜CCL20的表达(P<0.05)(图3-C),图像分析结果见图3-D。通过对CCL20受体蛋白CCR6表达情况检测发现(图3 E-H),与正常组(图3-E)相比,模型组大鼠结肠CCR6 蛋白阳性表达增强(P<0.05)(图3-F),健脾方可显著降低大鼠结肠CCR6 阳性积分光密度值(P<0.05)(图3-G)。在对TNBS诱导的CD炎症过程中重要的转录因子NF-κB p65检测发现(图3I-L),与正常组(图3-I)相比,模型组大鼠结肠黏膜间质内的淋巴细胞、单核/巨噬细胞胞质内NF-κB P65阳性表达明显增强(P<0.05)(图3-J),健脾方可显著降低大鼠结肠黏膜间质内的淋巴细胞、单核/巨噬细胞胞质和胞核内NF-κB P65阳性积分光密度值(P<0.05),(图3-K)。提示健脾方能够下调CD大鼠结肠异常增高的NF-κB P65表达,图像分析结果见图3-L。荧光检测结果同原位杂交检测结果一致。

图1 CD大鼠结肠组织学损伤评分及HE染色(×200)

图2 各组大鼠结肠黏膜中CCL20、CCR6、NF-κB P65 mRNA表达情况(×200)
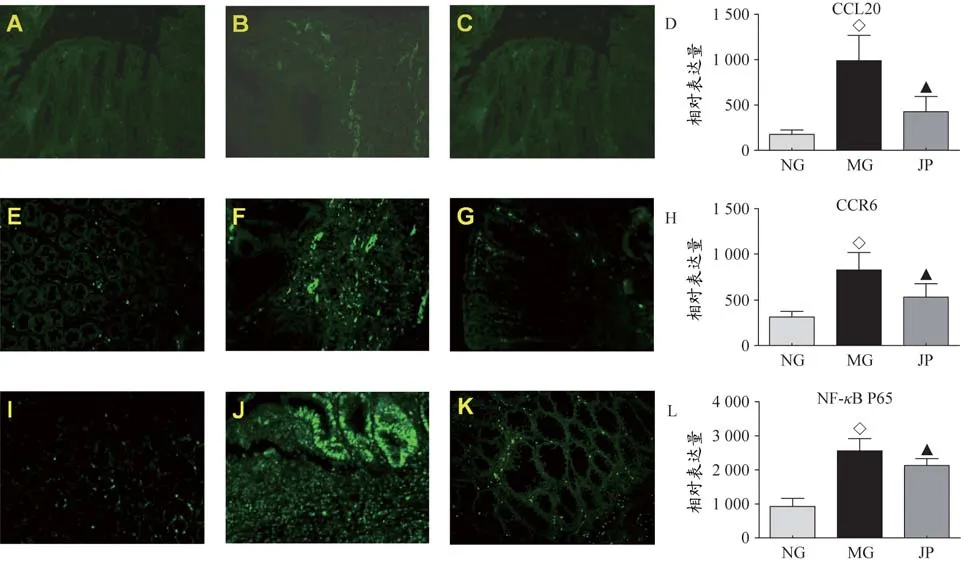
图3 各组大鼠结肠黏膜中CCL20、CCR6、NF-κB P65表达情况(×200)
2.5 健脾方对CD大鼠结肠粘膜IL-23的影响
由图5可知,ELISA结果显示IL-23在正常组大鼠结肠黏膜中呈低表达,在模型组中呈高表达状态(P<0.05)。健脾方可显著降低大鼠结肠细胞因子IL-23的表达水平(P<0.05)。
3 讨论
中医学没有关于克罗恩病的专门论述,目前多数学者认为其属于中医学“腹痛”、“泄泻”、“肠澼”、“交肠”等范畴,如《内经》描述的“肠澼”、“赤沃”、“注下赤白”与CD症状接近。湿热蕴结、脾胃虚弱是克罗恩病的主要病因病机,清热健脾是中医药治疗克罗恩病的有效治疗原则,考虑此病反复发作、持续时间较长,久病及肾,故以茯苓、白术、补骨脂健脾化湿温肾。健脾方由补骨脂、茯苓、白术、白头翁、马齿苋、石榴皮、炙诃子、藿香组成。方中补骨脂温脾止泻、补肾助阳,茯苓利水渗湿、健脾宁心,白术健脾燥湿,利水化湿,白头翁清热解毒,凉血止痢,马齿苋清热解毒,止血凉血,石榴皮涩肠止泻、止血,炙诃子涩肠止泻,藿香辟秽祛湿,构成本方健脾化湿、温肾涩肠、解毒凉血之功效,本研究通过观察CD模型大鼠结肠大体形态损伤及组织病理学评分,结合结肠粘膜细胞因子IL-23、CCL20及其受体CCR6、以及NF-ΚB p65表达,研究健脾方治疗CD的可能的效应与作用机制。
在正常结肠黏膜组织中,趋化因子CCL20和CCR6仅有少量表达,呈弱阳性。CCL20与CD4+T细胞表面CCR6结合后,可趋化和激活各种白细胞、未成熟树突状细胞和淋巴细胞和T细胞亚群等[19],促使树突状细胞从血液迁移至消化道黏膜固有层[20-23]。临床研究表明,CD患者CCL20 mRNA含量远远高于UC患者[24]。而且炎症性肠病基因组研究表明CCR6基因多态性与CD相关[25-27]。在CD结肠上皮细胞均分泌CCL20,且可被IL-1β和TNFα诱导,CCR6+未成熟树突状细胞被募集至黏膜固有层[28,29],且黏膜炎症可以在阻断CCL20和CCR6信号途径后减轻。给药中和CCL20抗体,可抑制CCR6+T细胞募集至黏膜固有层,减轻结肠炎症[30]。TNBS诱导的CD大鼠经健脾方治疗,通过结肠组织学损伤评分及HE染色观察其疗效显著,CD是一种与机体免疫功能异常密切相关的疾病,有研究显示:阻断CCL20和CCR6信号途径后,可减轻黏膜炎症[30]。本实验发现CCL20和CCR6 mRNA在大鼠结肠黏膜中呈现少量表达状态,TNBS能够诱导炎症的出现,同时CCL20、CCR6 mRNA出现表达的上调,与前期研究结果一致[28,29],IL-23在正常组大鼠结肠黏膜中呈低表达,在模型组中呈高表达状态。健脾方可显著降低大鼠结肠细胞因子IL-23的表达水平。在对CCL20、CCR6蛋白表达的观察中发现,这两种蛋白会同基因呈现出同样的变化趋势,笔者可以推论,健脾方能够下调CD大鼠结肠IL-23、CCL20、CCR6相关的炎症,改善CD大鼠一般情况,发挥良好的治疗作用。
NF-κB p65作为参与炎症反应的基因调控中的重要转录因子,参与了CD的发生与发展,NF-κB最常见的为p65/p50异二聚体,也是其活性的主要形式[31]。有研究表明,CCL20是NF-κB的靶基因,且NF-κB可进一步增强IL-23、CCL20以及CCR6的表达[4]。不同疾病研究中显示:免疫和炎症反应中大量基因的表达受NF-κB的调节。可在调控免疫应答、炎症反应、细胞增殖、分化和细胞凋亡等不同的生理病理过程中与所必需的多种基因启动子或增强子上的位点特异结合,启动这些基因的转录,可见其在机体的免疫应答、炎症反应和细胞的生长发育中起重要作用[32,33]。有研究显示CD患者的NF-κB p65表达很高,尤其是大量表达在CD的活动期NF-κB,主要存在于上皮细胞与巨噬细胞[34]。在笔者的动物研究发现,正常组大鼠结肠黏膜NF-κB P65及其mRNA会随着TNBS诱导炎症的出现而表达增加,参与CD的发生与发展。健脾方同样能够发挥下调CD大鼠结肠异常增高的NF-κB p65及其 mRNA表达的作用。

图4 各组大鼠结肠黏膜中IL-23表达情况
综上所述,健脾方可减轻CD大鼠结肠黏膜炎症,具有良好的治疗作用。下调CD大鼠结肠异常增高的NF-κB P65表达,同时能够降低CD大鼠结肠异常增高的IL-23、CCL20及其受体CCR6的表达,笔者初步推测,这可能是健脾方治疗CD大鼠潜在的重要机制。趋细胞因子IL-23、CCL20与其受体CCR6、NF-κB与肠道炎症和免疫应答中密切相关,降低CD大鼠结肠异常增高的IL-23、CCL20及其受体CCR6的表达可能是其治疗克罗恩病的重要靶点。但针对IL-23、CCL20/CCR6与NF-κB p65相关性分析有待于进一步深入研究,同时,健脾方的药理作用可能涉及到多靶点、多途径来发挥其效应机制,本研究初步揭示健脾方治疗CD的效应机制,以期为中医药治疗CD提供了新的选择和选择依据。
1 Baumgart D C, Sandborn W J. Crohn’s disease.Lancet, 2012, 380 (9853): 1590-1605.
2 Middel P, Raddatz D, Gunawan B. Increased number of mature dendritic cells in Crohn’s disease: evidence for a chemokine mediated retention mechanism.Gut, 2006, 55 (2): 220-227.
3 Cheluvappa R. Experimental appendicitis and appendectomy modulate the CCL20-CCR6 axis to limit inflammatory colitis pathology.Int J Colorectal Dis, 2014, 29 (10): 1181-1188.
4 Izadpanah A, Dwinell M B, Eckmann L,et al. Regulated MIP-3alpha/ CCL20 production by human intestinal epithelium: mechanism for modulating mucosal immunity.Am J Physiol Gastrointest Liver Physiol, 2001, 280 (4): G710-719.
5 Liao F, Lee H H, Farber J M. Cloning of STRL22, a new human gene encoding a G-protein-coupled receptor related to chemokine receptors and located on chromosome 6q27.Genomics, 1997, 40: 175-180.
6 Zaballos A, Varona R, Gutierrez J,et al. Molecula rcloning and RNA expression of two new human chemokine receptor-like genes.Biochem Biophys Res Commun, 1996, 227: 846-853.
7 Baba M, Imai T, Nishimura M,et al. Identification of CCR6, the specific receptor for a novel lymphocyte-directed CC chemokine LARC.J Biol Chem, 1997, 272: 14893-14898.
8 Greaves D R, Wang W, Dairaghi D J,et al. CCR6, a CC chemokine receptor that interacts with macrophage inflammatory protein 3 a and is highly expressed in humand endritic cells.J Exp Med, 1997,186: 837-844.
9 Ng SC1, Lam Y T, Tsoi K K,et al. Systematic review: the efficacy of herbal therapy in inflammatory bowel disease.Aliment Pharmacol Ther, 2013, 38 (8): 854-83.
10 Rahimi R, Nikfar S, Abdollahi M. Induction of clinical response and remission of inflammatory bowel disease by use of herbal medicines: a meta-analysis.World J Gastroenterol, 2013, 19 (34): 5738-5749.
11 Yu Z1, Liu H J, Dun H H,et al. Effect of Pulsatilla Decoction on the expression of proinflammatory cytokines in inflammatory bowel disease.Zhongguo Ying Yong Sheng Li Xue Za Zhi, 2011, 27 (4): 416-419.
12 Lu S W, Liu H J, Zhao W,et al. Molecular mechanisms involved in the treatment of inflammatory bowel disease by Pulsatilla decoction.Zhongguo Ying Yong Sheng Li Xue Za Zhi, 2011, 27 (1): 106-109.
13 Morris G P, Beck P L, Herridge M S,et al. Hapten-induced model of chronic inflammation and ulceration in the rat colon.Gastroenterology, 1989, 96 (3):795-803.
14 吴焕淦,刘慈荣,庞惠芳,等. 克隆氏病模型的制备及其形态学研究.现代康复, 2000, 4 (12): 28-29.
15 周长玉,王江滨,王立英. Th1/Th2介导免疫反应在TNBS诱导炎症性肠病动物模型中的作用探讨. 中国实验诊断学, 2007, 11(12): 1684-1686.
16 刘敬军,郑长青,潘丽丽,等. BALB/C小鼠炎症性肠病动物模型建立方法探讨. 世界华人消化杂志, 2005, 13(14): 1776-1778.
17 Kitamura Y, Yokoyama M, Matsuda H,et al. Heterogeneity of mast cells and phenotypic change between subpopulations.Ann Rev Immunol, 1989, 7:59.
18 Lindemann S, Tolley N D, Dixon D A,et al. Activated platelets mediate inflammatory signaling by regulated interleukin 1beta synthesis.J Cell Biol, 2001, 154 (3): 485-490.
19 Comerford I, Bunting M, Fenix K,et al. An immune paradox: how can the same chemokine axis regulate both immune tolerance and activation?: CCR6/CCL20: a chemokine axis balancing immunological tolerance and inflammation in autoimmune disease.Bioessays, 2010, 32 (12): 1067-1076.
20 Le Borgne M, Etchart N, Goubier A,et al. Dendritic cells rapidly recruited into epithelial tissues via CCR6/CCL20 are responsible for CD8+T cell cross priming in vivo.Immunity, 2006, 24: 191-201.
21 钟万锷,周国雄,丁晓凌,等. 趋化因子MIP-3a及其受体CCR6在溃疡性结肠炎中的表达及其意义.第二军医大学学报, 2008, 29 (10): 16-18.
22 Watanabe S, Yamakawa M, Hiroaki T,et al. Correlation of dendritic cell infiltration with active crypt inflammation in ulcerative colitis.Clin Immunol, 2007, 122 (3): 288-297.
23 Kwon J H, Keates S, Bassani L,et al. Colonic epithelial cells are a major site of macrophage inflammatory protein 3α (MIP-3α) production in normal colon and inflammatory bowel disease.Gut, 2002, 51(6): 818-826.
24 Mitsuhashi M, Targan S R. Ex vivo simulation of IgG Fc and T-cell receptor functions: an application to inflammatory bowel disease.Inflamm Bowel Dis, 2008, 14(8):1061-1067.
25 Van Limbergen J, Wilson D C, Satsangi J. The genetics of Crohn’s disease.Annu Rev Genomics Hum Genet, 2009, 10: 89-116.
26 Kochi Y, Okada Y, Suzuki A,et al. A regulatory variant in CCR6 is associated with rheumatoid arthritis susceptibility.Nat Genet, 2010, 42:515-519.
27 Barrett J C, Hansoul S, Nicolae D L,et al. Genome-wide association defines more than 30 distinct susceptibility loci for Crohn’s disease.Nat Genet, 2008, 40: 955-962.
28 Kwon JH, Keates S, Bassani L,et al. Colonic epithelial cells are a major site of macrophage inflammatory protein 3alpha (MIP-3alpha) production in normal colon and inflammatory bowel disease.Gut, 2002, 51: 818-826.
29 Kaser A, Ludwiczek O, Holzmann S,et al. Increase dexpression of CCL20 in human inflammatory bowel disease.J ClinImmuno, 2004, 24:74-85.
30 Katchar K, Kelly C P, Keates S,et al. MIP-3alpha neutralizing monoclonal antibody protects against TNBS-induced colonic injury and inflammation in mice.Am J Physiol Gastrointest Liver Physio, 2007, l292: G1263-1271.
31 Sullivan J C, Kalaitzidis D, Gilmore T D,et al. Rel homology domaincontaining transcrip tion factors in the cnidarian Nematostella vectensis.Dev Genes Evol, 2007, 217 (1): 63-72.
32 Bantel H, Berg C, Vieth M,et al. Mesalazine inhibit activation of transcrip tion factor NF kappa B in inflamed mucosa of patients with ulcerative colitis.Am J Gastroenterol, 2000, 95 (12): 3452-3457.
33 Rogler G, Brand K, Vogl D,et al. Nuclear factor-kappa B activity and intestinal inflammation in dextran sulphate sodium (DSS)-induced colitis in mice is suppressed by gliotoxin.Clin Exp Immunol, 2000, 120 (1): 59-65.
34 刘彬果,杨本明,高骥. NF-κB在肠道炎症和免疫应答中的作用.胃肠病学和肝病学杂志, 2009, 18 (10): 886-888.
Study on Regulation Mechanism of NF-κB P65, IL-23, CCL20 and Its Receptors in Colon of Rat Model of Crohn’s Disease Treated by Spleen-invigorating Prescription
Wu Luyi1, Liu Huirong2, Weng Zhijun2, Lu Ying1, Ji Guang3
(1. Shanghai Research Institute of Qigong, Shanghai University of Traditional Chinese Medicine, Shanghai 200030, China; 2. Shanghai Research Institute of Acupuncture and Meridian, Shanghai 200030, China; 3. Shanghai Research Institute of Spleen and Stomach Diseases, Shanghai University of Traditional Chinese Medicine, Shanghai 200030, China)
This study was aimed to observe the effect of nuclear factor NF-κB P65 signaling pathway on cytokine IL-23, chemokine macrophage inflammatory protein-3 (CCL20) and its receptor CCR6 expression, and related mechanisms of spleen-invigorating prescription in the prevention and treatment of Crohn’s disease (CD) induced by trinitrobenzene sulfonic acid (TNBS). A total of 24 male SD rats were randomly divided into: (1) normal control group (NG,n= 8): rats in this group were given distilled water from the second week, once a day, the amount of gastric lavage according to 0.1 mL·kg-1, a total of 3 weeks; (2) model of TNBS group (MG,n= 8): rats in this group were given TNBS enema from the first week, enema dose (mL) = body weight (g) × 0.003 ml·g-1, once a week, the molding lasted a total of 4 weeks; (3) model of TNBS and spleen-invigorating prescription treatment group (JP,n= 8): rats in this group were treated with traditional Chinese medicine (TCM) of spleen-invigorating prescription in the second day from the beginning of the second week after TNBS enema, the amount of gastric lavage treatment according to 0.1 mL·kg-1, once a day by gavage for 3 weeks. The curative effect of the method of the colon tissue damage and the pathology of HE were used to observe the curative effect of the spleen-invigorating prescription. Immunofluorescence, ELISA and in situ hybridization were used to observe the expression of NF-κB P65, IL-23, CCL20, CCR6 protein and gene in colon mucosa of rats in each group. The results of immunofluorescence andin situ hybridization showed that CCL20 and CCR6 in the normal group rat’s colon were less expressed, while in the model group showed high expression (P<0.05). Spleen-invigorating prescription can significantly reduce the expression of CCL20 and its receptor CCR6 in rat’s colon (P<0.05). NF-κB P65 in normal rat’s colon showed low expression, while in the model group showed high expression (P<0.05). And spleen-invigorating prescription can significantly reduce rat’s colon NF-κB P65 expression level (P<0.05). ELISA results showed that the expression of IL-23 was low in the colon of rats in the normal group, while in the model group showed high expression (P<0.05). Spleen-invigorating prescription can significantly reduce the rat colonic cytokine IL-23 expression levels (P<0.05). It was concluded that spleen-invigorating prescription can reduce the degree of colitis in CD rats induced by TNBS. Its underlying mechanism was related to the inhibition of the NF-κB P65 signaling pathway, and then affect the expression of IL-23 and CCL20/CCR6.
Crohn’s Disease, NF-κB P65, IL-23, CCL20, Spleen-invigorating Prescription
10.11842/wst.2016.03.014
R285.5
A
(责任编辑:马雅静 张志华,责任译审:王 晶)
2016-02-14
修回日期:2015-03-04
* 上海市教委优秀青年教师科研基金(zzszy12011):克罗恩病模型制备及清热健脾方调节作用研究,负责人:吴璐一;上海中医药大学上海市针灸推拿学重点学科科研项目(JZ2012019):灸药结合治疗克罗恩病的研究,负责人:吴璐一。
** 通讯作者:季光,博士,主任医师,教授,博士生导师,主要研究方向:中医药防治酒精肝和脂肪肝的基础与临床研究。
