胃癌D2根治术后同期放化疗与化疗的疗效及毒副反应的Meta分析
2016-06-05郭天康杨屹立黄显斌
王 辉, 郭天康, 杨屹立, 黄显斌
甘肃省人民医院普外临床中心,甘肃 兰州 730000
胃癌D2根治术后同期放化疗与化疗的疗效及毒副反应的Meta分析
王 辉, 郭天康, 杨屹立, 黄显斌
甘肃省人民医院普外临床中心,甘肃 兰州 730000
目的 评价胃癌D2根治术后同期放化疗与化疗的疗效及毒副反应。方法 计算机检索2013年10月之前纳入Cochrane library图书馆、Embase数据库、PubMed数据库、Web of Science数据库、Wanfang数据库、CNKI数据库中比较胃癌D2根治术后同期放化疗与化疗的随机对照(RCT)研究。依据数据同质性或异质性确定数据使用固定效应模型或随机效应模型。使用RevMan 5.2软件进行数据分析,两组之间的差异用OR值和95%CI描述。结果 共纳入5个RCT研究,总计979例患者。通过Meta分析得出:胃癌D2根治术后同期放化疗与化疗相比,放化疗显著提高了5年局部无复发生存率(LRRFS)及3年总生存率(OS),但不能提高5年无远处复发生存率(DMRFS)及1年、3年、5年无病生存率(DFS)和1年、5年OS;且拥有和化疗同样的1~2级、3~4级恶心呕吐不良反应及1~2级、3~4级白细胞毒性反应。结论 今后研究应依据胃癌的分期、种族、淋巴结转移及淋巴结清扫数目来确定胃癌D2根治术术后同期放化疗与化疗。
D2淋巴结根治术;Meta分析;术后放化疗;术后化疗;胃癌
胃癌病死率较高,不同国家和地区的发病率和死亡率均有不同[1]。全球来说,过去几年里胃癌发病率已经下降,但仍然是一个公众健康问题[2]。胃癌治疗的高负担仍是一个公共卫生问题[3]。胃癌大多数诊治于中晚期,中晚期胃癌预后较差,手术治疗被认为是唯一可能治愈中晚期胃癌的手段。进展期胃癌需要运用化疗、放疗、放化疗、手术等综合治疗。手术联合淋巴结清扫推荐作为进展期胃癌的标准治疗。最近的临床研究表明手术联合淋巴结清扫与单纯手术相比,可以提高胃癌患者的生存率。
进展期胃癌治疗不推荐采取单纯手术治疗。在大多数国家和地区,运用综合性治疗包括化疗和放化疗作为新的辅助疗法在胃癌的治疗中具有较好疗效。美国西南肿瘤协作组0116临床研究[4]表明,手术联合术后辅助放化疗在胃食管肿瘤治疗中具有较长的生存时间。
在胃癌治疗中,放射治疗作为姑息疗法,已经与化疗结合使用。20世纪60年代有关胃癌回顾性临床试验研究放化疗(chemoradiotherapy,CRT)和单独化疗(chemotherapy,CT)或CRT和单独放疗(radiotheraphy,RT)在胃癌治疗中的疗效[5-7]。1968年,Childs等[5]报道胃癌患者接受放化疗取得11.6个月中位生存时间,而患者接受单纯化疗只有5.7个月的中位生存时间。Falkson等[6]报道了5-FU单药化疗、放疗与放化疗在胃癌治疗中的临床研究,结果显示55%放化疗患者、17%化疗患者具有较好的疗效。Klaassen等[7]报道了东部临床试验合作组(Eastern Cooperative Oncology Group,ECOG)5-FU单药治疗与5-FU联合放疗在不可切除的胃癌及胰腺癌患者取得良好的疗效。无论何种手术术式用于治疗进展期胃癌,患者应该接受辅助治疗,这是一个共识。
胃癌患者术式选择中,东亚国家将胃切除术联合D2淋巴结根治术是可根治性胃癌的标准治疗方法。在欧美国家也作为胃癌推荐手术方式而非治疗规范。荷兰胃癌试验组研究也表明D2淋巴结根治术后有良好的预后[8]。ACTS-GC和CLASSIC试验表明,D2淋巴结根治术后联合化疗可降低胃癌患者复发和死亡的风险,然而研究表明,D2术后有10%患者局部复发[9-10]。因此,探索D2淋巴结根治术后放疗联合化疗与单独化疗是否可进一步改善胃癌患者的预后有一定的必要性。
本研究共5个随机对照研究探讨胃癌D2根治术后同期放化疗与化疗的疗效及毒副反应。总体来说,在总生存率(OS)方面,5个随机对照中有2个研究[11-12]发现D2根治术后放化疗与化疗具有差异,而1个研究[13]表明没有差异;2个研究[13-14]表明在局部无复发生存率(LRRFS)方面具有显著差异;2个研究[13,15]表明D2根治术后放化疗提高无远处复发生存率(DMRFS)。基于以上研究不同结果,我们运用Meta分析方法分析上述差异。
1 资料与方法
1.1 文献检索策略通过Cochrane library图书馆、Embase数据库、PubMed数据库、Web of Science数据库、Wanfang数据库、CNKI数据库进行计算机文献检索。文献检索从数据库创建日期至2013年10月。采取主题词与自由词相结合的检索方式。中文以“胃癌、放化疗、化疗、随机对照试验”等为主题检索词,英文以“randomized controlled trial、stomach neoplasms、gastric carcinoma、cancer of the stomach、carcinoma of stomach、chemotherapy、chemotherapeutic、chemical therapy、chemoradiotherapy、radiotherapy and chemotherapy、radiation and chemotherapy”等作为主题词检索。如果同一作者报道同一研究,选择研究病例数最多的文献进行研究。如果相同的研究出现在其他出版物,本文将纳入提供最完整的随访时间的文献报道。本文也对相关引文进行检索。
1.2 入选标准纳入标准:所有胃癌D2根治术术后同期放化疗与化疗的随机对照研究。排除标准:摘要、快报、社论、专家意见、评论和个案报道;研究无有效数据;研究无对照组;研究包括其他疾病患者。
1.3 数据提取和质量评价采用统一制定的数据收集表,由两位研究者分别独立提取数据,包括第一作者、文献发表时间、病例数、年龄、性别构成比、干预措施、临床分期、随访时间、预后生存期及毒副作用等。数据提取过程中若出现争议,通过与第三方讨论解决分歧。
1.4 数据分析采用Cochrane协作网提供的RevMan 5.2统计分析软件进行数据分析(Version 5.1.2,2011,The Nordic Cochrane Centre,Cochrane Collaboration,www.cochrane-handbook.Org)。统计方法是基于系统评价干预措施的Cochrane手册[16]。当研究间具有统计学同质性(P≥0.1,I2≤50%)时,采用固定效应模型;当研究间具有统计学异质性(P<0.1,I2>50%)时,首先分析异质性来源,若未找到产生异质性的原因,则采用随机效应模型进行分析或不进行数据合并。亚组分析是基于患者根据接受放化疗和化疗不同观察时期及指标进行。所有的分析都使用符合方案(per protocol,PP)数据分析。当纳入研究大于10个研究时,使用漏斗图(Funnel plot)或Egger回归图评估发表偏倚[17],P<0.05为差异有统计学意义。
2 结果
2.1 检索结果及质量评价共纳入5篇文献[11-15],总计979例患者,所有文献均来自亚洲国家,其中中文文献2篇,英文文献3篇。只有2篇研究[12-13]使用调强放疗作为放疗的治疗。化疗方案中一个研究[15]使用卡培他滨与顺铂联合,一个[11]使用盐酸表柔比星、顺铂和氟尿嘧啶联合,3个[12-14]研究使用与0116实验相同的化疗方案(FL方案)。图1显示了纳入研究的方法学质量评价。表1显示了纳入研究的基本特征。

图1 纳入研究的方法学质量评价

表1 纳入研究的基本特征
注:治疗方案:
胡蓉环等[11]放化组:ECF方案,表柔比星50 mg/m2,顺铂60 mg/m2,氟尿嘧啶200 mg/m2,1次/d,持续21 d,休息1周后,行三维适型放疗,放疗剂量为45 Gy/25 F,5次/周,放疗期间每日同时给予氟尿嘧啶225 mg/m2,采用ECF方案化疗2个周期。化疗组:仅采用ECF方案,使用方法同上,化疗6个周期。
Kim等[14]放化组:1个周期FL方案,氟尿嘧啶425 mg/m2,四氢叶酸20 mg/m2,放疗5次/周,1.8 Gy/d,共45 Gy,连续2个周期FL。化疗组:5个周期FL方案,用法同上。
Lee等[15]放化组:2个周期XP方案,第1~14天卡培他滨1 650 mg/m2,第1天顺铂60 mg/m2,放疗45 Gy,同时卡培他滨1 650 mg/m2持续5周,2个周期XP方案,方法同上。化疗组:6个周期XP方案,方法同上,每3周重复,共6次。
瞿广桥等[12]放化组:FL方案,氟尿嘧啶500 mg/m2,四氢叶酸100 mg/m2,联合调强放射治疗,45 Gy/25次。化疗组:FL方案,用法同上,共6个周期。
Zhu等[13]放化组:FL方案,氟尿嘧啶400 mg/m2,四氢叶酸20 mg/m2,联合调强放疗,总剂量45 Gy,5周,接下来2个周期FL方案,方法同上。化疗组:FL方案,方法同上,持续5 d,共5个周期。
2.2 Meta分析结果
2.2.1 局部无复发生存率(LRRFS):3个随机对照试验[13-15]共899例患者,放化组462例,化疗组437例,放化组与化疗组治疗具有统计学同质性(P=0.99,I2=0)。利用固定效应模型Meta分析结果显示,与化疗组相比,放化疗可显著提高5年LRRFS(P=0.004,OR=1.77,95%CI:1.20~2.62,见图2)。
2.2.2 无远处转移复发生存率(DMRFS):3个随机对照试验[13-15]共899例患者,放化组462例,化疗组437例,放化组与化疗组治疗效果具有统计学同质性(P=0.36,I2=3%)。利用固定效应模型Meta分析结果显示,与化疗组相比,放化疗未能提高5年DMRFS(P=0.50,OR=1.11,95%CI:0.82~1.50,见图3)。
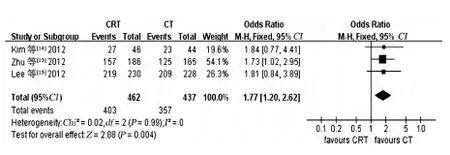
图2 5年局部无复发生存率

图3 5年无远处转移复发生存率
2.2.3 无病生存率(DFS):3个随机对照试验[13-15]共899例患者,放化组462例,化疗组437例,运用Meta分析结果计算1年DFS、5年DFS,放化组与化疗组治疗具有统计学同质性(1年DFS同质性:P=0.43;I2=0;5年DFS同质性:P=0.15,I2=47%)。利用固定效应模型Meta分析结果显示,与化疗组相比,放化疗未能提高1年DFS(P=0.60,OR=0.89,95%CI:0.58~1.37)、5年DFS(P=0.16,OR=1.23,95%CI:0.92~1.63,见图4)。
计算3年DFS异质性:P<0.00001,I2=95%,未能找出异质性原因,采取随机效益模型来计算。利用随机效应模型Meta分析结果显示,与化疗组相比,放化疗未能提高3年DFS(P=0.84,OR=0.87,95%CI:0.22~3.45,见图5)。

图4 1年、5年无病生存率

图5 3年无病生存率
2.2.4 总生存率(OS):3个随机对照试验[11-13]共431例患者,放化组226例,化疗组205例,统计1年OS;2个随机对照试验[12-13]共401例患者,放化组211例,化疗组190例,统计3年OS;2个随机对照试验[13-14]共441例患者,放化组232例,化疗组209例,统计5年OS。运用Meta分析分别计算1年、3年、5年OS。放化组与化疗组治疗效果具有统计学同质性[1年OS同质性(P=0.20,I2=37%);3年OS同质性(P=0.64,I2=0);5年OS同质性(P=0.40,I2=0)]。利用固定效应模型Meta分析结果显示,与化疗组比较,放化疗未能提高1年OS(P=0.92,OR=0.97,95%CI:0.50~1.87)、5年OS(P=0.33,OR=1.21,95%CI:0.82~1.76),但提高了3年OS(P=0.04,OR=1.51,95%CI:1.02~2.25,见图6)。
2.5 不良反应总体来说,3个随机对照试验[11,13,15]的不良反应是可以耐受的。最常见的不良反应为1~2级和3~4级恶心呕吐和白细胞毒性反应。运用Meta分析分别计算1~2级、3~4级恶心呕吐不良反应和1~2级、3~4级白细胞毒性反应。放化组与化疗组不良反应具有统计学同质性,1~2级恶心呕吐不良反应同质性(P=0.16,I2=45%);3~4级恶心呕吐不良反应同质性(P=0.20,I2=38%);1~2级白细胞毒性反应同质性(P=0.25,I2=29%);3~4级白细胞毒性反应同质性(P=0.76,I2=0)。利用固定效应模型Meta分析结果显示,与化疗组相比,放化疗拥有与化疗相同的1~2级恶心呕吐不良反应(P=0.12,OR=1.27,95%CI:0.94~1.71)及3~4级恶心呕吐不良反应(P=0.56,OR=1.16,95%CI:0.70~1.93),1~2级白细胞毒性反应(P=1.00,OR=1.00,95%CI:0.75~1.34)及3~4级白细胞毒性反应(P=0.09,OR=1.32,95%CI:0.95~1.84,见图7~8)。
2.3 发表偏倚评价当纳入研究大于10个研究时,使用漏斗图(Funnel plot)或Egger回归图研究发表偏倚,本研究共纳入5个随机对照试验,对此我们未进行发表偏倚分析。

图6 1年、3年、5年无病生存率

图7 1~2级、3~4级恶心呕吐不良反应

图8 1~2级、3~4级白细胞毒性反应
2.4 敏感性分析在进行逐一排除后进行敏感性分析LRRFS、DMRFS、DFS、OS和不良反应。最后结果与上述Meta分析结果一致。表明本Meta研究结果是稳定的。
3 讨论
大多数胃癌患者诊治时已属于进展期,而进展期胃癌应采取综合治疗,包括手术、放化疗、放疗和化疗。术后放化疗和术后化疗在胃癌治疗中均广泛使用,此次Meta分析评价胃癌D2根治术后同期放化疗与化疗的疗效与毒副反应。通过研究得出以下结论:与胃癌D2根治术后同期化疗相比,放化疗显著提高5年LRRFS、3年OS;但未能提高5年DMRFS、1年DFS、3年DFS、5年DFS、1年OS、5年OS,拥有与化疗同样的1~2级、3~4级恶心呕吐不良反应及1~2级、3~4级白细胞毒性反应。
理论上,胃癌术后结合适当的辅助治疗,被用来减少局部区域和远处的复发与转移来提高DFS、OS。尽管各种手术方式尽可能切除局部转移病灶,但局部复发依然是最常见导致胃癌患者术后高死亡率的原因,也有许多试验研究尝试减少切除后复发的风险,结果表明胃癌术后化疗作为一个单独的治疗手段没有使患者受益。也有研究表明术后放射治疗没有改善OS[18]。
一些研究结果证实化疗联合放疗在胃癌术后提高了LRRFS,其他研究也证实胃癌患者接受术前放化疗降低局部区域复发率,这些研究优势与许多多中心随机研究结果相一致[19]。
关于胃癌术后放化疗与化疗的毒副反应,胃癌术后切除肿瘤及清扫范围、大剂量的化疗药和放射治疗导致周围器官组织更大的不良反应,且放疗与化疗的结合加重白细胞毒性反应。0116试验[4]研究表明,556例胃癌患者通过手术R0切除,在术后治疗过程中毒副反应是主要问题,41%的患者发生3级毒副反应,32%的患者发生4级毒副反应,3例患者因毒副反应导致死亡。36%的患者因为毒副反应不能够完成治疗,这与本研究结果相一致。
根治性手术是可切除胃癌治疗的核心。设计良好的随机对照Ⅲ期试验[20-23]证实胃癌手术切除范围、淋巴结清扫范围及手术时机的选择与胃癌预后密切相关。西南肿瘤组(SWOG)0116试验[4]手术方式的选择也具有争议,D2淋巴结根治术作为胃癌根治术的推荐术式,西南肿瘤组0116试验只有10%的患者采取D2根治术,而超过50%的患者选择D0切除。因此,此研究表明放化疗在胃癌D2根治术后治疗是有争议的。在全球可切除的患者、其他可接受根治性手术的T3、T4期肿瘤患者及其他类型可切除的胃癌患者合并淋巴结转移者[4,24],扩大淋巴切除术及有效的术后辅助治疗[4]明显增加胃癌手术疗效[25]。在东欧国家,Bozzetti等[21]进行胃癌手术治疗的限制性手术,Cuschieri等[22](MRC trial)和Bonenkamp等[20](Dutch trial)停止胃癌治疗中扩大淋巴结清扫研究显示,D2淋巴结根治合并胰腺和脾脏切除无生存优势反而导致并发症增加,从而摒弃这种手术。
然而,重新回顾Bonenkamp等[20]试验研究(Dutch trial),经过长时间的随访,胃癌患者行D2根治术后延长了生存时间。此外,Bonenkamp等[20]进一步分析试验,排除了胃癌合并远端胰腺切除术和脾切除术病例(这些都是导致术后并发症的一个重要因素),发现胃癌患者行D2淋巴结根治术获得较高的生存率[26]。这一发现后来被两个小规模Ⅱ期前瞻性研究证实,该研究由意大利及英国实施。两者都得出结论,胃癌D2与D1淋巴结根治术相比,胃癌D2淋巴结根治术(未行合并胰腺切除及脾脏切除)可以提高胃癌患者生存期,且未增加胃癌患者复发率和死亡率[27-28]。因此,5年后的荷兰和MRC试验结果促使在第五版的TNM分期(UICC,1997)[29],提出新的概念即最少淋巴结清扫数目,这些研究结论对胃癌术后淋巴结清扫数目与患者预后做出评价。
在胃癌淋巴结清扫范围中,2006年第一个随机对照试验有关修改胃癌D2淋巴结根治术的疗效,根据第一版的日本胃癌的分类[30],新命名为D3淋巴结清扫。Wu等[25]证实,在一个设计良好的研究中超过200个胃癌患者,手术由训练有素、经验丰富的外科医师执行,D2淋巴结根治与D1淋巴结根治相比,D2淋巴结根治患者获得更长生存时间。研究表明,与之前相关研究相比,在未增加死亡率情况下,扩大淋巴结根治与其复发率增加有关。
本研究的其他一个因素是种族差别。在本Meta研究中,所有的病例全部来自亚洲国家。回顾性研究生存率在胃癌局部手术后亚洲和白人之间使用数据监测、流行病学、最终结果观察表明,1988年-2004年在美国胃腺癌患者是恒定的。总体而言,亚洲人比白种人具有更高的生存率(中位生存时间36个月vs23个月,P<0.001),这些差异在远端胃癌中影响最大,也与胃癌的分期及淋巴结的清扫数量有关[31]。东西方胃癌临床试验差异表明,在亚洲人和白人之间存在肿瘤生物学差异。
本研究结果表明,胃癌D2根治术后同期放化疗与化疗相比,只有LRRFS优势,在OS、DMRFS、DFS方面均无差异,且与化疗拥有相同的1~2级与3~4级恶心呕吐不良反应及1~2级与3~4级白细胞毒性反应。但是,缺乏足够随机对照试验是本研究的不足,且其中2个随机对照研究都是小规模研究,未能依据肿瘤分期、ECOG PS评分、Lauren分类来确定疗效。
在本研究中,未能依据肿瘤的TNM分期来确定胃癌术后辅助治疗疗效,从而确定患者何种分期最终从胃癌D2根治术后同期放化疗与化疗中受益。只有一个随机对照研究[14]依据肿瘤的分期进行研究。结果表明,胃癌术后同期放化疗与化疗相比显著提高了5年LRRFS,这项研究结果可能提示我们,在胃癌的治疗中,放化疗在Ⅲ期胃癌D2根治术后可以减少局部复发,从而提高DFS及OS。
另外,纳入研究不足之处是未对患者在治疗中辅助治疗毒副反应耐受程度做出明确定义,研究的纳入包括所有胃癌D2淋巴结根治术患者,不论是否合并淋巴结转移,不同淋巴结转移数目患者在我们的Meta研究中未能亚组分析,这有可能影响我们的结果。
本研究表明,胃癌D2术后同期放化疗与化疗相比,放化疗提高了5年LRRFS和3年OS,但不能提高患者5年DMRFS、1年、3年、5年DFS,1年、5年OS,拥有和化疗相同的1~2级、3~4级恶心呕吐不良反应和1~2级、3~4级白细胞毒性反应。我们看到越来越多的胃癌D2根治术患者依据TMN分期来确定患者效果。然而,很多治疗方案没有考虑术后放化疗作为胃癌患者的初始治疗。今后的研究应注重以下方面:研究处于更早期的胃癌患者;为了防止患者因为副反应而退出研究,研究应该做出明确的纳入指标及禁忌证来让患者接受放化疗;研究也应注重外科医师的专业水平,使患者接受更合理的手术方式及术后辅助治疗;确定胃癌患者的病理分型、分期、种族、淋巴结转移及淋巴结清扫数。通过以上研究,来确定胃癌D2根治术后患者术后何种辅助治疗获得更好的预后。
[1]Bray F, Jemal A, Grey N, et al. Global cancer transitions according to the Human Development Index (2008-2030): a population-based study [J]. Lancet Oncol, 2012, 13(8): 790-801.
[2]Jeffreys M, Stevanovic V, Tobias M, et al. Ethnic inequalities in cancer survival in New Zealand: linkage study [J]. Am J Public Health, 2005, 95(5): 834-837.
[3]Arnold M, Moore SP, Hassler S, et al. The burden of stomach cancer in indigenous populations: a systematic review and global assessment [J]. Gut, 2014, 63(1): 64-71.
[4]Macdonald JS, Smalley SR, Benedetti J, et al. Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal junction [J]. N Engl J Med, 2001, 345(10): 725-730.
[5]Childs DS Jr, Moertel CG, Holbrook MA, et al. Treatment of unresectable adenocarcinomas of the stomach with a combination of 5-fluorouracil and radiation [J]. Am J Roentgenol Ther Nucl Med, 1968, 102(3): 541-544.
[6]Falkson G, Falkson HC. Fluorouracil and radiotherapy in gastrointesinal cancer [J]. Lancet, 1969, 2(7632): 1252-1253.
[7]Klaassen DJ, MacIntyre JM, Catton GE, et al. Treatment of locally unresectable cancer of the stomach and pancreas: a randomized comparison of 5-fluorouracil alone with radiation plus concurrent and maintenance 5-fluorouracil-an Eastern Cooperative Oncology Group study [J]. J Clin Oncol, 1985, 3(3): 373-378.
[8]Hartgrink HH, van de Velde CJ, Putter H, et al. Extended lymph node dissection for gastric cancer: who may benefit? Final results of the randomized Dutch gastric cancer group trial [J]. J Clin Oncol, 2004, 22(11): 2069-2077.
[9]Bang YJ, Kim YW, Yang HK, et al. Adjuvant capecitabine and oxaliplatin for gastric cancer after D2 gastrectomy (CLASSIC): a phase 3 open-label, randomised controlled trial [J]. Lancet, 2012, 379(9813): 315-321.
[10]Sasako M, Sakuramoto S, Katai H, et al. Five-year outcomes of a randomized phase Ⅲ trial comparing adjuvant chemotherapy with S-1 versus surgery alone in stage Ⅱ or Ⅲ gastric cancer [J]. J Clin Oncol, 2011, 29(33): 4387-4393.
[11]Hu RH, Liu AW, Cai J, et al. Clinical observation of synchronous radiotherapy and chemotherapy in advanced gastric cancer after radical gastrectomy for gastric cancer D2 [J]. Practical Clinical Medicine, 2012, 13(12): 41-43. 胡蓉环, 刘安文, 蔡婧, 等. 进展期胃癌D2根治术后同步放化疗的临床观察[J]. 实用临床医学, 2012, 13(12): 41-43.
[12]Qu GQ, Xiong B. Clinical effect of postoperative concurrent chemoradiotheraphy for limited-advanced gastric carcinoma [J]. The Practical Journal of Cancer, 2006, 21(4): 390-391. 瞿广桥, 熊斌. 进展期胃癌术后同步放化疗的临床观察[J]. 实用癌症杂志, 2006, 21(4): 390-391.
[13]Zhu WG, Xua DF, Pu J, et al. A randomized, controlled, multicenter study comparing intensity-modulated radiotherapy plus concurrent chemotherapy with chemotherapy alone in gastric cancer patients with D2 resection [J]. Radiother Oncol, 2012, 104(3): 361-366.
[14]Kim TH, Park SR, Ryu KW, et al. Phase 3 trial of postoperative chemotherapy alone versus chemoradiation therapy in stage Ⅲ-Ⅳ gastric cancer treated with R0 gastrectomy and D2 lymph node dissection [J]. Int J Radiat Oncol Biol Phys, 2012, 84(5): e585-e592.
[15]Lee J, Lim do H, Kim S, et al. Phase Ⅲ trial comparing capecitabine plus cisplatin versus capecitabine plus cisplatin with concurrent capecitabine radiotherapy in completely resected gastric cancer with D2 lymph node dissection: the ARTIST trial [J]. J Clin Oncol, 2012, 30(3): 268-273.
[16]Higgins JP, Green S. Cochrane handbook for systematic reviews of interventions [M]. John Wiley & Sons, Ltd, 2008.
[17]Peters JL, Sutton AJ, Jones DR, et al. Comparison of two methods to detect publication bias in meta-analysis [J]. JAMA, 2006, 295(6): 676-680.
[18]Shah MA, Kelsen DP. Postoperative adjuvant chemoradiotherapy in high risk stomach carcinoma [J]. Chirurg, 2002, 73(4): 325-330.
[19]Reed VK, Krishnan S, Mansfield PF, et al. Incidence, natural history, and patterns of locoregional recurrence in gastric cancer patients treated with preoperative chemoradiotherapy [J]. Int J Radiat Oncol Biol Phys, 2008, 71(3): 741-747.
[20]Bonenkamp JJ, Hermans J, Sasako M, et al. Extended lymph-node dissection for gastric cancer [J]. N Engl J Med, 1999, 340(12): 908-914.
[21]Bozzetti F, Marubini E, Bonfanti G, et al. Subtotal versus total gastrectomy for gastric cancer: five-year survival rates in a multicenter randomized Italian trial. Italian Gastrointestinal Tumor Study Group [J]. Ann Surg, 1999, 230(2): 170-178.
[22]Cuschieri A, Weeden S, Fielding J, et al. Patient survival after D1 and D2 resections for gastric cancer: long-term results of the MRC randomized surgical trial. Surgical Co-operative Group [J]. Br J Cancer, 1999, 79(9-10): 1522-1530.
[23]Songun I, Keizer HJ, Hermans J, et al. Chemotherapy for operable gastric cancer: results of the Dutch randomised FAMTX trial. The Dutch Gastric Cancer Group (DGCG) [J]. Eur J Cancer, 1999, 35(4): 558-562.
[24]House MG, Brennan MF. Neoadjuvant therapy for gastric cancer [J]. Adv Surg, 2008, 42: 151-168.
[25]Wu CW, Hsiung CA, Lo SS, et al. Nodal dissection for patients with gastric cancer: a randomised controlled trial [J]. Lancet Oncol, 2006, 7(4): 309-315.
[26]Hartgrink HH, van de Velde CJ. Status of extended lymph node dissection: locoregional control is the only way to survive gastric cancer [J]. J Surg Oncol, 2005, 90(3): 153-165.
[27]Degiuli M, Sasako M, Ponti A, et al. Survival results of a multicentre phase Ⅱ study to evaluate D2 gastrectomy for gastric cancer [J]. Br J Cancer, 2004, 90(9): 1727-1732.
[28]Edwards P, Blackshaw GR, Lewis WG, et al. Prospective comparison of D1 vs modified D2 gastrectomy for carcinoma [J]. Br J Cancer, 2004, 90(10): 1888-1892.
[29]Sobin LH, Gospodrowicz MK, Wittekind C. TNM classification of malignant tumors (UICC International Union Colorectal carcinoma: Pathologic aspects Against Cancer) [M]. 7th ed. New York: Wiley-Blacvkwell, 2009.
[30]Maruyama K, Okabayashi K, Kinoshita T. Progress in gastric cancer surgery in Japan and its limits of radicality [J]. World J Surg, 1987, 11(4): 418-425.
[31]Artinyan A, Ellenhorn JD. Ethnic differences in outcome from resected gastric adenocarcinoma in the United States: improved survival in Asian Americans [J]. J Clin Oncol, 2008, 26(15S).
(责任编辑:马 军)
Postoperative chemoradiotherapy versus postoperative chemotherapy for gastric cancer with concurrent completely resected D2 lymphadenectomy: a Meta-analysis of the efficacy and toxic-side effects
WANG Hui, GUO Tiankang, YANG Yili, HUANG Xianbin
Clinical Center of General Surgery, People’s Hospital of Gansu Province, Lanzhou 730000, China
Objective To investigate the efficacy and toxic-side effects of postoperative chemoradiotherapy and postoperative chemotherapy for gastric cancer with concurrent completely resected D2 lymphadenectomy. Methods All RCTs that compared postoperative chemoradiotherapy with postoperative chemotherapy for gastric cancer with concurrent completely D2 lymphadenectomy resected were included in the Meta-analysis. A systematic research of relevant studies published through Oct. 2013 was conducted using the Cochrane library databases, Embase, PubMed, Web of Science, Wanfang and CNKI databases. Meta-analysis was performed by RevMan 5.2 software to obtain the relative hazards of adjuvant chemoradiotherapy to chemotherapy on efficacy and toxic-side effects. Odds ratios (ORs) and 95%CIwere calculated to estimate the association strength. Results A total of 979 patients from 5 RCTs were included. All patients were from Asian countries. Compared with chemotherapy, chemoradiotherapy significantly improved the survival rates of 5-year local regional relapse-free survival (LRRFS) and 3-year overall survive (OS); but did not improve the survival rate of 5-year distant metastasis regional relapse-free survival (DMRFS), 1-year, 3-year and 5-year disease free survival (DFS), 1-year and 5-year OS, and had same risk of grade 1~2, grade 3~4 nausea and vomiting toxicities, grade 1~2, grade 3~4 neutropenia toxicities. Conclusion Further clinictrials depending on different tumor stage, race, lymph node metastasis, sweep lymph node numbers, receiving chemoradiotheraphy and chemotherapy with completely resected D2 lymphadenectomy resected gastric cancer should be conducted.
Completely resected D2 lymphadenectomy; Meta-analysis; Postoperative chemoradiotherapy; Postoperative chemotherapy; Gastric cancer
10.3969/j.issn.1006-5709.2016.01.009
王辉,住院医师,研究方向:胃肠道肿瘤诊治。E-mail:wanghui0326@163.com
郭天康,主任医师,研究方向:普通外科。E-mail:guotiankang2009@163.com
R735.2
A
1006-5709(2016)01-0035-08
2014-10-26
