AIF-1在溃疡性结肠炎及缺血性肠炎结肠组织中表达的差异
2016-06-05甘静娣
刘 翔, 甘静娣, 林 虹
广州医科大学附属第二医院消化内科,广东 广州 510260
AIF-1在溃疡性结肠炎及缺血性肠炎结肠组织中表达的差异
刘 翔, 甘静娣, 林 虹
广州医科大学附属第二医院消化内科,广东 广州 510260
目的 比较溃疡性结肠炎(ulcerative colitis,UC)与缺血性肠炎(ischemic colitis,IC)患者结肠黏膜中同种异体移植物炎症因子-1(allograft inflammatory factor-1,AIF-1)、白细胞介素-1(interleukin-1,IL-1)表达水平的差异,以探讨AIF-1参与UC发病的可能性。方法 收集2010年1月-2014年12月34例确诊为UC和31例确诊为IC的患者结肠黏膜标本,另以12名正常人为对照,用ELISA方法检测AIF-1、IL-1的表达水平。结果 UC患者结肠黏膜AIF-1表达水平较IC和正常人高(P<0.05),IC患者结肠黏膜AIF-1水平与正常人比较,差异无统计学意义(P>0.05)。UC患者结肠黏膜IL-1表达水平与IC患者比较,差异无统计学意义(P>0.05),但二者均高于正常人(P<0.05)。UC及IC患者AIF-1与IL-1表达水平无相关性(P>0.05)。结论 AIF-1可能参与了UC的发病。
同种异体移植物炎症因子-1;白细胞介素-1;溃疡性结肠炎;缺血性肠炎;致病机制
对于溃疡性结肠炎(ulcerative colitis,UC)的发病机制,比较主流的观点认为是在遗传易感性的基础上,肠道黏膜免疫系统由于对肠道微生态菌群发生过度的免疫反应而导致结肠持续性炎症[1]。近年来有研究显示,UC的发病有着自身免疫的背景,但究竟是何种与自身免疫相关因子参与其中,尚无定论。肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素-1(interleukin-1,IL-1)等炎症因子虽经证实与UC的发病密切相关,但缺乏特异性[2]。同种异体移植物炎症因子-1(allograft inflammatory factor-1,AIF-1)是新近发现和机体自身免疫有关的炎症因子,其是否参与了UC的发病目前尚无相关报道,故有必要对此进一步研究。
1 资料与方法
1.1 一般资料选取2010年1月-2014年12月广州医科大学附属第二医院消化内科经肠镜及病理确诊为UC患者的结肠黏膜标本34例,男21例,女13例,年龄21~45岁,平均年龄(33.0±9.8)岁。经肠镜及病理确诊为IC患者31例,男22例,女9例,年龄48~72岁,平均年龄(61.0±8.4)岁。为确保UC与IC患者的结肠炎症程度基本一致,均选取肠道病变仅局限于左半结肠且肠镜下表现相似,且经病理切片证实炎症评分大致相似的患者。另设12名肠镜检查正常的健康人为对照组,对照组经病理切片证实无明显炎症。
1.2 仪器及操作方法
1.2.1 标本采集:患者确诊后均于肠镜下取病变肠段的黏膜组织,切片及匀浆后分别用于病理切片和ELISA检测。12名健康人于肠镜下取黏膜组织。ELISA试剂盒:IL-1(深圳晶美公司,批号:2014278),AIF-1(深圳晶美公司,批号:2014392)。
1.2.2 病理评分:由病理医师对结肠炎症进行评分。评分标准[3]:平均观察15个400倍放大的视野,取其炎症评分的平均值。炎症评分由浸润程度(无为0分,轻度1分,中度2分,重度3分)、病变范围(无为0分,1%~25%为1分,26%~50%为2分,51%~75%为3分,76%~100%为4分)评分的总和表示。
1.2.3 ELISA测定AIF-1、IL-1的表达:采用试剂盒推荐的双抗体夹心ELISA法。处理好结肠组织样本后,将预包被好的抗AIF-1或IL-1单抗酶标板上分别加入标准品和待测样品,结合后加入抗AIF-1或IL-1抗体,形成免疫复合物后再加入辣根过氧化物酶标记的Steptavidin,最后加入酶底物显色,492 nm波长处测吸光度值,通过标准曲线求出待测样品中的AIF-1或IL-1浓度。
2 结果
2.1 各组结肠组织的炎症评分UC患者结肠组织炎症评分(5.1±1.22)分与IC患者(4.3±1.07)分相比,差异无统计学意义(P>0.05),但二者均高于正常人(0.5±0.13)分(P<0.05,见图1、表1)。
2.2 各组结肠组织中AIF-1的表达UC患者结肠组织中AIF-1的表达(1.030±0.228)ng/ml较IC患者(0.195±0.046)ng/ml和正常人(0.137±0.034)ng/ml高(P<0.05);IC患者AIF-1水平与正常人相比,差异无统计学意义(P>0.05,见图1、表1)。
2.3 各组结肠组织中IL-1的表达UC患者结肠组织中IL-1的表达(2.61±0.673)ng/ml与IC患者(3.05±0.879)ng/ml相比,差异无统计学意义(P>0.05),但二者均高于正常人(0.31±0.092)ng/ml(P<0.05,见图1、表1)。

表1 各组结肠组织中炎症评分和AIF-1、IL-1的表达
注:与正常组比较,*P<0.05;与IC组比较,∆P<0.05。
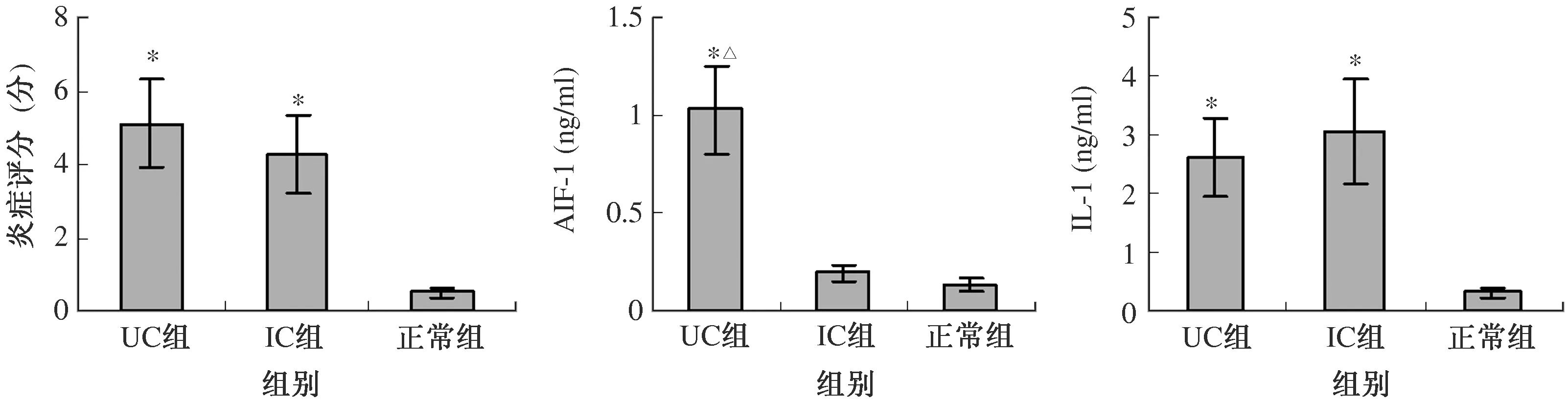
注:与正常组比较,*P<0.05;与IC组比较,∆P<0.05。
2.4 UC及IC患者AIF-1与IL-1表达的相关性在UC患者结肠组织中,AIF-1与IL-1表达水平无相关性(r=0.14,P>0.05);在IC患者结肠组织中,AIF-1与IL-1表达水平也无相关性(r=0.22,P>0.05)。
3 讨论
目前针对UC发病机制的研究多数集中在遗传易感、肠道微生态、机体免疫等几个方面,且彼此有交叉,如遗传易感使得机体免疫容易失衡,结肠黏膜免疫失衡又产生了对肠道内微生物的过度免疫[4]。但这些均不能圆满解释UC发病中肠道炎症持续维持的原因,因此有部分学者认为,遗传易感和肠道微生态只是外因,主要的内因还是机体产生了自身免疫。
自身免疫反应的维持不可避免的需要众多免疫分子和免疫细胞的参与,已有研究证实TNF-α、IL-1、IL-4、IL-10、选择素等众多免疫分子均参与了UC的病理进程。但这些因子多缺乏特异性,不仅在UC疾病中存在,而且在其他自身免疫性疾病及众多非特异性炎症中也广泛存在并起作用。有没有一些特异性高的免疫分子在UC的发病中起着独特的作用,值得进一步探索。
为考察UC特异性的自身免疫特性,本研究选择IC作为对照,IC是一种非特异性以肠道黏膜缺血坏死为特点的炎症反应,并无自身免疫背景,因此比较二者的免疫分子水平差异,可为我们寻找特异性免疫分子指明方向。鉴于IC多发≥50岁的老年患者,且患者往往具有血流动力学异常的发病背景,同时发病部位往往局限于左半结肠,为避免与UC之间炎症水平的差异过大,本研究特选择炎症局限于左半结肠且炎症水平类似于IC的UC病例,并通过统一的病理评分标准来筛选出有比较意义的分组病例。本研究首先比较了UC组和IC组的病理评分,发现二者并无显著性差异,说明选择的UC和IC病例有着大致相同的炎症水平,能在此基础上对免疫分子进行进一步的比较。本研究还发现,UC组与IC组的结肠组织IL-1表达水平无显著差异,也从炎症水平的微观方面证实二者之间具有可比性。
AIF-1是一种重要的炎症因子,其特性为高度保守,与器官移植后排异、自身免疫性疾病等具有自身免疫背景的病理过程有着密切关系[5]。其也参与了类风湿性关节炎、实验性结肠炎、系统性硬化等疾病的发病。本研究发现,在UC患者结肠黏膜组织中,AIF-1的表达明显较正常人高,说明AIF-1确实有可能参与了UC炎症反应的进程,IC患者的结肠组织中AIF-1的表达并未升高,说明AIF-1可能有着鲜明的自身免疫的特点。对比IL-1的表达水平差异似乎更能说明此点,IL-1作为一种有着广泛作用的促炎细胞因子,其介导的炎症反应缺乏特异性,本研究发现UC患者结肠黏膜中IL-1水平较正常人明显升高,这与国内外已有的研究一致[6],这一结果说明在UC患者体内,非特异性的炎症已被激活。本研究同时发现,UC患者与IC患者结肠黏膜中IL-1的表达水平无明显差异,此结果一方面继续证实了IL-1所代表的炎症反应并不具有特异性,另一方面也说明本研究中选择的UC及IC病例AIF-1水平具有可比性。
本研究还发现无论在UC患者还是IC患者体内,AIF-1水平与IL-1水平均无相关性,说明二者虽然都是炎症因子,但在特异性上有着根本的差别,结合已有的关于UC免疫反应的研究成果,可以推测,AIF-1水平可能代表特异性炎症的水平,在UC的炎症维持中起着重要作用,甚至从某种意义上说,与UC的自身免疫特性是一致的;而IL-1的水平并无特异性,其介导的细胞免疫、趋化因子的黏附等炎症病理过程是UC发病机制中的“结果”,仅能代表肠道黏膜损害程度与病理变化[7]。鉴于AIF-1表达水平能够体现UC的特异性炎症,值得在今后的研究中进一步明确AIF-1及其上下游通路在UC发病机制中的作用。
[1]Liu L, Wang X, Zhu ZA. Clinical research of ulcerative colitis combined with gut microflora imbalance [J]. Chin J Gastroenterol Hepatol, 2014, 23(11): 1299-1301.
刘玲, 王鑫, 朱祖安. 溃疡性结肠炎合并肠道菌群失调的临床研究[J]. 胃肠病学和肝病学杂志, 2014, 23(11): 1299-1301.
[2]Thomas S, Baumgart DC. Targeting leukocyte migration and adhesion in Crohn’s disease and ulcerative colitis [J]. Inflammopharmacology, 2012, 20(1): 1-18.
[3]Zhang L, Zhao J, Li C, et al. Cloning and characterization of allograft inflammatory factor-1 (AIF-1) from Manila clam Venerupis philippinarum [J]. Fish Shellfish Immunol, 2011, 30(1): 148-153.
[4]Morohashi T, Iwabuchi K, Watano K, et al. Allograft inflammatory factor-1 regulates trinitrobenzene sulphonic acid-induced colitis [J]. Immunology, 2003, 110(1): 112-119.
[5]Sommerville LJ, Kelemen SE, Ellison SP, et al. Increased atherosclerosis and vascular smooth muscle cell activation in AIF-1 transgenic mice fed a high-fat diet [J]. Atherosclerosis, 2012, 220(1): 45-52.
[6]Wang CZ, Zhou ZY, Luo HS. Clinical and histopathological features of dextran sulfate sodium induced colitis in mice [J]. Chin J Gastroenterol Hepatol, 2014, 23(6): 629-631.
王长征, 周中银, 罗和生. 葡聚糖硫酸钠诱导小鼠实验性结肠炎的临床和组织病理学特征研究[J]. 胃肠病学和肝病学杂志, 2014, 23(6): 629-631.
[7]Teramoto K, Miura S, Tsuzuki Y, et al. Increased lymphocyte trafficking to colonic microvessels is dependent on MAdCAM-1 and C-C chemokine mLARC/CCL20 in DSS-induced mice colitis [J]. Clin Exp Immunol, 2005, 139(3): 421-428.
(责任编辑:王豪勋)
Difference of AIF-1 expression level in colon tissue between ulcerative colitis and ischemic colitis
LIU Xiang, GAN Jingdi, LIN Hong
Department of Gastroenterology, the Second Affiliated Hospital of Guangzhou Medical University, Guangzhou 510260, China
Objective To compare the differences of allograft inflammatory factor-1 (AIF-1) and interleukin-1 (IL-1) expressions in colon tissue between ulcerative colitis (UC) and ischemic colitis (IC), and explore the possibility of the role of AIF-1 in pathogenesis of UC.Methods Intestinal mucosa of 34 patients diagnosed as UC and 31 patients diagnosed as IC from Jan.2010 to Dec.2014 and 12 normal subjects were collected, AIF-1 and IL-1 expression levels were detected by ELISA. Results AIF-1 expression level of UC patients was higher than that in IC patients and normal subjects (P<0.05), but there was no difference between IC patients and normal subjects (P>0.05). There was no difference of IL-1 expression level between UC patients and IC patients (P>0.05), but both were higher than normal subjects (P<0.05). AIF-1 and IL-1 expression levels of IC patients and UC patients had no relevance (P>0.05).Conclusion AIF-1 may be involved in the pathogenesis of UC.
AIF-1; IL-1; Ulcerative colitis; Ischemic colitis; Pathogenesis
10.3969/j.issn.1006-5709.2016.01.013
刘翔,博士,副教授,研究方向:胃肠道微生态及炎症性肠病。E-mail:liuxiang317@sohu.com
R574.62
A
1006-5709(2016)01-0053-03
2015-03-28
