胃癌组织中APPL1和COX-2的表达及其与患者预后的关系
2016-06-05翟俊山宋久刚王艳梅朱超慧
翟俊山,李 楠,宋久刚,王艳梅,朱超慧,吴 凯
解放军第309医院消化内科,北京 100091
胃癌组织中APPL1和COX-2的表达及其与患者预后的关系
翟俊山,李 楠,宋久刚,王艳梅,朱超慧,吴 凯
解放军第309医院消化内科,北京 100091
目的 探讨胃癌组织中APPL1和COX-2蛋白表达情况、二者相关情况及其与患者生存期的关系。方法 应用免疫组织化学SP法检测83例经手术切除石蜡包埋存档胃癌组织中APPL1和COX-2蛋白的表达情况。结果 胃癌组织中APPL1和COX-2表达阳性率分别为60.2%(50/83)、62.7%(52/83)。APPL1的表达与胃癌的浸润深度、淋巴结转移、TNM分期、组织学类型差异有统计学意义(P<0.05);COX-2的表达与胃癌的浸润深度、淋巴结转移、TNM分期差异有统计学意义(P<0.05),而与组织学类型差异无统计学意义(P>0.05)。它们与肿瘤患者年龄、性别差异均无统计学意义(P>0.05)。相关分析结果显示APPL1与COX-2表达呈正相关(P<0.05)。生存曲线研究结果显示APPL1和COX-2表达与患者术后生存时间显著相关(P<0.05)。结论 APPL1和COX-2表达程度与胃癌的浸润深度、淋巴结转移、TNM分期密切相关,影响患者的生存时间。
APPL1;COX-2;胃癌;预后;免疫组化
胃癌的发病率及病死率在我国一直处于高位水平,因目前尚无有效的早期诊断方法,确诊时往往已是中晚期,虽经治疗,生存质量及时间仍受到明显影响[1],提高胃癌的早期诊断及早期治疗对患者预后意义重大。研究肿瘤的发病机制,明确其分子机制,尽可能发掘肿瘤的“关键”分子标志物是目前肿瘤诊断和分子靶向治疗的关键。磷酸酪氨酸衔接蛋白(adaptor protein containing PH domain,PTB domain and leucine zipper motif 1,APPL1)表达产物是细胞内一种功能蛋白,与脂联素结合,传递细胞信号,在多种肿瘤,如结肠癌[2]、肺癌[3]中表达均上调,但尚无在胃癌中表达情况的报道。本文应用免疫组织化学SP法联合检测基因APPL1和环氧化物酶2(COX-2)在经手术切除石蜡包埋的胃癌组织中的表达水平,研究APPL1和COX-2表达产物与胃癌生物学特性的关系,为胃癌的早期诊断及分子靶向治疗提供依据。
1 资料与方法
1.1 一般资料选取解放军第309医院2007年1月-2009年12月确诊为胃癌后经手术切除治疗的患者为研究对象,共83例。从病理科调阅其存档石蜡块进行免疫组织化学SP法染色。83例患者中男56例,女27例,年龄26.1~83.2岁,平均年龄(57.7±10.3)岁。所有病例术前均未予新辅助化疗,术后常规给予化疗。从术后开始随访,随访内容包括患者的一般情况,肿瘤有无复发、转移,术后治疗情况;共随访5年,生存时间超过5年的统一算为5+年,随访过程中失访的算作截尾数据,生存时间以上一次能随访到的时间计算。
1.2 试剂兔抗人APPL1多克隆抗体及APPL1阳性对照片购于上海沪峰生物技术公司;兔抗人COX-2单克隆抗体及COX-2阳性对照片购于北京中杉金桥生物技术有限公司;SP免疫组织化学试剂盒和DAB显色剂购于Invitrogen公司。
1.3 方法(1)免疫组化SP操作方法:对病理科存档石蜡块进行切片,每块切片5张,切片厚度3 μm。分别进行空白、APPL1、COX-2及两种蛋白阳性对照片染色。染色方法按试剂盒说明书进行;(2)结果判断:染色强度评分标准:无色为0分,浅色为1分,中等染色为2分,深染色为3分;染色细胞阳性率评分标准为:没有细胞染色为0分,<10%为1分,10%~50%为2分,>50%为3分。染色强度评分与染色细胞阳性率评分乘积<3记为(-),≥3记为(+)。随机选取10个高倍视野,平均分作为每张切片的最终结果。
1.4 统计学处理采用SPSS 19.0统计软件进行分析,计数资料用χ2检验,相关性分析采用Spearman等级相关,生存率比较采用Log-rank时序检验,预后分析采用Cox多因素回归分析,P<0.05为差异有统计学意义。
2 结果
2.1 胃癌中APPL1和COX-2的表达APPL1蛋白阳性主要为细胞浆着色,COX-2蛋白阳性主要为细胞膜着色,颜色从淡黄色至棕褐色。经过综合判断,APPL1阳性率为60.2%(50/83),COX-2阳性率为62.7%(52/83)(见图1)。
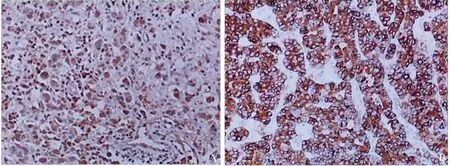
图1 胃癌中APPL1和COX-2的表达(SP 100×) A:APPL1在胃癌中的表达;B:COX-2在胃癌中的表达
2.2 胃癌中APPL1和COX-2表达与临床病理的关系及其相关性APPL1在胃癌中的表达与浸润深度、淋巴结转移、TNM分期、组织学类型差异有统计学意义(P<0.05);COX-2在胃癌中的表达与浸润深度、淋巴结转移、TNM分期差异有统计学意义(P<0.05),与不同的组织学类型差异无统计学意义(P>0.05)。它们与肿瘤患者年龄、性别差异均无统计学意义(P>0.05,见表1)。Spearman相关分析结果显示APPL1与COX-2表达呈正相关,相关系数为0.618(P<0.05)。
2.3 Kaplan-Meier生存分析分别将APPL1和COX-2表达分阳性组和阴性组,绘制生存曲线,进行Log-rank时序检验。分析结果显示APPL1阳性组生存时间为(23.15±11.17)月,显著低于阴性组(32.13±18.19)月(P<0.05); COX-2阳性组生存时间为(23.15±19.34)月,显著低于阴性组(33.13±18.23)月(P<0.05)。
2.4 Cox多因素回归分析对APPL1和COX-2的表达情况、浸润深度、TNM分期、淋巴结转移和年龄、性别分别赋值进行Cox多因素分析表明,除年龄、性别及组织学类型外其他因素均对生存时间有影响(P<0.05)。其中APPL1阳性表达的风险比为1.95(95%CI:1.120~2.724,P<0.05);COX-2阳性表达的风险比为2.12(95%CI:1.376~3.032,P<0.05)。
3 讨论
APPL1共由709个氨基酸组成,定位于3号染色体上,是细胞内的一种功能性蛋白,由Mitsuuchi等[4]于1999年首先发现。APPL1参与细胞信号传递,涉及多个细胞信号通路,介导多种细胞反应。APPL1与脂联素结合,在细胞内有抗氧化、抗动脉硬化、调节炎症反应及平衡血糖等多种功能,越来越受到人们的重视[5]。APPL1在胰腺组织中广泛分布,病理状态下不能正确介导胰岛素调节血糖功能,与胰岛素抵抗和Ⅱ型糖尿病有关[6]。新近实验证实,APPL1还与肝纤维化有关,在肝纤维化患者血清中APPL1明显上升,且随着Child-Pugh分级增加而增高[7]。APPL1介导了结直肠癌缺失基因(deleted in colorectal carcinoma, DCC)的抗细胞凋亡作用,在多种肿瘤组织中,DCC表达缺失,抗凋亡作用受到影响[8]。APPL1还与人表皮生长因子(epidermal growth factor receptor, EGFR)信号通路密切相关,在肿瘤组织中,APPL1参与了EGFR信号通路传递,引起了EGFR信号通路中重要蛋白Rab5a的过度表达[9]。且多个实验已证实,APPL1在多种肿瘤如乳腺癌[10]、卵巢癌[11]中高表达,参与癌症的侵袭转移。本研究中胃癌的浸润深度、淋巴结转移、TNM分期、不同组织学类型均有APPL1的表达水平改变,表明APPL1与胃癌关系密切。环氧化酶(cyclooxygenase,COX)基因与肿瘤增殖及凋亡密切相关,其表达产物COX-2是花生四烯酸代谢过程中的关键酶。COX-2蛋白有促进肿瘤细胞增殖、抑制肿瘤细胞凋亡、逃避生物体内细胞免疫监视作用,促进癌前疾病向肿瘤转化作用[12];且可以诱导血管内皮生长因子分泌,促进肿瘤新生血管形成,支持肿瘤生长[13]。在本研究中,COX-2表达与胃癌的组织学类型差异无统计学意义,考虑COX-2蛋白与肿瘤的组织学起源关系不大。
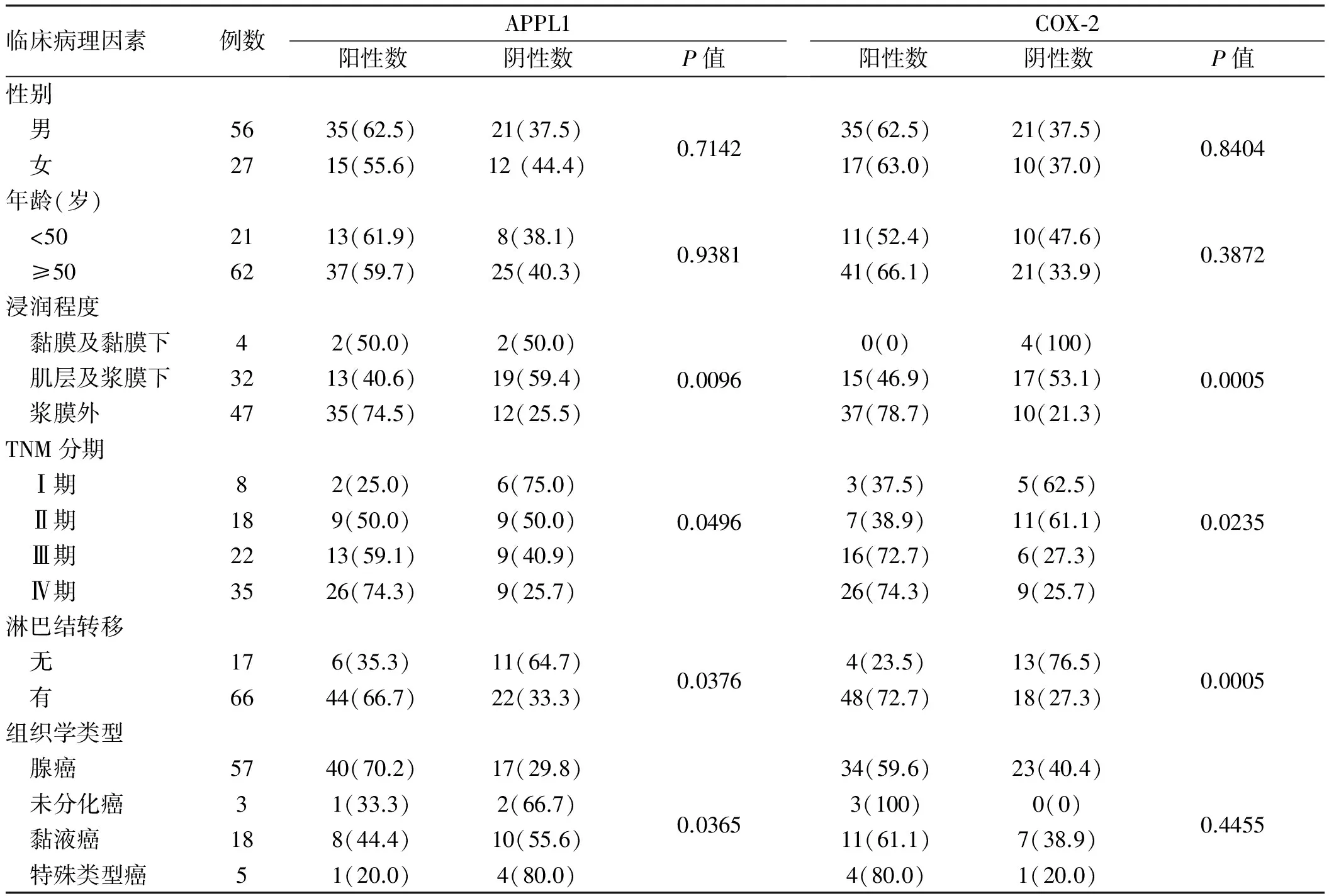
表1 APPL1和COX-2在胃癌表达及与胃癌临床病理之间的关系[例数(%)]
在本研究中,APPL1与COX-2在胃癌表达有相关性,相关系数为0.618。APPL1与COX-2分别涉及多条细胞信号通路,考虑二者在胃癌的发病机制中具有交叉的细胞信号通路。查阅文献得知,MAPK/ERK信号通路可能在其中起了桥梁作用,该信号通路被激活后,上调COX-2分子水平[14]。COX-2可抑制p53在细胞内的聚集,从而抑制细胞凋亡[15],这在恶性肿瘤发生中有重要作用。细胞实验证实APPL1通过竞争性抑制TRB3增强胰岛素刺激的Akt磷酸化,同时通过改变Raf-1的磷酸化位点激活MAPK/ERK信号通路[16]。二者可能就是通过这种内在机制,协同促进胃恶性肿瘤的发生、发展。
我们重点研究了APPL1与COX-2在胃癌组织上蛋白表达的变化及相互关系,结果显示APPL1和COX-2在胃癌组织上均高表达,表明二者均与胃癌的发生密切相关。且在胃癌组织中二者呈正相关,表明二者通过细胞内信号通路具有协同作用。进一步研究二者的内在作用机制,把二者作为同一个靶点,可为胃癌的诊断治疗带来新亮点。
[1]Zhang WD, Miao SJ. Analysis on epidemic characteristics of cancer death rate in China [J]. Chinese Journal of Health Education, 2009, 25(4): 246-248. 张伟东, 苗树军. 我国恶性肿瘤死亡率流行病学特征分析[J]. 中国健康教育, 2009, 25(4): 246-248.
[2]Bidkhori G, Narimani Z, Hosseini Ashtiani S, et al. Reconstruction of an integrated genome-scale co-expression network reveals key modules involved in lung adenocarcinoma [J]. PLoS One, 2013, 8(7): e67552.
[3]Rao HM, Qiu F, Sun Y, et al. The expression of APPL1 and VEGF-C in colorectal cancer tissues and their correlation [J]. Journal of Colorectal & Anal Surgery, 2013, 19(1): 5-9. 饶惠民, 邱堃, 孙羽, 等. APPL1与VEGF-C在结直肠腺癌中的表达及相关性研究[J]. 结直肠肛门外科, 2013, 19(1): 5-9.
[4]Mitsuuchi Y, Johnson SW, Sonoda G, et al. Identification of a chromosome 3p14.3-21.1 gene, APPL, encoding an adaptor molecule that interacts with the oncoprotein-serine/threonine kinase AKT2 [J]. Oncogene, 1999, 18(35): 4891-4898.
[5]Tu Q, Zhang J, Dong LQ, et al. Adiponectin inhibits osteoclastogenesis and bone resorption via APPL1-mediated suppression of Akt1 [J]. J Biol Chem, 2011, 286(14): 12542-12553.
[6]Cheng KK, Lam KS, Wang B, et al. Signaling mechanisms underlying the insulin-sensitizing effects of adiponectin [J]. Best Pract Res Clin Endocrinol Metab, 2014, 28(1): 3-13.
[7]Zhong YD, Hu ZL, Xiong QF, et al. Relationship of serum APPL1 and Child-Pugh classification in hepatitis B liver cirrhosis patients [J]. Chinese Hepatology, 2014, 19(11): 854-856. 钟艳丹, 胡志亮, 熊清芳, 等. 乙型肝炎肝硬化患者血清APPL1水平与Child-Pugh分级的关系[J]. 肝脏, 2014, 19(11): 854-856.
[8]Liu J, Yao F, Wu R, et al. Mediation of the DCC apoptotic signal by DIP13 alpha [J]. J Biol Chem, 2002, 277(29): 26281-26285.
[9]Zhao Z, Liu XF, Wu HC, et al. Rab5a overexpression promoting ovarian cancer cell proliferation may be associated with APPL1-related epidermal growth factor signaling pathway [J]. Cancer Sci, 2010, 101(6): 1454-1462.
[10]Chen Q, Liu WY, Zhao Z, et al. Expression and significance of Rab5a and APPL1 in breast cancer [J]. Zhonghua Zhong Liu Za Zhi, 2012, 34(11): 838-841.
[11]Zhao Z, Liu XF, Wu HC, et al. Rab5a overexpression promoting ovarian cancer cell proliferation may be associated with APPL1-related epidermal growth factor signaling pathway [J]. Cancer Sci, 2010, 101(6): 1454-1462.
[12]Misra S, Sharma K. COX-2 signaling and cancer: new players in old arena [J]. Curr Drug Targets, 2014, 15(3): 347-359.
[13]Kim NK, Park JK, Shin E, et al. The combination of nuclear factor kappa B, cyclo-oxygenase-2 and vascular endothelial growth factor expression predicts poor prognosis in stage Ⅱ and Ⅲ colorectal cancer [J]. Anticancer Res, 2014, 34(11): 6451-6457.
[14]Wang ZL, Fan ZQ, Jiang HD, et al. Selective Cox-2 inhibitor celecoxib induces epithelial-mesenchymal transition in human lung cancer cells via activating MEK-ERK signaling [J]. Carcinogenesis, 2013, 34(3): 638-646.
[15]Khajeniazi S, Allameh A, Soleimani M, et al. Changes in COX-2 and oxidative damage factors during differentiation of human mesenchymal stem cells to hepatocyte-like cells is associated with downregulation of P53 gene [J]. Biol Chem, 2013, 394(9): 1213-1222.
[16]Tian C, Jin X, Ye X, et al. Long term intake of 0.1% ethanol decreases serum adiponectin by suppressing PPARγ expression via p38 MAPK pathway [J]. Food Chem Toxicol, 2014, 65(1): 329-334.
(责任编辑:马 军)
Expressions of APPL1 and COX-2 in gastric carcinoma and relationship with the prognosis of patients
ZHAI Junshan, LI Nan, SONG Jiugang, WANG Yanmei, ZHU Chaohui, WU Kai
Department of Gastroenterology, the 309 Hospital of PLA, Beijing 100091, China
Objective To investigate the expressions of APPL1 and COX-2 in gastric carcinoma and relationship with the prognosis of patients.Methods The expressions of APPL1 and COX-2 were detected by immunohistochemical methods in 83 paraffin-embedding surgical resection specimens.Results The positive expression rates of APPL1 and COX-2 were 60.2% (50/83), 62.7% (52/83). The expression of APPL1 was notably correlated with the depth of invasion, lymph nodes metastasis, TNM stage, pathologic type in gastric carcinoma (P<0.05); The expression of COX-2 was notably correlated with the depth of invasion, lymph nodes metastasis, TNM stage in gastric carcinoma (P<0.05), but not related to the pathologic type (P>0.05). Both of them were not correlated with the age and sex (P>0.05). The expression of APPL1 was positively correlated with COX-2. The expressions of APPL1 and COX-2 were correlated with the survival time of postoperative patients (P<0.05).Conclusion The expressions of APPL1 and COX-2 are obviously correlated with the depth of invasion, lymph nodes metastasis, TNM stage in gastric carcinoma and affect the survival time of postoperative patients.
APPL1; COX-2; Gastric carcinoma; Prognosis; Immunohistochemistry
国家自然科学基金(81101852)
翟俊山,主治医师,研究方向:胃癌分子生物学。E-mail:fmmuzjs@163.com
李楠,博士,主任医师,研究方向:胃癌分子生物学。E-mail:xhk309@126.com
10.3969/j.issn.1006-5709.2016.01.004
R735.2
A
1006-5709(2016)01-0016-04
2015-04-02
