胃癌组织中BNIP3基因甲基化及其与DNMT1表达的关系
2016-06-05王学淳姜相君
高 燕,王学淳,姜相君
青岛市市立医院1.消化内二科;2.放射科,山东 青岛 266000
胃癌组织中BNIP3基因甲基化及其与DNMT1表达的关系
高 燕1,王学淳2,姜相君1
青岛市市立医院1.消化内二科;2.放射科,山东 青岛 266000
目的 探讨人胃癌组织DNMT1表达及其与BNIP3基因甲基化状态的关系。方法 收集120例手术切除并经病理学证实的胃癌组织及其相应的癌旁正常组织,采用甲基化特异性PCR(MSP)方法检测胃癌组织及其相应癌旁组织BNIP3基因甲基化状态,采用免疫组化SP法检测BNIP3基因及DNMT1基因的蛋白表达水平。结果 120例胃癌组织中有72例发生了BNIP3基因甲基化,甲基化阳性率为60.0%,其相应癌旁正常组织有5例发生了BNIP3甲基化,甲基化阳性率为4.2%,差异有统计学意义(χ2=85.839,P<0.01),胃癌组织中BNIP3基因甲基化状态与患者性别、年龄、肿瘤大小、肿瘤分期无相关性(P>0.05),而与分化程度及淋巴结转移情况有相关性(P<0.05),胃癌组织中BNIP3蛋白的表达率为17.5%(21/120),显著低于其癌旁正常组织(80.0%,96/120),差异有统计学意义(χ2=93.809,P<0.01),胃癌组织中DNMT1蛋白的表达率为75.0%(90/120),显著高于其癌旁正常组织(5.8%,7/120),差异有统计学意义(χ2=119.195,P<0.01)。胃癌组织中BNIP3蛋白与DNMT1蛋白的表达呈负相关(r=-0.542,P<0.01)。结论 DNMT1高表达可能导致BNIP3蛋白表达减少,从而参与了胃癌的发生。
胃癌;甲基化特异性PCR;Bcl-2/腺病毒E1B 19k Da结合蛋白3;DNA甲基转移酶1
胃癌严重危害人类健康,是消化系统常见恶性肿瘤之一,最近的一项统计数据显示,2012年胃癌新发病例95万1 600人,死亡72万3 100人,男性发病率约为女性的2倍[1]。胃癌的发生有着明显的地域差别,全世界一半以上的胃癌发生在东亚,特别是中国[2]。
DNA甲基转移酶1(DNA methyl-transferase 1, DNMT1)是催化DNA甲基化的主要酶,主要负责DNA复制后甲基化状态的维持,其异常表达通常伴有全基因组、癌基因的低甲基化及抑癌基因的高甲基化,前者使细胞核型不稳定,突变率增加及癌基因激活,后者使抑癌基因失活。
Bcl-2/腺病毒E1B 19 kDa结合蛋白3(bcl-2/adenovirus E1B 19 kDa interacting protein 3, BNIP3)是bcl-2家族成员之一,含有BH3结构域,具有促凋亡作用,属于抑癌基因,可以直接促进肿瘤细胞凋亡[3]。BNIP3是一个与腺病毒E1B 19 kDa相互作用的蛋白,它可因缺氧而表达上调,诱导肿瘤细胞凋亡,也可因DNA甲基化而表达沉默,从而导致肿瘤的发生、发展。BNIP3基因甲基化导致其表达失活,是参与胃癌发生、发展的重要机制。Erkan等[4]的研究表明,胰腺癌中BNIP3基因甲基化使其表达缺失引起化疗抵抗,导致预后不良。之前的研究未分析BNIP3基因的甲基化水平与DNMT1高表达之间的关系,BNIP3基因发生甲基化是否是由DNMT1高表达所致。本研究选取120例胃癌组织及其相应癌旁组织,检测BNIP3基因启动子区甲基化情况及DNMT1的表达情况,探讨其在胃癌发生、发展过程中的作用。
1 资料与方法
1.1 一般资料选取2013年1月-2014年12月在青岛市市立医院普外科手术切除的胃癌标本120例,男68例,女52例,年龄33~85岁,平均年龄(62.3±2.25)岁,所有标本均经病理学证实且术前未行放化疗治疗,同时收集相应的癌旁正常组织作为对照,癌旁组织取自距离癌组织5 cm以上区域。其中80例属于TNM分期中的Ⅰ期或Ⅱ期,40例为Ⅲ期或Ⅳ期,有淋巴结转移72例,无淋巴结转移48例。标本离体后快速冻存于液氮,取出后立即置于-80 ℃冰箱内保存备用。所用标本均取两份,一份用于DNA提取,另一份置于中性甲醛溶液中固定24 h,用于免疫组化法蛋白检测。
1.2 实验步骤
1.2.1 基因组DNA提取:按照TIANGEN组织DNA提取试剂盒说明书进行DNA提取,提取后经紫外分光光度计法检测DNA的浓度及纯度,-20 ℃条件下保存备用。
1.2.2 DNA亚硫酸氢钠修饰及纯化回收:按照EZ DNA Methylation-GoldTMkit试剂盒(D5005)说明书的操作要求对DNA进行修饰及纯化,回收纯化的DNA。
1.2.3 甲基化特异性PCR(MSP):取修饰后的DNA进行PCR扩增反应,具体步骤参照说明书进行。BNIP3甲基化及非甲基化引物见表1。反应总体积25 μl:上下游引物各1 μl,已修饰的DNA模板2 μl,10×Buffer 3 μl,2.5 mmol/L dNTPs 2 μl,TransTaqTMHiFi DNA Polymerase 0.3 μl,ddH2O 15.7 μl。PCR反应条件:95 ℃预变性7 min,95 ℃ 10 s,55 ℃ 10 s,72 ℃ 8 s,共40个循环,最后72 ℃延伸1 min。取扩增后的PCR产物行1.5%琼脂糖电泳,用凝胶成像分析仪观察并分析结果、拍照。

表1 BNIP3基因甲基化特异性PCR引物序列
1.2.4 免疫组化SP法:所有标本经4%的多聚甲醛固定,石蜡包埋,4 μm厚连续切片,DAB显色,苏木素复染,梯度酒精脱水,二甲苯透明,中性树胶封片,显微镜阅片。结果判定:阳性对照采用已知表达阳性的切片,阴性对照采用PBS缓冲液代替一抗。BNIP3蛋白主要表达于细胞质内,阳性染色细胞为胞质内出现棕黄色颗粒,DNMT1蛋白主要表达于细胞核中。依据阳性细胞百分率和着色强度半定量积分法[5]判断结果:阳性细胞百分率<5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,>76%为4分;显色强度以多数细胞呈色反应为准,无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分两积分相乘,0分为阴性(-),1~4分为弱阳性(+),5~8分为阳性(++),9~12分为强阳性(+++),将阴性与弱阳性视为阴性表达,阳性与强阳性视为阳性表达。
1.3 统计学方法采用SPSS 13.0软件进行统计学分析。两样本率的比较采用χ2检验或Fisher精确概率法。两种蛋白表达的相关性分析采用Spearman相关性分析。P取双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1 BNIP3基因在胃癌组织及其相应癌旁组织的甲基化状态BNIP3在胃癌组织及其相应癌旁组织的甲基化阳性率分别为60.0%(72/120)和4.2%(5/120),两者相比,差异有统计学意义(χ2=85.839,P<0.01)。
2.2 胃癌组织中BNIP3基因甲基化状态与患者临床病理特征的关系BNIP3基因甲基化阳性率与胃癌患者的性别、年龄、肿瘤大小、肿瘤分期无相关性(P>0.05),而与分化程度、淋巴结转移等临床病理特征有相关性(P<0.05,见表2)。
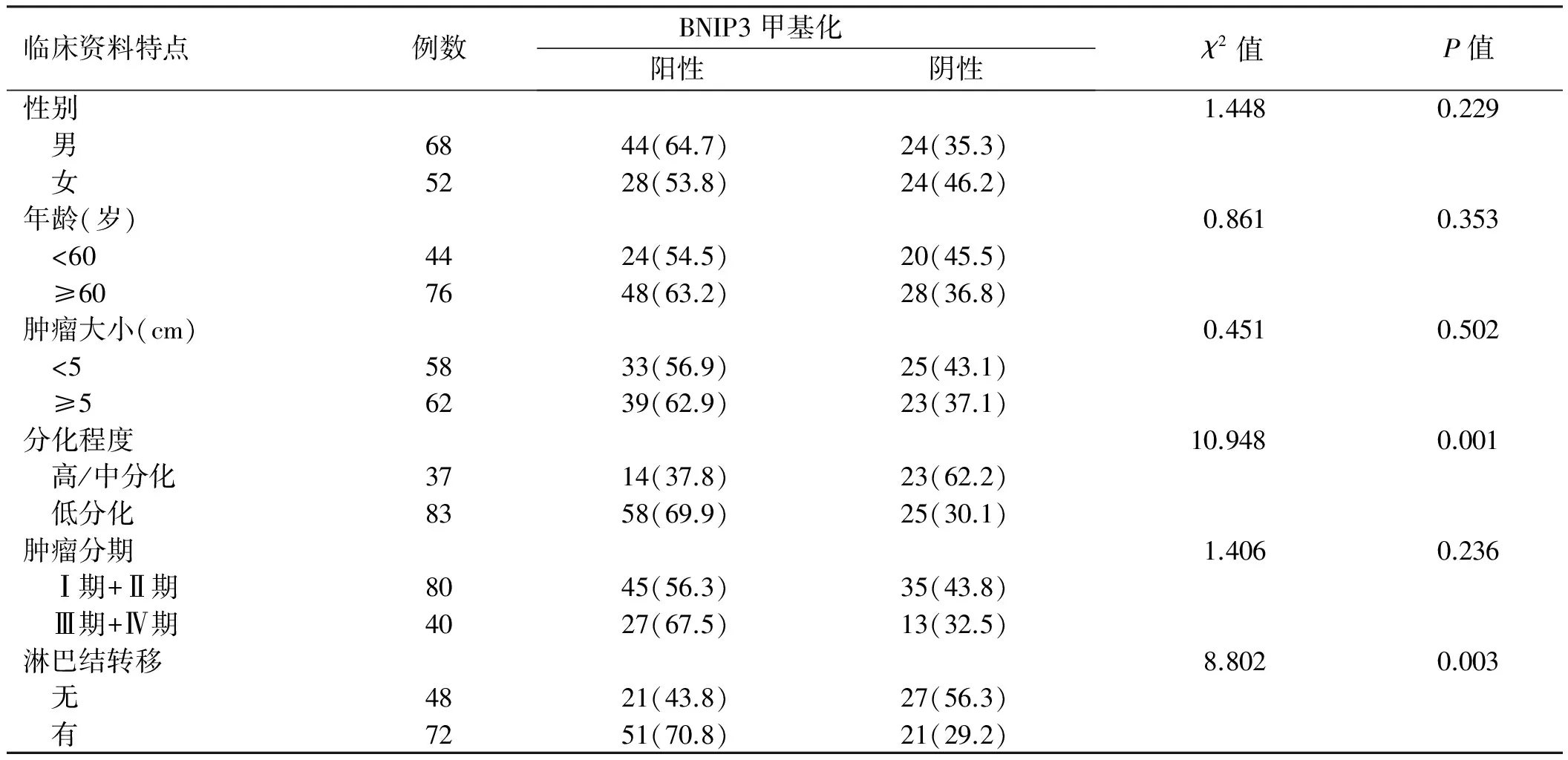
表2 胃癌组织BNIP3基因甲基化与患者临床资料特点的关系[例数(%)]
2.3 胃癌组织及其相应癌旁组织中BNIP3蛋白和DNMT1蛋白表达情况BNIP3蛋白在胃癌组织中的阳性表达率为17.5%(21/120),其癌旁正常组织的阳性表达率为80.0%(96/120),两者相比,差异有统计学意义(χ2=93.809,P<0.01),DNMT1蛋白在胃癌组织中的阳性表达率为75.0%(90/120),在相应癌旁组织的阳性表达率为5.8%(7/120),差异有统计学意义(χ2=119.195,P<0.01)。BNIP3蛋白主要表达于细胞质中,DNMT1蛋白主要表达于细胞核中(见图1~2)。

图1 BNIP3蛋白在胃癌组织及癌旁正常胃组织的表达(SP 200×) A:胃癌组织;B:癌旁正常组织;图2 DNMT1蛋白在胃癌组织及癌旁正常组织的表达(SP 200×) A:胃癌组织;B:癌旁正常组织
2.4 胃癌组织DNMT1蛋白表达与BNIP3蛋白表达的相关性结果显示:胃癌组织中BNIP3蛋白与DNMT1蛋白的表达呈负相关(r=-0.542,P<0.01,见图3)。
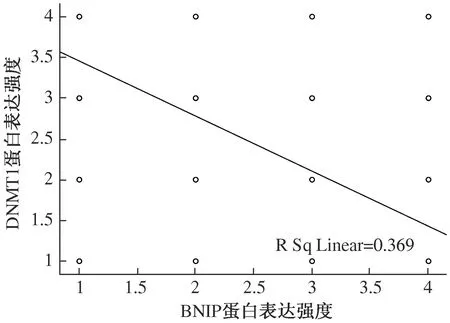
注:坐标轴上1、2、3、4分别代表蛋白表达强度(-)、(+)、(++)、(+++)。
图3 胃癌组织中BNIP3蛋白与DNMT1蛋白表达关系散点图
Fig 3 The scatter plot of the relationship between BNIP3 and DNMT1 protein
3 讨论
胃癌的发生是一个多因素参与、多基因、多步骤相互作用的复杂过程,其机制涉及遗传学及表观遗传学改变。表观遗传学变化是指在不改变DNA序列的情况下,基因表达发生可遗传变异的现象,主要包括DNA甲基化、组蛋白修饰、染色体重塑及非编码RNA调控,其中对DNA甲基化的研究最广泛且是当前研究的热点。异常的DNA甲基化可以导致抑癌基因在转录水平沉默,从而导致肿瘤的发生、发展。
DNA甲基化是抑癌基因表达沉默的一种常见机制,大量研究表明,许多肿瘤发生、发展过程中存在DNA的异常甲基化。异常的DNA甲基化表现为全基因组、癌基因的低甲基化及抑癌基因的高甲基化,它是恶性肿瘤基本特征之一。DNA甲基转移酶(DNMTs)是催化、维持DNA甲基化状态的重要生物酶家族,其家族成员DNMT1主要负责DNA复制后甲基化状态的维持,DNMT1表达上调可促进DNA异常甲基化。已有研究证实,DNMT1在前列腺癌[6]、胰腺癌[7]、肾透明细胞癌[8]及Burkitt淋巴瘤[9]等恶性肿瘤中高表达。此外,刘斌等[10]研究发现,胃癌组织中的DNMT1活性显著升高,DNMT1蛋白阳性表达率显著高于其相应癌旁组织,这与我们实验室之前的研究结果具有一致性[11-12]。本次实验发现:DNMT1蛋白在胃癌组织中的阳性表达率为75.0%(90/120),在相应癌旁组织的阳性表达率为5.8%(7/120),差异有统计学意义,也证明了DNMT1蛋白的高表达可能参与了胃癌的发生。
人的BNIP3基因全长1 535 bp,定位于10q26.3,属于一种抑癌基因,在恶性肿瘤中发挥促凋亡作用。肿瘤细胞中BNIP3基因的异常甲基化,抑制其基因表达,从而使肿瘤细胞逃避缺氧诱导的细胞凋亡。Hiraki等[13]应用MSP方法对结直肠癌组织及癌旁正常组织进行甲基化状态检测,发现癌组织BNIP3基因甲基化水平显著高于癌旁正常组织,且BNIP3甲基化可能成为预测S-1/CPT-11联合治疗结直肠癌低反应性的一个分子标志物。本研究显示:120例胃癌标本,癌组织中有72例发生了BNIP3基因甲基化,甲基化阳性率显著高于其相应的癌旁组织,胃癌组织中BNIP3蛋白阳性表达率显著低于其相应的癌旁组织。因此,我们推断,正是由于BNIP3基因发生了甲基化,导致蛋白低表达,制约了其促凋亡功能的发挥,从而促进了胃癌的发生、发展。
本次实验探讨了DNMT1表达与BNIP3基因甲基化状态的关系,根据实验结果我们推测胃癌组织DNMT1的高表达使BNIP3基因启动子区发生甲基化,蛋白表达下调。An等[14]应用U0126抑制MEK信号通路,结果减少了DNMT1的表达,且恢复了缺氧诱导的BNIP3的表达,这表明BNIP3启动子区的甲基化是DNMT1通过MEK信号转导通路调节的。这进一步支持了我们的推测。同时我们采用Spearman相关性分析,探讨了BNIP3蛋白与DNMT1蛋白表达的关系,结果发现,这两个蛋白之间的表达呈负相关。
胃癌是严重影响居民健康的消化道恶性肿瘤,寻找胃癌发生过程中的分子标志物对于其早期诊断、治疗是十分重要的。BNIP3基因甲基化是胃癌发生的重要分子生物学机制,并且其甲基化是可逆的。Abe等[15]应用甲基转移酶抑制剂使甲基化的BNIP3基因去甲基化,结果恢复了胰腺癌中BNIP3基因的表达,诱导了缺氧介导的肿瘤细胞死亡。Liu等[16]的研究表明,BNIP3基因在肝细胞癌、结肠癌中均发生了甲基化,使用轮枝孢菌素A使BNIP3基因启动子区去甲基化,BNIP3基因表达上调,可以帮助人类癌症治疗过程中克服化疗药物抵抗,增强肿瘤细胞对凋亡的敏感性。因此,检测BNIP3基因的甲基化状态有助于胃癌的筛查、诊断,去甲基化剂的应用有望成为胃癌治疗的新靶点。我们以后还需要更多大样本、多基因的实验,建立完备的胃癌相关基因甲基化谱,为胃癌的诊断、治疗提供新策略。
[1]Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012 [J]. CA Cancer J Clin, 2015, 65(2): 87-108.
[2]Ang TL, Fock KM. Clinical epidemiology of gastric cancer [J]. Singapore Med J, 2014, 55(12): 621-628.
[3]Li LJ, Tang SS. Research advancement on BNIP3 in regulating tumor cell autophagy and death [J]. J Clin Pathol Res, 2014, 34(6): 779-785. 李丽君, 唐圣松. BNIP3调控肿瘤细胞自噬及凋亡的研究进展[J]. 临床与病理杂志, 2014, 34(6): 779-785.
[4]Erkan M, Kleff J, Esposito I, et al. Loss of BNIP3 expression in a late event in pancreatic cancer contributing to chemoresistance and worsened prognosis [J]. Oncogene, 2005, 24(27): 4421-4432.
[5]Xu LZ, Yang WT. The judgment standard of immunohistochemistry results [J].China Oncology, 1996, 6(4): 229 -231. 许良中,王文涛.免疫组织化学反应结果的判断标准[J].中国癌症杂志, 1996, 6(4): 229-231.
[6]Zhang W, Jiao H, Zhang X, et al. Correlation between the expression of DNMT1, and GSTP1 and APC, and the methylation status of GSTP1 and APC in association with their clinical significance in prostate cancer [J]. Mol Med Rep, 2015, 12(1): 141-146.
[7]Li A, Omura N, Hong SM, et al. Pancreatic cancer DNMT1 expression and sensitivity to DNMT1 inhibitors [J]. Cancer Biol Ther, 2011, 9(4): 321-329.
[8]Li M, Wang Y, Song Y, et al. Aberrant DNA methyltransferase 1 expression in clear cell renal cell carcinoma development and progression [J]. Chin J Cancer Res, 2014, 26(4): 371-381.
[9]Robaina MC, Mazzoccoli L, Arruda VO, et al. Deregulation of DNMT1, DNMT3B and miR-29s in Burkitt lymphoma suggests novel contribution for disease pathogenesis [J]. Exp Mol Pathol, 2015, 98(2): 200-207.
[10]Liu B, Gu LP, Xing CP, et al. Clinical significance and association of caveolin-1 and DNMT1 gene with carcinogenesis, development of gastric carcinomas [J]. World Chinese Journal of Digestology, 2009, 17(15): 1561-1566. 刘斌, 顾立萍, 邢传平, 等. Caveolin-1、DNMT1基因与胃癌发生发展的关系及其临床意义[J]. 世界华人消化杂志, 2009, 17(15): 1561-1566.
[11]Jiang XJ, Chu LL, Cui YX, et al. Relationship between promoter methylation of the Runx3 and Rassf1a genes and DNMT1 expression in gastric cancer [J]. World Chinese Journal of Digestology, 2012, 20(35): 3457-3463. 姜相君, 初蕾蕾, 崔艳欣, 等. Runx3、Rassf1a基因启动子在胃癌组织中的高甲基化及DNMT1的表达[J]. 世界华人消化杂志, 2012, 20(35): 3457-3463.
[12]Yu YP, Li CY, Huang GN, et al. Methylation of the PCDH8 promoter and DNMT1 expression in gastric cancer [J]. Chin J of Oncol Prev and Treat, 2014, 6(3): 261-264. 于云鹏, 李长严, 黄冠男, 等. 胃癌组织中PCDH8基因甲基化及DNMT1表达的关系[J]. 中国癌症防治杂志, 2014, 6(3): 261-264.
[13]Hiraki M, Kitajima Y, Nakafusa Y, et al. CpG island methylation of BNIP3 predicts resistance against S-1/CPT-11 combined therapy in colorectal cancer patients [J]. Oncol Rep, 2010, 23(1): 191-197.
[14]An HJ, Lee H, Paik SG. Silencing of BNIP3 results from promoter methylation by DNA methyltransferase 1 induced by the mitogen-activated protein kinase pathway [J]. Mol Cells, 2011, 31(6): 579-583.
[15]Abe T, Toyota M, Suzuki H, et al. Upregulation of BNIP3 by 5-aza-2′-deoxycytidine sensitizes pancreatic cancer cells hypoxia mediated cell death [J]. Gastroenterol, 2005, 40(5): 504-510.
[16]Liu F, Liu Q, Yang D, et al. Verticillin A overcomes apoptosis resistance in human colon carcinoma through DNA methylation-dependent upregulation of BNIP3 [J]. Cancer Res, 2011, 71(21): 6807-6816.
(责任编辑:马 军)
Relationship between promoter methylation of BNIP3 gene and DNMT1 expression in gastric cancer
GAO Yan1, WANG Xuechun2, JIANG Xiangjun1
1.Department of NO.2 Gastroenterology; 2.Department of Radiology, Qingdao Municipal Hospital, Qingdao 266000, China
Objective To investigate the relationship between the expression of DNMT1 and BNIP3 methylation in gastric cancer.Methods One hundred and twenty patients with gastric cancer were enrolled in our study. All samples cancerous and corresponding adjacent normal gastric mucosa were obtained surgically and confirmed pathologically. The methylation status of BNIP3 gene promoter was detected by Methylation-specific PCR, while the expressions of BNIP3 and DNMT1 proteins were measured by immunohistochemistry.Results Seventy-two cases showed a methylation of BNIP3 promoter in samples of tumorous tissue among 120 patients, the methylation frequency was 60.0%, which was 4.2% in samples of adjacent normal tissue (χ2=85.839,P<0.01). The BNIP3 methylation status was not related with age, gender, tumor size, TNM stage in gastric cancer tissues (P>0.05), but related with differentiation degree and lymph node metastasis. BNIP3 protein showed a significantly lower level in cancerous tissue than that in normal gastric tissue (17.5%vs80.0%,χ2=93.809,P<0.01), while DNMT1 protein showed a significantly higher level (75.0%vs5.8%,χ2=58.79,P<0.001) in cancerous tissue than that in normal gastric tissue (χ2=119.195,P<0.01). The expression of BNIP3 protein was negatively correlated with DNMT1 protein (r=-0.542,P<0.01).Conclusion The high expression of DNMT1 may induce the low expression of the BNIP3 protein, which may be associated with the occurrence of gastric cancer.
Gastric cancer; Methylation-specific PCR; Bcl-2/adenovirus E1B 19 kDa interacting protein 3; DNA methyl-transferase 1
青岛市公共领域科技支撑计划(2012-1-3-1-(10)-nsh)
高燕,硕士在读。研究方向:消化道肿瘤的早期诊疗。E-mail:623339774@qq.com
姜相君,主任医师,研究方向:消化道肿瘤的早期诊疗。E-mail:drjxj@163.com
10.3969/j.issn.1006-5709.2016.01.006
R735.2
A
1006-5709(2016)01-0024-05
2015-06-12
