人胃癌组织中γδT细胞亚群变化及意义
2016-06-05陈新孚刘军权陈光侠吕小婷费素娟
陈新孚,刘 建,刘军权,陈光侠,吕小婷,朱 云,费素娟
1. 徐州市第一人民医院消化科,江苏 徐州 221002;2. 徐州市第六人民医院血液科;3. 解放军第97医院消化科 生物治疗中心;4. 徐州医学院附属医院消化科
人胃癌组织中γδT细胞亚群变化及意义
陈新孚1,刘 建2,刘军权3,陈光侠1,吕小婷3,朱 云3,费素娟4
1. 徐州市第一人民医院消化科,江苏 徐州 221002;2. 徐州市第六人民医院血液科;3. 解放军第97医院消化科 生物治疗中心;4. 徐州医学院附属医院消化科
目的 通过检测人胃癌组织中γδT细胞及其亚群多种效应分子、细胞因子的水平,了解γδT细胞及其亚群的功能变化及意义。方法 选取手术切除的新鲜胃癌组织和正常胃组织(距离癌灶边缘>5 cm)标本,采用Ⅱ型胶原酶等酶消化法分离成单细胞悬液;流式细胞术检测γδT细胞颗粒酶B、穿孔素、CD107a和IL-17A、IFN-γ的水平。结果 (1)胃癌组织中CD27+γδT细胞比例显著高于CD27-γδT细胞的比例及正常胃组织中CD27+γδT细胞比例(P<0.05);(2)胃癌组织中γδT细胞IL-17A的分泌水平明显高于正常胃组织(P<0.05),而颗粒酶B、穿孔素、CD107a等抗肿瘤效应分子的表达与正常胃组织比较,差异无统计学意义(P>0.05);(3)CD27+γδT细胞IL-17A的分泌水平显著高于CD27-γδT细胞(P<0.01),且其在胃癌组织中明显高于正常胃组织(P<0.05),在Ⅲ/Ⅳ期胃癌组织明显高于Ⅰ/Ⅱ期胃癌组织(P<0.05)。结论 (1)胃癌组织中的γδT细胞分泌IL-17A明显增高;(2)CD27+γδT细胞亚群是胃癌组织中γδT细胞的优势亚群,并可能通过分泌细胞因子IL-17A参与胃癌的发生、发展。
胃癌;γδT细胞;CD27;IL-17A
根据T细胞受体(T cell receptor,TCR)的不同人体内T细胞分为两大类,即γδT细胞和αβT细胞。γδT细胞多为CD4-CD8-的双阴性T细胞(少部分为CD8+),由TCR信号途径调节表达的锌指转录因子ThPOK控制着γδT细胞的发育和成熟[1-2]。目前关于γδT细胞与肿瘤之间关系的研究已受到广泛关注。但关于胃癌微环境中γδT细胞的功能活性的研究报道较少,因此,本实验检测了人胃癌组织中γδT细胞及其亚群的变化。
1 资料与方法
1.1 一般资料选取徐州医学院附属医院2013年7月-2014年8月住院行手术治疗的胃癌患者21例,标本采集之前患者均未进行过放、化疗,且无HIV、病毒性肝炎及自身免疫性疾病史,未使用过免疫抑制剂。所有患者术后均经病理诊断证实为胃癌。男14例,女7例,年龄33~79岁,中位年龄58岁。所有患者均按照国际抗癌协会临床TNM分期标准进行分期,其中TNM Ⅰ/Ⅱ期组9例,TNM Ⅲ/Ⅳ期组12例。
1.2 主要试剂和仪器Ⅱ型胶原酶、透明质酸酶及DNA酶Ⅰ(Sigma公司);FITC标记的鼠抗人穿孔素、CD107A、IFN-γ,APC标记的鼠抗人γδTCR,Percp-Cy5.5标记的鼠抗人CD27,PE标记的鼠抗人IL-17A、颗粒酶 B、淋巴细胞活化剂、固定剂及破膜剂(以上抗体均为BD Biosciences公司);RPMI 1640培养基、胎牛血清(Gibco公司);流式细胞仪(BD Biosciences公司)。
1.3 方法
1.3.1 单细胞悬液的制备:由手术切除的胃癌患者胃组织中获取约2 g新鲜胃癌组织和2 g正常胃组织(距离癌灶边缘>5 cm)标本,在超净台上去除脂肪和组织表面的血液和黏液。分析天平称重并记录组织重量,无菌生理盐水清洗,剪刀剪碎,放置于RPMI 1640培养液中,加入Ⅱ型胶原酶、透明质酸酶及DNA酶Ⅰ,37 ℃恒温水浴箱中振荡消化,3~5 min振荡一次,30 min后提取已消化的细胞悬液,200目滤网过滤,取滤过液离心,弃上清,RPMI 1640液洗涤后加入Percoll分离液中,1 800 r/min离心15 min,分别吸取各密度层的细胞,RPMI 1640液洗涤2次,收集细胞进行相关实验研究。
1.3.2 γδT细胞(及CD27+/-γδT细胞)穿孔素、粒酶B、CD107a的检测:采用RPMI 1640培养液(含100 ml/L小牛血清)将淋巴细胞层的细胞调整为1×109/L,离心后加入APC Mouse Anti-Human γδTCR 5 μl和PerCP-Cy5.5 Mouse Anti-Human CD27 5 μl,重悬后室温避光孵育15 min,再依次加入Fix&Perm中的Reagent A、B各100 μl,重悬后室温避光孵育15 min,PBS液洗涤,分别加入PE Mouse Anti-Human Granzyme B 5 μl、FITC Mouse Anti-Human Perforin 20 μl和FITC Mouse Anti-Human CD107a 5 μl,重悬并室温避光孵育15 min,PBS液洗涤后流式细胞仪检测,BD FACS Diva软件分析。
1.3.3 γδT细胞(及CD27+/-γδT细胞)IL-17A和IFN-γ的检测:RPMI 1640培养液(含100 ml/L小牛血清)将淋巴细胞层的细胞调整为1×109/L,加入BD LEUKO ACTVTN GolgiPlug 2 μl置于37 ℃,5% CO2培养箱培养4~6 h,然后按顺序分别加入APC Mouse Anti-Human γδTCR 5 μl、PerCP-Cy5.5 Mouse Anti-Human CD27 5 μl、Fix&Perm Reagent A、B各100 μl并重悬室温避光孵育,加入PE Mouse Anti-Human IL-17A 20 μl和FITC Mouse Anti-Human IFN-γ 2 μl,室温避光孵育后用PBS液洗涤,流式细胞仪检测,BD FACS Diva软件分析。
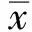
2 结果
2.1 胃癌组织和正常胃组织中γδT细胞及其亚群的比例胃癌组织中CD27+γδT细胞比例(68.40±1.94)%明显高于正常胃组织(58.98±3.46)%,CD27-γδT细胞比例(31.60±1.94)%则明显低于正常胃组织(41.02±3.46)%(P<0.05)。胃癌组织中CD27+γδT细胞比例较CD27-γδT细胞比例明显升高(P<0.01)。但胃癌组织中γδT细胞比例(11.91±0.81)%与正常胃组织中γδT细胞比例(11.74±0.98)%比较,差异无统计学意义(P>0.05,见图1A)。
2.2 胃癌组织和正常胃组织中γδT细胞颗粒酶B、穿孔素和CD107a表达水平的比较胃癌组织中γδT细胞颗粒酶B(18.19±1.06)%、穿孔素(7.99±0.88)%和CD107a(90.52±1.11)%的表达水平与正常胃组织中γδT细胞颗粒酶B(15.48±1.98)%、穿孔素(5.62±1.10)%和CD107a(86.10±1.35)%比较,差异均无统计学意义(P>0.05,见图1B)。胃癌不同临床分期之间CD27+γδT细胞和CD27-γδT细胞上述三种效应分子表达水平比较,差异无统计学意义(P>0.05)。
2.3 胃癌组织和正常胃组织中γδT细胞IL-17A和IFN-γ分泌水平的比较胃癌组织中γδT细胞IL-17A(7.54±1.37)%的分泌水平明显高于正常胃组织(3.47±0.69)%,差异有统计学意义(P=0.01)。胃癌组织与正常胃组织中γδT细胞IFN-γ的分泌水平分别为(15.32±2.39)%和(13.22±1.42)%,差异无统计学意义(P>0.05,见图1C)。

注:N:正常胃组织,T:胃癌组织,GrB:颗粒酶B,PFP:穿孔素。*P<0.05,**P<0.01,NS:P>0.05。
2.4 胃癌组织和正常胃组织中CD27+γδT细胞与CD27-γδT细胞的功能比较胃癌组织中CD27+γδT细胞IL-17A(7.44±1.52)%的分泌水平明显高于CD27-γδT细胞(1.24±0.43)%及正常胃组织CD27+γδT细胞(3.17±0.63)%(P<0.05)。正常胃组织内CD27+γδT细胞IL-17A的分泌水平显著高于CD27-γδT细胞(0.50±0.14)%(P<0.01)。然而,颗粒酶B、穿孔素、CD107a和IFN-γ的表达水平在CD27+γδT细胞亚群与CD27-γδT细胞亚群之间比较,差异无统计学意义(P>0.05,见图2)。
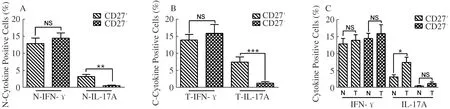
注:CD27+:CD27+γδT细胞,CD27-:CD27-γδT细胞,N:正常胃组织,T:胃癌组织。*P<0.05,**P<0.01,***P<0.001,NS:P>0.05。
图2 CD27+γδT细胞与CD27-γδT细胞IL-17A、IFN-γ水平的比较 A:正常胃组织;B:胃癌组织;C:胃癌组织与正常胃组织
Fig 2 Comparison of the levels of IL-17A and IFN-γ between CD27+γδT cells and CD27-γδT cells A: normal gastric tissue; B: gastric cancer tissue; C: normal gastric tissue and gastric cancer tissue
2.5 γδT细胞及其亚群IL-17A、IFN-γ水平与胃癌临床分期之间的关系γδT细胞IL-17A的分泌水平在Ⅲ/Ⅳ期胃癌组织内(9.29±2.10)%显著高于正常胃组织(4.12±0.88)%(P<0.05)。Ⅰ/Ⅱ期胃癌组织内CD27+γδT细胞IL-17A(4.14±0.80)%的分泌水平低于Ⅲ/Ⅳ期胃癌组织(P<0.05);但CD27-γδT细胞IL-17A的分泌水平在胃癌不同临床分期之间比较,差异无统计学意义(P>0.05);另外,IFN-γ的分泌水平在胃癌不同临床分期之间及CD27+γδT细胞和CD27-γδT细胞之间比较,差异均无统计学意义(P>0.05,见表1)。

表1 γδT细胞IL-17A、IFN-γ水平与胃癌临床分期之间的关系
注:与Ⅲ/Ⅳ期胃癌组织CD27+γδT细胞组相比,aP<0.05;与正常胃组织相比,bP<0.05。
3 讨论
关于γδT细胞的分群方法,目前尚无相关共识,Ribot等[3]研究发现,γδT细胞在胸腺分化过程中就已经形成具有不同功能特性的γδT细胞亚群,这种分化与多种分子机制有关;他们认为CD27可以作为区分小鼠IFN-γ阳性γδT细胞和IL-17阳性γδT细胞的表面标志,即CD27+γδT细胞主要分泌IFN-γ,CD27-γδT细胞主要分泌IL-17。从胰腺、淋巴结和其他组织中(如肺和肠道)分离得到的CD27+γδT细胞刺激后可以分泌IFN-γ,而CD27-γδT细胞刺激后主要分泌IL-17[4]。然而,关于CD27能否作为人体内γδT细胞的表面标志的研究少有报道。我们检测了人胃癌组织和正常胃组织内γδT细胞及其亚群的比例变化,结果显示γδT细胞的比例在胃癌组织与正常胃组织内无明显差异,但是,胃癌组织中CD27+γδT细胞亚群的比例显著高于CD27-γδT细胞亚群及正常胃组织CD27+γδT细胞亚群,即CD27+γδT细胞亚群为人胃癌组织内主要的γδT细胞亚群。
颗粒酶B、穿孔素和CD107a作为淋巴细胞细胞毒活性的标志[5-7],其表达水平可以反映淋巴细胞的抗肿瘤活性。本实验采用流式细胞术检测人胃癌组织与正常胃组织中γδT细胞及其亚群颗粒酶B、穿孔素和CD107a的表达水平。结果显示,胃癌组织中的γδT细胞(包括CD27+γδT细胞亚群和CD27-γδT细胞亚群)和NK细胞、NKT细胞及CD8+T细胞等细胞毒细胞类似,也能表达颗粒酶B、穿孔素及CD107a,且胃癌组织中γδT细胞及其亚群颗粒酶B、穿孔素和CD107a的表达水平与正常胃组织比较,无明显降低,表明在胃癌微环境中γδT细胞及其亚群并没有表现出与其细胞毒活性相关的免疫抑制。
IL-17家族是人体内重要细胞因子,尤其是IL-17A已被广泛研究,其多由CD4+T细胞分泌,但也有研究发现γδT细胞也是体内IL-17A的重要来源[8]。相关研究发现γδT细胞在牛结核分枝杆菌卡介苗刺激后IL-17A表达升高,并可促进中性粒细胞在肿瘤灶的聚集和抑制肿瘤生长[9]。但是也有研究发现,在小鼠纤维肉瘤模型中,肿瘤浸润的γδT细胞表达的IL-17A能促进肿瘤血管生成并促进肿瘤生长[10]。在另一个包含多种不同肿瘤模型的研究中,发现化疗后的瘤体内分泌IL-17A的γδT细胞和CD8+T细胞与抑制肿瘤生长有关[11]。我们的实验结果显示,胃癌组织中γδT细胞IL-17A的分泌水平比正常组织明显升高,而Ⅰ/Ⅱ期胃癌组织中γδT细胞IL-17A的分泌水平低于Ⅲ/Ⅳ期胃癌组织,但差异无统计学意义(这也可能与病例数少有关),然而,Ⅲ/Ⅳ期胃癌组织内γδT细胞IL-17A的分泌水平显著高于正常胃组织。另外,胃癌组织及正常胃组织中CD27+γδT细胞IL-17A的分泌水平均高于CD27-γδT细胞,且CD27+γδT细胞IL-17A的分泌水平还表现为胃癌组织高于正常胃组织、Ⅲ/Ⅳ期胃癌组织高于Ⅰ/Ⅱ期胃癌组织。CD27+γδT细胞IL-17A的分泌水平与胃癌的发展呈现出明显的一致性。以上结果表明,随着胃癌的形成和进展,γδT细胞及CD27+γδT细胞亚群IL-17A的分泌水平是增加的。这种高表达可能与胃肠道黏膜的炎症-癌变发展途径密切相关[6]。
我们的实验结果发现人胃癌组织内CD27+γδT细胞亚群和CD27-γδT细胞亚群虽然IL-17A的分泌水平存在明显差异,但IFN-γ的分泌水平没有明显区别,与此前小鼠体内的相关研究结果并不相同。因此,在人体内不能简单地用CD27作为γδT细胞的表面标志。然而,根据上述相关结果可以认为CD27+γδT细胞亚群是人胃癌组织中γδT细胞的优势亚群,且γδT细胞及CD27+γδT细胞亚群可能通过分泌IL-17A参与了胃癌的发生、发展。
[1]Park K, He X, Lee HO, et al. TCR-mediated ThPOK induction promotes development of mature (CD24-) gammadelta thymocytes [J]. EMBO J, 2010, 29(14): 2329-2341.
[2] Zarin P, Wong GW, Mohtashami M, et al. Enforcement of γδ-lineage commitment by the pre-T-cell receptor in precursors with weak γδ-TCR signals [J]. Proc Natl Acad Sci U S A, 2014, 111(15): 5658-5663.
[3] Ribot JC, Ribeiro ST, Correia DV, et al. Human γδ thymocytes are functionally immature and differentiate into cytotoxic type 1 effector T cells upon IL-2/IL-15 signaling [J]. J Immunol, 2014, 192(5): 2237-2243.
[4] Ribot JC, deBarros A, Pang DJ, et al. CD27 is a thymic determinant of the balance between interferon-gamma- and interleukin 17-producing gammadelta T cell subsets [J]. Nat Immunol, 2009, 10(4): 427-436.
[5] He J, Li L, Wei W, et al. Expression of perforin and granzyme-B in peripheral blood lymphocyte in patients with prostate cancer and the clinical significance [J]. Zhong Nan Da Xue Xue Bao Yi Xue Ban, 2015, 40(4): 387-391.
[6] Aktas E, Kucuksezer UC, Bilgic S, et al. Relationship between CD107a expression and cytotoxic activity [J]. Cell Immunol, 2009, 254(2): 149-154.
[7] Viel S, Charrier E, Marcais A, et al. Monitoring NK cell activity in patients with hematological malignancies [J]. Oncoimmunology, 2013, 2(9): e26011.
[8] Cai Y, Shen X, Ding C, et al. Pivotal role of dermal IL-17-producing γδT cells in skin inflammation [J]. Immunity, 2011, 35(4): 596-610.
[9] Takeuchi A, Dejima T, Yamada H, et al. IL-17 production by γδ T cells is important for the antitumor effect of Mycobacterium bovis bacillus Calmette-Guérin treatment against bladder cancer [J]. Eur J Immunol, 2011, 41(1): 246-251.
[10]Wakita D, Sumida K, Iwakura Y, et al. Tumor-infiltrating IL-17-producing gammadelta T cells support the progression of tumor by promoting angiogenesis [J]. Eur J Immunol, 2010, 40(7): 1927-1937.
[11] Ma Y, Aymeric L, Locher C, et al. Contribution of IL-17-producing gamma delta T cells to the efficacy of anticancer chemotherapy [J]. J Exp Med, 2011, 208(3): 491-503.
(责任编辑:马 军)
The significance of γδT cell from the tumor tissue of human gastric carcinoma
CHEN Xinfu1, LIU Jian2, LIU Junquan3, CHEN Guangxia1, LV Xiaoting3, ZHU Yun3, FEI Sujuan4
1. Department of Gastroenterology, Xuzhou First People’s Hospital, Xuzhou 221002; 2. Department of Hematology, the Sixth People’s Hospital of Xuzhou; 3. Department of Gastroenterology, Biological Therapy Center, the 97th Hospital of PLA; 4. Department of Gastroenterology, the Affiliated Hospital of Xuzhou Medical College, China
Objective To investigate the significance of γδT cells by detecting the level of γδT and its effector molecules and secreting different cytokines in human gastric cancer tissues. Methods Freshly excised gastric tumor tissues and normal gastric tissues (being greater than 5 cm from the tumor edge) from gastric carcinoma patients were selected and incubated them with the solution containing collagen Ⅱ and made them into single cell suspensions. A flow cytometer was used to detect the levels of Granzyme B, Perforin, CD107a, IL-17A and IFN-γ. Results Firstly, the proportion of CD27+γδT cells subtype was higher than that of CD27-γδT cells subtype in the gastric carcinoma tissue and it was also higher than the proportion of CD27+γδT cells subtype from normal gastric tissue (P<0.05). Secondly, the level of IL-17A that γδT cells secreted in the gastric tumor tissues was obviously higher than that in the normal gastric mucosa (P<0.05). But, there were no differences in the proportions of Granzyme B, Perforin, CD107a between the gastric tumor tissue and the normal gastric tissue (P>0.05). Thirdly, in the gastric carcinoma tissue and normal gastric tissue, the proportion of CD27+γδT cells subtype secreting IL-17A was obviously higher than that of CD27-γδT cells subtype secreting (P<0.01). Additionally, the proportion of CD27+γδT cells subtype from gastric carcinoma tissue secreting IL-17A was also higher than that of CD27+γδT cells subtype from normal gastric tissue (P<0.05). The proportion of CD27+γδT cells subtype from the Ⅲ/Ⅳ stage gastric carcinoma tissue secreting IL-17A was higher than that from the Ⅰ/Ⅱ stage gastric carcinoma tissue secreting (P<0.05). Conclusion Firstly, in gastric tumor tissue, the level of γδT cells secreting cytokines IL-17A is significantly increased. Secondly, the CD27+γδT cells subtype is the major functional active cells subtype of γδT cells in the gastric carcinoma tissue. Additionally, it may take part in the appearance and development of gastric cancer by secreting cytokines IL-17A.
Gastric carcinoma; γδT cell; CD27; IL-17A
南京军区医学科技创新课题(011Z009)
陈新孚,硕士,主治医师,研究方向:消化道肿瘤的基础与临床。E-mail: 626014646@qq.com
朱云,硕士,主任医师,硕士生导师,研究方向:平战时部队官兵消化性溃疡致病因素及防治。E-mail: xxfwb@cumt.edu.cn;费素娟,硕士,主任医师,硕士生导师,研究方向:消化道肿瘤的基础及临床研究。E-mail: xyfyfeisj99@163.com
10.3969/j.issn.1006-5709.2016.01.005
R735.2
A
1006-5709(2016)01-0020-04
2015-05-05
