SN50联合5-氟尿嘧啶通过调节NF-κB信号通路抑制人胃癌裸鼠移植瘤生长的研究
2016-06-05徐睿玲王新红刘冰熔
刘 静, 刘 婷, 徐睿玲, 王新红, 刘冰熔
哈尔滨医科大学附属第二医院消化内科,黑龙江 哈尔滨 150086
论著·胃癌
SN50联合5-氟尿嘧啶通过调节NF-κB信号通路抑制人胃癌裸鼠移植瘤生长的研究
刘 静, 刘 婷, 徐睿玲, 王新红, 刘冰熔
哈尔滨医科大学附属第二医院消化内科,黑龙江 哈尔滨 150086
目的 探讨NF-κB通路抑制剂SN50联合5-氟尿嘧啶(5-FU)对人胃癌裸鼠移植瘤生长的影响及机制。方法 建立荧光素酶标记的人胃癌细胞株SGC7901,常规传代培养,采用对数生长期细胞建立人胃癌裸鼠皮下移植瘤模型。14 d后随机分为4组:对照组、5-FU干预组、SN50干预组、5-FU+SN50干预组。每组8只动物,共给药4周。观察并记录各组裸鼠皮下移植瘤的生长情况,游标卡尺测量瘤体长短径,于停药次日处死裸鼠,称取瘤重,计算肿瘤体积、肿瘤生长抑制率、绘制肿瘤生长曲线。通过体内可见光成像技术分别于第1、7、14、21、28天对裸鼠进行活体成像,记录移植瘤光子数,绘制皮下移植瘤光子数曲线图。免疫组化方法检测移植瘤中NF-κBp65表达情况。结果 与其他三组相比,5-FU+SN50干预组肿瘤体积、抑瘤率及光子数差异均有统计学意义(P<0.05);与对照组及SN50干预组比较,5-FU干预组肿瘤体积和光子数明显减少(P<0.05),抑瘤率明显增加(P<0.05);SN50干预组与对照组相比,肿瘤体积、抑瘤率及光子数差异无统计学意义(P>0.05)。NF-κBp65阳性率依次为对照组47.4%、5-FU组57.1%、SN50组11.8%、5-FU+SN50组25.0%。结论 5-FU单药及5-FU+SN50均能抑制裸鼠胃癌皮下移植瘤的生长,而联合应用效果更明显;SN50可通过抑制NF-κB信号转导通路的活化,显著增强5-FU对裸鼠胃癌皮下移植瘤的抑制作用。
核转录因子-κB;胃癌;SN50;5-氟尿嘧啶
对于进展期胃癌患者来说,全身的化学治疗是主要的治疗手段之一,然而大部分肿瘤对化疗药物具有不同程度的抗药性,这常常是治疗失败的主要原因。如何提高胃癌细胞对化疗药物的敏感性,是进展期胃癌治疗的关键。核转录因子-κB(nuclear factor-kappaB,NF-κB)是调节肿瘤细胞存亡的重要因子,其活化可调节多种基因的表达[1],使肿瘤细胞逃避化疗药物诱导的凋亡,是目前已知的影响化疗效果最重要的机制之一。SN50是一种活性多肽,它的结构与P50相似,可以竞争性抑制P50与细胞核内DNA的结合,从而阻断NF-κB信号转导通路活化[2-3]。近年,在胃癌的化学治疗上取得了很大进步,如对5-氟尿嘧啶(5-fluorouracil,5-FU)的认识更加深刻,故将常规化疗药物与NF-κB通路抑制剂联合应用是一种切实可行的肿瘤治疗方法。本研究联合应用NF-κB通路抑制剂SN50与5-FU,以期待更有效的抑制胃癌裸鼠移植瘤的生长,为胃癌的临床化疗与靶向治疗提供理论依据。
1 材料与方法
1.1 材料胃癌细胞株SGC7901购自中科院上海细胞所细胞库。BABL/c雄性裸小鼠购自上海斯莱克实验动物有限责任公司,实验动物合格证编号:2007000527363。5-FU购自天津金耀氨基酸有限公司。SN50购自美国Sigma公司。含高糖的DMEM培养基购自美国Gibco公司。胎牛血清购自美国HyClone公司。水合氯醛购自扬州市奥鑫助剂厂。D-荧光素钾购自北京中科汇文遗传技术发展中心。鼠抗人NF-κBp65多克隆抗体购自美国Santa Cruz公司。免疫组化化学染色SP试剂盒及DAB染色试剂盒购自福建迈新公司。
1.2 方法
1.2.1 建立荧光素酶标记的胃癌细胞株SGC7901:实验委托上海英为信科技有限公司完成。
1.2.2 细胞培养:人胃癌细胞株SGC7901于实验室常规传代培养,生长于含有10%灭活胎牛血清、青霉素(100 U/ml)和链霉素(100 mg/ml)的高糖DMEM培养基中,于37 ℃,5% CO2的培养箱内培养。细胞每2~3 d传代一次,所有实验采用对数生长期细胞。
1.2.3 建立裸鼠皮下移植瘤模型:选取BABL/c雄性裸小鼠32只,鼠龄4周,体质量18~20 g。将对数期生长的人胃癌细胞株SGC7901制备成5×107/ml的悬液,用1 ml注射器抽取单细胞悬液0.2 ml,于裸鼠背侧近右后臀部接种,注射局部出现明显皮丘。14 d后所有裸鼠皮下均出现约5 mm的皮下结节,裸鼠皮下移植瘤均建立成功。
1.2.4 分组及给药:待肿瘤平均直径约5 mm后,将裸鼠随机分为对照组、5-FU干预组、SN50干预组及5-FU+SN50干预组,每组8只。对照组:0.2 ml/d无菌生理盐水腹腔注射,3次/d;5-FU干预组:5-FU 25 mg·kg-1·d-1腹腔注射,3次/周;SN50干预组:SN50 400 μg/kg腹腔注射,3次/周;5-FU+SN50干预组:5-FU 25 mg·kg-1·d-1和SN50 400 μg/kg腹腔注射,3次/周。共给药4周,停药次日采用颈椎脱臼法处死裸鼠,测量肿瘤重量、计算抑瘤率。
观测指标:(1)肿瘤体积测量:注药后每7 d用游标卡尺测量移植瘤长径(a)、短径(b),计算肿瘤体积:V=1/2a×b2;绘制BALB/c裸小鼠皮下移植瘤生长曲线;(2)抑瘤率:处死裸鼠后剥出瘤块,用电子天平称取瘤重(W),抑瘤率(%)=(对照组平均瘤重-用药组平均瘤重)/对照组平均瘤重×100%。
1.2.5 体内可见光成像技术:通过IVIS成像系统分别在给药的第1、7、14、21、28天对裸鼠进行活体成像。每组随机选取裸鼠4只,先腹腔注射荧光素酶底物200 μl,使裸鼠充分活动以至底物快速吸收入血,5 min后给予10%的水合氯醛50 μl,待裸鼠麻醉后,将其放入暗箱中合适位置,摆好体位,关好暗箱门,获取图像及光子数。
1.2.6 免疫组化法:所有组织标本离体后采用10%甲醛固定,常规石蜡包埋,4 μm厚连续切片,免疫组化染色所用一抗NF-κBp65的工作浓度为1∶300。结果判断:用PBS代替一抗作为阴性对照,用购买试剂公司所提供的已知NF-κBp65阳性切片作为阳性对照,以细胞染为黄色到棕黄色为阳性标准,按阳性细胞的数量及染色强度将阳性定为3级,400倍计数至少5个随机视野,取平均值,阳性细胞数<10%计为阴性,阳性细胞数占10%~29%为+,30%~59%为++,>60%为+++,采用盲法计数。
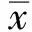
2 结果
2.1 移植瘤体积的变化对照组、SN50干预组、5-FU干预组、SN50+5-FU干预组在治疗初期肿瘤体积均逐渐增大,但对照组和SN50干预组生长速度更快,二者移植瘤体积变化差异无统计学意义(P>0.05)。从第14天开始5-FU干预组和5-FU+SN50干预组与对照组相比,移植瘤体积的变化差异有统计学意义(P<0.05);5-FU+SN50干预组对肿瘤生长的抑制作用显著强于5-FU干预组(P<0.05,见表1)。
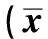


组别不同时段各组移植瘤体积第1天第7天第14天第21天第28天对照组132.7±17.43285.3±27.82419.6±21.16526.9±29.32712.4±37.2SN50干预组120.7±18.17264.2±26.13407.4±23.74537.3±31.23658.7±27.185⁃FU干预组143.6±20.54267.1±21.89 354.6±17.54☆# 417.8±27.56☆# 498.5±26.13☆#5⁃FU+SN50干预组127.4±21.54246.3±16.15 307.1±18.55☆#& 329.4±19.76☆#& 268.9±20.97☆#&
注:与对照组相比,☆P<0.05;与SN50干预组相比,#P<0.05;与5-FU干预组相比,&P<0.05。
2.2 抑瘤率的比较用药后5-FU干预组及5-FU+SN50干预组肿瘤生长明显减慢,瘤重显著低于其他组,其抑瘤率分别为34.29%、56.24%,与对照组相比,差异有统计学意义(P<0.05),但SN50干预组与对照组相比,差异无统计学意义(P>0.05)。与其他三组相比,5-FU+SN50干预组抑瘤率显著增加,差异有统计学意义(P<0.05,见表2)。
表2 治疗结束后各组移植瘤平均瘤重及抑瘤率的比较
Tab 2 Comparison of average tumor weight and inhibition rate after treatment
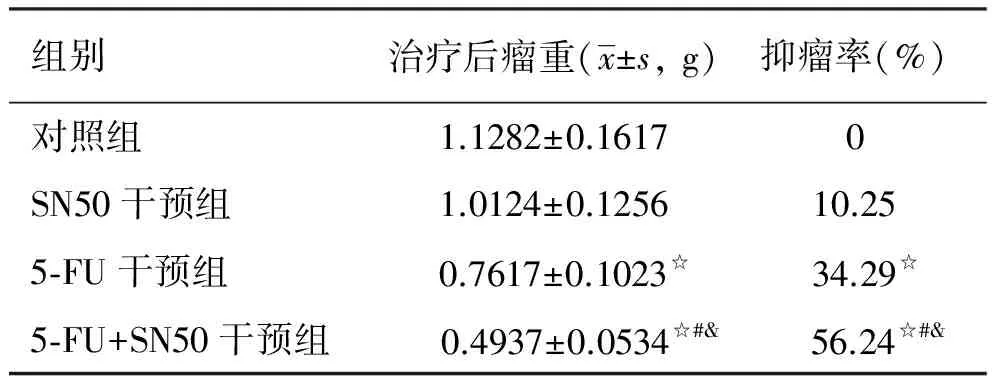
组别治疗后瘤重(x±s,g)抑瘤率(%)对照组1.1282±0.16170SN50干预组1.0124±0.125610.255⁃FU干预组0.7617±0.1023☆34.29☆5⁃FU+SN50干预组 0.4937±0.0534☆#& 56.24☆#&
注:与对照组相比,☆P<0.05;与SN50干预组相比,#P<0.05;与5-FU干预组相比,&P<0.05。
2.3 生物发光检测结果5-FU+SN50干预组移植瘤光子数治疗前后无明显变化,而对照组和SN50干预组移植瘤光子数显著增加。与其他三组相比,5-FU+SN50干预组移植瘤光子数明显降低,差异有统计学意义(P<0.05)。5-FU干预组与对照组相比,移植瘤光子数明显降低,差异有统计学意义(P<0.05),而SN50干预组与对照组相比,移植瘤光子数差异无统计学意义(P>0.05,见图1~2)。

图1 各组移植瘤的光子数量比较

图2 SN50和5-FU对人胃癌细胞株SGC7901裸鼠移植瘤的影响
2.4 免疫组化法检测NF-κBp65的表达情况免疫组化结果显示活化后的NF-κBp65定位胞核,免疫组化阳性产物呈棕黄色颗粒状,各组阳性率依次为:对照组47.4%、SN50组11.8%、5-FU组57.1%、SN50+5-FU组25.0%(见表3)。可见5-FU可进一步激活胃癌裸鼠皮下移植瘤组织中NF-κB通路的活化,而SN50干预后其活化程度下降。

表3 NF-κBp65在各组移植瘤中的表达
注:与对照组相比,☆P<0.05;与SN50干预组相比,#P<0.05;与5-FU干预组相比,&P<0.05。
3 讨论
研究表明,在胃癌等许多恶性肿瘤组织、细胞株及动物模型中均能检测到NF-κB的异常活化[4]。Li等[5]发现NF-κB在胃癌的4种细胞系AGC、MKN28、MKN45、SGC7901中均可被不同程度活化。也有研究表明,5-FU可进一步激活胃癌细胞的NF-κB通路的活化,NF-κB通路活化后可调节胃癌细胞生存、凋亡、血管生成[6-7]、扩散和转移[8]等相关基因的表达,从而提高肿瘤细胞的耐药率,严重影响了肿瘤化学治疗的效果。Camp等[9]研究发现5-FU和SN-38可诱导胃癌细胞株AGC和NCI-N87中NF-κB的活化,用腺病毒IκBα超抑制物(Ad.IκBα-SR)预处理细胞后,可明显提高化疗药物诱导的凋亡和生长抑制。
本实验旨在研究NF-κB通路抑制剂SN50和化疗药物5-FU联合应用对胃癌裸鼠皮下移植瘤的作用。结果显示与单用SN50和5-FU相比,5-FU+SN50干预组在肿瘤体积、抑瘤率及移植瘤光子数方面差异均有统计学意义。免疫组化NF-κBp65表达情况,表明SN50可明显抑制NF-κB通路活化,但无明显抑制肿瘤生长效应,可能因为胃癌细胞可能通过激活其他通路如PI3K/AK1信号通路的活化[10],调节与肿瘤细胞凋亡的相关因子的表达,进而使肿瘤细胞逃避凋亡。实验结果表明在对照组移植瘤组织中,NF-κB通路已被部分活化,而5-FU干预后该通路可被进一步活化,SN50干预后该通路明显被抑制。这也就提示5-FU+SN50干预组移植瘤体积及光子数明显减少可能与NF-κB通路被抑制有关,因该通路被抑制后上调了促凋亡蛋白P53、Bax的表达[11],而下调抑凋亡蛋白的表达,如肿瘤坏死因子受体相关因子TRAF1和TRAF2、Bcl-2、细胞凋亡蛋白抑制物c-IAP和c-IAP2等的表达[12-15],进而促进细胞凋亡。
本实验以荧光素酶标记的人胃癌SGC7901细胞株裸鼠皮下移植瘤模型为研究对象,采用体内可见光成像技术在不同的时间记录药物干预后裸鼠移植瘤的数据变化,初步探讨了NF-κB信号转导通路抑制剂SN50和5-FU联用抑制胃癌细胞生长的效应。结果提示,SN50与5-FU联合应用能显著增强对胃癌细胞株SGC7901裸鼠皮下移植瘤的抑制作用,为胃癌的临床化疗和靶向治疗提供基础理论支持并值得进一步研究与探讨。
[1]Zhu BS, Xing CG, Lin F, et al. Blocking NF-κB nuclear translocation leads to p53-related autophagy activation and cell apoptosis [J]. World J Gastroenterol, 2011, 17(4): 478-487.
[2]Sun JL, Zhu BS, Gong W, et al. Effects of combined therapy of LY294002 and SN50 on nude mice model with gastric cancer [J]. Chin J Gastrointest Surg, 2011, 14(5): 364-367.
孙家磊, 朱宝松, 龚巍, 等. LY294002联合SN50对裸鼠胃癌模型肿瘤细胞生长和凋亡的影响[J]. 中华胃肠外科杂志, 2011, 14(5): 364-367.
[3]Liu T, Liu D, Liu J, et al. Effect of NF-κB inhibitors on the chemotherapy-induced apoptosis of colon cancer cell line HT-29 [J]. Exp Ther Med, 2012, 4(3): 716-722.
[4]Chao X, Zao J, Xiao-Yi G, et al. Blocking of PI3K/AKT induces apoptosis by its effect on NF-κB activity in gastric carcinoma cell line SGC7901 [J]. Biomed Pharmacother, 2010, 64(9): 600-604.
[5]Li Q, Yu YY, Zhu ZG, et al. Effect of NF-κB constitutive activation on proliferation and apoptosis of gastric cancer cell lines [J]. Eur Surg Res, 2005, 37(2): 105-110.
[6]Gutierrez-Orozco F, Stephens BR, Neilson AP, et al. Green and black tea inhibit cytokine-induced IL-8 production and secretion in AGS gastric cancer cells via inhibition of NF-κB activity [J]. Planta Med, 2010, 76(15): 1659-1665.
[7]Xie TX, Xia Z, Zhang N, et al. Constitutive NF-κB activity regulates the expression of VEGF and IL-8 and tumor angiogensis of human glioblastoma [J]. Oncol Rep, 2010, 23(3): 725-732.
[8]Kang MH, Oh SC, Lee HJ, et al. Metastatic function of BMP-2 in gastric cancer cells: the role of PI3K/AKT, MAPK, the NF-κB pathway, and MMP-9 expression [J]. Exp Cell Res, 2011, 317(12): 1746-1762.
[9]Camp ER, Li J, Minnich DJ, et al. Inducible nuclear factor-kappaB activation contributes to chemotherapy resistance in gastric cancer [J]. J Am Coll Surg, 2004, 199(2): 249-258.
[10]Rasul A, Ding C, Li X, et al. Dracorhodin perchlorate inhibits PI3K/Akt and NF-κB activation, up-regulates the expression of p53, and enhances apoptosis [J]. Apoptosis, 2012, 17(10): 1104-1119.
[11]Endo F, Nishizuka SS, Kume K, et al. A compensatory role of NF-κB to p53 in response to 5-FU-based chemotherapy for gastric cancer cell lines [J]. PLoS One, 2014, 9(2): e90155.
[12]Pacaud R, Sery Q, Oliver L, et al. DNMT3L interacts with transcription factors to target DNMT3L/DNMT3B to specific DNA sequences: role of the DNMT3L/DNMT3B/p65-NFκB complex in the (de-)methylation of TRAF1 [J]. Biochimie, 2014, 104: 36-49.
[13]Oussa NA, Soumounou Y, Sabbagh L. TRAF1 phosphorylation on Serine 139 modulates NF-κB activity downstream of 4-1BB in T cells [J]. Biochem Biophys Res Commun, 2013, 432(1): 129-134.
[14]Lee S, Challa-Malladi M, Bratton SB, et al. Nuclear factor-κB-inducing kinase (NIK) contains an amino-terminal inhibitor of apoptosis (IAP)-binding motif (IBM) that potentiates NIK degradation by cellular IAP1 (c-IAP1) [J]. J Biol Chem, 2014, 289(44): 30680-30689.
[15]Varfolomeev E, Goncharov T, Fedorova AV, et al. c-IAP1 and c-IAP2 are critical mediators of tumor necrosis factor alpha (TNF-alpha)-induced NF-kappaB activation [J]. J Biol Chem, 2008, 283(36): 24295-24299.
(责任编辑:马 军)
Study on growth inhibition of human gastric cancer xenografts in nude mice by SN50 combined with 5-fluorouracil regulating NF-κB signaling pathway
LIU Jing, LIU Ting, XU Ruiling, WANG Xinhong, LIU Bingrong
Department of Gastroenterology, the Second Affiliated Hospital of Harbin Medical University, Harbin 150086, China
Objective To investigate the growth inhibition of human gastric cancer xenografts in nude mice by SN50 combined with 5-fluorouracil (5-FU). Methods Human gastric cancer SGC7901 cell line was constructed to express firely luciferase, which was conventional serial subcultured. The models of human gastric cancer xenografts in nude mice were established, then randomly divided into 4 groups after 14 days as follows: control group, 5-FU group, SN50 group, 5-FU+SN50 group, the drugs mentioned above were administrated for 4 weeks. Bioluminescence imaging technique was applied at 1, 7, 14, 21, 28 days to nude mice. The xenograft tumor photon numbers were measured and subcutaneously transplanted tumor photon number curve was drawn. Nude mice were sacrificed the next day after drug withdrawal and the tumors were weighed. Treatment size of the xenografts were measured by vernier caliper. The tumor volume and tumor growth inhibiting rates were calculated and the curve tumor growth was drawn. The expression of NF-κBp65 was detected by immunohistochemistry in the xenografts. Results There were significant differences in average tumor volumes, inhibition rates and the photon number in the combined treatment group compared with the other groups (P<0.05). Compared with the control group and SN50 group, the average volumes and photon number of tumor were significantly lower in 5-FU group, while the growth inhibition rates of tumor were significantly higher (P<0.05). No statistical significances were found in average tumor volumes, inhibition rates and the photon number between SN50 group and control group (P>0.05). The positive rate of NF-κBp65 in each group as follows: control group 47.4%, 5-FU group 57.1%, SN50 group 11.8%, 5-FU+SN50 group 25.0%. Conclusion 5-FU only or combined with SN50 can inhibit gastric cancer tumor growth, and drug combination is more effective; SN50 can inhibit the activation of NF-κB signaling pathway to reduce expression of NF-κBp65 in tumor cells, significantly enhancing the growth inhibition of human gastric cancer xenografts in nude mice by 5-FU thereby.
Nuclear factor-kappa B; Gastric cancer; SN50; 5-fluorouracil
10.3969/j.issn.1006-5709.2016.01.002
国家自然科学基金(30871152)
刘静,硕士研究生,研究方向:消化道肿瘤的基础研究。E-mail:0liujing@163.com
刘冰熔,主任医师,博士生导师,研究方向:消化系统肿瘤的基础研究。E-mail:liubingrong@medmail.com.cn
R735.2
A
1006-5709(2016)01-0005-04
2015-05-18
