食管动力学障碍不同亚型对胃食管反流病的影响
2016-06-05郭子皓郭宝娜姜佳丽展玉涛
李 莉,郭子皓,郭宝娜,陈 婧,姜佳丽,展玉涛,张 川
首都医科大学附属北京同仁医院消化内科,北京 100730
食管动力学障碍不同亚型对胃食管反流病的影响
李 莉,郭子皓,郭宝娜,陈 婧,姜佳丽,展玉涛,张 川
首都医科大学附属北京同仁医院消化内科,北京 100730
目的探讨食管动力学障碍不同亚型在胃食管反流病(gastroesophageal reflux disease,GERD)中的作用。方法收集40例GERD典型症状患者,全部行食管高分辨率测压(high-resolution manometry,HRM)和24 h食管动态pH阻抗监测,根据HRM结果,分为动力正常组、失蠕动收缩组、弱蠕动收缩组、间断收缩组。分析食管动力学障碍不同亚型及正常食管动力患者胃食管病理性反流情况。结果40例典型GERD症状患者中动力正常组10例(25.0%),失蠕动收缩组11例(27.5%),弱蠕动收缩组19例(47.5%),间断收缩组30例(75.0%)。失蠕动收缩组及弱蠕动收缩组反流次数明显多于食管动力正常组(96.7±65.5、92.7±49.1vs69.5±31.3,P<0.05),以弱酸反流(53.3±52.2、47.7±34.6vs20.3±15.3,P<0.05)为主;而病理性酸暴露程度无明显差别。与食管动力正常组相比,间断收缩组患者总pH<4时间(%)明显升高(8.4±3.9vs14.3±7.6,P<0.05);DeMeester评分有升高趋势,但差异无统计学意义(27.9±43.9vs50.6±60.6,P>0.05)。结论食管收缩力差的患者更易出现反流次数增加且以弱酸反流为主;而食管收缩模式障碍的患者则与食管远端酸暴露更为相关。
胃食管反流病;食管动力学障碍;高分辨率测压
胃食管反流病(gastroesophageal reflux disease,GERD)是指胃内容物反流入食管、口腔(包括喉部)或肺所引起的不适症状或并发症[1]。既往研究显示东亚地区人群中的GERD患病率约为6.7%~17%,且发病率呈逐年上升趋势,但其具体的发病机制仍不十分清楚,研究表明食管动力功能障碍是其发病机制中的重要环节[2-6]。随着食管高分辨率测压系统(high-resolution manometry,HRM)的广泛应用,食管动力障碍的检出率已得到明显提升,新近发表的芝加哥动力障碍分类标准3.0[7]将食管动力学障碍进行了具体的分型,与传统方法相比,起到了很好的补充作用,本文旨在探讨食管动力学障碍不同亚型在GERD中的作用,为GERD精准治疗提供理论依据。
1 资料与方法
1.1 一般资料选取2015年9月-2015年12月因反酸、烧心或非心源性胸痛、咽痛、咳嗽就诊于首都医科大学附属北京同仁医院消化科胃肠功能室行食管HRM及24 h食管动态pH阻抗检测的患者,排除贲门失驰缓症、消化性溃疡、胃肠道肿瘤、食管及胃十二指肠手术史、糖尿病、结缔组织病等其他影响胃肠道功能的系统性疾病患者。将24 h食管动态pH阻抗检测诊断为GERD的40例患者纳入研究,根据HRM结果,按照2015版芝加哥食管动力障碍分类标准3.0[7]分为动力正常组、失蠕动收缩组[远端收缩积分(distal contractile integral,DCI)<100(mmHg.s.cm)]、弱蠕动收缩组[DCI在100~450(mmHg.s.cm)之间]、及间断收缩组[20 mmHg收缩等压轮廓内收缩中断累及>5 cm]。分析食管动力学障碍不同亚型及正常食管动力患者病理性反流情况。
1.2 仪器和方法
1.2.1 HRM:采用荷兰MMS高分辨胃肠动力学检查系统,22通道水灌注硅胶导管测压。受试者测压前1周停用抑酸、促动力及镇静药物。检查前禁食8 h,受试者取坐位,石蜡油润滑后经鼻孔插入,调整导管位置后固定于鼻翼。测定试管压力时患者取平卧位,嘱受试者停止吞咽10 s记录食管各段基础压力水平,后分别吞咽5 ml温水10次。待所有程序完成后,拔出测压导管。
1.2.2 24 h食管动态pH阻抗检测方法:于患者食管测压后进行。监测前,将电极置于pH 4.0和7.0标准缓冲液中校准,将24 h食管pH阻抗监测仪的导管经鼻插入,使电极置于食管下括约肌(LES)上缘5 cm处,连续24 h监测pH值及阻抗值,记录患者三餐、卧位及立位、出现症状事件的时间,经计算机软件分析图形。
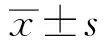
2 结果
2.1 高分辨率测压结果食管动力正常组10例(25.0%)、失蠕动收缩组11例(27.5%)、弱蠕动收缩组19例(47.5%)、间断收缩组30例(75.0%)。
2.2 食管24 h动态pH阻抗监测结果失蠕动收缩组及弱蠕动收缩组总反流次数明显多于食管动力正常组(96.7±65.5、92.7±49.1vs69.5±31.3,P<0.05),以弱酸反流(53.3±52.2、47.7±34.6vs20.3±15.3,P<0.05)为主;而病理性酸暴露程度三组无明显差异(见表1)。与食管动力正常组相比,间断收缩组患者总pH<4时间(%)明显升高(8.4±3.9vs14.3±7.6,P<0.05);DeMeester评分有升高趋势,但差异无统计学意义(27.9±43.9vs50.6±60.6,P>0.05)(见表2)。
表1 不同食管收缩力度组GERD患者24 h食管动态pH阻抗监测情况
Tab 1 Results of 24 h impedance-pH monitoring in the patients with different esophageal contractile vigors

组别例数DeMeester评分总pH<4(%)总反流次数弱酸反流次数混合反流次数动力正常组1025.7±20.816.9±10.669.5±31.320.3±15.329.5±17.5失蠕动收缩组1130.8±24.816.2±6.496.7±65.553.3±52.254.6±46.1弱蠕动收缩组1922.8±27.39.9±2.692.7±49.147.7±34.633.4±12.3P值>0.05>0.05<0.05<0.05>0.05
表2 不同食管收缩模式组GERD患者24 h食管动态pH阻抗监测情况
Tab 2 Results of 24 h impedance-pH monitoring in the patients with different esophageal contraction patterns

组别例数DeMeester评分总pH<4(%)总反流次数弱酸反流次数混合反流次数动力正常组1027.9±43.98.4±3.978.3±32.840.7±28.129.5±17.5间断收缩组3050.6±60.614.3±7.681.4±55.936.4±32.429.5±20.9P值>0.05<0.05>0.05>0.05>0.05
3 讨论
GERD是临床上常见疾病,但具体发病机制尚不清楚。研究发现食管动力障碍普遍存在于GERD患者中,与食管动力正常者相比,动力障碍的GERD患者酸反流增多,食管酸廓清延迟。近年来,随着GERD发病率的增加及动力学研究的进展,越来越多的学者认为GERD是各种动力障碍的综合作用,属于多种因素导致的消化系统动力障碍性疾病[8-10]。但目前临床上对于食管动力学障碍不同亚型是如何影响GERD的相关研究罕有报道。2015年发表的芝加哥动力障碍分类标准3.0[7]将食管动力学障碍进行了具体的分型,首次提出从收缩力度和收缩模式两个维度上对食管运动功能进行分类。本研究发现在GERD患者中食管动力异常者十分常见,占患者总数的75.0%,其中失蠕动收缩组27.5%,弱蠕动收缩组47.5%,间断收缩组75.0%。
随着质子泵抑制剂(proton pump inhibitors,PPIs)的问世,难治性胃食管反流病(refractory gastroesophageal reflux disease,RGERD)的发病率明显增加,引起了国内外消化界的普遍关注。一项对168例RGERD患者的研究[11]发现,37%的患者存在弱酸反流与症状的相关性,其中约有42%的典型反流症状与弱酸性反流存在相关性。Nakagawa等[12]对35例服用PPI超过8周的RGERD患者行24 h pH阻抗监测,详细记录其反流事件与症状相关性,结果发现服用PPI后,GERD患者食管反流物的pH值由酸反流变成了弱酸反流,同时弱酸反流至近端食管的程度是患者出现阳性症状一个主要因素。因此弱酸反流可能是RGERD患者症状形成较重要的因素之一。关于弱酸反流引起GERD的机制目前尚未完全清楚,目前认为弱酸反流大多为气体和液体的混合反流,可以扩张近端食管,而近端食管比远端食管更为敏感且具有更低的顺应性,导致RGERD症状的发生。本研究发现,食管收缩力度异常的GERD患者弱酸反流明显增加,且发现与弱蠕动收缩组相比失蠕动收缩组弱酸反流增加更为明显。与酸反流不同,弱酸反流物的成分以气液混合为主,对食管收缩力度更加依赖,需要更加有力的食管收缩才能得到廓清。因此我们有理由推测对于以弱酸反流为主的RGERD患者增加食管收缩力度治疗,很可能得到良好的收益。
Fletcher等[13]发现在餐后胃食管交界(esophagogastric junction,EGJ)存在一个未受食物缓冲作用的高酸区域“酸袋”。近年来“酸袋”作为GERD的可能发病机制之一越来越受到众多学者的关注[10]。Beaumont等[14]比较了10名健康者与22例GERD患者,发现GERD患者的酸袋比健康者长,而酸袋的位置越高(特别是膈上酸袋与膈下酸袋相比),发生反流的概率越大,由此推测扩大的酸袋可能是其病因之一。Rohof等[15]使用可以治疗“酸袋”的海藻酸盐,确实降低了此类GERD患者的酸相关症状。研究发现“酸袋”的形成与食管裂孔疝,胃动力下降,及胃解剖结构和进食高脂、高蛋白、香辣食物等相关,但是与食管动力的关系目前尚未明确[16-17]。新版芝加哥食管动力障碍分类标准明确将食管20 mmHg收缩等压轮廓内收缩中断累及>5 cm称为间断收缩,是GERD最常见的食管蠕动收缩模式障碍。本研究发现存在食管间断收缩的GERD患者总pH<4时间(%)明显升高,DeMeester评分有升高趋势,推测反流物流入食管后,患者出现食管蠕动中断的现象导致反流物潴留于EGJ,出现了拟“酸袋”的现象,加重了食管远端病理性酸暴露的程度,从而加重了GERD症状。
综上所述,GERD患者中大多数存在食管动力异常。食管收缩力下降的患者更易出现反流次数增加且以弱酸反流为主,推测其可能在RGERD中起重要作用;而食管收缩模式障碍则与食管远端酸暴露更为相关。另外,本研究提示根据GERD患者食管动力学障碍不同亚型采取个体化的治疗措施可能取得更满意的疗效。
[1]Katz PO, Gerson LB, Vela MF. Guidelines for the diagnosis and management of gastroesophageal reflux disease [J]. Am J Gastroenterol, 2013, 108(3): 308-328.
[2]Fass R. Erosive esophagitis and nonerosive reflux disease (NERD): comparison of epidemiologic, physiologic and herapeutic characteristics [J]. J Clin Gastroenterol, 2007, 41(2): 131-137.
[3]Vakil N, van Zanten SV, Kahrilas P, et al. The montreal definition and classification of gastroesophageal reflux disease: a global evidencebased consensus [J]. Am J Gastroenterol, 2006, 101(8): 1900-1920.
[4]El-Serag HB, Sweet S, Winchester CC, et al. Update on the epidemiology of gastroesophageal reflux disease: a systematic review [J]. Gut, 2014, 63(6): 871-880.
[5]Fornari F, Callegari-Jacques SM, Scussel PJ, et al. Is ineffective oesophageal motility associated with reflux oesophagitis? [J]. Eur J Gastroenterol Hepatol, 2007, 19(9): 783-787.
[6]Zerbib F, Bruley des Varannes S, Simon M, et al. Functional heartburn: definition and management strategies [J]. Curr Gastroenterol Rep, 2012, 14(3): 181-188.
[7]Kahrilas PJ, Bredenoord AJ, Fox M, et al. The Chicago Classification of esophageal motility disorders, v3.0 [J]. Neurogastroenterol Motil, 2015, 27(2): 160-174.
[8]王慧, 陈帝, 张玲, 等. 胃食管反流病食管酸暴露和食管动力学变化特征[J]. 胃肠病学和肝病学杂志, 2014, 23(9): 1001-1003. Wang H, Chen D, Zhang L, et al. Characteristics of esophageal acid exposure and motility on patients with gastroesophageal reflux disease [J]. Chin J Gastroenterol Hepatol, 2014, 23(9): 1001-1003.
[9]Savarino E, Zentilin P, Mastracci L, et al. Microscopic esophagitis distinguishes patients with non-erosive reflux disease from those with functional heartburn [J]. J Gastroenterol, 2013, 48(4): 473-482.
[10]Boeckxstaens G, El-Serag HB, Smout AJ, et al. Republished: symptomatic reflux disease: the present, the past and the future [J]. Postgrad Med J, 2015, 91(1071): 46-54.
[11]Mainie I, Tutuian R, Shay S, et al. Acid and non-acid reflux in patients with persistent symptoms despite acid suppressive therapy:a multicentre study using combined ambulatory impedeance-pH monitoring [J]. Gut, 2006, 55(10): 1398-1402.
[12]Nakagawa K, Koike T, Iijima K, et al. Characteristics of symptomatic reflux episodes in Japanese proton pump inhibitor-refractory non-erosive reflux disease patients [J]. World J Gastroenterol, 2015, 21(47): 13352-13359.
[13]Fletcher J, Wirz A, Young J, et al. Unbuffered highly acidic gastric juice exists at the gastroesophageal junction after a meal [J]. Gastroenterology, 2001, 121(4): 775-783.
[14]Beaumont H, Bennink RJ, de Jong J, et al. The position of th acid pocket as a major risk factor for acidic reflux in health subjects and patients with GORD [J]. Gut, 2010, 59(4): 441-451.
[15]Rohof WO, Bennink RJ, Smout AJ, et al. An alginate-antacid formulation localizes to the acid pocket to reduce acid reflux in patients with gastroesophageal reflux disease [J]. Clin Gastroenterol Hepatol, 2013, 11(12): 1585-1591.
[16]吴光勤, 王雯. 胃内酸袋的研究进展及与胃食管反流病的关系[J]. 世界华人消化杂志, 2013, 21(36): 4092-4097. Wu GQ, Wang W. Gastric acid pocket and gastroesophageal reflux disease [J]. World Chinese Journal of Digestology, 2013, 21(36): 4092-4097.
[17]Kahrilas PJ, McColl K, Fox M, et al. The acid pocket: a target for treatment in reflux disease? [J].Am J Gastroenterol, 2013, 108(7): 1058-1064.
(责任编辑:李 健)
Effects of different subtypes of esophageal motility disorders in gastroesophageal reflux disease
LI Li, GUO Zihao, GUO Baona, CHEN Jing, JIANG Jiali, ZHAN Yutao, ZHANG Chuan
Department of Gastroenterology, Beijing Tongren Hospital, Capital Medical University, Beijing 100730, China
Objective To investigate the role of different subtypes of esophageal motility disorders in gastroesophageal reflux disease (GERD).Methods Forty patients who underwent High-resolution manometry (HRM) and 24 h impedance-pH monitoring due to reflux symptoms were enrolled. The characteristics of GERD in different subtypes of esophageal motility disorders were analyzed.Results Among 40 patients with typical symptoms of GERD, normal esophageal motility was found in 10 cases (25.0%), loss of peristalsis was found in 11 cases (27.5%), weak peristalsis was found in 19 cases (47.5%), intermittent contraction was found in 30 cases (75.0%). The number of reflux in loss of peristalsis and weak peristalsis groups was significantly more than that in esophageal motility normal group (96.7±65.5, 92.7±49.1vs69.5±31.3,P<0.05);there was no significant difference of pathological acid reflux in 3 groups (P>0.05). Compared with normal esophageal motility group, pH<4 time (%) was significantly higher in intermittent contraction patients (8.4±3.9vs14.3±7.6,P<0.05); DeMeester rates tended to increase (27.9±43.9vs50.6±60.6,P>0.05).Conclusion The number of weakly acidic reflux in GERD patients with ineffective esophageal motility was significantly more than that in esophageal motility normal group; and intermittent contraction patterns in patients were closely related to distal esophageal acid exposure.
Gastroesophageal reflux disease; Esophageal motility disorders; High-resolution manometry
北京市医管局临床医学发展专项(扬帆计划)重点医学专业发展计划项目“微创消化外科”(ZYLX201612)
李莉,硕士,主治医师,研究方向:胃肠道动力障碍性疾病与肝病学。E-mail:doctorlili008@163.com
张川,主任医师,研究方向:消化系统疾病内镜下诊治。E-mail:digestivezhang@163.com
10.3969/j.issn.1006-5709.2016.09.018
R571
A 文章编号:1006-5709(2016)09-1037-03
2016-03-28
