亚甲基四氢叶酸还原酶A1298C多态性与结直肠癌患者化疗敏感性的相关性研究
2016-06-05董秋美黄赛花
董秋美,黎 莹,黄赛花
广东省人民医院 广东省医学科学院肿瘤中心1.胃肠肿瘤内科; 2.放疗科, 广东 广州510080
亚甲基四氢叶酸还原酶A1298C多态性与结直肠癌患者化疗敏感性的相关性研究
董秋美1,黎 莹1,黄赛花2
广东省人民医院 广东省医学科学院肿瘤中心1.胃肠肿瘤内科; 2.放疗科, 广东 广州510080
目的探讨结直肠癌(colorectal cancer, CRC)患者亚甲基四氢叶酸还原酶(methylenetetrahydrofolate reductase,MTHFR)基因A1298C多态性与化疗有效率和预后的相关性。方法收集经病理学确诊的Ⅳ期CRC患者75例,接受标准的FOLFOX6或XELOX方案化疗,化疗前抽取患者外周血,采用DNA测序法检测MTHFR基因A1298C多态性,观察不同基因型化疗有效率和无进展生存时间(PFS),分析二者的相关性。结果75例CRC者中,MTHFR1298 AA、AC、CC基因型频率分别为61.3%、34.7%、4.0%,化疗有效率分别为39.1%、30.8%、33.3%,差异无统计学意义(P>0.05)。AA型和AC/CC型化疗中位PFS分别为13.3个月、11.4个月,差异具有微弱的边际统计学意义(P=0.068)。结论MTHFR A1298C基因多态性和患者化疗后有效率无关。MTHFR 1298携带AA基因型的患者化疗后PFS略优于携带C基因型的患者。
亚甲基四氢叶酸还原酶;结直肠癌;有效率;无进展生存时间
结直肠癌(colorectal cancer,CRC)在全球范围内是发病率和死亡率最高的恶性肿瘤之一[1],也是我国最常见的消化道恶性肿瘤。由于大部分CRC患者在确诊时已到中晚期,单纯的手术治疗难以达到根治的效果或部分晚期患者已失去手术机会,因此对于大部分中晚期患者,化疗是最主要的治疗手段。但不同的个体在疗效和预后方面存在明显差异,越来越多的研究发现,这些差异源自不同个体药物代谢基因的不同。因而如何从药物遗传学和药物基因组学角度研究患者之间药物敏感性和预后的差异,如何选择个体化的治疗方案,对于提高临床治疗水平、改善患者预后具有重要意义。
目前,氟尿嘧啶类药物联合奥沙利铂是治疗CRC的标准方案,其中氟尿嘧啶类药物的抗肿瘤作用受到多种代谢酶的影响。亚甲基四氢叶酸还原酶(methylenetrahydrofolate reductase, MTHFR)通过影响5-FU细胞毒作用的辅助因子对其抗肿瘤活性产生影响。MTHFR是叶酸代谢过程的关键酶,其生化功能是催化5,10-亚甲基四氢叶酸还原为5-甲基四氢(5,10-MTHE)叶酸,是调节叶酸代谢的一种限速酶。MTHFR基因具有多态性,最常见的多态性为C677T和A1298C两个位点,研究发现这两个位点基因的改变会影响MTHFR酶活性,并进一步影响氟尿嘧啶类药物的抗肿瘤活性[2]。因C677T位点的研究比较多,而A1298C位点的研究比较少,且无确定性结论,因此本研究采用基因测序法检测CRC患者MTHFR基因A1298C多态性,分析不同基因型化疗疗效和预后的关系,为临床个体化疗提供理论依据。
1 资料与方法
1.1 一般资料收集2012年1月-2014年3月在广东省人民医院经病理确诊CRC患者75例,年龄27~76岁,平均年龄和中位年龄分别为:(56.2±12.3)岁和56岁。所有病例经影像检查证实具有可测量病灶,分期均为Ⅳ期,接受晚期一线标准的FOLFOX6或XELOX方案化疗。患者临床特征见表1。
表1 75例CRC患者基本特征[例数(%)]
Tab 1 Characteristics of 75 CRC patients [n(%)]
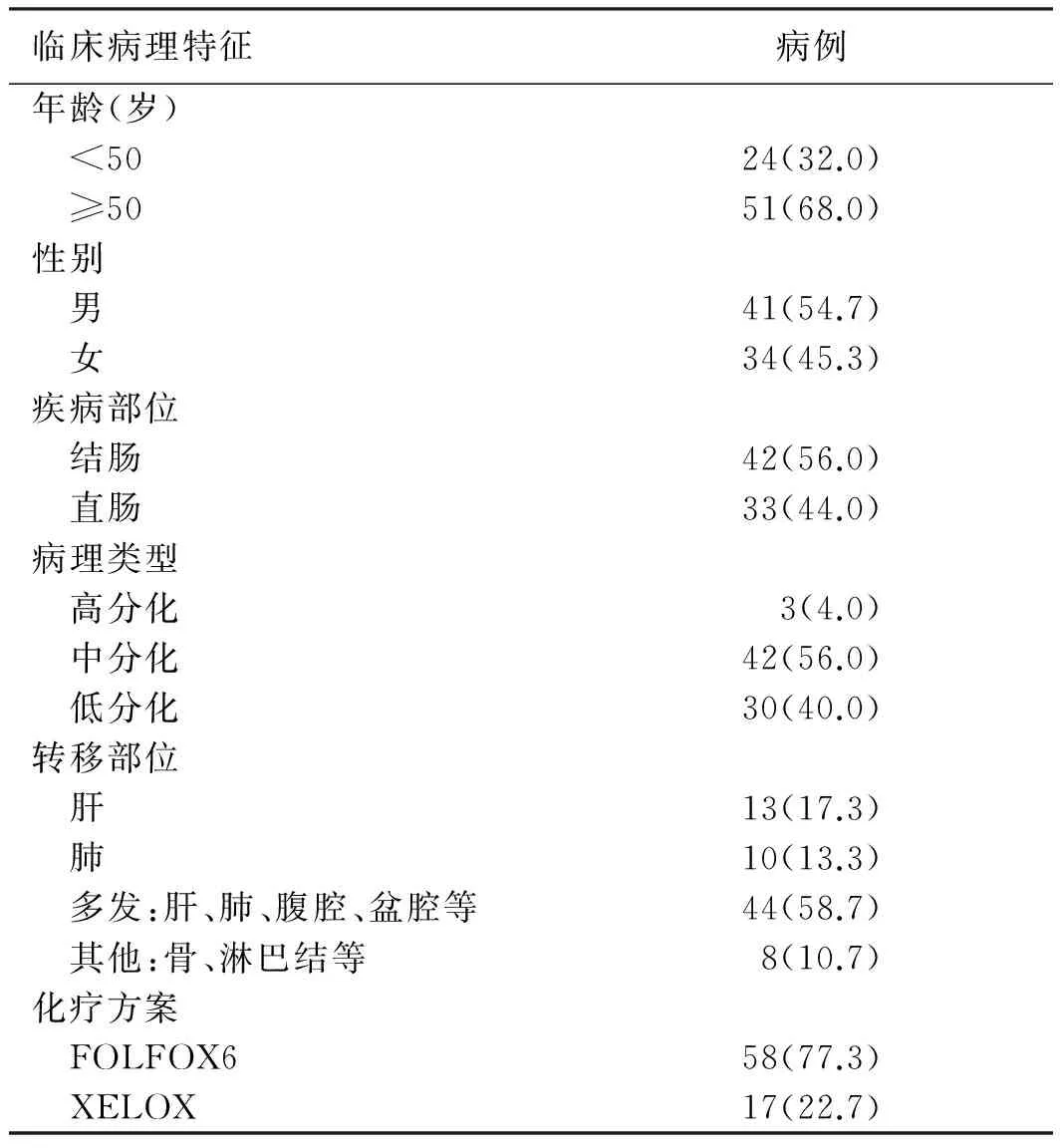
临床病理特征病例年龄(岁) <5024(32.0) ≥5051(68.0)性别 男41(54.7) 女34(45.3)疾病部位 结肠42(56.0) 直肠33(44.0)病理类型 高分化3(4.0) 中分化42(56.0) 低分化30(40.0)转移部位 肝13(17.3) 肺10(13.3) 多发:肝、肺、腹腔、盆腔等44(58.7) 其他:骨、淋巴结等8(10.7)化疗方案 FOLFOX658(77.3) XELOX17(22.7)
1.2 方法所有患者化疗前抽取静脉血2 ml,采用全血DNA提取试剂盒提取DNA,采用PCR-测序方法检测基因序列。引物序列参考文献[3],正向引物:5’-TGAAGGAGAAGGTGTCTGCGGGA-3’,反向引物:5’-AGGACGGTGCGGTGAGAGTG-3’。反应总体积25 μl,含引物 ( 10 mmol ) 各1.0 μl、4×dNTP( 各2. 5 mmol/L) 2.5 μl、Taq 酶1 IU、基因组DNA 溶液0.5 μl、10×Buffer (含MgCl2)2.5 μl。反应条件为94 ℃预变性2 min;94 ℃ 30 s、62 ℃ 30 s、72 ℃ 30 s, 共35个循环;72 ℃延伸7 min。DNA测序方法采用反向测序法。
1.3 治疗方案75例Ⅳ期CRC患者接受一线FOLFOX6或XELOX方案化疗。58例患者接受FOLFOX6方案[4]化疗:奥沙利铂100 mg/m2ivd 3 h,亚叶酸钙400 mg/m2ivd 2 h,5-FU 400 mg/m2iv,5-FU 2 400 mg/m2civ 46 h,每2周重复。17例患者接受XELOX方案[4]化疗:奥沙利铂130 mg/m2ivd 3 h,希罗达 1 000 mg/m2bid po 连续14 d,每3周重复。
1.4 疗效评价标准疗效评价采用RECIST 1.1标准分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、稳定(stable disease,SD)和进展(progressive disease,PD)。疾病控制率为CR+PR+SD,有效率为CR+PR,患者化疗过程中每2周期评价疗效。
1.5 统计学方法采用SPSS 16.0统计软件进行分析。不同基因型间化疗有效率、疾病控制率的比较采用χ2检验进行分析。不同基因型化疗后无进展生存时间(progression-free survival,PFS)采用Kaplan-Meier法进行分析,并进行Log-rank检验,P<0.05为差异具有统计学意义。
2 结果
2.1 MTHFR A1298C基因型分布AA基因型46例(61.3%),AC基因型26例(34.7%),CC基因型3例(4.0%,见表2)。
2.2 MTHFR A1298C不同基因型患者化疗后评价疗效根据RECIST 1.1评价疗效,75例患者中,无CR病例,PR 27例(36.0%),SD 17例(22.7%),PD 31(41.3%),疾病控制率:PR+SD共44例,占58.7%。从表2可以看出AA基因型患者化疗后PR率略高于AC/CC型患者,但差异无统计学意义(P>0.05)。
表2 75例患者MTHFR A1298C不同基因型与同化疗有效率相关性对比分析[例数(%)]
Tab 2 Relationship between genotypes of MTHFR A1298C and response rate of 75 CRC patients[n(%)]

基因型病例数PRSDPDχ2值P值AA4618(39.1)11(23.9)17(37.0)0.9930.609AC268(30.8)6(23.1)12(46.1)CC31(33.3)0(0)2(66.7)
2.3 不同基因型与CRC患者PFS的关系75例Ⅳ期CRC患者接受手术和化疗后随访患者PFS,中位随访时间为14个月(5~20个月),无失访病例。治疗后全部患者平均PFS为12.61个月(11.56~13.66个月);中位PFS为 13个月(11.71~14.28个月)。因1298纯合突变CC型病例数太少,和AC型合并进行统计分析,AA基因型患者平均PFS为13.3个月,略优于AA/AC型11.4个月,差异具有微弱的边际统计学意义(P=0.068,见图1)。
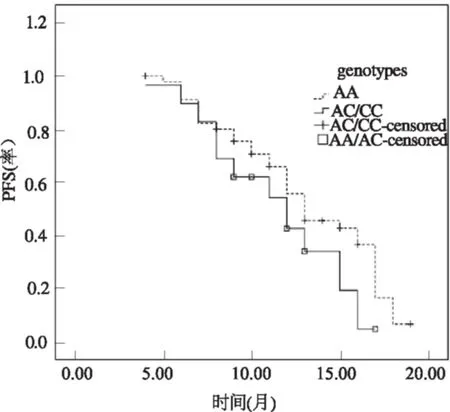
图 1 CRC患者MTHFR A1298C不同基因型PFS曲线(P=0.068)
Fig 1 PFS of CRC patients with different genotypes of MTHFR A1298C(P=0.068)
3 讨论
早期CRC的症状隐匿,因而大部分CRC患者在确诊时已属晚期,需要进行以化疗为主的全身治疗。氟尿嘧啶类药物联合奥沙利铂组成的FOLFOX方案或XELOX方案是中晚期CRC治疗的标准方案[5],在CRC晚期一线治疗中显示出很好的抗肿瘤活性。研究显示FOLFOX和XELOX方案在CRC的抗肿瘤活性具有等效性[6-7]。在上述两种方案中起主要作用的氟尿嘧啶类药物的疗效与多种代谢酶的活性相关,其中MTHFR对氟尿嘧啶类抗肿瘤药物的活性有较大影响,且影响到患者的预后。MTHFR通过影响5-FU细胞毒作用的辅助因子对其药效产生影响。5,10-MTHF是5-FU与胸苷酸合成酶(TS)形成三重复合物的重要辅助因子,而MTHFR不可逆的催化5,10-MTHF,使其转变为5-甲基四氢叶酸,以减少5,10-MTHF的含量。C677T和A1298C是MTHFR表型改变的两个相关单链构象多态性[8]。这两种变异则通过降低MTHFR酶活性及增加细胞内5,10-MTHF的含量,增强氟尿嘧啶类药物的抗肿瘤活性[9]。
目前关于MTHFR基因677位点多态性同胃肠道恶性肿瘤化疗敏感性的研究较多,而关于MTHFR 1298位点方面的研究甚少,并且无确切结论。郑磊贞等[10]研究发现MTHFR A1298C 携带AC基因型的胃癌患者化疗后中位生存时间为47.5个月,明显优于AA型和CC型(27.6个月和22.9个月),具有边际统计学意义。Blank等[11]研究结果却完全相反,认为MTHFR A1298C AC基因型是接受新辅助化疗的胃癌的不良预后因素,但与化疗有效率无关。Cecchin 等[12]通过对262例患者的研究发现Ⅱ、Ⅲ期CRC患者接受含5-FU的辅助化疗时,A1298C CC基因型是结直肠患者无病生存时间(DFS)和总生存时间(OS)短的因素。Etienne等[13]在晚期CRC患者的研究中发现,A1298C的基因多态性与5-FU/全氢叶酸的化疗有效率无相关性,但是与预后相关:携带纯合突变CC基因型是预后差的因素。然而也有完全阴性的结果,Zhu等[14]和Ulrich等[15]的研究则认为MTHFR C677T和A1298C 这两个位点基因型和CRC患者的预后无相关性。
可见目前关于MTHFR基因A1298C位点多态性同胃肠道癌患者化疗疗效及预后相关性的研究甚少,且结论不一致,尤其是同CRC预后的相关性尚无确切结论。因为大部分CRC患者一线化疗进展后进入二线治疗,而总生存受到后续治疗的影响较大,相比总生存,一线化疗后的PFS能更好地反映患者对化疗方案的疗效,因此本研究重点研究PFS。本研究采用基因测序法分析CRC患者外周血MTHFR A1298C位点的单核苷酸多态性,随访CRC患者化疗后PFS,初步结果表明,MTHFR A1298C位点的不同基因型同患者化疗有效率无关,但野生型纯合子AA型患者无进展生存期略优于携带C基因型的患者,具有微弱的边际统计学意义(P=0.068),同Cecchin、Etienne等[12-13]的研究结果相一致。通过本项研究发现MTHFR 1298基因型对CRC患者化疗后PFS具有非常有限的预测价值。考虑到本研究病例数较少,需扩大病例数进一步研究。
[1]Siegel R, Naishadham D, Jemal A. Cancer statistics,2012 [J]. CA Cancer J Clin, 2012, 62(1): 10-29.
[2]Wu NC, Su SM, Lin TJ, et al. Methylenetetrahydrofolate reductase C677T and A1298C polymorphisms and fluorouracil-based treatment in Taiwan colorectal cancer [J]. Anticancer Drugs, 2015, 26(8): 888-893.
[3]季明华, 吴建中, 唐金海. 亚甲基四氢叶酸还原酶基因多态性与乳腺癌新辅助化疗敏感性关系的研究探讨[J]. 实用临床医学杂志, 2012, 16(1): 1-4.
Ji MH, Wu JZ, Tang JH. Relationship between genetic polymorphisms of methylenetetrahydrofolate reductase and sensitivity of breast cancer to neoadjuvant chemotherapy [J]. Journal of Clinical Medicine in Practice, 2012, 16(1): 1-4.
[4]André T, Iveson T, Labianca R, et al. The IDEA (International Duration Evaluation of Adjuvant Chemotherapy) Collaboration: Prospective Combined Analysis of Phase III Trials Investigating Duration of Adjuvant Therapy with the FOLFOX (FOLFOX4 or Modified FOLFOX6) or XELOX (3 versus 6 months) Regimen for Patients with Stage III Colon Cancer: Trial Design and Current Status [J]. Curr Colorectal Cancer Rep, 2013, 9: 261-269.
[5]Cassidy J, Clarke S, Díaz-Rubio E, et al. XELOX vs FOLFOX-4 as first-line therapy for metastatic colorectal cancer: NO16966 updated results [J]. Br J Cancer, 2011,105(1): 58-64.
[6]Cassidy J, Clarke S, Diaz-Rubio E, et al. Randomized phase iii study of capecitabine plus oxaliplatin compared with fluorouracil/folinic acid plus oxaliplatin as first-line therapy for metastatic colorectal cancer [J]. J Clin Oncol, 2008, 26(12): 2006-2012.
[7]Zhang C, Wang J, Gu H, et al. Capecitabine plus oxaliplatin compared with 5-fluorouracil plus oxaliplatin in metastatic colorectal cancer: meta-analysis of randomized controlled trials [J]. Oncol Lett, 2012, 3(4): 831-838.
[8]Weisberg I, Tran P, Christensen B, et al. A second genetic polymorphism in methylenetetrahydrofolate reductase (MTHFR) associated with decreased enzyme activity [J]. Mol Genet Metab, 1998, 64(3): 169-172.
[9]Toffoli G, De Mattia E. Pharmacogenetic relevance of MTHFR polymorphisms [J]. Pharmacogenomics, 2008, 9(9): 1195-1206.
[10]郑磊贞, 章莉, 陈思宇, 等. 胃癌患者叶酸代谢通路相关基因的多态性与卡培他滨联合紫杉醇化疗后生存期的关系[J]. 肿瘤, 2011, 31(5): 442-446. Zheng LZ, Zhang L, Chen SY, et al. Relationship between polymorphisms of related genes in the folic acid metabolic pathway and survival of gastric cancer patients treated with capecitabine combined with paclitaxel [J]. Tumor, 2011, 31(5): 442-446. [11]Blank S, Rachakonda S, Keller G, et al. A retrospective comparative exploratory study on two methylentetrahydrofolate reductase (MTHFR) polymorphisms in esophagogastric cancer: the A1298C MTHFR polymorphism is an independent prognostic factor only in neoadjuvantly treated gastric cancer patients [J]. BMC Cancer, 2014, 14: 58.
[12]Cecchin E, Perrone G, Nobili S, et al. MTHFR-1298 A>C (rs1801131) is a predictor of survival in two cohorts of stage II/III colorectal cancer patients treated with adjuvant fluoropyrimidine chemotherapy with or without oxaliplatin [J]. Pharmacogenomics J, 2015, 15(3): 219-225.
[13]Etienne MC, Formento JL, Chazal M, et al. Methylenetetrahydrofolate reductase gene polymorphisms and response to fluorouracil-based treatment in advanced colorectal cancer patients [J]. Pharmacogenetics, 2004, 14(12): 785-792.
[14]Zhu L, Wang F, Hu F, et al. Association between MTHFR polymorphisms and overall survival of colorectal cancer patients in Northeast China [J]. Med Oncol, 2013, 30(1): 467.
[15]Ulrich CM, Rankin C, Toriola AT, et al. Polymorphisms in folate-metabolizing enzymes and response to 5-fluorouracil among patients with stage II or III rectal cancer (INT-0144; SWOG 9304) [J]. Cancer, 2014, 120(21): 3329-3337.
(责任编辑:马 军)
The relationship between polymorphism of MTHFR A1298C and chemotherapy sensitivity of colorectal cancer patients
DONG Qiumei1, LI Ying1, HUANG Saihua2
1.Department of Gastrointestinal Medical Oncology; 2. Department of Radiotherapy, Guangdong General Hospital, Cancer Centre, Guangdong Academy of Medical Sciences, Guangzhou 510080, China
Objective To investigate the relationship between the polymorphism of the methylenetetrahydrofolate reductase (MTHFR) A1298C and the response rate and progression free survival (PFS) of advanced colorectal cancer (CRC) treated by chemotherapy.Methods Seventy-five stage Ⅳ CRC patients confirmed by pathology were treated with FOLFOX6 or XELOX regimen and DNA of peripheral blood was obtained before chemotherapy. MTHFR A1298C genotypes were detected by PCR and sequencing method. The response rate and PFS of patients with different genotypes were recorded, relationship between them was analyzed.Results Of the 75 patients, the frequencies of MTHFR 1298 AA, AC, CC genotype were 61.3%, 34.7% and 4.0%; the response rates of AA, AC, CC genotype were 39.1%, 30.8%, 33.3%, respectively, there was no significant difference(P>0.05). The mean PFS of AA and AC/CC genotype were 13.3 months and 11.4 months, respectively, there was weak marginal significance (P=0.068). Conclusion The present study indicated that no significant difference between the response rate of chemotherapy and MTHFR A1298C genotype. The PFS of the patients with AA genotype was superior to AC/CC genotype with the weak marginal significance.
Methylenetetrahydrofolate reductase; Colorectal cancer; Response rate; Progression free survival
广东省科技计划项目(2012B031800409);广东省医学科研基金项目(A2014033)
董秋美,博士,主任医师,研究方向:胃肠道恶性肿瘤的综合治疗和研究。E-mail: dqmzhang@163.com
10.3969/j.issn.1006-5709.2016.09.005
R735.3+4
A 文章编号:1006-5709(2016)09-0978-04
2016-01-09
